Introducción
El cáncer gástrico (CG) ocupa el 5º y 4º lugar en incidencia y mortalidad por cáncer en el mundo. respectivamente. En Colombia. tan solo en el año 2020 se registraron 8214 nuevos casos de CG y 6491 muertes por esta enfermedad. lo que la convierte en la neoplasia con mayor mortalidad. siendo responsable del 11.7% de todas las muertes por cáncer en el país1. La mayoría de los pacientes con CG se encuentra en estadios avanzados de la enfermedad al momento de su presentación. teniendo el 34% metástasis a órganos distantes en la valoración clínica inicial2. La terapia sistémica y el cuidado paliativo constituyen los pilares del tratamiento de los pacientes con CG localmente avanzado. no susceptible de manejo quirúrgico o con metástasis a distancia (también conocido como CG incurable3). quienes tienen medianas de supervivencia global (SG) que no suelen superar los 16 meses4. No obstante. en los últimos años la terapia de conversión (TC). definida como el tratamiento quirúrgico dirigido a obtener una resección completa o R0. tras una buena respuesta a la quimioterapia de inducción. ha venido ganado adeptos como una estrategia novedosa para intentar mejorar los desenlaces oncológicos de los pacientes con tumores inicialmente considerados irresecables. tanto por razones técnicas como oncológicas4. En este contexto tiene lugar el concepto de cirugía adyuvante como la cirugía resectiva con intención curativa después de quimioterapia sistémica5.
Ahora bien. los carcinomas gástricos muestran una biología tumoral diversa. según el sitio al cual se propagan y las particularidades en la forma de presentación y comportamiento de la enfermedad metastásica. En la actualidad. no existe consenso sobre los criterios para la selección de los pacientes candidatos a TC. así como tampoco sobre cuál es la quimioterapia ideal y el intervalo óptimo entre la quimioterapia y la cirugía6.
Aunque prometedora. la TC en CG no se ha probado mediante ensayos clínicos controlados. probablemente por la complejidad misma de la terapia. aún en desarrollo. y por el bajo número de pacientes candidatos a esta conducta7. La información sobre la eficacia de la TC para el manejo de los pacientes con CG avanzado proviene de estudios retrospectivos en un solo centro. que incluyen pacientes con una gran variedad de factores no curativos y de investigaciones de cohorte multicéntricas. tanto retrospectivas como prospectivas. que se enfocan en pacientes con un único factor no curativo4.
El objetivo del presente estudio fue estimar los resultados del tratamiento con TC en una serie de casos de pacientes con cáncer gástrico avanzado e incurable en el Servicio de Cirugía Gastrointestinal del Instituto Nacional de Cancerología de Colombia (INC). en un período de 12 años.
De acuerdo con nuestro conocimiento. esta sería la primera cohorte de conversión en CG informada en Colombia.
Materiales y métodos
Se incluyeron los pacientes llevados a quimioterapia sistémica de inducción y posteriormente a cirugía con intención curativa entre el 1° de enero de 2010 y el 31 de diciembre de 2021. Los criterios de elegibilidad de los pacientes fueron: 1) tener un adenocarcinoma gástrico primario comprobado histológicamente. 2) tener un tumor considerado incurable por ser T4b. es decir. un tumor con invasión de las estructuras u órganos adyacentes; por compromiso ganglionar extrarregional o por metástasis a distancia en los estudios de estadificación.
Nos limitamos a los casos de tumores irresecables por ser localmente avanzados o por metástasis ganglionares o hematógenas. sin incluir pacientes con diseminación peritoneal. que expresan una biología tumoral diferente y en nuestra institución son manejados por el grupo de malignidad peritoneal.
La tomografía axial computarizada (TAC) contrastada de tórax y abdomen y la laparoscopia fueron los únicos métodos empleados durante la estadificación clínica de los pacientes. Se excluyeron aquellos con tumores de la unión esofagogástrica Siewert I y II. ya que en este escenario la terapia neoadyuvante es el estándar de tratamiento. De otro lado. los pacientes en quienes no se logró una resección R0 fueron excluidos de los análisis de supervivencia. al no recibir cirugías consideradas como curativas. lo cual constituye un fracaso de la TC.
Se revisaron las historias clínicas electrónicas de la institución almacenadas en la plataforma SAP®. Se recogieron las características demográficas y clínicas de los pacientes. La escala de funcionalidad empleada fue la del Eastern Cooperative Oncologic Group. ECOG8. por su sigla en inglés. Se incluyeron las variables relacionadas con la quimioterapia de inducción. el tipo de cirugía. el vaciamiento ganglionar. los hallazgos patológicos obtenidos del espécimen quirúrgico. las complicaciones y mortalidad a 30 y 90 días posoperatorios utilizando la clasificación de Clavien-Dindo9; se registró también la terapia sistémica adyuvante. la SG a los 3 y 5 años y la recurrencia tumoral.
Se realizó una prueba de normalidad de Shapiro Wilk. Para las variables cuantitativas con distribución normal. se utilizaron los valores de media y desviación estándar y para las de distribución no normal. medianas y rangos intercuartílicos. Se determinaron intervalos de confianza del 95%. Las variables categóricas se tabularon con frecuencias absolutas y relativas.
La SG se calculó desde la fecha de la primera quimioterapia hasta la muerte por cualquier causa. Los casos de pérdida del seguimiento o terminación del estudio sin la presencia del desenlace fueron manejados como censuras a la derecha. Las funciones de supervivencia se estimaron con tablas de vida y por el método de Kaplan-Meier y. posteriormente. se realizaron curvas de supervivencia a los 3 y 5 años. Se utilizó el software Stata 16®. Para el desarrollo de este trabajo se obtuvo el aval del Comité de ética institucional (CEI) del INC.
Resultados
Se encontraron 23 pacientes con CG avanzado incurable por invasión de órganos adyacentes. compromiso ganglionar extrarregional o metástasis hematógenas. llevados a TC en el período mencionado. La respuesta a la TC se evaluó en todos los pacientes mediante TAC contrastados previos a la cirugía. Dos casos fueron excluidos de los análisis de supervivencia al no recibir resecciones R0. de modo que se analizaron 21 pacientes. El 74% fueron hombres. la edad promedio al momento del diagnóstico fue de 56 años (rango 4272) y 20 (96%) tenían un ECOG8 de 0 o 1. Un tercio de los casos tenía un tumor de localización distal. La pérdida de las proteínas del complejo MMR evaluada por inmunohistoquímica. como sucedáneo de inestabilidad microsatelital. se encontró en el 13% de los tumores.
El criterio de irresecabilidad más frecuente fue tener un tumor T4b (56.5%); la irresecabilidad fue confirmada por imágenes en el 39.1% de los pacientes y en el 60.9% restante mediante laparoscopia/laparotomía. En 10 (43.5%) pacientes. el procedimiento quirúrgico de estadificación se llevó a cabo en el INC.
La mediana de tiempo entre la finalización de la quimioterapia de inducción y la cirugía fue de 48 días. Al 52.2% de los pacientes se les realizó una gastrectomía total; el 87% fueron llevados a un vaciamiento ganglionar D2 con una media de 34.3 ganglios resecados.
La patología mostró que solo dos (8.7%) pacientes alcanzaron una respuesta patológica completa (pCR) tras la quimioterapia de inducción; uno de ellos además fue el único en recibir radioterapia preoperatoria (50Gy). Los dos (8.7%) pacientes R1 corresponden a: 1) hombre de 42 años llevado a una gastrectomía total y pancreatectomía central en bloque con margen esofágico positivo. que falleció en el día 23 posoperatorio (pop) y 2) hombre de 70 años llevado a una gastrectomía total más colecistectomía con margen positivo en la vesícula biliar. que continuaba vivo al momento del cierre del estudio (23 meses). Otros aspectos quirúrgicos y patológicos se detallan en la tabla 1.
TABLA 1 Desenlaces quirúrgicos y patológicos de 23 pacientes con terapia de conversión por cáncer gástrico avanzado
| Características | n | % |
|---|---|---|
| Tipo histológico | ||
| Intestinal | 16 | 69.7 |
| Difuso | 5 | 21.7 |
| Mixto | 1 | 4.3 |
| No clasificado | 1 | 4.3 |
| HER2‡ | ||
| Sí | 3 | 13 |
| No | 17 | 73.9 |
| No está el dato | 3 | 13 |
| Criterio para considerar la TC | ||
| T4b | 13 | 56.6 |
| T4b con ganglios metastásicos a distancia | 2 | 8.7 |
| Solo ganglios metastásicos a distancia | 4 | 17.4 |
| Solo metástasis hepáticas | 3. | 13 |
| Metástasis hepáticas con ganglios metastásicos a distancia | 1 | 4.3 |
| Técnica quirúrgica | ||
| Gastrectomía total | 12 | 52.2 |
| Gastrectomía subtotal | 3 | 13 |
| Gastrectomía total con resección de órganos adicionales | 6 | 26.1 |
| Gastrectomía subtotal con resección de órganos adicionales | 2 | 8.7 |
| Tipo de vaciamiento ganglionar | ||
| D1 | 2 | 8.7 |
| D1+ | 1 | 4.3 |
| D2 | 20 | 87 |
| Estadio yp¶ (21**) | ||
| I | 3 | 14.5 |
| II | 6 | 28.5 |
| III | 12 | 57 |
*Tumores de la unión gastroesofágica Siewert III. subcardiales y corporales. †Tumores antropilóricos. ‡Sobreexpresión del receptor HER2. gen ErbB2. ¶AJCC 8th ed.. 2017 - clasificación posneoadyuvancia. **Excluyendo los dos pacientes que alcanzaron una pCR.
Los esquemas de quimioterapia de inducción más frecuentemente utilizados estuvieron basados en platinos y fluoropirimidinas (Tabla 2).
TABLA 2 Esquemas de quimioterapia empleado en 23 pacientes como terapia de conversión por cáncer gástrico avanzado
| Quimioterapia | n | % |
|---|---|---|
| Cisplatino + 5-Fluorouracilo | 3 | 13 |
| Cisplatino + 5-Fluorouracilo + Leucovorina | 1 | 4.3 |
| Docetaxel + Cisplatino + 5-Fluorouracilo | 2 | 8.7 |
| Cisplatino + Capecitabina | 4 | 17.4 |
| Carboplatino + Capecitabina | 1 | 4.3 |
| Capecitabina + Oxaliplatino | 5 | 21.7 |
| Docetaxel + Oxaliplatino + Leucovorina + 5-Fluoruracilo | 5 | 21.7 |
| Capecitabina + Oxaliplatino + Trastuzumab | 1 | 4.3 |
| Ácido folínico + 5-Fluorouracilo + Oxaliplatino | 1 | 4.3 |
En cuanto a los desenlaces quirúrgicos. 10 (43.5%) pacientes tuvieron complicaciones dentro de los 90 días posoperatorios; se presentaron dos mortalidades y cuatro complicaciones de tipo IIIb o superiores de la clasificación de Clavien-Dindo9.
En nuestra serie. 18 pacientes (78.2%) recibieron quimioterapia posoperatoria. En 11 casos (52%) se documentó recurrencia tumoral durante el seguimiento. seis de ellos (28.6%) antes de los 6 meses de la resección quirúrgica. Las recurrencias se identificaron a nivel hepático. óseo. peritoneal. en ganglios y tejidos blandos.
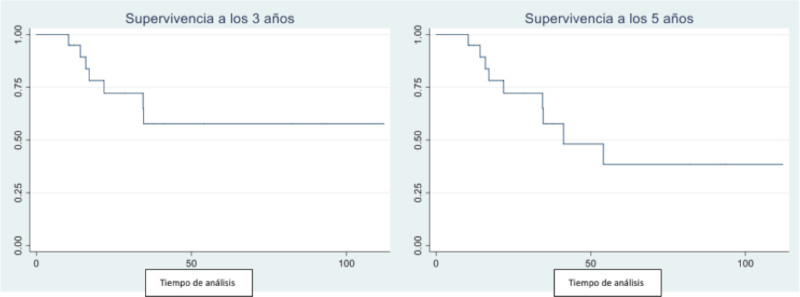
Tras una mediana de seguimiento de 28 meses (rango 9-115 meses). el 52.2% (12) de los pacientes se encontraban vivos. 10 habían fallecido (43.5%) y uno perdió el seguimiento (4.3%). La mediana de supervivencia de esta serie fue de 41.2 meses y la SG a 3 y 5 años fue 57.7% y 38.5% respectivamente (Fig. 1).
Discusión
Este trabajo muestra los resultados de la TC para el tratamiento de CG irresecable en una serie de pacientes en un centro oncológico latinoamericano. Teniendo en consideración que clásicamente estos pacientes irían a quimioterapia paliativa o mejor cuidado de soporte. este enfoque terapéutico permite ofrecer un tratamiento con intención curativa y mejorar el pronóstico de un grupo muy seleccionado de casos. La mediana de supervivencia en esta serie fue 41.2 meses. superior a la informada por las dos series latinoamericanas disponibles en la literatura. Ramos y cols.10 con 11.3 y Gallardo-Rincón y cols.11 con 13 meses. La SG a 3 y 5 años es inferior cuando se compara con la mayoría de las series asiáticas. como es el caso de Sato y cols.12 con 75.4% a los 3 años. pero superior a la referida en la serie italiana de Morgagni y cols.13 con 39.4%. Sin embargo. no todos los trabajos aportan los mismos datos. lo que hace difícil cotejar resultados (Tabla 3 10-40).
TABLA 3 Series de casos de terapia de conversión en cáncer gástrico
| Año | Referencia | Número de pacientes llevados a TC | Criterio de irresecabilidad/ operabilidad más frecuente | ≥ D2 | R0 n (%) * | Mediana de seguimiento en los pacientes llevados TC† (meses) | Mediana de supervivencia (meses)* | SG* |
|---|---|---|---|---|---|---|---|---|
| 1997 | Nakajima et al. 14 | 19 | PAN/N3 | NE | 9 (47%) | NE | NE | 55.6%¶ |
| 2000 | Gallardo-Rincón et al.11 | 10 | NE | 50% | 7 (70%) | NE | 13.3 | NE |
| 2002 | Yano et al.15 | 14 | Peritoneo | NE | 8 (57%) | NE | NE | NE |
| 2010 | Suzuki et al.16 | 20 | PAN/N3 | NE | 11 (55%) | 32.2 | NE | 80%‡ |
| 54.9%§ | ||||||||
| 2012 | Satoh et al.17 | 44 | Peritoneo | 82% | 26 (59%) | > 24 | 19.2 | 75%‡ |
| 2012 | Kanda et al.18 | 28 | PAN/N3 | 96.30 % | 26 (93%) | 37.5 | 29 | 49.5%§ |
| 2013 | Han et al.19 | 34 | PAN/N3 | NE | 26 (76%) | 22.7 | 22.9 | 41.4%§ |
| 2014 | Kim et al.20 | 18 | Peritoneo | 100% | 10 (55%) | NE | 37 | 50%§ |
| 40%¶ | ||||||||
| 2014 | Saito et al.21 | 16 | Peritoneo | 100% | 13 (81%) | NE | 53 | 53.8%§ |
| 2015 | Fukuchi et al.21 | 40 | Otro | NE | 32 (80%) | NE | 62 | 49%¶ |
| 2015 | Ito et al.23 | 14 | Peritoneo | NE | 14(100%) | 24.8 | 29.5 | 65.6%§ |
| 2015 | Kinoshita et al.24 | 34 | PAN/N3 | 50% | 27 (79%) | NE | NE | 63.5%§ |
| 2017 | Sato et al.25 | 33 | PAN/N3 | 100% | 28 (85%) | NE | 47.9 | 48.6%¶ |
| 2017 | Mieno et al.26 | 31 | PAN/N3 | 77% | 23 (74%) | 53.8 | NE | 71.3%§ |
| 2017 | Uemura et al.27 | 43 | PAN/N3 | 100% | 15 (35%) | NE | 24 | NE |
| 2017 | Einama et al.28 | 10 | PAN/N3 | 100% | 100.00 % | NE | 29 | NE |
| 2017 | Maeda et al.29 | 3 | PAN/N3 | 100% | 3 (100%) | NE | NE | 100%‡ |
| 2017 | Yamaguchi et al.30 | 84 | PAN/N3 | NE | 43 (51%) | 28.5 | 41.3 | NE |
| 2017 | Al-Batran et al. AIO-FLOT331 | 36 | PAN/N3 | NE | 29 (80%) | 27.5 | NE | NE |
| 2018 | Morgagni et al.13 | 33 | PAN/N3 | 91.90 % | 22 (67%) | NE | 38 | 39.4%§ |
| 2018 | Beom et al.32 | 101 | PAN/N3 | 75.20 % | 57 (56%) | 63.3 | NE | NE |
| 2019 | Solaini et al.33 | 45 | Peritoneo | 91.10 % | 30 (67%) | 25 | NE | NE |
| 2019 | Li et al.34 | 81 | PAN/N3 | NE | 66 (81.4%) | NE | NE | NE |
| 2019 | Ramos et al.10 | 16 | T4b | 81.30 % | 13 (81.3%) | 8.9 | 11.3 | NE |
| 2019 | Wang et al.35 | 122 | PAN/N3 | 100% | 113 (92.6%) | 63.6 | NE | NE |
| 2019 | Choe et al.36 | 26 | NE | NE | 22 (84.6%) | 36.1 | NE | NE |
| 2019 | Sato et al.12 | 48 | Peritoneo | NE | 35 (72.9%) | 52 | NE | 75.4%§ |
| 2020 | Arigami et al.37 | 13 | Hígado | NE | NE | NE | NE | NE |
| 2020 | Chen et al.38 | 95 | PAN/N3 | NE | 47 (49.5%) | 20.7 | 49.3 | NE |
| 2021 | Yoshida et al.39 | 1902 | PAN/N3 | 79.30 % | 839 (69.6%) | NE | 56.6 | NE |
| 2022 | Kano et al.40 | 79 | Peritoneo | 93.70 % | 63 (79.7%) | NE | NE | 61.8%§ |
| 2023 | Briceño et al. | 23 | T4b | 87% | 21(91.3%) | 28 | 41.2 | 57.7%§ |
| 38.5%¶ |
*Pacientes que recibieron una cirugía con intención curativa (R0) del total de pacientes llevados a TC. †En el total de pacientes llevados a TC. ‡ Supervivencia global a 2 años. §Supervivencia global a 3 años. ¶Supervivencia global a 5 años.
PAN: Ganglios linfático paraaórticos (para-aortic lymph nodes). NE: no especificado/reportado.
En el trabajo de Yoshida y cols.41. los autores proponen una clasificación integral para la TC con respecto a las características biológicas y heterogéneas del GC en estadio IV que ha tenido amplia aceptación y ha ayudado en la construcción de un lenguaje común al respecto5. En estas categorías hay una división principal entre los pacientes con compromiso peritoneal macroscópico y sin él. Este trabajo se enfocó en los casos de pacientes con tumores localmente avanzados. con metástasis resecables o ganglios extrarregionales. que pueden incluirse en las categorías I y II. Ahora bien. con respecto al compromiso ganglionar. Yoshida establece una diferencia clara entre el compromiso de los ganglios paraaórticos en las estaciones 16a2 (entre el tronco celíaco y la vena renal izquierda) y 16b1 (entre la vena renal izquierda y la arteria mesentérica inferior). que corresponden a la categoría I y el compromiso de otros ganglios paraaórticos. incluyendo las estaciones 16a1 (hiato aórtico). 16b2 (entre la arteria mesentérica inferior y la bifurcación aórtica) (Fig. 2) y ganglios extraabdominales. que corresponden a la categoría II. Sin embargo. el estudio CONVO GC-139 encontró que la supervivencia de los pacientes con metástasis a ganglios linfáticos paraaórticos en las estaciones 16 a1/b2 no fue inferior a la de aquellos con compromiso 16 a2/ b1. Esto probablemente apoya la evidencia creciente con respecto a una biología tumoral similar entre los casos con metástasis hematógenas y linfáticas. aun con compromiso extrarregional. pero diferente de aquellos con diseminación peritoneal.
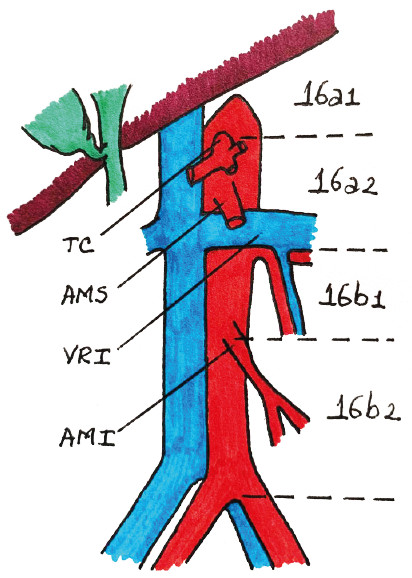
FIGURA 2 Grupo ganglionar Nº 16 (paraaórtico) y sus subdivisiones: TC: tronco celíaco. AMS: arteria mesentérica superior. VRI: vena renal izquierda. AMI: arteria mesentérica inferior.
En cuanto a la recurrencia en CG. se ha considerado recurrencia temprana la reaparición de la enfermedad antes de los 2 años de la resección curativa. y múltiples trabajos han explorado los factores predictores de esta42. No resulta claro si este concepto puede aplicarse al escenario de la TC. en donde un porcentaje importante de pacientes recurre tempranamente aun con resecciones R0. Es posible que la estandarización del vaciamiento ganglionar extendido (D2+). incluido en la sexta edición de la guía japonesa para el tratamiento del CG posterior a neoadyuvancia con compromiso ganglionar voluminoso. evidente en las imágenes previas a la terapia sistémica. pueda aportar evidencia al respecto.
Este trabajo tiene importantes limitaciones por su naturaleza retrospectiva y por tratarse de pacientes de un único centro. así como por la presencia de múltiples esquemas de tratamiento empleados en la TC. Son necesarios estudios multicéntricos que permitan caracterizar mejor a este grupo de pacientes y sus aspectos particulares en la región.
Muy probablemente los estudios RENAISSANCE y SURGIGAST. aún en curso. aportarán información relevante que permita optimizar la selección de pacientes candidatos a TC. estandarizar los esquemas de tratamiento y definir mejor el papel de la cirugía en este contexto.
Resulta difícil categorizar y tratar de forma uniforme a todos los pacientes con GC en estadio IV o con tumores localmente avanzados. No todos los casos son elegibles para TC. lo que hace necesario optimizar la selección de los pacientes para maximizar su eficacia. También es importante considerar los riesgos de esta estrategia. como el eventual deterioro en la calidad de vida posoperatoria con una supervivencia limitada y la recaída tumoral temprana. Consideramos que estos pacientes deben ser tratados siempre por grupos multidisciplinarios y en centros oncológicos de referencia.
En conclusión. con una adecuada selección. la TC fue una alternativa que permitió rescatar pacientes con CG avanzado y regresarlos al terreno de la intención curativa mejorando la SG de una entidad altamente letal.











 texto em
texto em