Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Quebracho (Santiago del Estero)
versión On-line ISSN 1851-3026
Quebracho (Santiago del Estero) vol.22 no.1 Santiago del Estero ene. 2014
TRABAJO CIENTÍFICO
Caracterización del crecimiento miceliar del hongo ectomicorrícico Lactarius aff. deliciosus y su simbiosis con plántulas de Pinus radiata
Characterization of mycelial growth of ectomycorrhizal fungus Lactarius aff. deliciosus and its symbiosis with Pinus radiata
Pereira, G.1; J. L. Campos1; D. Chávez1; L. Anabalón2 y C. Arriagada3
1 Universidad de Concepción Campus Los Ángeles, Departamento de Ciencia y Tecnología Vegetal. Casilla 341, Los Ángeles, Chile, Tel.: 56-43- 405293, Fax: 56-43-314974, E-mail: gpereira@udec.cl
2 Universidad Católica de Temuco, Facultad de Recursos Naturales, Escuela de Ciencias Ambientales. Casilla 15-D, Temuco, Chile.
3 Universidad de la Frontera, Departamento de Ciencias Forestales. Casilla 54-D, Temuco, Chile.
Recibido en abril de 2013
Aceptado en mayo de 2014
RESUMEN
Se describen las características macroscópicas y microscópicas de colonias aisladas de Lactarius aff. deliciosus creciendo en medio de cultivo. Su velocidad de crecimiento fue determinada para los medios de cultivo Aneurina-acido fólico-agar (BAF), Melin-Norkrans-modificado (MMN) y papa dextrosa agar (PDA), como también, la biomasa miceliar en condiciones estáticas y agitadas en el medio de cultivo BAF, evaluando a su vez, la variación de pH del medio. Producida la síntesis micorrícica de Pinus radiata + L. deliciosus se procedió a describir el tipo de estructuras micorrícicicas que se formaron en los sistemas radiculares. Los resultados indican que la mayor velocidad de crecimiento se logró en el medio de cultivo BAF con 1,35 mm/día-1 y la menor en el medio PDA con sólo 0,21 mm/día. La mayor producción de biomasa miceliar se logró en condiciones de cultivo estáticas con pH del medio ajustado en 5,5 (107 mg) y la menor producción de biomasa en condiciones agitada con pH ajustado en 6,0 (67,2 mg). El crecimiento de L. deliciosus en medio de cultivo líquido provocó cambio en el pH, tendiendo siempre hacia la acidificación. En condiciones de cultivo estáticas se obtuvieron las mayores variaciones de pH. La especie P. radiata logró realizar simbiosis con L. deliciosus, presentando estructuras definidas en los sistemas radiculares a los 3,5 meses de inoculadas. Las estructuras de las ectomicorrizas formadas son de dicotomias simples o ramificadas, sésiles o cortamente pecioladas, de color café claro anaranjado cuando jóvenes, con un manto del tipo plectenquimático, poco desarrollado.
Palabras clave: Hongo comestible; Crecimiento in vitro; Síntesis micorrícica.
ABSTRACT
We described the macroscopic and microscopic colonies isolated from Lactarius aff. deliciosus growing in culture medium. Their growth rate was determined for the culture media Aneurine-Folic Acid-Agar (BAF), Melin-Norkrans-Modified (MMN) and Potato Dextrose Agar (PDA) as well, mycelial biomass under static and agitated in the BAF culture medium, assessing in turn, changes in pH. Synthesis produced mycorrhizal Pinus radiata + L. deliciosus proceeded to describe the type of mycorrhizal structures that were formed in the root systems. The results indicate that the higher growth rate was achieved in the culture medium with 1.35 mm BAF/day and the lowest in the PDA medium with only 0.21 mm/day. Increased production of mycelial biomass was obtained in static culture conditions with medium pH adjusted to 5.5 (107 mg) and the lowest biomass production in shaken conditions with pH adjusted to 6.0 (67.2 mg). Growth of L. deliciosus in liquid culture medium caused change in pH, always tending to acidification. In static culture conditions were obtained the greatest changes in pH. The species P. radiata performed symbiosis with L. deliciosus, presenting structures defined in the root systems at 3.5 months of inoculation. The ectomycorrhizae formed structures are simple dichotomies or branched, sessile or shortly stalked orange light brown when young, with a mantle of type plectenchymatous, underdeveloped.
Keywords: Edible fungus; Growth in vitro; Mycorrhizal synthesis.
1. INTRODUCCION
Los hongos comestibles silvestres son recursos forestales no madereros de importancia ecológica, económica y cultural en las zonas en donde se desarrollan (Garibay-Origel et al., 2009). Ellos cumplen un rol fundamental en la naturaleza, pues entregan a las plantas nutrientes, agua y protección, cuando son micorrícicos y descomponen la materia orgánica dejando disponibles los nutrientes inmóviles cuando ellos son saprófitos (Honrubia et al., 1992, Garibay-Origel et al., 2009). Estos recursos micológicos pueden constituirse en un factor de impulso muy importante para el desarrollo sostenible de las zonas de aptitud preferentemente forestal (Lázaro, 2008, Honrubia et al., 2008). Al respecto, Díaz et al., (2009), afirman que el uso de hongos comestibles confiere un valor añadido indiscutible en las plantas micorrizadas ya que la producción de hongos como cultivos secundarios podrían ser un recurso económicamente muy valioso en el manejo forestal. Los hongos silvestres comestibles son recursos naturales endógenos cada vez más valorados, y han comenzado a formar parte de lo que se podría denominar una gastronomía de elite, por lo que su interés en los mercados nacionales e internacionales se incrementa progresivamente (Honrubia et al., 2008). Entre estos recursos micológicos se encuentra la especie Lactarius deliciosus, hongo micorrícico que crece asociado a especies del género Pinus, siendo reportado creciendo bajo condiciones controladas en simbiosis con P. pinea (Rincón et al., 1999), P. pinaster y P. sylvestris (Parladé et al., 2004), P. halepensis, P. nigra, P. oocarpa, P. ayacahuite, P. hartwegii P.pseudostrobus y P. rudis (Díaz et al., 2007), P. halepensis (Díaz et al., 2009) y P pinaster (Parladé et al., 2011). Varias especies de hongos ectomicorrícicos, incluyendo L. deliciosus pueden ser aislados y cultivados a nivel de colonias en laboratorio, lo que facilita su manipulación y posterior utilización en micorrizaciones controladas de plantas en vivero, siendo necesario para ello determinar las condiciones y técnicas culturales que permitan la optimización de esta simbiosis hongo-planta (Pereira et al., 2007). Al respecto, Díaz et al., (2009), afirman que el inóculo miceliar de L. deliciosus y las prácticas culturales adecuadas permiten obtener plantas bien micorrizadas.
En el presente estudio se describen las características macroscópicas y microscópicas de colonias de Lactarius aff. deliciosus aisladas de campo, creciendo en medios de cultivos específicos. Se describe la síntesis micorrícica y las características morfológicas de las estructuras de L. deliciosus en simbiosis con P. radiata. Se plantea como hipótesis de trabajo que este hongo micorrícico comestible puede ser cultivado con éxito en condiciones in vitro para ser posteriormente utilizado como inóculo miceliar líquido en micorrizaciones controladas con la especie Pinus radiata.
2. MÉTODOS
El hongo ectomicorrícico utilizado en este estudio corresponde a Lactarius aff. deliciosus L. Gray, especie recolectada en plantación adulta de Pinus radiata D. Don de la Comuna de Alto Bíobío, provincia del Bíobío, región del Bíobío, Chile (37° 49’ 12.65" S y 71° 40’ 13.54" O). Este hongo fue aislado en laboratorio a partir de tejido interno estéril de cuerpos fructíferos jóvenes. Su identificación se realizó de acuerdo a características macroscópicas y microscópicas de sus basidiocarpos (Gerhardt et al., 2000, Calonge, 2009). Los medios de cultivo utilizados fueron Aneurina-Ácido fólico-Agar (BAF), Melin-Norkrans-modificado (MNM) (Honrubia et al., 1995) y papa dextrosa agar (PDA) (Royo et al., 1998).
Determinación de la velocidad media de crecimiento radial. A partir de colonias en crecimiento activo fueron extraídos discos de agar micelio de 5 mm de diámetro, los que se transfirieron a placas de Petri de 10 cm de diámetro, con 20 ml de medio de cultivo BAF, MMN y PDA, según correspondiera, con pH ajustado para 5,8. Estos medio fueron previamente autoclavados a 121 °C, durante 30 minutos. En cada tratamiento se consideraron tres repeticiones. Las placas de Petri se incubaron en estufa a 24 ± 1 ºC durante 30 días a oscuridad, tiempo durante el cual se midió el crecimiento radial de las colonias con regla graduada. Las características macroscópicas y microscópicas de las colonias se observaron bajo lupa binocular de alta resolución (marca Olympus modelo SZ2-ILST) y microscópio Olympus modelo CX30) con cámara Moticam 2000, incorporada. Finalizado el período de evaluación se ajustaron los datos mediante una ecuación de regresión con la finalidad de determinar la pendiente de la curva de crecimiento y el promedio de crecimiento por día (mm día-1) (Vázquez-García et al., 2002).
Producción de biomasa en medio líquido y evaluación de la variación del pH. De los cultivos stock de L. deliciosus fueron retirados de los márgenes de las colonias dos discos de agar-micelio (5 mm diámetro) para ser transferidos a matraces Erlenmeyer (100 ml) que contenían 40 ml de medio líquido BAF con pH ajustado para 5,5, 6,0 y 6,5, según correspondiera. Los cuales habían sido autoclavados a 121 ºC durante 15 minutos en forma previa. Para cada tratamiento probado se consideraron tres réplicas. Posteriormente, los matraces fueron incubados en oscuridad a 24 ± 1 ºC durante ocho semanas en condiciones estáticas (cámara de incubación) y de agitación constante (incubadora con agitación de 90 rpm). Se evaluó la producción de biomasa miceliar, recuperando la biomasa producida, filtrando el medio a través de papel filtro, previamente pesado. La masa miceliar retenida en el papel filtro, fue llevada a estufa a 60º C por 24 horas con el fin de determinar su peso seco.
Para la evaluación de la variación del pH final del medio de crecimiento con la producción de biomasa miceliar, se determinó en cada uno de los tratamientos la disminución o aumento del pH a través de un pHmetro marca HANNA, modelo HI 8424.
Producción de inóculo miceliar líquido y micorrización de plántulas de P. radiata. De acuerdo a los resultados de los ensayos anteriores y bajo la misma metodología, se produjo el inóculo miceliar líquido en medio BAF modificado, con pH ajustado para 5,5 y condiciones de cultivo estáticas (Honrubia et al., 1995). Los matraces fueron incubados durante seis semanas y la biomasa producida fue cosechada y triturada en licuadora manual agregando agua destilada para formar una suspensión miceliar líquida utilizada como fuente de inóculo en las plántulas de P. radiata. Para ello, con la antelación suficiente, semillas de dicha especie se germinaron en contenedores de 25 cc, bajo condiciones controladas de cámara de crecimiento (24 ± 1 ºC, 70% Humedad Relativa y fotoperiodo de 16 horas luz). Cuando las plántulas iniciaron su crecimiento radicular secundario se trasplantaron a contenedores de 260 cc con una mezcla de sustrato (turba, vermiculita y perlita en proporción 1:2:1 v/v, previamente autoclavada a 121 °C, por una hora por tres días consecutivos), momento en el cual se les aplicó 10 ml por plántula de la suspensión miceliar (equivalente a una concentración de 1 ml de micelio fresco diluido en 10 mL de aguas destilada), quedando el micelio en contacto directo con el sistema radicular (Chávez et al., 2007). Las plántulas fueron mantenidas en cultivo en cámara de crecimiento durante 3,5 meses, siendo regadas una a dos veces por semana a capacidad de campo (según etapa de desarrollo), y fertilizadas con 10 ml por plántula cada 15 días con solución nutritiva de Hoagland.
Caracterización de estructuras micorrícicas desarrolladas. Una vez que la síntesis de L. deliciosus se produjo con la especie hospedera P. radiata, se procedió a la descripción de los caracteres morfológicos y anatómicos de las estructuras desarrolladas. De los sistemas radiculares de las plántulas se seleccionaron, bajo lupa binocular, las dicotomías más representativas, caracterizando su forma, color, superficie y dimensiones; para posteriormente bajo microscopio de alta resolución (X40 y X100) determinar tipo de agregado celular, presencia y extensión de la red de Harting (Agerer, 1986; Agerer, 1991; Honrubia et al., 1995; Smith y Read, 2008).
Análisis estadístico. Las variables evaluadas fueron la velocidad media de crecimiento radial (mm día-1) para medio sólido y biomasa (mg) para medio líquido. Para la determinación de la velocidad media de crecimiento radial de L. deliciosus se aplicó un análisis de varianza unifactorial. Para la biomasa fúngica se aplicó un análisis factorial. Los factores analizados fueron pH con tres niveles (5,5, 6,0, y 6,5) y la condición de cultivo con dos niveles (estático y agitación), con un total de seis tratamientos con tres réplicas cada uno (matraz), lo que constituyó un total de 18 unidades muestrales. Los datos se sometieron a un análisis de varianza y la comparación de medias se calculó según la prueba Tukey (P<0,05). Para el análisis de datos se utilizó el software Statistica versión 6.0.
3. RESULTADOS
Caracterización de las colonias de L. deliciosus. Micelio de color crema en etapa inicial del crecimiento, con marcadas tonalidades naranjas en el centro de las colonias en etapas posteriores, margen generalmente regular, color del reverso no uniforme de una tonalidad crema-anaranjado, especialmente en el centro de las colonias (Figura 1A). Hifas pigmentadas de color amarillo-anaranjado con diámetros que oscilan entre 2-5 micras, ramificaciones simples, las cuales no presentan fíbulas, pero sí, numerosas anastomosis (Figura 1B). Textura fibrilosa y a veces flocosa o plumosa en el centro de las colonias (Figura 1A y 1B). Presencia de abundantes cordones miceliares en colonias más antiguas (Figura 1C).
Velocidad de crecimiento radial. Los resultados muestran que L. deliciosus presenta un comportamiento diferente de crecimiento en los tres medios de cultivo probado(Figura 2A). Se observa quela mayor velocidad de crecimiento se logra en el medio de cultivo BAF (1,35 mm día-1), mientras que el menor desarrollo se presenta en el medio de cultivo PDA(0,21 mm día-1), produciéndose diferencias significativas entre el crecimiento de L. deliciosus logrado en el medio de cultivo BAF, respecto a los medios MMN y PDA, los cuales a su vez alcanzan diferencias significativas entre ellos.
Producción de biomasa. Los resultados de la Figura 1B muestran que L. deliciosus, presenta crecimiento en el medio de cultivo (BAF) en las dos condiciones de estudio probadas (agitación y estática), y para los tres tipos de pH utilizados (5,5, 6,0, y 6,5). La mayor producción de biomasa se logra en condiciones de cultivo estáticas con pH del medio 5,5 y 6,0 (107 y 101,9 mg, respectivamente), seguidos del tratamiento condición estática con pH 6,5 (87 mg) y tratamiento condición agitada pH 6,5 (87 mg). Se observa que los tratamientos con condiciones agitadas y pH 6,0 y 5,5 (67,2 y 74,7 mg, respectivamente) son los que obtienen los más bajos crecimientos en biomasa. A nivel de significancia estadística sólo se producen diferencias entre el tratamiento condición estática con pH 5,5 y el tratamiento condición agitada con pH 6,0. El resto de los tratamientos no mostraron diferencias estadísticas significativas.

Figura 1. (A) Características del crecimiento de las colonias. (B) Detalles del micelio. (C) Presencia de cordones miceliares en colonias. (D) Características de estructura micorrícicas en formación. (E) Estructura micorrícicas adulta. (F) Detalles del agregado celular. (G) Característica de la red harting intercelular.
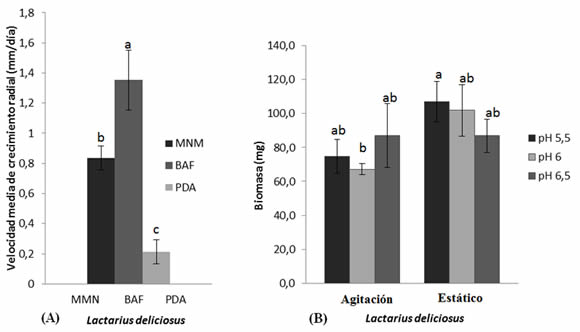
Figura 2. (A) Velocidad media de crecimiento radial de L. deliciosus en medios de cultivo MMN, BAF y PDA. (B) Producción de biomasa miceliar en condiciones estáticas y de agitación con pH ajustados a 5,5, 6,0 y 6,5. Valores seguidos por la misma letra no presentan diferencias significativas (P < 0,05).
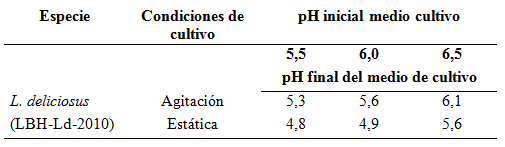
Variación de pH del medio de cultivo. Los resultados indican que el cultivo de L. deliciosus en medio líquido provoca cambios en el pH respecto al pH inicial del medio, tendiendo siempre hacia la acidificación (Tabla 1). Se observa que el grado de acidificación aumenta a medida que el valor de pH inicial del medio fue mayor, independiente de las condiciones de cultivo probadas (estática o agitación). Las condiciones estáticas fueron las que mayor variación de pH lograron, siendo éstas de 0,7, 1,1 y 0,9 unidades de pH para los medios de crecimiento con pH 5,5, 6,0 y 6,5, respectivamente. En condiciones agitadas de cultivo se lograron diferencias de pH de 0,2, 0,4 y 0,4 para iguales condiciones de pH inicial del medio de cultivo.
Tabla 1. Modificación de pH en medio de cultivo líquido (BAF) durante cuatro semanas de crecimiento.
Valores promedio de tres repeticiones.
Síntesis micorrícica y características morfológicas de las estructuras. Los resultados indican que P. radiata logra realizar simbiosis con L. deliciosus, presentando estructuras definidas en parte del sistema radicular a los 3,5 meses de inoculadas. Las estructuras de las ectomicorrizas desarrolladas en los sistemas radiculares son dicotómicas simples o ramificadas, sésiles o cortamente pecioladas, color café claro-anaranjado cuando jóvenes, tornándose café-rojizo en su madurez (Figura 1D y 1E). Superficie reticulada, ramificaciones de forma recta con puntas redondeadas de 1,3 a 5,8 mm de largo y de 0,5 a 0,7 mm de diámetro. Manto del tipo plectenquimático poco desarrollado, formado por células alargadas con terminaciones redondeadas (Figura 1F). La red de Harting se extiende bien desarrollada hasta la tercera capa de células corticales (Figura 1G).
4. DISCUSIÓN
La adecuada selección de las especies de hongos micorrícicos como simbiontes y su posterior manipulación, tanto en laboratorio como en vivero, pueden ser aspectos claves para lograr con éxito el establecimiento de muchas especies vegetales en campo (Honrubia et al., 1992, Chávez et al., 2007). Las características morfológicas de las colonias una vez aislado el hongo de interés, es un aspecto clave a considerar si se quiere tener la certeza que se trabajará con el hongo deseado. Al respecto, las colonias de L. deliciosus puestas en cultivo presentaron características macroscópicas y microscópicas similares a las descritas por Torres (1992), Sánchez et al., (2000) y Flores et al., (2008). Pero diferentes en la coloración con tonalidades verdosas descrita para algunas cepas cultivadas por Royo et al., (1998) y Sánchez et al., (2000). Se destaca el cambio de color crema a marcadas tonalidades naranjas en el centro de las colonias a medida que éstas se desarrollaron, así como la presencia abundante de anastomosis y cordones miceliares en colonias más desarrolladas, como también, la ausencia de fíbulas en ellas.
Los resultados en relación a la velocidad de crecimiento de L. deliciosus, en los diferentes medios de cultivo, concuerdan con los encontrados por Sánchez et al., (2000) y Chávez el al., (2009), quien logra para cepas de L. deliciosus mayores crecimientos radiales en el medio de cultivo BAF, respecto al medio MMN y PDA. Al respecto, Torres (1992), afirma que no todos los hongos micorrícicos crecen bien en un mismo medio, requiriendo algunos géneros de un medio más rico en nutrientes para que su crecimiento sea óptimo. De acuerdo con Daza et al., (2005), ello estaría relacionado directamente con la fuente de carbono, nitrógeno y vitaminas que poseen los medios de cultivos. Por su parte, Carrillo (2000), afirma que la glucosa tiene efecto directo sobre el crecimiento en biomasa de los hongos, pero que el diámetro de las colonias parece no depender de la cantidad de glucosa del medio.
La especie L. deliciosus presentó crecimiento en medio de cultivo líquido BAF en las dos condiciones de estudio probadas (estática y agitada), y para los tres pH ensayados; siendo la condición estática la que alcanzó la mayor biomasa (107 y 101,9 mg) para los pH ajustados en 5,5 y 6,0, y la condición de cultivo agitada con pH 5,5 y 6,0, la que logró los menores crecimientos (74,7 y 67,2 mg, respectivamente). Al respecto, Carrillo (2000) afirma que el crecimiento de los hongos en cultivos puros es diferente dependiendo si el medio de cultivo es líquido o sólido. En este sentido, Durand (1995) sostiene que la fermentación líquida en biorreactores o sólida en vermiculita son los procedimientos más acertados para producir micelio en grandes cantidades.
El cultivo de L. deliciosus en medio líquido provoca cambios en el pH del medio, tendiendo siempre hacia la acidificación. El grado de acidificación aumentó a medida que el valor de pH inicial del medio fue mayor, independiente de las condiciones de cultivo probadas (estática o agitación). Las condiciones estáticas fueron las que mayor variación de pH lograron, siendo éstas de 0,7, 1,1 y 0,9 unidades de pH para los medios de crecimiento con pH inicial de 5,5, 6,0 y 6,5, respectivamente. Al respecto, Pereira et al., (2007), trabajando con las especies de hongos micorrícicos Rhizopogon luteolus, Suillus bellinii y S. luteus en medio de cultivo BAF sólido encontró resultados con tendencias similares. Por su parte, Chávez et al., (2009) registra diferencias estadísticas significativas en cambios de pH para L. deliciosus cultivado en medio líquido,al cabo de 50 días de evaluación. La acidificación del medio de crecimiento por parte del hongo podría estar explicada, de acuerdo con Hung y Trape (1983), García-Rodríguez et al., (2006), Chávez et al., (2009), por la producción de ácidos orgánicos y absorción de iones que requiere el hongo para su desarrollo miceliar. Propiedades que podrían estar correlacionadas con las condiciones del sitio en donde los hongos fueron aislados (Pereira et al., 2007).
La síntesis micorrícíca de L. deliciosus + P. radiata es factible de lograr cuando se utiliza micelio vegetativo, generándose estructuras micorrícicas definidas en parte del sistema radicular a los 3,5 meses de aplicado el inóculo a las plántulas. Resultados que concuerdan con los encontrados por Díaz et al., (2009) para la especie P. halepensis, quienes trabajaron con dosis de 10 ml/planta de micelio líquido, como también, con los resultados encontrados por Parladé et al., (2004), para las especies P. pinaster y P. sylvestri utilizando inóculo vegetativo de L. deliciosus crecido en sustrato sólido. Parladé et al., (2011) lograron síntesis micorrícica in vitro de P. pinaster + L. deliciosus utilizando dosis de micelio líquido de 5 ml/planta. Al respecto, Flores et al., (2005), lograron síntesis micorrícica de L. indigo con cinco especies de Pinus neotropicales, utilizando micelio vegetativo fragmentado en agua destilada (30-40 gr de micelio en 500 ml de agua), aplicando una dosis de 30 ml/planta de dicha suspensión. Dichos autores logran síntesis micorrícicas en tiempos inferiores a los 3,5 meses, pero trabajando en cultivos in vitro. Al respecto, Pera y Parlade (2005), afirman que la formulación y la dosis del inóculo aplicado influyen en la efectividad de la inoculación controlada de las plantas en vivero.
Las características de las estructuras micorrícicas formadas por P. radiata + L. deliciosus concuerdan, en gran parte, con las descripciones realizadas por Torres y Honrubia (1993) para P. halepensis + L. deliciosus, Carrillo (2000) para P. halepensis + L. deliciosus, y en algunos aspectos, a las descripciones realizada por Díaz et al., (2007) para L. deliciosus y especies de Pinus neotropicales. Se debe destacar el tipo de manto plectenquimático que desarrolló P. radiata + L. deliciosus en los sistemas radiculares, resultados que concuerdan con Díaz et al., (2007) para Pinus oocarpa + L. deliciosus, como también, para L. indigo + P. halepensis. Flores et al., (2005) encuentra el mismo tipo de manto para la especie L. indigo en simbiosis con cinco especies de Pinus neotropicales. Al respecto, Agerer (1987 y 2002), afirman que el tipo de manto plectenquimático es una característica común en ectomicorrizas de las especies de Lactarius, sección Dapeters. En este mismo tenor Smith y Read (2008) describen manto plectenquimático para L. glyciomus, L. pubescens y L. picinus.
La red de Harting encontrada en la simbiosis P. radiata + L. deliciosus está bien desarrollada hasta la tercera capa de células corticales, resultados que concuerdan con Flores et al., (2005) para L. indigo en simbiosis con P. oocarpa, P. ayacahuite y P. pseudostrobus. Es importante destacar la ausencia de hongos micorrícicos contaminantes en los sistemas radiculares de las plántulas de P. radiata en simbiosis con L. deliciosus y las plantas control sin micorrizas, lo que guardaría directa relación con las condiciones de cultivo controladas en donde se desarrolló el estudio.
Por último, se destaca el aporte de resultados inéditos para el cultivo in vitro de L. deliciosus que se debieran tener en consideración para la producción de inóculo miceliar líquido, y su posterior aplicación en micorrizaciones controladas de P. radiata. Como también, la descripción morfológica detallada de las estructuras micorrícicas formadas en esta simbiosis.
5. CONCLUSIONES
Lactarius deliciosus es una especie que puede ser aislada de cuerpos fructíferos recolectados en el campo, presentando el crecimiento de las colonias características macroscópicas y microscópicas propias de su especie.
De los tres medios de cultivo probados, Aaneurina-Acido fólico-Agar (BAF) es en el cual se logra las mayores velocidades de crecimiento de la especie L. deliciosus.
La mayor producción de biomasa miceliar de L. deliciosus en medio de cultivo BAF líquido se logra en condiciones estáticas, con pH ajustado en 5,5.
El cultivo deL. deliciosus en medio líquido provoca cambios en el pH, respecto al pH inicial del medio; tendiendo siempre hacia la acidificación.
La inoculación controlada de plántulas de P. radiata con inóculo miceliar de L. deliciosus en suspensión líquida permite obtener plantas micorrizadas con estructuras definidas en los sistemas radiculares.
AGRADECIMIENTOS
Los autores agradecen el financiamiento otorgado por la Dirección de Investigación de la Universidad de Concepción, a través del Proyecto DIUC Código 209.415.011-1.0.
6. REFERENCIAS BIBLIOGRÁFICAS
1. Agerer, R. 1986. "Studie on ectomycorrhizae. II. Introductory remarks on their characterizations and identification". Mycotaxon, 26: 473-492. [ Links ]
2. Agerer, R. 1987-2002. "Colour atlas of ectomycorrhizae". Einhorn-Verlag, Schwäbisch Gmünd. [ Links ]
3. Agerer, R. 1991. "Characterization of ectomycorrhiza". In: Norris JR, Read DJ, Varma AK, eds. Techniques for the study of mycorrhiza. London, UK: Academic Press, Methods in Microbiology 23:25-73 [ Links ]
4. Carrillo, C. 2000. "Producción de inóculo de hongos ectomicorrrícicos y micorrización controlada de Pinus halepensis Miller en vivero". Tesis Doctoral. Universidad de Murcia. España. 240p. [ Links ]
5. Calonge, F. D. 2009. "Guía de bolsillo para el buscador de setas". Ediciones Mundi-Prensa. Madrid. 158p. [ Links ]
6. Chávez, D.; G. Pereira y A. Machuca. 2007." Crecimiento in vitro de cuatro especies de hongos ectomicorrícicos recolectados en plantaciones de Pinus radiata". Agrociencia 23(2): 79-84. [ Links ]
7. Chávez, D.; G. Pereira y A. Machuca. 2009. "Crecimiento in vitro de Lactarius deliciosus en medio de cultivo BAF y MNM". (en línea) (fecha de consulta: 25 marzo 2014): p.1-8. Disponible en: <http://dspace.utalca.cl/handle/1950/6263> [ Links ]
8. Daza, A., J. Manjón; A. Aguilar; M. Bernedo,; M. Camacho; L. Romero y C. Santamaría. 2005. "Crecimiento in vitro y capacidad micorrícica de varios aislamientos de Lacatarius deliciosus". IV Congreso Forestal Español. Tomo 4. pp: 182-188. Zaragoza, España. [ Links ]
9. Díaz, G.; R. Flores y M. Honrubia. 2007. "Lactarius indigo and L. deliciosus form mycorrhizae with Eurasian or Neotropical Pinus species". Sydowia59: 32-45. [ Links ]
10. Díaz, G.; C. Carrillo y M. Honrubia. 2009. "Production of Pinus halepensis seedlings inoculated with the edible fungus Lactarius indigo under nursery conditions". New Forest 38: 215-227. [ Links ]
11. Durand, A. 1995. "The INRA-Dijón reactors: desing and applications". Abstracts of II International symposium on solid state fermentation. Montpellier. Francia.
12. Flores, R.; G. Díaz y M. Honrubia. 200. "Mycorrhizal síntesis of Lactarius indigo (Schw.) Fr. With five Neotropical pine species". Mycorrhiza 15: 563-570.
13. Flores, R.; M. Honrubia y G. Díaz. 2008. "Caracterización de cepas de Lactarius sección Deliciosi de Guatemala y su comparación con cepas europeas de L. deliciosus". Revista Mexicana de Micología 26: 51-55. [ Links ]
14. García-Rodríguez, J.L.; J. Pérez-Moreno, A. Aldrete; V. Cetina-Alcalá y H. Vaquera-Huerta. 2006. "Caracterización del hongo silvestre ectomicorrícico Pisolithus tinctorius (Pers.) Coke et Couch en cultivo y en simbiosis con eucalipto y pino". Agrociencia 40:665-676. [ Links ]
15. Garibay-Origel, R.; M. Martínez-Ramos y J. Cifuentes. 2009. "Disponibilidad de esporomas de hongos comestibles en los bosques de pino-encino de Ixtlán de Juárez-Oaxacal". Revista Mexicana de Biodiversidad 80(2): 1-11. [ Links ]
16. Gerhardt, E; J Vila y X. Llimona. 2000. "Hongos de España y de Europa. Barcelona, España". Omega. 957 p. [ Links ]
17. Honrubia, M.; P. Torres; G. Díaz y A. Cano. 1992. "Manual para micorrizar plantas en viveros forestales. Ministrio de Agricultura, Pesca y Alimentación". ICONA. Madrid, España. 44 p. [ Links ]
18. Honrubia, M.; P. Torres; G. Díaz y A. Morte. 1995. "Biotecnología forestal: Técnicas de micorrización y micropropagación de plantas". Secretariado de Publicaciones, Universidad de Murcia. Murcia. 85 p. [ Links ]
19. Honrubia, M.; G. Pereira; A. Morte & A. Machuca. 2008. "Recursos micológicos como elementos estratégicos para la diversidad de la producción forestal y el desarrollo rural". Revista Chile Forestal. 335:47-49. [ Links ]
20. Hung, L. y J. M. Trappe. 1983. "Growth variation between and within species of ectomycorrhizal fungi in response to pH in vitro". Mycologia 75:234-241. [ Links ]
21. Lázaro, A. 2008. "El aprovechamiento micológico como vía de desarrollo rural en España: las facetas comerciales y recreativas". Análes de Geografía 28(2): 111-136. [ Links ]
22. Parladé, J.; J. Pera y J. Luque.2004. "Evaluation of mycelial incula of edible Lactarius species for the production of Pinus pinaster and P. sylvestris mycorrhizal seedlings under greenhouse conditions". Mycorrhiza 21: 393-401. [ Links ]
23. Parladé, J.; S. Hortal y H. De la Vega. 2011. "Intraspecific variability of Lactarius deliciosus isolates: colonization ability and survival after cold storage". Mycorrhiza 21: 393-401. [ Links ]
24. Pera, J. y J. Parladé. 2005. "Inoculación controlada con hongos ectomicorrícicos en la producción de planta destinada a repoblaciones forestales: estado actual en España". Investigación Agraria Sistema de Recursos Forestales 14(3): 419-433. [ Links ]
25. Pereira, G.; J. Herrera; A. Machuca y M. Sánchez. 2007. "Efecto del pH sobre el crecimiento in vitro de hongos ecomicorrícicos recolectados de plantaciones de Pinus radiata". Bosque 28(3): 215-219. [ Links ]
26. Rincón, A.; I. F. Alvarez y J. Pera. 1999. "Ectomycorrhizal fungi of Pinus pinea L. in northeastern Spain". Mycorrhiza 8: 271-276. [ Links ]
27. Royo, P.; M. Fernández y Fischer, C. 1998. "Síntesis micorrícica de Lactarius deliciosus Fr. y Pinus silvestre L". Investigación Agraria Sistema de Recursos Forestales Vol. 17 (1 y 2): 87-93. [ Links ]
28. Sánchez, F.; M. Honrubia y P. Torres. 2000. "Características culturales de algunos hongos ectomicorrícicos en cultivo puro". Revista Iberoamericana de Micología 17:127-134. [ Links ]
29. Smith, S.E. y D. J. Read. 2008. "Mycorrhizal simbiosis". Third Edition. 800 p. [ Links ]
30. Torres, P. y M. Honrubia. 1993. "Ectomicorrizas de Pinus halepensis Miller". Congreso Forestal Español. Tomo III. 421-426. [ Links ]
31. Torres. P. 1992. "Estudio de las ectomicorrizas de pino carrasco (Pinus halepensis Miller)". Tesis Doctoral. Universidad de Murcia. España. 165 p. [ Links ]
32. Vázquez-García A.; G Santiago-Martínez y A. Estrada-Torres. 2002. "Influencia del pH en el crecimiento de quince cepas de hongos ectomicorrizógenos". Anales del Instituto de Biología, Universidad Nacional Autónoma de México. Serie Botánica73:1-15. [ Links ]














