Introducción
El análisis de orina completa es una parte esencial entre los exámenes de rutina en los laboratorios de análisis clínicos, establecida como la tercera prueba realizada con mayor frecuencia en los mismos (1) (2). En la actualidad, se considera una “técnica de pesquisa” (indispensable en la valoración de la salud del riñón) (3) (4) (5), que se usa como examen médico de fácil acceso a la muestra (6) y apropiada para la detección, el diagnóstico y el seguimiento de trastornos renales, de las vías urinarias y de algunas alteraciones metabólicas (7) (8) (9).
Los analizadores de orina han logrado un mayor rendimiento y una adecuada estandarización del estudio (10) y han mejorado la exactitud y la precisión del mismo. En comparación con la técnica manual, esta tecnología ha mostrado una buena performance y concordancia, en particular con la microscopía, para detectar glóbulos rojos, glóbulos blancos, bacterias y células epiteliales escamosas (11) (12) y mostró una mayor variabilidad de los resultados de las tiras de orina, probablemente debido a los falsos positivos o negativos propios de las mismas. Esta tecnología se vuelve menos confiable para detectar otros elementos formes como células epiteliales no escamosas, cilindros no hialinos, cristales inusuales y lípidos (9) (13) (14) (15), lo que hace recordar que la microscopía manual es necesaria para confirmar algunas estructuras formes de la orina (16) (17) (18).
No menos importante es el análisis químico de la orina, donde diversos grupos que trabajan sobre enfermedad renal crónica (ERC), enfermedad cardíaca e hipertensión resaltan la problemática de carácter mundial de la proteinuria, en su rol de marcador sensible de disfunción renal progresiva y factor de riesgo independiente de la morbimortalidad cardiovascular (CV) (19). Es así que se ha propuesto en guías y consensos el uso de la tira de orina como el test de tamizaje de elección para el hallazgo de proteinuria en la valoración de la misma, la búsqueda del paciente con ERC (20) y la estratificación del daño cardiovascular, donde se estableció que proteinurias (≥1+; una cruz o más) por tira reactiva de orina fueran juzgadas con decisión clínica (21) y propusieron que las mismas se confirmen cuantitativamente por relación proteína/creatinina urinaria (Pr/Cr) en muestras aisladas (22).
En 2019, Erba Lachema s.r.o. lanzó al mercado “Laura-XL® - Erba Mannheim” (República Checa y Eslovaquia), una plataforma automatizada para el análisis de orina que permite evaluar las tres etapas que constituyen el estudio de orina completa (estudio físico, químico y microscópico).
En este trabajo se propone como objetivos: evaluar el desempeño de Laura XL® Erba-Mannheim por comparación con el analizador de orina iRICELL® - Beckman Coulter (Chatsworth, CA, EE.UU.), plataforma evaluada en su desempeño por diversos autores, entre los cuales se incluyen los del presente trabajo y, como segundo objetivo, evaluar la aplicación de la determinación de proteinuria en este analizador como test de tamizaje en la valoración de la misma en una población general, por correlación entre los valores semicuantitativos establecidos por las tiras DEKA PHAN® (Laura XL®) y los cuantitativos logrados a partir del analizador de química Hitachi Modular Cobas® 8000 (Roche) y establecer a la vez, la concentración de proteínas urinarias expresadas en cruces en Laura XL® (técnica semicuantitativa), a partir de la cual se debería emplear una técnica cuantitativa para incrementar la sensibilidad en la medición de proteínas urinarias en rangos de decisión médica.
Materiales y Métodos
Diseño del estudio
Estudio retrospectivo analítico realizado en una única institución de la ciudad de Córdoba, en el Laboratorio Central del Sanatorio Allende, sucursal Nueva Córdoba, Córdoba, Argentina.
Muestras
Se analizaron 225 muestras de orina en fresco de pacientes ambulatorios, internados y del servicio de guardia de dicha institución, de ambos sexos y sin restricción de edad. Las muestras fueron recolectadas en recipientes estériles descartables, sin conservantes, y obtenidas a diferentes horas del día. Se tomaron como criterios de inclusión que las mismas fuesen obtenidas con al menos dos horas de retención, tuvieran un volumen ≥20 mL de muestra y que fueran procesadas antes de cumplida la primera hora de su recolección. Las muestras incluidas se alicuotaron por duplicado en tubos de ensayo cónicos con un volumen de 8 mL y se procesaron en simultáneo por ambos analizadores de orina, designando los resultados como “Laura XL” e “IRIS” respectivamente.
Parámetros evaluados
En cada instrumento se realizó el análisis físico, químico y microscópico de las muestras. Se establecieron para su evaluación los siguientes parámetros: pH, turbidez, color, proteínas, hemoglobina, glucosa, nitritos y número de tiras con alguna reacción positiva (proteína, glucosa, nitritos, hemoglobina y cetonas). Para la valoración microscópica se evaluó la presencia de: células epiteliales, leucocitos, hematíes y el criterio de normalidad del sedimento. Para este último se definieron los grupos: “Orina Normal” y “Orina Activa”. Se consideró como orina activa a toda muestra que tuviera un sedimento patológico, es decir, aquel que presentara leucocituria y/o hematuria fuera de los valores de referencia, cilindros patológicos, piocitos o que su evaluación quedara excluida del criterio de orina normal.
En forma paralela, se cuantificó la concentración de proteínas en un Modular COBAS® 8000 (Hitachi-Roche) de las muestras que presentaron reacción positiva para las mismas en tiras de orinas DEKA PHAN® en Laura XL®.
Instrumentos y ensayos
Se emplearon dos analizadores de orina: Laura XL® - Erba Mannheim (Erba Lachema s.r.o, República Checa y Eslovaquia) constituidos por dos módulos en un solo bloque. Se controló diariamente con un control interno BIO-RAD LiquicheckTM Urinalysis Control, nivel 1 y 2. En el módulo de química se evaluaron semicuantitativamente los analitos de orina mediante tiras reactivas DEKA PHAN®-10 parámetros (densidad, pH, leucocitos, nitritos, hemoglobina, proteínas, glucosa, cetonas, bilirrubina y urobilinógeno). La evaluación de los resultados de la tira se ejecuta por análisis del cambio de color de las imágenes en cada almohadilla de la tira; cada color se procesa mediante un algoritmo integrado y se calcula en consecuencia el resultado final. En la cámara de color/turbidez, el primero se determina por un sensor de color y turbidez por dispersión de la luz. En el módulo de microscopía se llena una cubeta de sedimentación donde la muestra se deja 6,5 minutos para tal fin, posteriormente se realiza la captura de 15 imágenes para su examen. La apreciación del sedimento se realiza por reconocimiento, clasificación y cuantificación de los elementos formes presentes (tecnología de inteligencia artificial) empleando como unidad de conteo el factor Hpf (high-power field o campo de alto poder) volumen equivalente, utilizado para ajustar los recuentos de elementos formes de menor tamaño obtenidos en la microscopía automatizada en Laura XL® (resultado del recuento=recuento/µL del elemento forme x factor Hpf donde Hpf=0,18) con respecto a la técnica de microscopía manual estandarizada. El valor de 0,18 (provisto por el fabricante) corresponde a la técnica manual estandarizada que emplea un volumen de muestra de orina a procesar de 10 mL, volumen de sedimento de 0,5 mL, gota de muestra después de centrifugada, para visualización al microscopio, de 10-15 µL y tamaño de cubreobjetos de 18x18 mm.
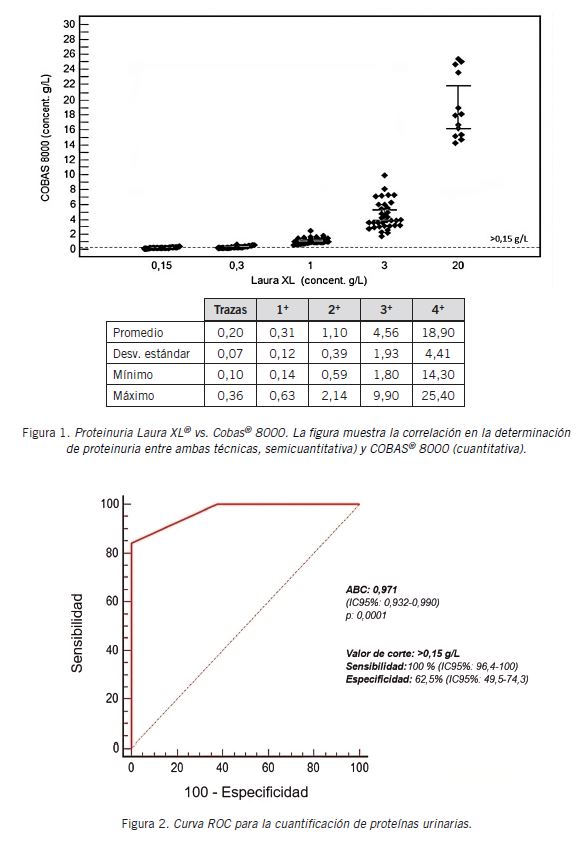
En la técnica automatizada de Laura XL la medición de proteína urinaria fue realizada por tiras reactivas DEKA PHAN® (técnica semicuantitativa). Se informó con la siguiente escala (Escala n°2 de las disponibles por el software): proteinuria 0,15 g/L, 0,3 g/L, 1 g/L, 3 g/L y 20 g/L (equivalentes a trazas, 1+, 2+, 3+ y 4+ respectivamente).
La segunda plataforma fue un iRICELL® - Beckman Coulter (IRIS Diagnostic -Chatsworth, CA, EE.UU.) constituida por un módulo de química “iChem®-VELOCITY” y un módulo de microscopía iQ® 200-ELITE, ambos controlados con sus respectivos controles internos: IRISpecTM CA/CB/CC e iQ-Control/Focus Set. El módulo de química evalúa la tira de orina por reflectancia a tres longitudes de onda (LED nominales a 472 nm, 525 nm y 630 nm +/- 2 nm), la densidad lo hace por índice de refracción utilizando un refractómetro Atago; el color por sensor y la turbidez de la muestra se determina por dispersión de la luz. El segundo módulo, iQ® 200-ELITE realiza el diagnóstico por imagen por medio de flujo laminar con técnica Digital Flow Morphology y el software Auto-Particle Recognition (APR), clasificando y cuantificando las imágenes en categorías preestablecidas.
En ninguno de los analizadores se realiza el centrifugado de las muestras y se empleó una celda de decantación en Laura XL® y una celda de flujo laminar en iRICELL®.
La cuantificación de las proteínas urinarias se realizó en un analizador de química Modular COBAS® 8000 - Hitachi (Hitachi High-Tecnologies Corporation. Tokio, Japón) por el método turbidimétrico TPU-3.
Métodos estadísticos
Se emplearon los programas estadísticos MedCalc v10.2 (versión demo) y GraphPad InStat v3.01 (versión demo). Para el análisis de concordancia de variables categóricas se empleó el índice de concordancia Kappa de Cohen (k). Variables analizadas: turbidez, color, nitritos, hemoglobina, cetonas, proteínas, glucosa, tiras reactivas positivas, células epiteliales, leucocitos, hematíes y criterio de normalidad. Se consideraron los siguientes valores de k para su interpretación: >0,20 pobre concordancia, 0,21-0,40 escasa concordancia, 0,40-0,60 moderada concordancia, 0,61-0,80 buena concordancia y 0,81-1,00 muy buena concordancia. Para el análisis de correlación lineal, entre variables numéricas, se utilizó el coeficiente de correlación de Spearman, se evaluó: pH, densidad, glucosuria y proteinuria. Para establecer la exactitud diagnóstica del valor de corte para proteinuria, se realizó una curva ROC, se consideró la cuantificación de proteínas urinarias por COBAS® 8000 como referencia, tomando como criterio de clasificación un valor >0,30 g/L, se cotejó contra la escala en cruces de las tiras reactivas DEKA PHAN®. Se consideró un p<0,05 como estadísticamente significativo.
Resultados
Los resultados de la comparación de Laura XL® vs. iRICELL® se muestran en la Tabla I. Se observó una escasa concordancia en la determinación de turbidez, buena concordancia en las determinaciones de color, cetonas, hemoglobina, glucosa, células epiteliales, leucocitos, hematíes y número total de tiras con reacción positiva para los analitos antes descriptos y muy buena concordancia para proteínas, nitritos y criterio de normalidad. También se observó una correlación estadísticamente significativa para pH y densidad. En el caso de la proteinuria, en la comparación entre Laura XL® vs. Cobas® 8000 (técnica semicuantitativa vs. cuantitativa) se obtuvo una alta significancia estadística (rs =0,916; p≤0,0001) (Fig. 1). Por curva ROC se determinó que la mayor exactitud diagnóstica correspondió a una concentración >0,15 g/L con una sensibilidad del 100% (IC95%=96,4-100%) y una especificidad del 62,5% (IC95%=49,5-74,3%) (Fig. 2); dicha concentración equivale a orinas con 1+ o más de proteínas urinarias establecida por tira reactiva DEKA PHAN® en Laura XL®.
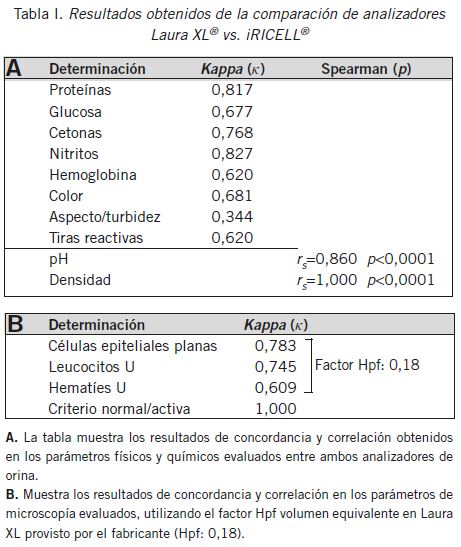
A. La tabla muestra los resultados de concordancia y correlación obtenidos en los parámetros físicos y químicos evaluados entre ambos analizadores de orina. B. Muestra los resultados de concordancia y correlación en los parámetros de microscopía evaluados, utilizando el factor Hpf volumen equivalente en Laura XL provisto por el fabricante (Hpf: 0,18).
Tabla I Resultados obtenidos de la comparación de analizadores Laura XL® vs. iRICELL®
Discusión y Conclusiones
Enfatizando en los resultados considerados de relevancia clínica (glucosuria, hemoglobina, nitritos, cetonas, proteinuria y criterio de normalidad), se fundamenta un adecuado desempeño de Laura XL® en esta institución, que mostró además una buena aceptación entre los profesionales; esto en gran parte fue posible por la experiencia previa en el uso e interpretación de analizadores de orina.
Se considera la necesidad de modificaciones en el software que permitan ajustar rangos de lectura como el de claridad/turbidez, que podrían ser aplicados como futuras actualizaciones del mismo.
En el caso de la turbidez, determinación en la cual se obtuvo la mayor discordancia, se encontró que Laura XL® presentaba una escala con valores de corte elevados, lo que hacía que algunas muestras ligeramente turbias fueran clasificadas como límpidas. Este fue el motivo causal de la discordancia hallada en nuestros resultados; no obstante, esta determinación es fácilmente corroborable en forma visual directa o por microscopía. Al evaluar el criterio de normalidad por microscopia, los resultados fueron certeros en relación a iRICELL®, ya que mostraron que el 100% de los sedimentos con clasificación de activo/patológico establecidos por este último, fueron igualmente determinados por Laura XL®.
En la determinación de proteinuria, se establece en el presente trabajo que a partir de la presencia de 1+ determinada por tiras DEKA PHAN® en Laura XL se debería cuantificar, dado que es un valor indicativo de confirmación por un método cuantitativo.
Las limitaciones en este trabajo fueron el bajo número de muestras patológicas que se analizaron, hecho inherente a una población general de pacientes. Se entiende que estos analizadores están pensados para ser usados como test de pesquisa, y que pierden rendimiento y confiabilidad en poblaciones con patologías específicas, como los pacientes renales, evento ya descripto por Chandrashekar et al. (15), quienes mostraron que los parámetros del análisis de orina automatizado son pobres predictores de lesión renal aguda y no encontraron acuerdo con la microscopía manual. Otra limitación podría ser el valor del “factor Hpf” en el conteo de los elementos formes del sedimento urinario, aunque adecuar el mismo modificaría los resultados de la comparación e interpretación del análisis de la microscopía de orina.
Sería apropiado, que con el correr del tiempo, más usuarios puedan compartir sus prácticas en el uso de este analizador de orina.
En base a los resultados obtenidos en el tiempo de uso transcurrido y teniendo en cuenta las determinaciones con relevancia de decisión clínica que fueron consideradas, se concluye que el desempeño del autoanalizador de orinas Laura XL® - Erba Mannheim fue satisfactorio, ya que mostró un rendimiento acorde a las necesidades y normativas de esta institución.
Con respecto a la determinación de proteínas urinarias, al obtener una correlación con alta significación estadística para una técnica cuantitativa, se avaló su utilización como test de tamizaje para la valoración y estudio de las mismas. En este trabajo se propone realizar la cuantificación de las muestras que presenten 1+ o más de proteínas urinarias determinadas por tiras DEKA PHAN® en Laura XL®.
Agradecimientos
Los autores agradecen con gran afecto al Dr. Sergio L. Grutadauria, al Dr. Ricardo D. Guglielmone y a la Dra. Silvia I. Barzón por sus incondicionales apoyos y colaboraciones otorgadas.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses respecto del presente trabajo.












 uBio
uBio