Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Ciencia y Tecnología
On-line version ISSN 1851-7587
Rev. cienc. tecnol. no.12 Posadas July/Dec. 2009
BIOQUÍMICA - FARMACIA
Ensayos preliminares in vitro de la capacidad aflatoxigénica de aspergillus flavus aislados de maní
In vitro preliminary assessment of aflatoxin ability of aspergillus flavus from peanuts
María E. Schapovaloff1, Isabel A. Señuk1, María C. Vedoya1, Martha G. Medvedeff1.
1.Cátedra de Micología. Facultad de Ciencias Exactas, Químicas y Naturales. Universidad Nacional de Misiones. UNaM. Avenida Mariano Moreno 1375. Posadas (3300). Misiones. Argentina. E-mail: micologia@ fceqyn.unam.edu.ar
• Martha Gladys Medvedeff1 Bioquímica. Doctor en Ciencias Técnicas. Cargo: Profesor Adjunto. Categoría Sistema de Incentivos: III.
• María Celina Vedoya1 Bioquímica. Maestría en Tecnología en Alimentos con tesis en desarrollo. Cargo: Jefe de Trabajos Prácticos. Categoría Sistema de Incentivos: III.
• María Elena Schapovaloff1 Licenciatura en Genética. Carrera de Doctorado en desarrollo. Cargo: sin cargo. Categoría Sistema de Incentivos: sin categoría.
• Isabel Any Señuk1 Estudiante de Licenciatura en Genética. Cargo: sin cargo. Categoría Sistema de Incentivos: sin categoría.
Resumen
En el presente trabajo se determinó, en semillas de maní el nivel de contaminación fúngica, caracterización morfológica de poblaciones de Aspergillus flavus y la producción de aflatoxinas en un medio indicador. Se ensayaron mil semillas de maní poscosecha distribuidas en grupos de cinco por placa de Petri, para la exteriorización de los hongos. Las especies de Aspergillus se aislaron en agar Czapek para su identificación. La producción de aflatoxinas de las poblaciones de A. flavus, se evaluó con el medio de agar coco. El 52% de las semillas presentó contaminación fúngica y se obtuvieron 57 aislamientos de A. flavus. Mediante visualización de un halo azul fluorescente bajo luz uV, un 12% de las cepas de A. flavus manifestaron ser productoras de aflatoxinas.
Palabras Clave: Aspergillus flavus; Aflatoxinas; Maní.
Abstract
In the present peanut study fungi level contamination, morphological characterisation of Aspergillus flavus populations and their aflatoxins production in a medium with an indicator were determined. A thousand postharvest peanuts were placed in groups of five in Petri dishes for fungi development. Fungi were isolated in Czapeck agar for Aspergillus species identication. To determine aflatoxins presence in Aspergillus populations, a coconut agar medium was used. A 52% of the seeds showed fungi contamination, from which 57 A. flavus were isolated. Aflatoxin-producing colonies were detected under long-wave uV light (365 nm) by blue fluorescence around the colonies, 12 % of A. flavus strains shwed to be aflatoxin producers.
Key Words: Aspergillus flavus; Aflatoxins; Peanut.
Introducción
El maní (Arachis hypogaea L.) es uno de los cultivos leguminosos más importante del mundo. Su origen está en Sudamérica, donde el género Arachis está ampliamente distribuido en Brasil, Paraguay, Bolivia, Argentina y Uruguay [1].
El maní tiene importancia como alimento por su valor energético y nutricional. Es una fuente rica en proteínas (25 % de la masa de los granos) y vitamina E (antioxidante), además de contener vitaminas del complejo B, ácido fólico, y minerales como calcio, fósforo, potasio y zinc [2].
Participa con 10 % de la producción mundial de aceite comestible, siendo los principales productores: India, China, Estados Unidos, Nigeria, Indonesia y Senegal [3]. La Argentina es el segundo exportador de maní después de EE.UU., principalmente para consumo humano directo [4].
El maní está expuesto a contaminación por hongos. La contaminación o la invasión por estos microorganismos pueden ocurrir en el suelo, durante el proceso de formación de las semillas, en la colecta y también en las fases de secado y almacenamiento [5, 6, 7, 8, 9]. Los mohos responsables más frecuentes pertenecen a los géneros Aspergillus, Penicillum y Rhizopus [10].
En condiciones favorables, varias especies fúngicas pueden producir micotoxinas que son metabolitos secundarios con potencial para causar toxicosis en el hombre y en los animales; cuando las semillas contaminadas son destinadas a la alimentación. En el grupo de estas sustancias, las más encontradas en los granos de maní y en sus derivados son las aflatoxinas B1, B2, G1 y G2 (AFB1, AFB2, AFG1, AFG2) [11, 12]. Estas micotoxinas son producidas, principalmente, por cepas toxigénicas de Aspergillus flavus Link y por Aspergillus parasiticus Speare [13].
La presencia de aflatoxinas es mayor en maní respecto a otras especies, debido a la alta afinidad del género Aspergillus por el cultivo, principalmente en condiciones de estrés hídrico hacia fines del ciclo [14], o elevada humedad durante la cosecha [15]. La presencia de micotoxinas en los alimentos conlleva a efectos tóxicos agudos o crónicos en la salud humana y animal, lo que ha determinado la regulación de sus niveles tanto nacional como internacionalmente. El control sanitario es factor condicionante de la comercialización de los granos [16].
Los objetivos que motivaron este estudio consistieron en la determinación del nivel de contaminación fúngica, caracterización morfológica de poblaciones de Aspergillus flavus en semillas de maní destinadas a consumo humano, así como también la producción de aflatoxinas, in vitro, en un medio indicador.
Materiales y Métodos
Se procesaron mil semillas de maní producidas y comercializadas en diferentes zonas de la provincia de Misiones.
Áreas de estudio
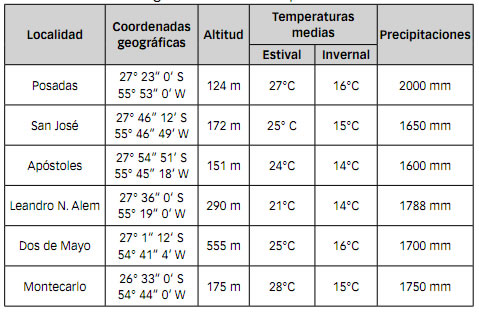
Las muestras estudiadas fueron obtenidas de seis municipios productores de maní de la provincia de Misiones: Dos de Mayo, Leandro N. Alem, Apóstoles, Montecarlo, San José y Posadas. El clima de estas áreas es subtropical sin estación seca, con abundantes precipitaciones de una media anual de 1700 mm (Tabla 1).
Tabla 1. Coordenadas geográficas, altitud, temperatura y precipitaciones de los sitios de origen de las muestras procesadas.
Método de incubación en papel de filtro
Para detectar los hongos asociados a las semillas de maní, se utilizó la técnica de Neergaard [17]. Se seleccionaron 50 semillas, aparentemente sanas, de cada una de las veinte muestras obtenidas y estas fueron transferidas, asépticamente, en grupos de cinco a placas de Petri. En la base de cada placa se dispuso papel de filtro esterilizado y embebido en agua destilada estéril. Las semillas, convenientemente distribuidas en las placas, fueron incubadas en estufa a temperatura de 25 °C ± 2 ºC por un período de 7 a 14 días para la exteriorización y desarrollo de los hongos [18].
Identificación de los hongos
Tras la visualización del desarrollo fúngico en las semillas de maní, se procedió al aislamiento de las diferentes especies para la posterior identificación en base a las característica macro y microculturales [19].
Determinación de las especies aspergillus
Se aislaron los Aspergillus de color verde oliva amarillento, típico del grupo A. flavus. Para la identificación presuntiva de A. flavus se utilizó el medio diferencial A. flavus y A. parasiticus agar (AFPA) [20]. En este medio, esta especie produce una coloración naranja-amarillenta característica en el reverso de la colonia luego de 48 h de incubación a 30 °C. La mayoría de las características fueron observadas a los 7 días de incubación. La identificación definitiva de las cepas se realizó de acuerdo con la clave de Klich y Pitt (1988) [21] y Pitt y Hocking (1997) [20].
Presencia de aflatoxinas
Para determinar la presencia de aflatoxinas en las poblaciones de A. flavus, las cepas se sembraron en medio rápido de detección agar coco (AC) y se incubaron durante 5 días a 25 °C. Tras el desarrollo fúngico las placas de AC se observaron bajo luz ultra violeta (365 nm). La presencia de un halo fluorescente azul alrededor de la colonia indica producción in vitro de la toxina [22].
Resultados y Discusión
De las muestras de semillas de maní analizadas, el 52 % presentó contaminación fúngica y fueron identificados los siguientes géneros: Aspergillus, Fusarium, Penicillium, Rhizopus y Sclerotium. Dentro de los géneros encontrados, se aislaron hongos de almacenamiento como de suelo [23].
El análisis sanitario de las semillas contaminadas acusó una ocurrencia simultánea de más de una especie fúngica en la misma semilla. Asociaciones de A. flavus, R. stolonifer y A. niger fueron frecuentes. Se debe tener en cuenta que la humedad relativa, la presencia de agua y las variaciones de temperatura, durante el proceso de formación y desarrollo de las semillas, son factores determinantes en la intensidad de la infección y contaminación por estos microorganismos [24].
Del 52 % de las semillas de maní procesadas, que presentaron contaminación fúngica, se aislaron 57 cepas de A. flavus. Especies de Aspergillus son consideradas iniciadoras del deterioro de las semillas y granos, causando daño, decoloración y alteraciones nutricionales [6].
Es importante destacar que las condiciones ambientales que favorecen el desarrollo de los hongos no son las mismas que favorecen la formación de aflatoxinas. La temperatura óptima de crecimiento, especialmente para A. flavus, está entre los 36 °C y 38 °C, con registros de actividad entre los 8 °C y 44 °C, con humedad relativa superior al 80 %. Mientras que la producción máxima de aflatoxinas se registra en el intervalo de 25 °C a 28 °C [25]. En Misiones, estas condiciones climáticas son habituales, no sólo en temporada estival sino incluso durante período invernal.
De las 57 cepas de A. flavus analizadas, el 88 % (50/57) no produjeron halo azul fluorescente bajo luz UV en agar coco a los 5 días de incubación, el 12 % (7/57) fue fuertemente fluorescente. La incubación de A. flavus en agar coco y su posterior exposición bajo luz UV, ha sido una prueba rápida y efectiva en la detección de cepas aflatoxicogénicas [26]. Davis et al. (1987) confirmaron por análisis químico la producción de aflatoxinas de las cepas que producen halo azul fluorescente en este medio de cultivo. Las que producen halo intenso son potentes productoras de aflatoxinas [22]. Inquieta la frecuencia de aislamiento de A. flavus, los cuales frente a factores ambientales específicos pueden producir las AFB1 y AFB2, potentes metabolitos teratogénicos y carcinogénicos [21, 27, 28, 29, 30].
Conclusiones
Se constató la presencia de los siguientes hongos asociados a las semillas de maní: Aspergillus spp., Fusarium spp., Penicillium spp., Rhyzopus spp. y Sclerotium spp.
Del 52 % de las semillas que presentaron contaminación fúngica, se obtuvieron 57 aislamientos de Aspergillus flavus.
El estudio de la capacidad aflatoxigénica in vitro, de las cepas de A. flavus fue de un 12 %.
Los cuidados en el almacenamiento, en especial en el control de humedad y temperatura, ayudarían a la prevención de la contaminación fúngica en las semillas de maní, tanto para el consumo "in natura" como para productos industrializados.
1. KRAPOVICKAS A. Y GREGORY W.C. Taxonomy of the genus Arachis (Leguminosae). Bonplandia 8: p. 1-186. 1994. [ Links ]
2. CONAB (COMPANHIA NACIONAL DE ABASTECIMENTO). Conjunturas agropecuárias-especiais 2005. Amendoim análise perspectiva do mercado 2004-2005. Março/2004. Disponible en http://www.conab.gov.br/centro.asp. Consultada el: 10 de Septiembre 2007. [ Links ]
3. BELTRÃO N.E.M. A Ccltura do amendoim na agricultura familiar brasileira, 2001. Disponible en http://www.21.sede.embrapa.gov.br/noticias. Consultada el: 18 de Diciembre 2007. [ Links ]
4. CASINI C.; MARTÍNEZ M.J. Y DARDANELLI J. Maní. Características del maní argentino, 2007; 168-171. Disponible en http://www.inta.gov.ar. Consultada el: 05 de Mayo 2008. [ Links ]
5. ROSSETTO C.A.V., CARVALHO V.N. Y MORAES L.T. Contaminação fúngica do amendoim em função das doses de calcário e das épocas de amostragem. Bragantia, Campinas 62: p. 437-445. 2003. [ Links ]
6. PITT J.I., DYER S.K. Y MCCAMMON, S. Systemic invasion of developing peanut plants by Aspergillus flavus. Let Appl Microbiol. 13: p. 16-20. 1991. [ Links ]
7. FERNANDEZ E., ROSOLEM C.A., MARINGONI A.C. Y OLIVEIRA D.M.T. Fungus incidence on peanut grains as affected by drying method and Ca nutrition. Field Crops Res. 52: p. 9-15. 1997. [ Links ]
8. ALMEIDA F., MORAES J. Y SANTOS R. Influência do beneficiamento, da embalagem e do ambiente de armazenamento na qualidade sanitária de sementes de amendoim. Rev. Bras Ol. Fibros. 2: p. 97-102. 1998. [ Links ]
9. BRUNO R.L.A., AZEREDO G.A., QUEIROGA V.P., ARAÚJO E. Y DINIZ E. Qualidade fisiológica e microflora de sementes de amendoim cv. Br-1 durante o armazenamento. Rev. Bras. Ol. Fibros. 4: p. 141-152. 2000. [ Links ]
10. MORAES S.A., MARIOTTO P.R. Diagnóstico da patologia de sementes de amendoim no Brasil. Rev. Bras. Sementes 7: p. 41-43. 1985. [ Links ]
11. HILL R.A., BLANKENSHIP P.D., COLE R.J. Y SANDER T.H. Effect of soil moisture and temperature on preharvest invasion of peanuts by the Aspergillus flavus group and subsequent aflatoxin development. Appl. Environ. Microbiol. 45: p. 628-633. 1983. [ Links ]
12. KUMEDA Y. Y ASSAO T. Heteroduplex panel analysis, a novel method for genetic identification of Aspergillus Section Flavi strains. Appl. Environ. Microbiol. 67: p. 4084-4090. 2001. [ Links ]
13. ANGLE J.S., DUNN K.A. Y WAGNER G.H. Effect of cultural practices on the soil populations of Aspergillus flavus and Aspergillus parasiticus. Soil Sc. Soc. Am. J. 46: p. 301-303. 1982. [ Links ]
14. MELOUK H.A. Y SHOKES F.M. Management of soilborne fungal pathogens. Peanut health management. Ed. The American Phytopathological Society. Minnesota USA p. 75-82. 1995. [ Links ]
15. FONSECA, H. Sistema de amostragem para análise de aflatoxinas en grãos. Rev. Microbiol. 21: p. 66-70. 1991. [ Links ]
16. VAN EGMONT H.P., JONKER M.A. EN: MAGAN, N.; OLSEN, M. Mycotoxins in food. Detection and control. Editorial Wood-head Publishing Limited. Capítulo 3: p. 49-68. 2004. [ Links ]
17. NEERGAARD P. Seed Pathology. The Mac Millan Press LTDA, London. Capítulo 2: p. 839. 1979. [ Links ]
18. FARIAS A.X. Contaminacão endógena por Aspergillus spp. e seus telomorfos com potencial toxígeno em milho póscolheita do estado do Paraná. Itaguaí: Universidade Federal Rural do Rio de Janeiro. p. 52. Tese de Mestrado. 1996. [ Links ]
19. BARNETT H.L. Y HUNTER B.B. lustrated genera of imperfect fungi. 3ra. Edição. Burgess Publishing Company, Minesota p. 209. 1972. [ Links ]
20. PITT J.I. Y HOCKING A.D. Fungi and Food Spoilage. 2da. Edición. Gaithersburg, MD, Blackie Academic & Professional p. 592. 1997. [ Links ]
21. KLICH M.A. Y PITT J.I. Differentiation of Aspergillus flavus from A. parasiticus and other closely related species. Transactions of the British Mycological Society 91: p. 99-108. 1988. [ Links ]
22. DAVIS N.D., IYER S.K. Y DIENER U.L. Improved method of screening for afaltoxin with a coconut agar medium. Appl. Environ. Microbiol. 53: p. 1593-1595. 1987. [ Links ]
23. DINIZ S.P. Micotoxinas. Livraria e Editora Rural. 1ra. Edición p. 181. 2002. [ Links ]
24. MERONUCK R.A. The significance of fungi in cereal grains. Plant Dis 71: p. 287-291. 1987. [ Links ]
25. SOAVE J. Y WETZEL M.M.V. (EDS). Patologia de Sementes. 5ta. Edición. Fundação Cargil. Campinas p. 347-357. 1987. [ Links ]
26. LIN M.T. Y DIANESE J.C. A coconutagar medium for rapid detection of aflatoxin production by Aspergillus spp. Phytopatol. 66: p. 1466-1469. 1976 [ Links ]
27. WICKLOW D.T. The mycology of stored grain: An ecology perspective. Stored grain ecosystems 7: p. 197-249. 1995. [ Links ]
28. DHINGRA O.D. Y NETTO R.A.C. Micotoxinas em grãos. RAPP 6: p. 49-101. 1998. [ Links ]
29. GURJÃO, K.C.O. Qualidade fisiológica, nutricional e sanitária de sementes armazenadas de amendoim (Arachis hypogaea L.), produzidas no semi-árido nordestino. Dissertação de mestrado, UFPB-CCT-Campus II, Curso de pós-graduação em engenharia agrícola p. 88. 1995. [ Links ]
30. GUZMÁN DE PEÑA D. La exposición a la aflatoxina B1 en animales de laboratorio y su significado en la salud pública. Salud Pública Mex. 49: p. 227-235. 2007. [ Links ]
Recibido: 11/03/09.
Aprobado: 04/09/09.














