INTRODUCCIÓN
El género Jatropha L. (Euphorbiaceae) posee una distribución pantropical, con más de 100 especies en América, 70 en África y Arabia, y cuatro en la India (Fernández Casas, 2016). Las plantas son utilizadas en la medicina folklórica tradicional para curar diversas enfermedades, así como ornamentales y como cultivos energéticos, debido a las propiedades de sus semillas para la obtención de biodiesel (Sharma & Singh, 2012). Dado que la demanda mundial de biodiesel ha aumentado en los últimos años, el interés por nuevos cultivos oleaginosos se ha incrementado notablemente. Varios autores estudiaron la producción de este biocombustible obtenido a partir de especies de Jatropha y analizaron las formas de cultivo, el área geográfica óptima para el desarrollo agroforestal, el contenido y calidad de aceite de las semillas, la conversión de aceites a subproductos, etc. (Achten et al., 2008; Falasca & Ulberich, 2008; Aranda Rickert et al., 2011; Wassner et al., 2012). La especie más estudiada en este sentido a nivel mundial es Jatropha curcas L., y los trabajos realizados revelan que la calidad del biocombustible obtenido a partir de los extractos de sus semillas cumple con los estándares mínimos, tanto europeos como americanos, requeridos para su utilización. Teniendo en cuenta el aprovechamiento económico de J. curcas, se están impulsando estudios a lo largo del mundo con el objetivo de ampliar el conocimiento
respecto de otras especies del género (Aranda Rickert et al., 2011; Wassner et al., 2012). Por ejemplo, en Argentina, el Instituto Nacional de Tecnología Agropecuaria (INTA), ha desarrollado un proyecto específico sobre Jatropha en el marco del Programa Nacional de Bioenergía (Consejo Agropecuario del Sur, 2009).
En la Argentina, habitan diez especies autóctonas distribuidas desde el norte al centro del país: Jatropha breviloba (Morong) Pax & K. Hoffm., J. excisa Griseb., J. gossypiifolia L., J. grossidentata Pax & K. Hoffm., J. hieronymi Kuntze, J. hippocastanifolia Croizat, J. isabelliae Müll. Arg., J. macrocarpa Griseb., J. pedersenii Lourteig y J. peiranoi Lourteig & O’Donell; además de J. curcas L. que es adventicia (Zuloaga et al., 2019; permanentemente actualizado en http://conosur.floraargentina.edu.ar). Jatropha breviloba, J. isabelliae y J. pedersenii, habitan en el noreste del país, dentro de la Provincia Fitogeográfica Paranaense, y están asociadas a ambientes húmedos; el resto de las especies nativas se distribuye en el noroeste del país, en las Provincias Fitogeográficas Chaqueña, del Monte, de las Yungas y Prepuneña (Font, 2003). En la región Fitogeográfica Chaqueña, el clima es cálido, con escasas precipitaciones estivales en la zona occidental y predominancia de bosques caducifolios xerófitos (Cabrera, 1994). Allí, es frecuente encontrar a J. excisa, J. hieronymi y J. macrocarpa, en poblaciones que se distribuyen en parches de tamaño variable (Aranda Rickert, 2011).
Estos taxones poseen hábito arbustivo, aunque J. hieronymi y J. macrocarpa pueden adoptar porte de árbol pequeño con el tiempo. Las tres especies son perennes, caducifolias, con hojas grandes y simples (lobuladas a palmadas), flores dispuestas en inflorescencias y frutos dehiscentes; su tallo es leñoso, con función de acumulación de reservas (Fernández Casas & Pizarro Domínguez, 2007a; 2007b; Aranda Rickert, 2011). Se ha reconocido la potencialidad de las tres especies para la obtención de biodiesel, a partir del aceite de sus semillas, siendo J. macrocarpa la más estudiada en este sentido (Falasca & Ulberich, 2008; Aranda Rickert et al., 2011; Clérici et al., 2013).
El estrés ambiental juega un papel importante en la evolución de las plantas; el rango de temperatura y la disponibilidad de agua se encuentran entre los principales factores que determinan el grado de especificidad en relación con el hábitat (Fahn & Cutler, 1992). De acuerdo al ambiente donde los vegetales se desarrollan, serán diferentes las estrategias para optimizar y asegurar la conducción de agua (Moglia & López, 2001; Montaño Arias et al., 2013). En lugares xerofíticos, la vegetación está sometida a radiación intensa, alternancia de temperaturas extremas, suelo pobre en nutrientes y baja disponibilidad de agua; todos estos factores llevan a cambios morfológicos, anatómicos y fisiológicos, que han permitido la evolución hacia formas vegetales aptas para crecer ante estas situaciones de déficit hídrico y altas temperaturas (Beltramini y Zapata, 2020). Las regiones que son secas y a la vez cálidas, ofrecen los ejemplos más claros de cómo el estrés hídrico influye en las características del xilema (Carlquist, 2001). El sistema xilemático de los vegetales que viven en ambientes secos está preparado para conducir la escasa cantidad de agua distribuida en un período anual determinado: posee vasos numerosos, agrupados y de diámetro pequeño, y elementos conductores de longitudes cortas; estas características confieren a las plantas una mayor seguridad y eficiencia en la conducción de agua, permitiendo resistir altas tensiones, disminuyendo el riesgo de embolia y otorgando resistencia al estrés hídrico (Fahn & Cutler, 1992; Carlquist, 2001; Moglia & López, 2001; León, 2005; Montaño Arias et al., 2013). La relación área de tejido xilemático/área total del tallo, también es un carácter anatómico que define la capacidad de transporte de agua. Se observa que en especies arbóreas, a medida que aumenta el área xilemática, la cantidad de agua transportada es mayor, y este carácter puede ser un indicador de mayor adaptación de las plantas a condiciones de baja humedad en el suelo (Sory Toure et al., 2010). Carlquist (1977) propuso índices para evaluar la vulnerabilidad a la sequía en plantas, el agrupamiento de los vasos y el grado de mesomorfía, que relaciona densidad, diámetro y longitud de los vasos. Estos índices permiten conocer la resistencia de las especies a bajas precipitaciones, principalmente en plantas que habitan en zonas secas. Además de las características del xilema, es posible identificar en los tallos otros caracteres anatómicos típicos de plantas xerófitas, como la presencia de tejidos reservantes, abundancia de tejidos de sostén (colénquima y esclerénquima) y de parénquima con cloroplastos, desarrollo temprano del cambium vascular y tejidos vasculares secundarios, entre otros (Pérez Cuadra & Cambi, 2014; Beltramini & Zapata, 2020).
Son pocos los trabajos realizados sobre la anatomía vegetativa de las especies nativas de Jatropha (Malbrán Barros et al., 2016; Tavecchio et al., 2016; Malbrán Barros et al., 2017; Malbrán Barros, 2018); los mismos se centran en aspectos de la estructura primaria, pero hasta el momento no se ha analizado el tallo con crecimiento secundario en ninguna de ellas. Teniendo en cuenta la falta de estudios anatómicos en estas especies nativas, y considerando su importancia como potenciales productoras de biodiesel, en este trabajo analizamos la morfoanatomía del tallo con crecimiento secundario de J. excisa, J. hieronymi y J. macrocarpa, considerando aspectos relacionados con el ambiente árido que habitan, a fin de aportar información que sea útil para su conservación y el posible uso sustentable de los taxones.
MATERIALES Y MÉTODOS
Área de estudio y colección de las muestras Se trabajó con material colectado en las provincias de Catamarca, Santiago del Estero y Córdoba, en localidades pertenecientes al Distrito Chaqueño Occidental de la Provincia Fitogeográfica Chaqueña de Argentina (Cabrera, 1994). En dicha región, la precipitación media anual es de 500-800 mm, con temperaturas máximas que superan los 45° C, y mínimas por debajo de 0° C; la vegetación está formada por bosques xerófitos, algunos palmares, estepas halófilas y sabanas edáficas o inducidas por incendios y desmontes (Cabrera, 1994; Giménez & Moglia, 2003).
Durante noviembre de 2016, se visitaron 3 sitios para cada una de las especies y se muestrearon tres ejemplares adultos, de aspecto saludable, en cada sitio. Se trabajó con nueve individuos de cada especie. Con el fin de obtener caracterizaciones comparables, se utilizaron secciones de ramas de segundo y tercer orden (considerando primer orden al eje principal), de aspecto leñoso y 2-3 cm de diámetro, que fueron fijadas en una mezcla de formaldehído, alcohol y ácido acético (FAA) (Zarlavsky, 2014). Los ejemplares de referencia están depositados en el Herbario del Museo Botánico de Córdoba (CORD). Los ejemplares de referencia en cada sitio de colecta son:
Jatropha excisa.
ARGENTINA. Catamarca. Depto. Capital, Banda de Varela, 65º45´30,39´´W y 28º26´05,96´´S, 578 m s.m., 21-XI-2016, Cosa et al. 435 (CORD); Camino a gruta de la Virgen del Valle, 65º47´80,97´´W y 28º25´18,87´´S, 635 m s.m., 21-XI- 2016, Cosa et al. 436 (CORD). Córdoba. Depto. Tulumba, RN 60, km 891, pasando Lucio V. Mansilla, camino a Deán Funes, 64º39´06,30´´W y 29º52´99,50´´S, 233 m s.m., 23-XI-2016, Cosa et al. 448 (CORD).
Jatropha hieronymi.
ARGENTINA. Santiago del Estero. Depto. Choya, RP 24, entrando 5 km a la Quebrada de Maquijata entre La Merced y Villa La Punta, 64º47´71,72´´W y 28º15´02,36´´S, 456 m s.m., 22- XI-2016, Cosa et al. 444 y 445 (CORD); RP 24, Villa La Punta cerca del Dique, 64º48´04,10´´W y 28º22´30,80´´S, 433 m s.m., 22-XI-2016, Cosa et al. 446 (CORD).
Jatropha macrocarpa.
ARGENTINA. Catamarca. Depto. Capital, RP 33, 18 km antes de San Fernando del Valle de Catamarca, 65º44´09,08´´W y 28º31´29,86´´S, 540 m s.m., 21-XI-2016, Cosa et al. 432 (CORD); Banda de Varela, 65º45´56,12´´W y 28º31´29,86´´S, 540 m s.m., 21-XI-2016, Cosa et al. 433 (CORD); Banda de Varela, 65º45´67,61´´W y 28º26´01,36´´S, 570 m s.m., 21-XI-2016, Cosa et al. 434 (CORD).
Estudios morfoanatómicos del tallo
Para los estudios exomorfológicos, se analizó tanto el material conservado, como el herborizado y los registros fotográficos in situ. Se describió el tallo según el color y la textura de la corteza, siguiendo el trabajo de Demaio et al. (2015). Para los estudios anatómicos se utilizaron ramas conservadas, de aproximadamente 2-3 cm de diámetro; se hicieron preparados histológicos temporarios a mano alzada, con una hoja de bisturí, realizando cortes transversales y longitudinales tangenciales, de 0,2 mm de espesor, aproximadamente. Se colorearon con azul astral- fucsina básica (Kraus et al., 1998), se enjuagaron con agua destilada y se montaron con glicerina. Este procedimiento evita la deshidratación, y de esta forma las muestras no se modifican o agrietan (Wang & Aitken, 2001). Las observaciones se realizaron con un microscopio óptico compuesto ZEISS Primo Star y se tomaron microfotografías con una cámara digital Nikon Coolpix S630. Para la clasificación de los laticíferos, se siguió a Dehgan & Craig (1978).
Variables xilemáticas analizadas
A partir de los preparados histológicos de cortes transversales, se calculó:
● Área del xilema/área total del tallo (%): se utilizaron fotografías de los preparados, que fueron analizadas con el programa ImageJ (Rasband, 2018), el cual permite conocer el área seleccionada de una imagen partiendo de una distancia conocida.
● Número de vasos por mm2: se obtuvo usando un ocular con cuadrícula de 0,065 mm2 y contando todos los vasos presentes en seis campos por individuo (54 campos por especie), seleccionados al azar. Los vasos fueron considerados como extremadamente poco numerosos (≤ 5 vasos por mm2), poco numerosos (5-20 vasos por mm2), numerosos (20-40 vasos por mm2), muy numerosos (40-100 vasos por mm2) y extremadamente numerosos (≥ 100 vasos por mm2) (Carlquist, 1977; IAWA Committee, 1989).
● Diámetro de los vasos: se midió el diámetro de seis vasos por individuo (54 para cada especie), seleccionados al azar. El diámetro se consideró muy pequeño (≤ 50 μm), pequeño (50-100 μm), mediano (100-200 μm) y grande (≥ 200 μm) (Carlquist, 1977; IAWA Committee, 1989).
A partir de los preparados histológicos de cortes longitudinales tangenciales, se calculó:
● Longitud de elementos de vaso: se midió la longitud de seis elementos por individuo (54 para cada especie), seleccionados al azar. La longitud se consideró corta (≤ 350 μm), mediana (350-800 μm) y larga (≥ 800 μm) (Carlquist, 1977; IAWA Committee, 1989).
Índices analizados
● Índice de vulnerabilidad (IV): se obtiene dividiendo la media del diámetro de los vasos por la media del número de vasos por mm2. Un índice mayor a uno indica vulnerabilidad a la sequía, y menor a uno demuestra resistencia (Carlquist, 1977).
● Índice de mesomorfía (IM): se calcula multiplicando la longitud media de los elementos de vaso por el IV. Un índice mayor a 200 representa un xilema mesofítico, y menor o igual a 75 significa que es xerofítico (Carlquist, 1977).
● Índice de agrupamiento de los vasos (IVg) : se obtiene dividiendo el número total de vasos por el número de grupos de vasos. Un índice igual a uno indica vasos exclusivamente solitarios, y a mayor índice, mayor es el grado de agrupamiento de vasos (Carlquist, 2001).
Análisis estadísticos
Para la variable “área del xilema/área total del tallo” se realizó un diseño completamente aleatorizado; para “número de vasos por mm2”, “diámetro de los vasos” y “longitud de los elementos de vaso” se realizó un diseño con estructura anidada de tratamientos, donde el factor “Individuo” está anidado dentro del factor “Especie”. Los datos cuantitativos obtenidos se sometieron a un análisis de la varianza (ANAVA), seguido por la prueba de LSD Fisher (P ≤ 0.05). Previamente, se corroboró que se cumplieran los supuestos de normalidad y homogeneidad de la varianza. Los análisis se llevaron a cabo mediante el paquete estadístico Infostat (Di Rienzo et al., 2018).
RESULTADOS
Exomorfología
Los tallos de las tres especies son glabros, de color verde a marrón en J. excisa, y grisáceo en J. hieronymi y J. macrocarpa. En estas dos últimas especies, la corteza o ritidoma es transversalmente exfoliante, es decir, se desprende en escamas que se enrollan cuando el tallo supera los tres cm de diám.; esto no ocurre en J. excisa (Fig. 1A-C). En los sitios de abscisión de las hojas, hay cicatrices prominentes. En J. excisa, las cicatrices foliares tienen forma orbicular achatada en el lado adaxial, mientras que en J. hieronymi y J. macrocarpa son suborbiculares con una concavidad en el lado abaxial que termina en un apículo (Fig. 1D-F). Se observan lenticelas distribuidas irregularmente en J. excisa y J. hieronymi, mientras que en J. macrocarpa las mismas se disponen en pequeños grupos. En J. excisa las lenticelas son más abundantes, alargadas, paralelas al eje del tallo y blanquecinas; en J. hieronymi y J. macrocarpa, se observan circulares y parduzcas (Fig. 1G-I).
Anatomía
Los tallos presentan forma circular en sección transversal. En los individuos adultos analizados, se observa en sus ramas de aspecto leñoso, un crecimiento secundario en etapa temprana. De afuera hacia adentro, se reconocen los siguientes estratos: peridermis, corteza, tejidos vasculares y médula (Fig. 2A-C), que se describen a continuación.
Peridermis: conformada por 2-4 estratos de súber, felógeno superficial y 2-8 capas de felodermis; la felodermis está compuesta por células rectangulares, aplanadas tangencialmente, sin espacios intercelulares; tanto el súber como la felodermis presentan paredes celulares engrosadas. En J. hieronymi y J. macrocarpa es continua, mientras que no lo es en J. excisa, donde la epidermis uniestratificada aún persiste. En ese caso, las células epidérmicas propiamente dichas son rectangulares, con cutícula lisa y delgada (Fig. 3A-C).
Corteza interna: se compone de aproximadamente 40 estratos de células en J. excisa y J. hieronymi, y 60 en J. macrocarpa.

Fig. 1 Exomorfología del tallo con crecimiento secundario de especies nativas de Jatropha. A, ritidoma no exfoliante de J. excisa, en tallo principal. B-C, ritidoma exfoliante de J. hieronymi y J. macrocarpa, respectivamente, en tallo principal. D-F, cicatrices foliares de J. excisa, J. hieronymi y J. macrocarpa, respectivamente, en ramas de segundo y tercer orden. Las flechas señalan la ubicación de las cicatrices. G-I, lenticelas en J. excisa, J. hieronymi y J. macrocarpa, respectivamente, señaladas por punta de flecha. Figura en color en la versión en línea http:// www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/906/1210
Se distinguen 2-3 capas externas de colénquima lamelar; por debajo, hay 2-4 estratos discontinuos de colénquima angular en J. hieronymi y J. macrocarpa, y 4-8 capas continuas en J. excisa. Los primeros 5-6 estratos de parénquima, ubicados por debajo del colénquima, presentan cloroplastos. Por debajo del clorénquima, el parénquima cortical de las tres especies posee células redondeadas con paredes moderadamente engrosadas y espacios intercelulares pequeños (Fig. 3A-C). En J. hieronymi, se observan pequeños grupos de fibras en la corteza, los cuales están ausentes en las otras dos especies (Fig. 2B). Además, se evidencian fibras perivasculares en las tres especies, dichas agrupaciones son más grandes en J. excisa y J. hieronymi en relación a las de J. macrocarpa (Fig. 2A-C y 4A-C). Algunas células parenquimáticas poseen cristales (drusas y pequeños cristales prismáticos), otras acumulan gránulos de almidón, los cuales son comparativamente más abundantes en J. macrocarpa (Figs. 3A-C y 4D-F). Hay abundantes laticíferos, principalmente en los estratos más próximos al floema, conteniendo látex de color pardo oscuro (Fig. 4A-D). En corte longitudinal tangencial, se observa que los laticíferos en J. macrocarpa son articulados no anastomosados, y no articulados, tanto ramificados como no ramificados. En J. excisa y J. hieronymi, además de los tres tipos mencionados, se evidenciaron también laticíferos articulados anastomosados (Fig. 5A-D).
Tejidos vasculares: evidencian una etapa temprana del crecimiento secundario, y se disponen en un anillo continuo de floema secundario, una zona cambial y un anillo continuo de xilema secundario (Fig. 2A-C). El floema consta de 6-10 estratos celulares; los radios parenquimáticos son uni o biseriados, aunque en J. macrocarpa, algunos se ensanchan, llegando a ser multiseriados. En las tres especies hay laticíferos en este tejido (Fig. 6A-C). En el xilema, la porosidad es difusa en las tres especies, con poros parcialmente solitarios y parcialmente agrupados en filas radiales; en los tres taxones se aprecian además, grupos pequeños de vasos que están en contacto entre sí por sus paredes radiales y tangenciales. Los radios parenquimáticos son uni y biseriados (Fig. 6D-F).
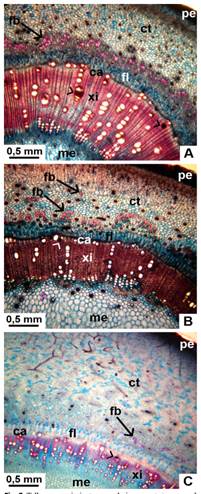
Fig. 2 Tallo con crecimiento secundario, en corte transversal de especies nativas de Jatropha. A, vista general de J. excisa. B, vista general de J. hieronymi. C, vista general de J. macrocarpa. Abreviaturas: ca, zona cambial; ct, corteza; fb, fibras; fl, floema secundario; me, médula; pe, peridermis; xi, xilema secundario. Con punta de flecha se señalan vasos ocluidos. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/906/1210
No se observó tilosis en ningún caso, pero en los tres taxones, algunos vasos aislados se encuentran ocluidos por una sustancia parda, presumiblemente taninos o gomas (Fig. 2A-C y Fig. 6B-C,E). El parénquima axial es de distribución apotraqueal; en J. excisa es agregado (Fig. 6D), mientras que en J. macrocarpa y J. hieronymi, se dispone como cordones entre los vasos y fibras, siendo difuso (Fig. 6E-F). En sección longitudinal tangencial, los elementos de vaso presentan punteaduras alternas, de contornos circulares a ovalados en sus paredes laterales; en los extremos, las paredes son oblicuas. Las fibras libriformes poseen paredes moderadamente engrosadas, y se encontraron además fibras septadas en las tres especies. Se observan granos de almidón tanto en las células del parénquima axial como en las células de los radios. Hay también traqueidas vasicéntricas, de paredes más finas (Fig. 7A-D).
Médula: formada por parénquima con células grandes, redondeadas a isodiamétricas, de paredes delgadas y con pequeños espacios intercelulares. En J. macrocarpa, se observan abundantes granos de almidón. Jatropha excisa y J. hieronymi poseen abundantes laticíferos, los cuales están ausentes en J. macrocarpa (Fig. 8A-C).
Variables xilemáticas analizadas
El xilema secundario de J. excisa y J. hieronymi presenta vasos numerosos (27,63 y 28,48 vasos por mm2, respectivamente), mientras que en J. macrocarpa son muy numerosos (58,67 vasos por mm2), existiendo diferencias significativas respecto a las otras dos especies. En cuanto al diámetro de los vasos, los valores medios indican que es pequeño (63,38 μm en J. excisa, 63,93 μm en J. hieronymi y 55,60 μm en J. macrocarpa), aunque J. macrocarpa se diferencia significativamente por poseer el diámetro medio más chico. Los miembros de vaso son de longitudes cortas en los tres taxones (304,76 μm en J. excisa, 280,95 μm en J. hieronymi y 221,69 μm en J. macrocarpa), siendo significativamente menor en J. macrocarpa. Respecto al área del xilema/área total del tallo (%), se encontraron diferencias significativas entre las tres especies: J. macrocarpa presentó el menor valor (9,35%), J. hieronymi presentó un valor intermedio (14,76%) y J. excisa el mayor porcentaje (24,32%).
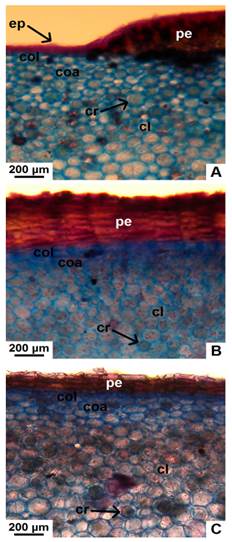
Fig. 3 Detalle de peridermis y corteza interna, en corte transversal de tallo con crecimiento secundario de especies nativas de Jatropha. A, peridermis en formación, colénquima y parénquima en J. excisa. B, peridermis, colénquima y parénquima en J. hieronymi. C, peridermis, colénquima y parénquima en J. macrocarpa. Abreviatura: cl, clorénquima; coa, colénquima angular; col, colénquima lamelar; cr, cristal; ep, epidermis; pe, peridermis. Figura en color en la versión en línea http://www.ojs.darwin.edu. ar/index.php/darwiniana/article/view/906/1210
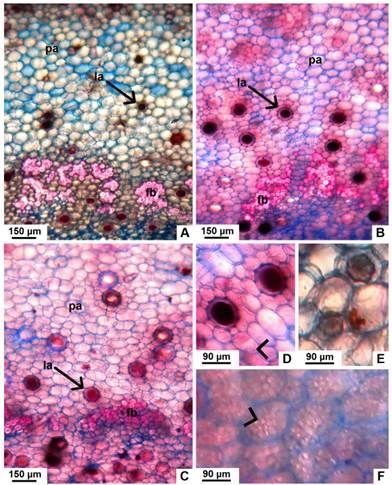
Fig. 4 Detalle de la corteza interna, en corte transversal de tallo con crecimiento secundario de especies nativas de Jatropha. A-C, corteza de J. excisa, J. hieronymi y J. macrocarpa respectivamente, mostrando fibras perivasculares y laticíferos. D, detalle de los laticíferos de J. hieronymi, donde se observa la pared del mismo y el látex de color pardo oscuro. E, células de J. macrocarpa conteniendo cristales (drusas). F, parénquima reservante de almidón en J. macrocarpa. Abreviaturas: fb, fibras; la, laticífero; pa, parénquima. Con punta de flecha se señalan los granos de almidón. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/906/1210
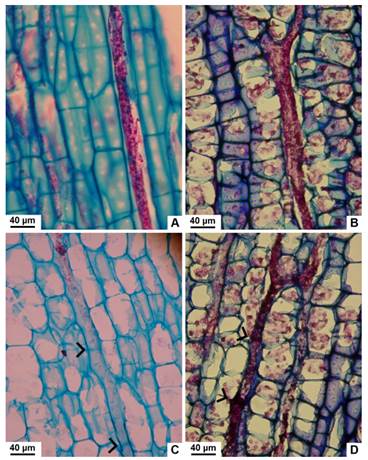
Fig. 5 Tipos de laticíferos observados en tallo con crecimiento secundario de especies nativas de Jatropha, vista longitudinal tangencial. A, no articulado, no ramificado de J. excisa. B, no articulado, ramificado de J. hieronymi. C, articulado, no anastomosado de J. macrocarpa. D, articulado, anastomosado de J. hieronymi. Con punta de flecha se señalan las articulaciones. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/ darwiniana/article/view/906/1210
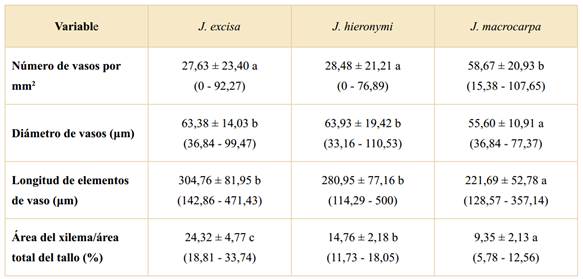
Tabla 1 Análisis de la varianza de caracteres analizados en tallo con crecimiento secundario de tres especies nativas de Jatropha. Los valores representan promedios ± desvío estándar; los números entre paréntesis son los valores mínimo y máximo observado para cada especie. Letras diferentes muestran diferencias significativas entre especies (p < 0,05).
Índices analizados
Jatropha excisa y J. hieronymi poseen un IV de 2,29 y 2,24 respectivamente. Por su parte, J. macrocarpa presentó un IV de 0,95, considerablemente menor en relación a las otras dos especies. Según el IM, las tres especies responden a un xilema mesofítico, aunque en J. macrocarpa fue considerablemente menor (210,61) en relación al de J. excisa (697,9) y J. hieronymi (629,33). El IVg es mayor a 1 en los tres taxones (2,88 en J. excisa, 3,1 en J. hieronymi y 2,83 en J. macrocarpa), lo cual significa que, si bien hay vasos solitarios, la mayoría se encuentran agrupados en el xilema secundario.
DISCUSIÓN
La morfoanatomía del tallo de las especies analizadas muestra una marcada uniformidad, no sólo en la composición de los tejidos, sino también en la disposición de los mismos, los cuales se distribuyen siguiendo el modelo más común en Euphorbiaceae (Thakur & Patil, 2012; Webster, 2014). A pesar de que los individuos analizados eran ejemplares adultos, los tres taxones evidenciaron una etapa temprana del crecimiento secundario, caracterizada por xilema y floema secundario en desarrollo, y una peridermis que, en el caso de J. excisa, aún estaba en formación. Es importante conocer las etapas tempranas del crecimiento secundario de estas especies ya que pone en evidencia que los meristemas laterales (el cámbium vascular y el felógeno) se desarrollan tempranamente, brindando a las plantas ciertas ventajas que les permiten protegerse en ambientes hostiles (Pérez Cuadra & Cambi, 2014).
Sólo en J. hieronymi y J. macrocarpa, el ritidoma se desprendía en láminas papiráceas; la presencia o ausencia de corteza exfoliante es un carácter con implicancia taxonómica (Dehgan, 2012). Los rasgos de la corteza externa han recibido comparativamente menos atención que el xilema en los estudios ecológicos de la resistencia al déficit de agua, pero la evidencia sugiere que su papel podría ser central en la seguridad hidráulica (Loram-Lourenço et al., 2020).
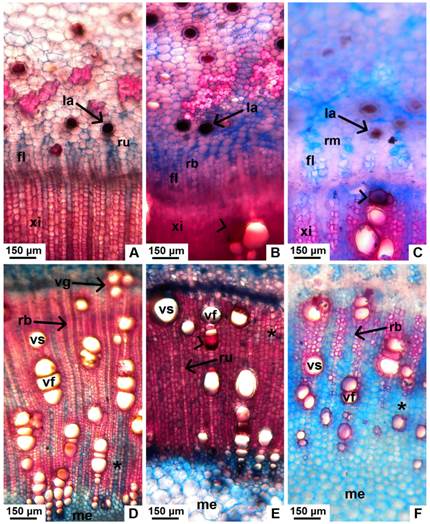
Fig. 6 Tejidos vasculares en tallo con crecimiento secundario de especies nativas de Jatropha, corte transversal. A, floema secundario de J. excisa, con radios uni y biseriados. B, floema secundario de J. hieronymi con radios uni y biseriados. C, floema secundario de J. macrocarpa, con radios multiseriados. D-F, xilema secundario en corte transversal, de J. excisa, J. hieronymi y J. macrocarpa, respectivamente. Abreviaturas: fl, floema secundario; la, laticífero; me, médula; rb, radio biseriado; rm, radio multiseriado; ru, radio uniseriado; vs, vaso solitario; vf, vasos en filas radiales; vg, vasos en grupos; xi, xilema secundario. Con punta de flecha se señala un vaso ocluido. Con asterisco se señalan zonas de parénquima apotraqueal. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/906/1210

Fig. 7 Xilema secundario en tallo de especies nativas de Jatropha, en corte longitudinal tangencial. A, detalle de traqueida de J. excisa. B-D, detalle de vasos de J. excisa, J. hieronymi y J. macrocarpa, respectivamente. Abreviaturas: fli, fibra libriforme; fse, fibra septada; gr, granos de almidón; pu, puntuaciones alternas; rp, radio parenquimático; tr, traqueida; va, vaso. Con punta de flecha se señalan los septos de las fibras. Figura en color en la versión en línea http:// www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/906/1210
La corteza externa generalmente está asociada con la protección al fuego y los patógenos (Rosell, 2016). Sin embargo, la presencia de células con paredes engrosadas y muy suberificadas en la peridermis, como presentaron las tres especies analizadas en este trabajo, provee una cubierta protectora y una barrera contra la pérdida de agua y solutos, que puede contribuir no sólo a una mejor adaptación a las regiones áridas, sino también a un aislamiento térmico contra inviernos helados (Tavecchio et al., 2016).
La corteza interna ancha de estas especies coincide con las observaciones de Thakur & Patil (2012), quienes estudiaron la anatomía del tallo con crecimiento primario de algunos representantes de la familia Euphorbiaceae. Se ha sugerido que, en plantas xerófitas, una corteza con gran cantidad de estratos celulares puede ser más eficiente para proteger los tejidos vasculares de la sequía u otros daños (Fahn & Cutler, 1992). El desarrollo de tejidos de sostén, como la presencia de varios estratos de colénquima en las tres especies analizadas, principalmente en J. excisa, es un importante indicador de xeromorfismo; ya que le confiere al tallo rigidez estructural, otorgándole resistencia al colapso y desgarramiento debido a la desecación (Beltramini & Zapata, 2020). Los tres taxones estudiados presentaron varios estratos de clorénquima, lo que les permite seguir llevando a cabo el proceso fotosintético en la corteza; esta característica se da sobre todo en troncos jóvenes, con escasa cantidad de ritidoma (Rodríguez-Calcerrada et al., 2015). La existencia de clorénquima en tallos leñosos fue reportada anteriormente en J. curcas (Thomas & Daniel, 2007). Una gran cantidad de investigaciones, sugieren que la presencia de tallos fotosintetizantes en especies de ecosistemas áridos favorece la supervivencia de las plantas ya que le confieren ventajas fisiológicas, incluyendo ganancia extra de carbono durante períodos de sequía, equilibrio de los costos respiratorios como resultado de la re-asimilación de CO y mayor eficiencia en el uso del agua (Cernusak & Cheesman, 2015; Ávila-Lovera et al., 2017).
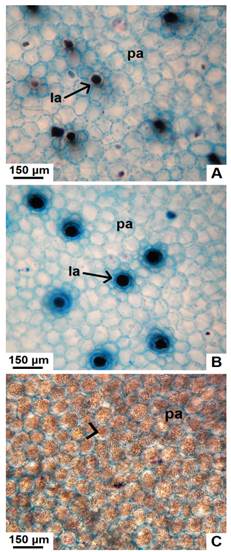
Fig. 8 Detalle de la médula parenquimática, en corte transversal de tallo con crecimiento secundario de especies nativas de Jatropha. A, médula de J. excisa, con laticíferos. B, médula de J. hieronymi con laticíferos. C, parénquima reservante de almidón en J. macrocarpa. Abreviaturas: la, laticífero; pa, parénquima. Con punta de flecha se señalan los granos de almidón. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/906/1210
La fotosíntesis cortical es particularmente importante en especies de hojas caducas, como las analizadas en el presente trabajo. Esto se ha constatado en varios casos donde se observó que la tasa fotosintética de los tallos es más alta durante la época de ausencia de follaje, debido a un aumento de la incidencia de la radiación solar (Ávila-Lovera et al., 2017; Simkin et al., 2020).
El almacenamiento de almidón es una fuente de reserva energética de extrema utilidad para aquellas plantas que habitan en ambientes adversos, desempeñando un papel en la preservación de las especies xerófitas (Fahn & Cutler, 1992). Granos de almidón fueron registrados en el parénquima cortical, xilemático y medular de los tallos de J. excisa, J. hieronymi y J. macrocarpa, observándose más abundancia en la última especie. La acumulación de almidón en el parénquima del xilema podría proteger a las plantas de la embolia inducida por la sequía, ya que se ha observado en otras especies que la hidrólisis del mismo es esencial en el proceso de recuperación de los elementos conductores afectados (Brodersen & McElrone, 2013). Tavecchio et al. (2016) reportaron la presencia de abundante almidón en tallos con crecimiento primario de J. macrocarpa, y señalaron que esa abundancia podría ayudar a esta especie durante los períodos fríos, manteniendo la concentración osmótica intracelular, por catabolismo de la macromolécula. Por su parte, Malbrán Barros (2018) también detectó granos de almidón en los tallos primarios de J. macrocarpa, J. excisa y, en menor cantidad en J. pedersenii, especie que habita en el litoral argentino, donde la humedad es mayor. Se ha reportado la presencia de ese carbohidrato en otros representantes del género que habitan en ambientes áridos o semiáridos, como Jatropha maheswarii Subr. & Nayar y J. curcas (Uthayakumari & Sumathy, 2011; Tavecchio et al., 2016).
En los ambientes áridos, la producción de biomasa vegetal es costosa, por lo tanto, las plantas han desarrollado diversos mecanismos para evitar la pérdida de biomasa causada por la herbivoría o el ataque de microorganismos. Entre estos mecanismos se puede citar la presencia de células contenedoras de cristales y los laticíferos (Fahn, 1986).
En los tres taxones estudiados se encontraron cristales en el parénquima cortical, tal como lo reportó Malbrán Barros (2018) en tallos con crecimiento primario de J. excisa, J. macrocarpa y J. pedersenii. Esta sustancia ergástica puede actuar como mecanismo de defensa contra herbívoros e interviene en la regulación de los niveles de calcio dentro de la planta (Jáuregui- Zúñiga & Moreno Cárcamo, 2004).
Los laticíferos son indicativos del éxito evolutivo en las especies que los presentan, ya que el látex actúa contra la herbivoría, agentes patógenos y posibilita el sellado de heridas (Ramos et al., 2020). En Jatropha se ha documentado la presencia de laticíferos de distintos tipos: articulados, no articulados e idioblásticos (Dehgan & Craig, 1978). Por su parte, Malbrán Barros (2018) menciona la existencia de laticíferos articulados y no articulados en tallos con crecimiento primario de J. excisa, J. macrocarpa y J. pedersenii. En relación al ambiente en que crecen las plantas, se ha determinado que la fluidez del látex disminuye drásticamente cuando las mismas están expuestas a la luz solar, siendo más viscoso que el que se produce temprano en la mañana o justo después del anochecer. Esta ocurrencia probablemente esté relacionada con la tasa de transpiración de las plantas, ya que el agua puede atravesar libremente la pared de casi todos los laticíferos (Ramos et al., 2019). Hasta el momento, no se conoce la composición química del látex de las especies nativas, por lo que sería muy interesante llevar a cabo pruebas histoquímicas, que proporcionen información sobre la presencia de metabolitos, demostrando el potencial de las especies como fuente de compuestos biológicamente activos a explorar (Diniz et al., 2013).
En el xilema, no se evidenció tilosis, pero sí la oclusión de algunos vasos con una sustancia parda. Hay estudios que indican que los conductos xilemáticos pueden obstruirse, ya sea por tilosis o compuestos como taninos, gomas o cristales, en épocas de déficit de agua; esas oclusiones ayudan a mantener la presión positiva en el tallo, necesaria para rellenar los vasos embolizados (Kitin et al., 2010; Tng et al., 2018).
En cuanto a las variables cuantitativas analizadas, las tres especies presentaron vasos numerosos, de longitudes cortas y diámetro pequeño. Estas características son típicas de plantas que habitan regiones áridas y semiáridas permitiéndoles soportar el estrés hídrico. Los elementos conductores cortos son más resistentes al colapso o deformación que los largos, debido al reforzamiento proporcionado por las paredes de los extremos, y confieren mayor seguridad al proceso conductivo. La estrechez de los vasos está correlacionada inversamente con el número de vasos para disminuir la vulnerabilidad a la cavitación (Carlquist, 1977; 2001). Oladipo & Illoh (2012) midieron variables xilemáticas en el leño de cinco especies de Jatropha que habitan en una región tropical de Nigeria que tiene mayor humedad que la Región Chaqueña y encontraron vasos más largos (402,56-527,62 µm) y más anchos (60,99-89,16 µm) respecto a lo hallado en este trabajo (221,69-304,76 µm de long. y 55,60-63,38 µm de diám.). Es de destacar que J. macrocarpa se diferenció significativamente de J. excisa y J. hieronymi por poseer los vasos de longitudes más cortas, más angostos y más numerosos, reuniendo las características más específicas de ambientes xerófitos. La mayor área del xilema/área total del tallo se encontró en J. excisa, indicando que facilitaría la conducción de agua, ya que a medida que el porcentaje de ese tejido aumenta, la cantidad de agua transportada es mayor (Sory Toure et al., 2010). Las especies expuestas a una alta incidencia de radiación solar poseen mayores tasas de evapotranspiración; para compensar esa liberación de agua a la atmósfera necesitan un área conductora más grande respecto a plantas con baja incidencia de radiación solar (Aparecido, 2014). Son pocos los trabajos que incluyen la medición del área de xilema al analizar la anatomía del tallo en relación al ambiente (Chui & Ewers, 1992; Rzepecki et al., 2011). La inclusión de esta variable, junto con otras que consideren distintos aspectos xilemáticos, puede brindar información valiosa en estudios eco-anatómicos, para comprender cómo la anatomía de las plantas influye en la conducción del agua (Aparecido, 2014).
El IVg mayor a 1 en las tres especies representa vasos agrupados en su mayoría. Según la clasificación de IAWA Committee (1989), serían vasos parcialmente solitarios y parcialmente agrupados en múltiples radiales. Este agrupamiento brinda mayor seguridad en la conducción, resistiendo las tensiones de agua de forma más eficaz que los vasos aislados; además, disminuye la posibilidad de que los vasos se tornen inactivos por embolia bajo estrés hídrico, perjudicando seriamente la conducción en la planta (Carlquist, 1977, 2001). El IV de 0,95, en J. macrocarpa, indica que dicha especie presenta un número y diámetro de vasos que le brindan resistencia a la sequía. En cuanto a J. excisa y J. hieronymi, si bien sus IV indicaron vulnerabilidad a la sequía, los valores obtenidos fueron relativamente bajos (2,29 y 2,24 respectivamente), lo que podría traducirse como una baja vulnerabilidad considerando que algunas especies de regiones húmedas tienen IV tan altos como 73,33 para Chorisia insignis HBK & K. y 42,50 para Chorisia speciosa A. St.-Hil. (Moglia & Gimenez, 1998). Montaño Arias et al. (2013) obtuvieron un IV de 3,56 para Mimosa hexandra M. Micheli, que habita en el matorral xerófito de México, y fue considerada como una especie de resistencia intermedia al estrés hídrico. En cuanto al IM, en los tres casos, es mayor a 200, siendo el xilema mesofítico, a pesar de que el valor en J. macrocarpa fue solo de 210,61, aproximadamente un tercio del valor obtenido para J. excisa y J. hieronymi (697,9 y 629,33 respectivamente). Se ha determinado que un xilema mesofítico, en conjunto con valores de IV menores a cinco, tal como ocurrió en las tres especies analizadas en este trabajo, indicaría que los taxa tienen un sistema de conducción seguro y eficaz para el movimiento del agua (Montaño Arias et al., 2013).
Es de importancia resaltar que hasta el momento, no se habían medido variables xilemáticas en tallos de ninguno de los representantes nativos ni se habían relacionado aspectos anatómicos con el ambiente que habitan. La información brindada en este trabajo contribuye al conocimiento de estas plantas nativas, y es fundamental si se pretende realizar cultivos a gran escala de estas especies de Jatropha para aprovechar su potencialidad como productoras de biodiesel. Argentina cuenta con importantes ventajas en la producción de materias primas con potencial para la obtención de este combustible. Este país, dispone de una alta dotación de recursos naturales y de amplias condiciones agroecológicas para el cultivo de diversas especies con fines energéticos (Vega, 2010) y, desde hace algunos años, se están desarrollando proyectos con cultivos de gran envergadura de J. curcas y J. macrocarpa en provincias del Noroeste, como Santiago del Estero y La Rioja (Aiassa, 2009). Las especies nativas de Jatropha analizadas en este trabajo se presentan como cultivos alternativos en regiones áridas o semiáridas del país, no compitiendo por superficie con las oleaginosas tradicionales utilizadas para la obtención de biodiesel (Falasca y Ulberich, 2008).
Este trabajo constituye una primera aproximación al conocimiento de la morfoanatomía del tallo con crecimiento secundario de estas especies nativas, pero aún quedan muchos aspectos por explorar. Futuros estudios anatómicos de las especies nativas de Jatropha, deberían complementar el presente con técnicas específicas, como maceración en leño para determinar características específicas del xilema secundario, pruebas histoquímicas y observaciones con luz polarizada. Estos análisis permitirán profundizar en aspectos de la morfoanatomía e histoquímica de los órganos vegetativos, contribuyendo al conocimiento de estos taxones y sus estrategias para vivir en un ambiente árido.
CONCLUSIONES
El tallo de las especies analizadas presenta ciertos caracteres anatómicos que son propios de plantas que habitan ambientes xerófitos y, que en conjunto, contribuyen a que las mismas puedan desarrollarse a pesar de las escasas precipitaciones y elevadas temperaturas, incluyendo: súber y felodermis
con paredes celulares engrosadas; corteza interna con varios estratos celulares; presencia de colénquima; presencia de clorénquima; sustancias ergásticas en corteza, tejido vascular y médula (látex, cristales y granos de almidón); vasos xilemáticos cortos, estrechos, numerosos y agrupados.
Jatropha macrocarpa posee un IV que representa resistencia a la sequía. En J. excisa y J. hieronymi, el IV no se corresponde con plantas de ambientes secos, aunque los valores no están alejados de lo citado para especies xerófitas. En las tres especies, el IM indica un xilema mesofítico; sin embargo, los valores obtenidos en conjunto con IV menores a cinco, sugiere que los taxones tienen un sistema de conducción seguro y eficaz para el movimiento del agua. Este estudio de anatomía ecológica brinda información novedosa sobre tres especies de importancia biológica, industrial y económica que son potenciales productoras de biodiesel.












 uBio
uBio 

