INTRODUCCIÓN
Los hongos cumplen diversos roles fundamentales en los ecosistemas naturales que habitan, como saprófitos descomponedores, simbiontes patógenos y mutualistas, y son componentes clave en la dinámica de los suelos por contribuir al ciclado de la materia orgánica y los nutrientes. En particular, los hongos mutualistas propician la nutrición de las plantas y de otros organismos, mientras que los patógenos tienen una relación antagónica con sus hospederos al reducir su fitness (Dighton & White, 2017).
En América, ciertos hongos se asocian en simbiosis mutualista con hormigas dentro de las cámaras del hormiguero. Las hormigas cortan hojas y restos vegetales que mezclan con saliva para formar el sustrato de cultivo del hongo y a cambio, utilizan partes del tejido fúngico para satisfacer sus necesidades nutricionales (Hölldobler & Willson, 1990; Currie et al.,1999; Currie, 2001; Schultz 2020).
Las hormigas cultivadoras se clasifican dentro de la tribu Attini (Hymenoptera; Formicidae; Myrmicinae), junto con otras de diferente hábito recientemente incluidas en esta tribu (Ward et al., 2015). Dentro de la tribu Attini encontramos la subtribu Attina, que comprende cerca de 250 especies de hormigas cultivadoras de hongos, diferenciadas en dos grupos informales que se basan en sus relaciones filogenéticas: Attinas “superiores” (derivadas), con los géneros Atta, Acromyrmex, Amoimyrmex (llamadas Hormigas Cortadoras de Hojas: HCH), Trachymyrmex, Mycetomoellerius, Paratrachymyrmex y Sericomyrmex, y Attinas “inferiores” (basales), grupo que incluye, entre otros géneros, a Cyphomyrmex, Mycetophylax, Mycetosorytis, Myrmicocrypta, Mycocepurus, Apterostigma (Mueller et al., 1998; Ward et al., 2015; Solomon et al., 2019; Cristiano et al., 2020).
Las Attinas son hormigas endémicas de América y presentan una mayor riqueza de especies en el Neotrópico (Mayhé-Nunes & Jaffé, 1998). Se estima que el origen de la simbiosis puede haber ocurrido hace unos 60 millones de años (Mueller et al., 2001; Mueller, 2002; Schultz & Brady, 2008) y existen varias hipótesis sobre este proceso (Mueller et al., 2001; Branstetter et al., 2017). Las hormigas establecen simbiosis nutricional con diferentes familias de hongos; así, la mayoría de los géneros de Attini se asocian con basidiomicetes de la tribu Leucocoprineae de la familia Agaricaceae, mientras que un grupo de Attini inferiores (especies del grupo Apterostigma pilosum) forman simbiosis con hongos de la familia Pterulaceae (Chapela et al., 1994; Mueller et al., 2001; Munkacsi et al., 2004; Schultz, 2020).
Las HCH poseen un rol ecológico muy importante en los ecosistemas del Neotrópico. Son consideradas los herbívoros dominantes y su efecto es comparable con los grandes ungulados africanos (Hölldobler & Willson, 1990; Costa et al., 2008). La distribución del material vegetal en los hormigueros y su estructura contribuyen al aporte de nutrientes, a la porosidad y al drenaje en el suelo (Rico Gray & Oliveira, 2007). Esto favorece la biota en términos de abundancia y composición de plantas al aumentar su fertilidad. Esto último es importante ya que facilita la sucesión, tanto primaria como la de paisajes perturbados (Wirth et al., 2003; Farji-Brener & Tadey, 2009).
La simbiosis entre hongos y hormigas está vastamente estudiada, ya que el comportamiento forrajero de las hormigas cortadoras (Atta y Acromyrmex) llamó la atención de los primeros naturalistas. Linnaeus en 1758 registró especies de la tribuAttini, en 1804 Fabricius creó el género Atta, y en 1865 Mayr el género Acromyrmex (Weber, 1966). Möller, por otra parte, fue el primero en observar y reportar la formación de basidiomas por parte del simbionte fúngico, y lo nombró Rozites gongylophora, material que posteriormente fue transferido a Leucocoprinus gongylophorus (Hein) (Mueller et al., 2017). El estadio sexual del hongo es infrecuente y sólo se produce cuando la hormiga reina muere y la colonia abandona el cultivo (Mueller, 2002).
Hasta hace poco tiempo, las evidencias mostraban que las HCH cultivaban sólo una especie fúngica, Leucocoprinus gongylophorus (Leucocoprineae, Agaricales) y las Attini “superiores” no cortadoras (Trachymyrmex, Mycetomoellerius, Paratrachymyrmex y Sericomyrmex) cultivan otra especie cercana (Leucocoprinus sp.). Dicha correspondencia entre hongos y sus cultivares se explicó cómo coevolución debido a la simbiosis obligada de los mismos (Chapela et al., 1994; Mueller et al., 1998; Mueller et al., 2001). Estudios recientes demuestran que las Attini superiores cultivan distintas especies filogenéticas de hongos que se agrupan en dos clados: A (Leucocoprinus gongylophorus) y B (seis especies filogenéticas del género Leucocoprinus, aún no descriptas) (Mueller et al., 2018).
La mayoría de los estudios sobre hongos cultivados por hormigas Attini fueron realizados en Centro y Norteamérica (Mueller et al., 1998; Green et al., 2002; Mehdiabadi et al., 2012). Teniendo en cuenta que estas hormigas son un modelo para estudiar la simbiosis e inferir relaciones evolutivas, es importante contemplar la diversidad presente en todos los ecosistemas, en particular en los del Neotrópico, región donde se habría originado esta simbiosis (Kusnezov, 1963; Fowler, 1983; Mueller et al., 2017).
La región Neotropical está vastamente representada en Argentina por varios tipos de vegetación y áreas fitogeográficas (Cabrera, 1976). Los estudios sobre hongos asociados a HCH en estas regiones son actualmente escasos (Lugo et al., 2013; Marfetán et al., 2015; Bich et al., 2017; Mueller et al., 2017; Mueller et al., 2018). Un relevamiento reciente de la diversidad fúngica en la región norte de Argentina a partir de muestras de ADN de suelos indicó la existencia de hongos simbiontes de hormigas cultivadoras de hongos no registrados previamente (Nouhra et al., 2018). En Argentina se citan 4 especies de Atta y 29 especies de Acromyrmex, de ellas unas 18 especies de Acromyrmex y 3 especies de Atta para Córdoba (Janicki et al., 2016; Antweb, 2018). Si bien existe en Córdoba un estudio sobre la diversidad de simbiontes fúngicos asociados a estas hormigas, los hongos no fueron caracterizados taxonómicamente (Abril & Bucher, 2007).
El objetivo de este trabajo es relevar los simbiontes fúngicos asociados a HCH del género Acromyrmex en dos distritos fitogeográficos dominantes de la provincia de Córdoba.
MATERIALES Y MÉTODOS
Sitios de estudio:
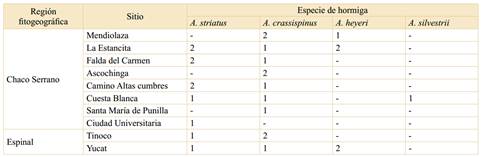
El estudio se realizó en la provincia de Córdoba en el dominio Chaqueño de la región Neotropical. Se seleccionaron 10 sitios de los cuales 7 pertenecen al distrito Chaqueño Serrano de la provincia Chaqueña (Chaco Serrano), 2 al distrito del Algarrobo de la provincia del Espinal (Espinal) y 1 sitio en Ciudad Universitaria Córdoba. Este último se incluyó en el Chaco Serrano por la cercanía que presenta con los sitios de esta región y representa un área de transición muy modificada entre las provincias fitogeográficas muestreadas (Cabrera 1976; Giorgis et al., 2017; Cabido et al., 2018; Zeballos et al., 2020) (Fig. 1).
Los muestreos se realizaron en el período comprendido entre noviembre de 2018 a mayo de 2019, en las siguientes ubicaciones; correspondiente al Distrito Chaqueño Serrano (Chaco Serrano): Ascochinga (30°56’21,1”S 64°19’09,9”O), Cuesta Blanca (31°29’42,8”S 64°35’30,7”O), Camino Altas cumbres (31°35’32,4”S 64°31’34,8”O), La Estancita (31°07’04,0”S 64°21’47,4”O), Mendiolaza (31°16’18,8”S 64°18’48,8”O), Camino Falda del Carmen (31°28’38,2”S 64°25’56,6”O), Santa María de Punilla (31°15’18,38”S 64°36’15,26”O) y Ciudad Universitaria Córdoba (31°26’05,3”S 64°11’33,2”O) y correspondientes al Distrito del Algarrobo (Espinal): Yucat (32°21’32,2”S 63°26’23,7”O) y Tinoco (31°06’08,9”S 63°50’44,6”O) (Fig. 1).
Cultivo y análisis molecular:
En cada sitio se muestrearon entre 1 y 5 hormigueros de las diferentes especies de HCH que se encontraron. Las muestras se obtuvieron cavando con una pala hasta acceder a la/las cámara/s conteniendo el/los jardín/es fúngicos, e intentando no destruir completamente el nido. Se extrajo el material fúngico y se aisló “in situ” en placas de Petri (entre 3 y 5 placas por hormiguero) previamente preparadas con medio agar de papa y dextrosa (APD) y un antibiótico (cloranfenicol). Una porción se fijó en fresco en buffer CTAB (Bromuro de cetiltrimetilamonio) para la posterior extracción y análisis de ADN. Para cada aislamiento se realizaron subcultivos a fin de asegurar su pureza y, cuando aparecieron contaminaciones, se realizaron nuevos repiques y aislamientos con el fungicida selectivo benomyl. Los cultivos se mantuvieron en oscuridad a 25°C en cámara de cultivo.
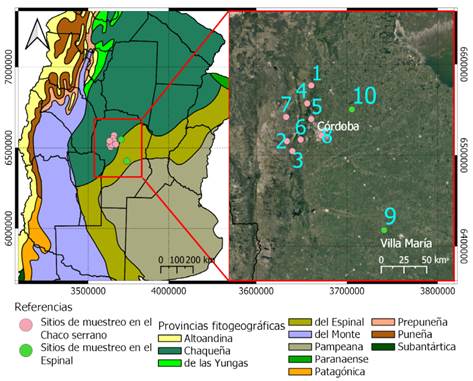
Fig. 1 Sección de las provincias fitogeográficas de Argentina (Cabrera 1976). El rectángulo rojo representa una ampliación de las áreas de muestreo con sus respectivos sitios de muestreo:1) Ascochinga, 2) Cuesta Blanca, 3) Camino Altas cumbres, 4) La Estancita, 5) Mendiolaza, 6) Camino Falda del Carmen, 7) Santa María, 8) Ciudad Universitaria, 9) Yucat, 10) Tinoco. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/950/1219
El ADN se extrajo de aproximadamente 50 mg de micelio fijado en CTAB de cultivos en APD (Gardes & Bruns, 1993) y se amplificó la región ITS (ITS1-5.8-ITS2) mediante PCR utilizando los primers ITS1F y ITS4B (Gardes & Bruns, 1993; White et al., 1990). Las amplificaciones se enviaron a Macrogen Inc. (Seúl, Corea del Sur) para la purificación y secuenciación del gen ITS, con el primer ITS4, en un equipo ABI 3730XL. Las secuencias así generadas fueron editadas con BioEdit v7.0.5, y de un total de 29 secuencias, 9 estuvieron completas en sus regiones intergénicas (690 a 700 pb) ITS1, ITS2 y el gen 5.8S ribosomal. De las 20 restantes se utilizaron aproximadamente 110 pb que corresponden a la región intergénica ITS2. Las secuencias se compararon con aquellas disponibles en bases de datos mediante la herramienta de búsqueda “Blast” en Genbank (http://www.ncbi.nlm.gov).
Las secuencias se alinearon con el servidor MAFFT 7.0 (Katoh & Standley, 2013) y con el servidor online del software Gblocks v. 0.91 b (Castresana, 2002) se eliminaron las regiones ambiguamente alineadas y se extrajeron los bloques comparables para el análisis. Se obtuvieron un total de 29 secuencias con sitios comparables. Se seleccionó K2+I como modelo de sustitución de nucleótidos con jModelTest 2.1 (Darriba et al., 2012) usando el criterio de información Akaike (AIC), y así se realizó un análisis de Máxima Verosimilitud en Mega-X (Kumar et al., 2018). Los valores de Bootstrap para el árbol más verosímil se calcularon sobre 1000 repeticiones. El análisis Bayesiano se realizó con MrBayes (Huelsenbeck & Ronquist, 2001) produciendo 10 000 000 de generaciones de árboles aleatorios sobre cuatro cadenas simultáneas y muestreando cada mil árboles.
Los cultivos fúngicos se caracterizaron morfológicamente de acuerdo con la bibliografía especializada (e.g. Weber, 1966; Curie, 2001; Miyashira et al., 2010), utilizando un microscopio óptico Carl Zeiss Primo Star. Para ello se realizaron preparaciones microscópicas coloreadas con floxina B (C.I. 45410), tanto de las estructuras fúngicas observadas en cultivos como aquellas extraídas directamente de los jardines fúngicos. Las hormigas se identificaron bajo lupa estereoscópica Nikon (SMZ745T), utilizando la clave de Gonçalves (1961) y una clave provisoria proporcionada por el Dr. Andrés F. Sánchez Restrepo. Las fotografías fueron tomadas con cámara AxioCam ERC 5s.
RESULTADOS
Se analizaron 28 hormigueros, 20 pertenecientes al distrito del Chaco Serrano, 7 pertenecientes al distrito del Algarrobo y 1 en la Ciudad universitaria de Córdoba (UNC, en un área relictual muy modificada de bosque chaqueño) (Tabla 1).
Se encontró que la diversidad taxonómica de los simbiontes fúngicos cultivados por HCH pertenecen a 2 clados bien diferenciados filogenéticamente (Fig. 2). El clado A (Leucocoprinus gongylophorus) y el clado B (Leucocoprinus sp.). Los hormigueros pertenecen a 4 especies: Acromyrmex crassispinus, A. striatus, A. heyeri y A. silvestrii (Fig. 3 - A, B, C y D). Se encontró que A. striatus cultiva hongos de ambos clados, el A en el Chaco Serrano y el B en el Espinal. El resto de las hormigas cultivan cepas del clado A independientemente de la región de la cual provengan.
Posición filogenética de los simbiontes fúngicos
Las relaciones filogenéticas observadas (Fig. 2) indican que las HCH se asocian en simbiosis nutricional con cepas de los dos clados antes mencionados. El clado A, con un soporte alto (99/1), representa un grupo monofilético de la especie Leucocoprinus gongylophorus. El clado B con igual soporte (99/1), representaría una especie aún no descrita del género Leucocoprinus.
Las hormigas A crassispinus y A heyeri cultivan siempre a L. gongylophorus, independientemente de la región. Acromyrmex striatus cultiva en el Chaco Serrano a L. gongylophorus y en el Espinal a Leucocoprinus sp. La hormiga A. silvestrii cultiva a L. gongylophorus en el Chaco Serrano.
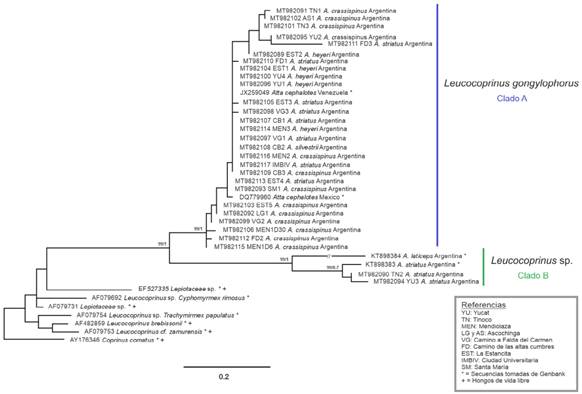
Fig. 2 Árbol filogenético obtenido por Máxima Verosimilitud. Las medidas de soporte son provistas por Bootstrap y Probabilidades Posteriores respectivamente. Coprinus comatus se utilizó como outgroup para enraizar el árbol. Los nombres de los simbiontes cuentan con su código de acceso a Genbank y la especie de hormiga asociada. La barra de escala representa el número esperado de cambios de nucleótidos por sitio.
Caracterización morfológica de cultivos
Los cultivos del simbionte fúngico se iniciaron en diferentes momentos debido a las fechas de recolecta y a los sucesivos repiques que se realizaron por contaminación. Todos comenzaron presentando una zona central de aspecto algodonoso, donde se observó una elevada densidad de hifas que disminuyeron en abundancia hacia la periferia, apareciendo hifas hialinas solo en los bordes externos del cultivo (0,5 cm de diámetro aproximado a los 15 días de cultivo). Al cabo de 30 días (aprox.), cuando los cultivos poseían un tamaño entre 1 y 1,5 cm de diámetro, las colonias presentaron exudados en forma de gotas hialinas amarillentas sobre la superficie del cultivo y desarrollaron estafilos con forma de copos blanquecinos, formados por agrupaciones de gongilidios (Fig. 4- C y D). Estas estructuras globosas se forman en las terminaciones hifales y se encuentran agrupadas en racimos denominados estafilos (Fig. 4- A y B). Si bien el simbionte fúngico del clado B presentó estafilos menos evidentes a simple vista, su crecimiento en cultivo fue similar al descrito anteriormente.
En los cultivos de ambos simbiontes (clados A y B), se observaron al microscopio, hifas hialinas cilíndricas, alargadas y delgadas con ramificaciones laterales y en forma de H. con septos simples y desprovistas de fíbulas. El grosor de las hifas en ambos fue de 4-7,5 μm. Los gongilidios presentaron variación en su forma a los 120 días de crecimiento en placa. El clado A presentó un grosor promedio de 27 μm (rango de 15-37 μm) y un largo promedio de 44 μm (rango de 37-50 μm), de forma ovoide (Fig. 4- B y D). El clado B presentó un grosor promedio de 33 μm (rango de 20-50 μm) y un largo promedio de 37 μm (rango de 25-52.5 μm), de aspecto globular (Fig. 4- A y C). En ambos cultivos los gongilidios fueron terminales, laterales y ocasionalmente intercalares.
DISCUSIÓN
Características de la simbiosis
En este trabajo, los resultados filogenéticos indican que la diversidad fúngica asociada a las HCH de los sitios estudiados estaría agrupada en dos clados bien diferenciados del género Leucocoprinus (Agaricaceae). Estos resultados son concordantes con los estudios recientes de Mueller et al. (2017, 2018), en los cuales se incluyeron hormigas con distribución en la Sudamérica austral.
Acromyrmex striatus cultivó cepas de ambos clados, el B (Leucocoprinus sp.) tal como lo reportaron Mueller et al. (2018) y el A (Leucocoprinus gongylophorus). La interacción de A. striatus con el simbionte de clado A no está registrada en la bibliografía y dependiendo de la región que habita, A. striatus cultiva uno u otro simbionte fúngico. Otros estudios reportan que, en Brasil, las hormigas cortadoras (Acromyrmex crassispinus, Acromyrmex coronatus y Atta laevigata) también cultivan ambos clados (Mueller et al., 2018). Esto sugiere que existen mecanismos de transferencia de las cepas fúngicas entre Attini superiores cortadoras y no cortadoras, dado que estas últimas se han encontrado con mayor frecuencia asociadas al simbionte fúngico del clado B (Mueller, 1998; Mueller et al., 2017).

Fig. 3 Vista frontal de hormigas cortadoras de hojas. A, Acromyrmex crassispinus. B, Acromyrmex striatus. C, Acromyrmex heyeri. D, Acromyrmex silvestrii. Escala = 1 mm. Figura en color en la versión en línea http:// www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/950/1219
Las hormigas Acromyrmex crassispinus, A. heyeri y A. silvestrii incluidas en nuestro análisis filogenético cultivan cepas del clado A (Leucocoprinus gongylophorus), tal como lo hacen otras especies en Argentina, como A. lobicornis (Lugo et al., 2013) y A. pubescens (Bich et al., 2017). Los resultados de este estudio concuerdan con trabajos previos en la ocurrencia de la asociación de A. heyeri y L. gongylophorus (Pereira et al., 2015).
A diferencia de nuestros resultados, en Brasil se observó que Acromyrmex crassispinus además de cultivar cepas del clado A también lo hace con cepas correspondientes al clado B (Mueller et al., 2017). En este estudio, sin embargo, la hormiga A. crassispinus cultiva a L. gongylophorus en todos los hormigueros analizados, independiente de la región que se encuentren.
Por otro lado, se analizaron Acromyrmex silvestrii y A. striatus que son cercanas filogenéticamente y basales dentro del género (Cristiano et al., 2013). El hormiguero de A. silvestrii incluido en este análisis se encontró en la región Chaqueña Serrana y se asocia con el simbionte fúngico del clado A. La caracterización molecular de este último es nueva para A. silvestrii.
El simbionte fúngico del clado B representa una especie (o complejo de especies) aún no descrita formalmente, debido a que no se ha recolectado su cuerpo fructífero (basidioma), pero informalmente suele denominarse como “Trachymyces” (e.g. Seal & Mueller, 2014) ya que siempre se lo encontró asociado a hormigas no cortadoras del género Trachymyrmex.
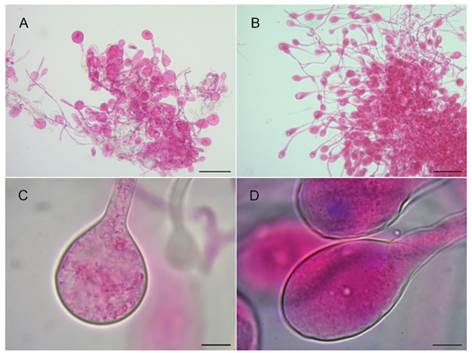
Fig. 4 Estafilos y gongilidios respectivamente en cultivo teñidos con floxina. A-C, Leucocoprinus sp. (clado B). B-D, Leucocoprinus gongylophorus (clado A). Escalas: A y B =100 μm, C y D =10 μm. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/950/1219
Los resultados de este estudio y la literatura sugieren que existe transferencias de simbiontes entre poblaciones de hormigas a nivel intra e interespecíficas (Mikheyev et al., 2006; Mueller et al., 2011a, 2017; Howe et al., 2018). Se ha observado que los mecanismos de transferencia pueden ser mediados por el hurto del simbionte, la adopción de jardines fúngicos abandonados o la usurpación de hormigueros por parte de las reinas fundadoras (Howe et al., 2018). Por esto, se infiere que la asociación entre las hormigas y hongos dependerá de las cepas fúngicas que se encuentren en el área que habitan las hormigas, la frecuencia en la que se den las transferencias y de que la combinación que se encuentre espacialmente sea favorecida por las fuerzas de selección (Mueller et al., 1998, 2011b). Esto último se debe a que se ha observado que algunas especies de hormigas no sobreviven cuando se les intercambia el simbionte fúngico (Seal & Mueller, 2014).
Las evidencias actuales y estos resultados sugieren que la coevolución apareada propuesta (Chapela et al., 1994; Mueller et al., 1998, 2001; Schultz & Brady, 2008) sería de tipo difuso, y que los mecanismos de intercambio de simbiontes serían muy frecuentes (Howe et al., 2018). Por ello, se piensa que la relación simbiótica especialista de hormigas que cultivan un único simbionte fúngico (Mikheyev et al., 2006) no sería tal, sino que diversos hongos serían cultivados por hormigas diferentes, como resultado de la transferencia de cultivares entre especies y géneros diversos de hormigas cultivadoras (Mueller et al., 2018).
Caracterización morfológica de cultivos
Los cultivos de ambos simbiontes son morfológicamente similares, presentando el desarrollo de gongilidios reunidos en estafilos. Si bien, la forma de estos fue diferente en los cultivos analizados, no se puede concluir que el carácter se mantenga constante dado que el crecimiento para cada cultivo fue medido en distintos momentos, como consecuencia de las sucesivas contaminaciones y repiques. Sin embargo, se observó que los estafilos eran menos abundantes en los cultivos del clado B. Esta observación concuerda con los análisis realizados por De Fine Licht et al. (2014) donde el clado B presentó menor densidad de estafilos por unidad de superficie.
CONCLUSIONES
Los hongos simbiontes de hormigas cortadoras de hojas en la región Chaqueña Serrana y del Espinal en Córdoba pertenecen a dos especies fúngicas diferentes, Leucocoprinus gongylophorus (clado A) y una especie no descripta del mismo género (clado B).
En cuanto a las hormigas, Acromyrmex striatus cultivó en los sitios de Espinal (Distrito del Algarrobo) el clado B, y en los sitios del Chaco Serrano (Distrito Serrano) el clado A. Por otra parte, Acromyrmex crassispinus y A. heyeri cultivaron en ambas regiones cepas fúngicas del clado A.
Se describe por primera vez a nivel morfológico y molecular (ITS) a Leucocoprinus gongylophorus en asociación con A. silvestrii para la región Neotropical. En el área de estudio, la relación simbiótica coevolutiva entre hongos y hormigas sería difusa y no altamente especializada. Estudios adicionales que incluyan sitios y simbiontes alternativos, podrían proporcionar datos adicionales sobre esta asociación.












 uBio
uBio