INTRODUCCIÓN
Bartonella henselae es un bacilo gramnegativo, agente etiológico de la enfermedad por arañazo de gato (EAG). Afecta a niños y a adultos jóvenes, con un pico entre los 2 y los 14 años.1'2 Los gatos domésticos representan el mayor reservorio. Estos contraen la enfermedad a través de un vector (artrópodo-pulga). Se adquiere por rasguño o mordedura de gatos, habitualmente cachorros.3
La forma de presentación más frecuente en inmunocompetentes es la linfadenopatía única asociada a fiebre. En el 85 % de los casos, se compromete un solo ganglio; los axilares y los epitrocleares son los más frecuentemente involucrados.3
La EAG posee un amplio espectro clínico. Existen formas de presentación menos frecuentes (el 10 % de los casos),1’2 consistentes, la mayoría de ellas, en síndrome febril prolongado y enfermedad hepatoesplénica.4 También se ha descripto compromiso óseo,2 ocular,5 neurológico6 y cardiológico.7
Debido al amplio espectro de manifestaciones, ningún criterio único debe considerarse el estándar de oro para el diagnóstico. Este se realiza por criterios clínicos, antecedente epidemiológico y realización de exámenes complementarios.3 Se han desarrollado técnicas serológicas basadas en la detección de anticuerpos específicos inmunoglobulina G (IgG) e inmunoglobulina M (IgM).8,9
Según reportes de la Academia Americana de Pediatría, existe en Estados Unidos una prevalencia de entre el 54 % y el 87 % en menores de 18 años.10 Al no ser una enfermedad de denuncia obligatoria, no existen datos en nuestro país.
En la práctica clínica pediátrica, es frecuente observar pacientes con linfadenopatía (única o múltiple) de evolución insidiosa que, luego de realizar exámenes complementarios, son atribuidas a B. henselae. Debido a la alta prevalencia de EAG observada en la consulta médica, asociada a las escasas publicaciones reportadas en el ámbito local, surge la importancia de determinar las distintas formas de presentación, motivo de consulta y necesidad de tratamiento antibiótico y/o internación.
El objetivo de este estudio fue analizar epidemiología, características clínicas y evolución de esta enfermedad en un hospital de alta complejidad de Argentina.
POBLACIÓN Y MÉTODOS
Se incluyeron niños de 0 a 16 años que consultaron en los Sectores de Bajo Riesgo y Bajo Riesgo Vespertino del Hospital de Pediatría Juan P. Garrahan desde el 01 de enero de 2019 hasta el 30 de junio de 2021 con clínica compatible y serología positiva. Se consideró diagnóstico serológico cuando se observó por inmunofluorescencia indirecta (IFI) una de las siguientes: a) IgM positiva, b) IgM negativa con valores significativos de IgG (punto de corte 1/256) o c) seroconversión de IgG a los 15-21 días. Se excluyeron niños con inmunodeficiencias primarias y/o secundarias.
Aspectos éticos
El protocolo de investigación fue aprobado por el Comité de Docencia e Investigación del Hospital Juan P. Garrahan. Su confección se basó en las Guías de Buenas Prácticas Clínicas de Investigación. Para el diagnóstico y tratamiento, se siguieron las normas de atención de nuestra institución. Los resultados fueron informados a cada paciente y a sus padres y/o tutores indicando el tratamiento o seguimiento correspondiente.
El acceso a la información del presente estudio utilizó los recaudos establecidos por las normas éticas y legales que protegen la confidencialidad (Ley 25326 de Protección de los Datos Personales). Los datos obtenidos no podrán utilizarse con fines distintos a los que motivaron su obtención.
Análisis estadístico
Se confeccionó una planilla de recolección de datos en la base de RedCap perteneciente al Hospital Juan P. Garrahan. Para la descripción de la muestra, se utilizaron proporciones para variables categóricas. Media y desviación estándar, o mediana y rango intercuartílico (RIC) para variables numéricas, según ajuste o no a normalidad.
El procesamiento de datos se realizó mediante el programa R i386 3.5.0.
RESULTADOS
Se incluyeron 150 niños, con una media de edad de 7,9 años ± 3,68. El 55,3 % (n = 83) eran varones.
En la anamnesis, la mayoría (68,7 %) refirió tener contacto con gatos; el 77,5 % eran cachorros. El 88,3 % eran mascotas domiciliarias.
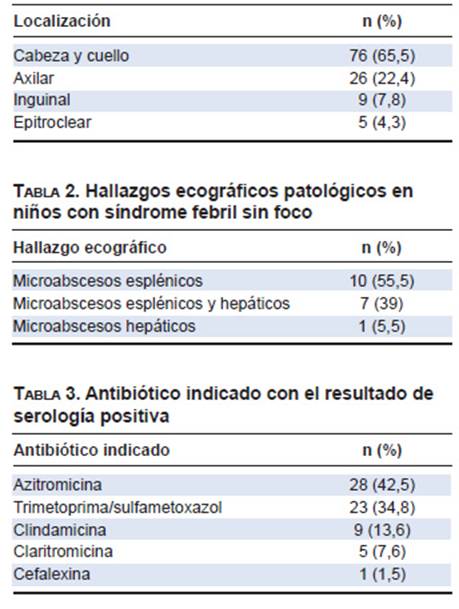
El motivo de consulta más frecuente fueron las adenopatías (84,7 %). La mayoría se presentó en un único sitio (91,3 %); cabeza y cuello fue la región más afectada (Tabla 1). La mediana de tiempo al momento de la consulta fue de 7 días (RIC 4-15 días). El 24,4 % asoció fiebre; solo 2 presentaron esplenomegalia. Se realizó ecografía de partes blandas al 54,3 %; se encontraron adenopatías abscedadas en el 37,7 %; requirieron drenaje 8 (21,1 %). Se solicitó ecografía abdominal al 39,4 %, que resultó patológica en el 30 %. Las lesiones más frecuentes fueron microabscesos esplénicos (73,3 %). Se encontró leucocitosis en el 91 % e hiperplaquetosis en el 18,2 %.
El síndrome febril sin foco motivó la consulta en el 15,5 % (n = 23). La mediana de la duración de la fiebre fue de 13 días (RIC 7-16 días). La mayoría de los pacientes (n = 18) presentó síndrome febril prolongado. Se realizó hemograma en 22 niños; se encontró leucocitosis en 6 e hiperplaquetosis en 5 de 22. Se efectuó PCR a 20 niños; se halló elevada en 19. Debido a falta de insumos, se realizó eritrosedimentación solo en 10 pacientes; resultó elevada en el 100 %. El hepatograma fue efectuado en 19 niños, pero solo uno presentó elevación de las enzimas hepáticas. La ecografía abdominal fue realizad en 21 niños; resultó patológica en 18 (85,7 %); se encontraron microabscesos esplénicos en el 94,4 % (Tabla 2). Dos niños asociaron dolor abdominal al síndrome febril, ambos con microabscesos esplénicos.
La mayoría presentó IgM e IgG positivas (88 %). En cuanto al resto del patrón serológico, el 8 % (n = 12) presentó IgM positiva con IgG negativa; el 3,3 % (n = 5), seroconversión de IgG, y solo un niño que consultó por síndrome febril prolongado de 21 días de evolución con adenopatía cervical presentó títulos altos de IgG (1/5120) con IgM negativa.
Con serología positiva, el 44 % recibió tratamiento antibiótico. Las adenopatías prolongadas fueron la principal causa de su instauración; la azitromicina fue el más utilizado (Tablas 3y 4).
El 14 % (n = 21) requirió internación. El compromiso sistémico la motivó en 11 niños y la adenitis abscedada en 10, de los cuales 8 requirieron drenaje y se observó fístula residual en 1. La mediana de días de internación fue de 6,6 días (RIC 3-17 días).
No se observaron complicaciones mayores ni secuelas.
DISCUSIÓN
Los gatos domésticos son el principal reservorio de B. henselae; la mitad de ellos tienen anticuerpos contra esta bacteria. La transmisión a los humanos se produce generalmente mediante la saliva o el arañazo del gato.2'3’11 En nuestro estudio, observamos alta prevalencia de contacto con gatos domésticos cachorros. Sin embargo, la ausencia de este antecedente epidemiológico en niños con enfermedad diagnosticada clínica y serológicamente podría deberse a un contacto esporádico no jerarquizado por la familia o alguna otra forma de contagio aún no determinada. Existen publicaciones que refieren que la pulga (Ctenocephalides felis), vector responsable de la transmisión horizontal de la enfermedad entre gatos, puede, con su picadura, infectar a humanos. También se menciona que las picaduras de garrapatas podrían transmitir la bacteria.12 Aunque es más común entre los felinos, el 10,1 % de los perros sanos y el 27,2 % de los enfermos en el sureste de los Estados Unidos tienen anticuerpos contra B. henselae. 13 No está claro, por el momento, si su presencia en caninos tiene importancia clínica para el humano.14
Cuando analizamos las formas de presentación, observamos diferencias entre la experiencia local y las publicaciones. Según Florin y col.,3 la forma de presentación más frecuente en inmunocompetentes es la linfadenopatía única asociada a fiebre. En la mayoría se compromete un solo ganglio; los axilares y los epitrocleares son los más frecuentemente involucrados.12 Esto tiene sustento científico en una serie de casos con 1200 pacientes publicada por Carithers y col.15
En nuestro análisis, el 65,5 % presentó adenopatías únicas localizadas en cabeza y cuello con alta frecuencia de microabscesos esplénicos. Esto justificaría la realización de ecografía abdominal en esta población. Solo se detectó pápula de inoculación cercana al sitio de la adenopatía en 8 niños. La diferencia en la localización podría deberse a la costumbre local de sostener entre los brazos a los animales y dormir con ellos. Esto llevaría a la presencia de lesiones en cabeza y cuello con la aparición local de adenomegalias. Debido a la alta frecuencia de EAG con adenopatías en nuestro hospital, el Servicio de Diagnóstico por Imágenes, al observar características ecográficas sospechosas, realiza ecografía abdominal para confirmar o descartar la presencia de microabscesos hepáticos y/o esplénicos. Esto explicaría la alta frecuencia de lesiones esplénicas.
Observamos alta prevalencia de adenopatías abscedadas con requerimiento de drenaje en el 21,1 %, mientras que la descripta en la bibliografía es de un 10 %.16 B. henselae se reconoce cada vez más como causa de síndrome febril prolongado (SFP) y fiebre sin foco (FSF) clínico evidente en niños.3 Un estudio identificó a B. henselae como la tercera causa infecciosa de SFP luego del virus de Epstein-Barr. Se encontró a B. henselae responsable del 5 % del total de 146 niños con SFP. El antecedente de exposición a gatos no se observó uniformemente, lo que sugiere que debe considerarse en la evaluación inicial de SFP, independientemente de la presencia del antecedente epidemiológico.17
Es interesante el elevado número de niños con SFP observado en nuestra población (12,6 %).
Esto podría deberse al alto índice de sospecha motivado por la consulta en un hospital de alta complejidad luego de consultas en centros de atención primaria. Es importante tener en cuenta la alta prevalencia de microabscesos esplénicos observados para determinar la necesidad de exámenes complementarios y su tratamiento, debido a que es mayor a la publicada hasta el momento. Jacobs y col.,17 encontraron que el 30 % de los casos de SFP causados por B. henselae tenían afectación hepatoesplénica. Nawrocki y col.,11 realizaron una búsqueda retrospectiva desde el 2005 hasta el 2014 de pacientes con EAG, encontraron 4759 menores de 14 años. Esta población representó el 36,2 % de los diagnósticos de enfermedad atípica y presentó mayor riesgo de compromiso hepatoesplénico (RR 1,76; IC95% 1,04-2,99) en comparación con los mayores de 15 años.
Sobre la base de todo lo expresado, B. henselae siempre debe considerarse como posibilidad diagnóstica en niños con SFP y SFS, así como también en pacientes con fiebre y dolor abdominal.3,9 Las imágenes abdominales permiten identificar compromiso hepático o esplénico. Aunque la tomografía computada es el estudio recomendado, la ecografía realizada por un profesional experimentado tiene elevado rendimiento y es útil para el seguimiento.9
El aislamiento de Bartonella en cultivo es difícil. Debido al crecimiento lento y la baja sensibilidad, es poco útil en la práctica clínica.3,8,9 Se han desarrollado técnicas serológicas basadas en la detección de anticuerpos específicos de tipo IgG e IgM. Los principales métodos utilizados son el ensayo de fluorescencia indirecta (IFI) y el inmunoensayo enzimático (ELISA).3'8 Las sensibilidades varían según el antígeno, los procedimientos de prueba y el punto de corte. El Centro de Detección de Enfermedades Infecciosas de Estados Unidos recomienda la detección de IgG mediante IFI, que reporta una sensibilidad del 88-100 % y una especificidad del 92-98 %.8 El punto de corte recomendando es de 1:64; algunos consideran títulos mayores de 1:256 como indicador de enfermedad aguda. La sensibilidad de la IgM varía desde el 71,4 % hasta el 95 %. Esta es menor con la técnica de ELISA en comparación con IFI (73 % vs. 93 %).8'18
La duración de la detección serológica de anticuerpos es importante para determinar infección aguda. Un resultado positivo de IgM (IFI) sugiere infección aguda, pero su producción es breve (alrededor de 3 meses) y la sensibilidad de la prueba es baja, en comparación con la excelente sensibilidad y especificidad de IgG. Por lo tanto, un resultado negativo de IgM no excluye enfermedad aguda. Si la muestra fue tomada en los primeros 10 a 14 días desde el inicio de los síntomas, con alta sospecha clínica y epidemiológica debería realizarse una nueva determinación.2'8’18 Los títulos de IgG también disminuyen con el tiempo. En las primeras etapas, los títulos de IgG e IgM pueden ser bajos, lo que requiere una segunda muestra para el diagnóstico (15-21 días entre ellas).18
Tabla 1: Localización de adenopatías únicas
Al igual que lo observado en nuestros datos, en una serie publicada por Armitano y col.,18 el patrón serológico más comúnmente observado fue IgM e IgG positivas. Debido a que Abarca y col.,8 encontraron que 21 de 37 niños tuvieron IgG positiva con IgM negativa, un resultado positivo de IgM podría tener utilidad para el diagnóstico, pero uno negativo no permitiría descartarlo. Es por esto que la IgM no cumple aún con los requisitos para reemplazar la IgG en el diagnóstico.
En inmunocompetentes, la EAG es de pronóstico favorable y autolimitado. El tratamiento es motivo de discusión.2’3’9 La EAG típica suele resolver en 2 a 6 meses.
En nuestra serie, se indicó tratamiento antibiótico al 44 %. Impresiona ser un alto porcentaje. Sin embargo, las consultas fueron efectuadas en un hospital de alta complejidad y esto actúa como sesgo, debido a que suelen asistir quienes escapan a la evolución esperada. Las principales causas de inicio del tratamiento fueron las adenopatías persistentes durante al menos 30 días y el síndrome febril. Debido a la evolución natural sin complicaciones y al riesgo de efectos adversos de los antimicrobianos, no se recomienda el tratamiento antibiótico en EAG típica.3 Sería beneficioso en los casos graves y en aquellos con alteraciones inmunológicas.19
Para infecciones leves a moderadas en inmunocompetentes, el tratamiento más adecuado consiste en analgésicos, calor local y control clínico periódico. Los ganglios pueden aspirarse para aliviar el dolor. No se recomienda la incisión ni el drenaje, debido a la formación de fístulas.3 En nuestra serie, solo 8 niños requirieron drenaje debido a abscedación y dolor. Se observó marcada mejoría a corto plazo.
Al analizar el tipo de antimicrobiano utilizado, las publicaciones mencionan una eficacia que oscila entre el 58 % y el 87 % con rifampicina, ciprofloxacina, gentamicina, azitromicina y trimetoprima-sulfametoxazol.3,20 Un estudio reveló una disminución del 80 % en el volumen de los ganglios en el 50 % de los tratados con azitromicina en comparación con el 7 % de los tratados con placebo. No hubo diferencia en el resultado clínico entre los grupos y no se demostró eficacia para enfermedad diseminada.21
Según Margileth, en aquellos con linfadenopatía significativa, se puede considerar el tratamiento con azitromicina durante 5 días.22 Podrían ser eficaces trimetoprima-sulfametoxazol, ciprofloxacina o rifampicina.3,12
Coincidiendo con dichas publicaciones, en nuestra serie, azitromicina y trimetoprima- sulfametoxazol fueron los más utilizados. No fue posible medir específicamente su eficacia, como así tampoco la disminución del volumen de las adenopatías.
Analizando las fortalezas de nuestro estudio, consideramos fundamental el elevado número de casos, con diagnóstico preciso tomando epidemiología, clínica y exámenes complementarios. Es fundamental recordar que hay escasa evidencia local. Al analizar las debilidades, la más importante es su realización en un centro de alta complejidad el cual no es, muchas veces, el primer sitio de consulta. La evolución y el seguimiento a mediano y largo plazo no pudieron realizarse.
Si bien hay diferencias, muchos de los datos obtenidos coinciden con las publicaciones. Existe la necesidad de continuar con nuevas investigaciones para obtener mayor evidencia científica.
CONCLUSIONES
El diagnóstico de EAG implica sospecha clínica, nexo epidemiológico y exámenes complementarios. La principal forma de infección correspondería al contacto con gatos cachorros. La EAG típica implica adenomegalias de evolución subaguda localizadas, fundamentalmente, en cabeza y cuello. Debido a la alta frecuencia de compromiso hepatoesplénico, la realización de ecografía abdominal estaría indicada en los niños con EAG más fiebre, especialmente si presentan dolor abdominal y/o hepato- o esplenomegalia.
Agradecimientos
Al Dr. Diego Amoedo, coordinador A/C Sector Bajo Riesgo y Bajo Riesgo Vespertino, Área Ambulatoria-Servicio de Clínica, Hospital de Pediatría Juan P. Garrahan, por haber participado en la revisión crítica del artículo.