Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.40 no.1 La Plata Jan./Mar. 2006
TEMAS DE INTERÉS
Guías del laboratorio para screening, diagnóstico y monitoreo de la injuria hepática*
EDITOR
D. Robert Dufour
Chief, Pathology and Laboratory Medicine Service, VA Medical Center, Washington, DC; Professor of Pathology, George Washington University School of Medicine.
GUIDELINES COMMITTEE
John A. Lott. Professor of Pathology, The Ohio State University College of Medicine
Frederick S. Nolte. Associate Professor of Pathology and Laboratory Medicine, Emory University School of Medicine
David R. Gretch. Associate Professor of Laboratory Medicine, University of Washington School of Medicine
Raymond S. Koff. Professor of Medicine, University of Massachusetts Medical Center
Leonard B. Seeff. Senior Scientist, Hepatitis C Programs, National Institute of Diabetes, Digestive, and Kidney Diseases, National Institutes of Health; Professor of Medicine, Georgetown University School of Medicine.
* Este documento ha sido traducido con permiso de la Nacional Academy of Clinical Biochemistry (NACB), Washington, DC. La NACB no se hace responsable de la exactitud de la traducción. Los puntos de vista presentados son los de los autores y no necesariamente los de la NACB.
SECCION III
Reconocimiento de la injuria hepática por el laboratorio
La injuria hepática se define por el daño a los hepatocitos. Tradicionalmente, se reconocen dos patrones principales de injuria hepática, aguda y crónica. Estos son a menudo denominados "hepatitis", e indican la presencia de inflamación en el hígado. Sin embargo, en algunas causas de injuria hepática, la inflamación es mínima o está ausente; por eso en este documento se usará el término más especifico de injuria hepática. La injuria hepática aguda se refiere al daño del hepatocito que ocurre abruptamente y en un corto período de tiempo. La característica más consistente de la injuria hepática aguda es la significativa elevación de las aminotransferasas (usualmente más de ocho veces el límite de referencia superior), a menudo acompañada por el aumento de la bilirrubina. La síntesis de proteínas está afectada en algunos casos, particularmente aquellos debidos a injuria directa de los hepatocitos por isquemia o ingestión de toxinas. La injuria hepática crónica se refiere a un daño continuo en el hepatocito durante largos períodos de tiempo, usualmente definidos como períodos mayores de 6 meses. La injuria hepática crónica usualmente se reconoce por una ligera elevación de las aminotransferasas (usualmente menos de 4 veces el límite de referencia superior), aunque las actividades pueden estar intermitentemente elevadas y, en un pequeño porcentaje de los casos, estar dentro de los límites de referencia. La excreción de bilirrubina y la síntesis de proteínas generalmente son normales. La fosfatasa alcalina generalmente se encuentra dentro de los límites de referencia en la mayoría de los casos de injuria hepática aguda y crónica; su medición generalmente es utilizada para reconocer desórdenes hepáticos con obstrucción del drenaje biliar, los que pueden de otra manera semejar injuria hepática aguda o crónica. Las proteínas totales, a menudo incluidas en los paneles hepáticos, no son útiles en la evaluación de la función hepática ya que están afectadas por cambios en niveles de inmunoglobulinas así como por cambios en la síntesis hepática. Un aumento en las globulinas es útil en pacientes con injuria hepática aguda o crónica para sugerir la posibilidad de una enfermedad autoinmune como causa de la injuria.
Recomendación:
Un panel hepático que contenga las siguientes pruebas debe ser usado para evaluar pacientes con enfermedad hepática conocida o sospechada: aspartato aminotransferasa, alanina aminotransferasa, fosfatasa alcalina, bilirrubina total, bilirrubina directa, proteínas totales y albúmina. Este panel es actualmente aprobado para ser reembolsado por Health Care Financing Administration for Medicare.
Injuria hepática aguda
La injuria hepática aguda puede ser reconocida por la presencia de ictericia o síntomas no específicos de enfermedad aguda acompañada por elevación de AST y/o ALT. Se estima que 80% de los individuos con hepatitis viral aguda no son nunca diagnosticados clínicamente aunque algunos pueden ser detectados por elevación de las aminotransferasas en la fase asintomática o con síntomas inespecíficos. Las actividades de AST y ALT son raramente mayores que 10 veces el límite de referencia superior en enfermedades diferentes de la injuria hepática aguda. ALP es mayor que 3 veces el límite de referencia superior en menos del 10% de los casos de injuria hepática aguda (174)(175). En la década pasada se observó una significativa disminución en la incidencia de la hepatitis viral aguda; en Centers for Disease Control and Prevention Sentinel Counties Study, la hepatitis B declinó un 55% y la hepatitis no-A, no-B (la mayoría de las cuales son hepatitis C) un 80% (175 a). Otras enfermedades hepáticas son las causas de los aumentos más comunes de AST o ALT; en un estudio reciente, el 25% de los casos con AST aumentada más de diez veces el límite de referencia superior presentaron una obstrucción como causa (176). En total, alrededor de 1-2% de los pacientes con obstrucción de los ductos biliares tienen un aumento transitorio en las actividades de AST y/o ALT > de 2.000 U/L (177)(178); las actividades de las aminotransferasas caen dentro del intervalo de referencia durante un lapso de 10 días aun si la obstrucción persiste (174)(176)(177).
Los valores mejor discriminantes para reconocer la injuria hepática aguda parecen ser 200 U/L para AST (sensibilidad 91%, especificidad 95%) y 300 U/L para ALT (sensibilidad 96%, especificidad 94%) (175). La AST supera 10 veces el límite superior del intervalo de referencia en más de la mitad de los pacientes al tiempo de presentación (175). En la hepatitis alcohólica no complicada, los valores de AST y ALT casi nunca son mayores a 10 veces el límite de referencia superior. La relación AST/ALT es mayor a 2 en el 80% de los casos y la fosfatasa alcalina está elevada en el 20% de los casos. (98)(179)(180). La ictericia ocurre en 60-70% de los casos de hepatitis alcohólica (179)(180). Las frecuencia de ictericia en pacientes con hepatitis viral aguda difiere tanto por la edad como por el agente etiológico. La ictericia es rara en niños con hepatitis viral y cuando se presenta es menos severa que en los adultos. En un estudio, sólo el 1% de los niños con hepatitis aguda tuvo un pico de bilirrubina mayor a 171 µmol/L (10 mg/dL), mientras que el 27% de los adultos sí los tuvieron (181). En adultos, la ictericia aparece en el 70% de los casos de hepatitis A aguda (182), 33-50% de los casos de hepatitis B aguda (183)(184) y 20-33% de los casos de hepatitis C aguda (185)(186). Existe una correlación directa entre la edad y el pico de bilirrubina sérica en niños; un aumento de 10 años en la edad se asoció con un aumento promedio con 85 µmol/L (5 mg/dL) en la bilirrubina. En adultos, no hay una relación entre la edad y el pico de bilirrubina (187). La distribución de la bilirrubina directa como porcentaje de la bilirrubina total es similar en la injuria hepática aguda y en la ictericia obstructiva: sólo 16% de los casos de injuria hepática aguda tienen bilirrubina directa < 50% de la bilirrubina total. Porcentajes menores de la bilirrubina directa sugieren otra causa para la ictericia, tal como la hemólisis (187).
Recomendaciones:
La injuria hepática aguda puede ser diagnosticada por ALT mayor que 10 veces el límite superior del intervalo de referencia y fosfatasa alcalina menos que 3 veces dicho límite (IIB).
La bilirrubina directa es necesaria para descartar causas de aumento de la bilirrubina total tales como hemólisis, pero no diferencia la injuria hepática de la ictericia obstructiva (IIB).
Marcadores de severidad
La hepatitis viral aguda A o B es generalmente una enfermedad autolimitante y la mayoría de los pacientes se recuperan completamente. De las personas con hepatitis C aguda, aproximadamente 80-85% desarrolla hepatitis crónica, aunque el porcentaje parece ser menor en niños o en mujeres jóvenes que reciben inmunoglobulina Rh (154)(188)(189). Raramente la injuria hepática aguda causa daño hepático severo y falla hepática aguda. Los análisis deben identificar los pacientes con mayor riesgo de falla hepática.
Las actividades de las aminotransferasas están más relacionadas con la causa de injuria hepática que con la severidad. Hay una débil correlación entre las actividades de las aminotransferasas y la bilirrubina en la hepatitis viral (175) y ninguna en la injuria hepática por isquemia o tóxica (190). El pico de las actividades de las aminotransferasas no se correlaciona con el pronóstico y puede caer con el empeoramiento de la condición del paciente; en todos los casos de injuria hepática, las actividades de la aminotransferasas comienzan a caer antes de que se presente el pico de bilirrubina, independientemente de que ocurra recuperación o deterioro (175)(191). El tiempo de protrombina (TP) es el predictor más importante del pronóstico; tiempos de corte > 4 segundos por encima del control, > 20 segundos, o INR > 6,5 han sido usados para identificar pacientes con alto riesgo de muerte (99)(191). En la injuria hepática isquémica o tóxica, la prolongación del TP es comúnmente más temprana luego de la injuria, con el pico de anormalidad entre las 24-36 horas retornando luego rápidamente al valor normal. En la injuria por acetominofeno, un TP prolongado no indica en si mismo probabilidad de falla hepática (94)(96), pero la elevación persistente o un aumento de TP por 4 días luego de la ingestión de acetominofeno si es indicativa (192). Otros tests pueden ser útiles para el pronóstico en el caso de causas específicas de injuria hepática (191). En la hepatitis viral, bilirrubina total > 257 µmol/L (15 mg/dL) indica injuria hepática severa y obliga a un estrecho monitoreo por encefalopatía (193). En la hepatitis alcohólica, bilirrubina > 428 µmol/L (> 25 mg/dL) o albúmina < 25 g/L (2.5 g/dL) predice una alta probabilidad de muerte (91)(180).
Recomendaciones:
Bilirrubina total > 257 µmol/L (15 mg/dL) o TP > 4 segundos por encima del límite superior de referencia en un individuo con hepatitis viral, en ausencia de otros factores que afectan los resultados, indican injuria hepática severa (IIB).
En la toxicidad por acetominofeno, una elevación persistente o un aumento del tiempo de protrombina durante más de 4 días luego de la ingesta de acetominofeno indica injuria hepática severa (IIB).
Diagnóstico diferencial
El patrón de las anormalidades en el laboratorio varía según las diferentes causas de injuria hepática aguda (Tabla XII).
A menudo es posible sospechar el tipo de agente causante de injuria hepática a partir del patrón anterior. La evaluación inicial de los pacientes con el patrón más común (inmunológico) de injuria hepática aguda debería incluir una historia de drogas y un testeo de anticuerpos para los virus de hepatitis A, B y C (VHA, VHB y VHC). La mayoría de las reacciones hepáticas por drogas ocurren dentro de los 3 a 4 meses de iniciado el tratamiento. Sin embargo, en algunos casos, la injuria hepática puede comenzar a manifestarse tan tarde como 12 meses luego de haber iniciado el tratamiento y en unos pocos casos la injuria puede tornarse evidente en días a semanas luego de abandonar la administración de la droga responsable (198). Por lo tanto, es importante preguntar acerca de todas las drogas que el paciente pudo haber recibido durante el año pasado o anteriores. La evaluación para la hepatitis viral debe utilizar el panel de hepatitis aguda aprobado por la Health Care Financing Administration. (IgM anti-VHA, IgM anti-HBc, AgHBs, y anti-VHC) (Fig. 8).
Tabla XII. Patrón de las pruebas de laboratorio en tipos de injuria hepática aguda.
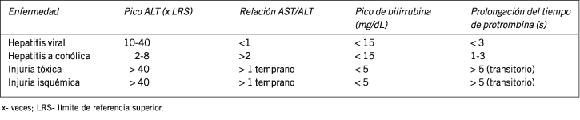
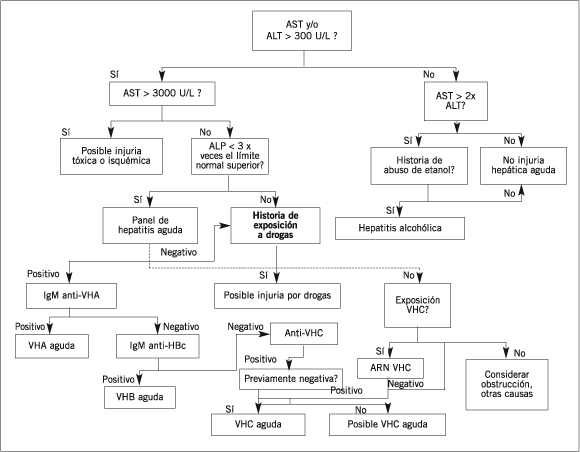
Figura 8. Abordaje para hepatitis aguda - En pacientes con signos o síntomas de injuria hepática aguda (fiebre, pérdida del apetito, orina oscura, materia fecal clara, ictericia), la evaluación inicial incluye determinación de las actividades de AST y ALT. Una ligera elevación en AST (< 10 veces el límite superior del intervalo de referencia), particularmente con AST > ALT, sugiere hepatitis alcohólica aguda, mientas que aumentos marcados (> 1.000 veces el límite superior del intervalo de referencia) sugiere fuertemente injuria hepática toxica o isquémica. En aquellos casos con valores intermedios, un panel de hepatitis aguda (ver texto) es el inicio para la evaluación. La presencia de IgM anti-VHA o IgM anti-HBc son considerados diagnóstico para hepatitis aguda A y B, respectivamente. La hepatitis C aguda no puede ser diagnosticada definitivamente por pruebas serológicas, pero se puede sospechar por aparición de anti-VHC en un paciente con ictericia, cuando fue previamente negativo) ó ARN VHC positivo en un paciente que carece de anti-VHC. En un paciente con resultados negativos para marcadores virales deben ser consideradas otras causas de injuria hepática aguda tal como la obstrucción, otros agentes infecciosos, enfermedad de Wilson, o hepatitis autoinmune (ver Tabla XIII).
La IgM anti-VHA, el test diagnóstico de elección para la infección aguda por VHA, desaparece a los 4-6 meses (194), mientras que los anticuerpos VHA totales persisten durante toda la vida (129) y se encuentran en un alto porcentaje de la población (130). Debido a ese corto período de transmisibilidad, el diagnóstico de la infección aguda por VHA debe realizarse tan rápido como sea posible luego de la presentación, idealmente dentro de las 48 horas, para permitir el tratamientode los individuos expuestos con globulina inmune. IgM anti-HBc y AgHBs son los tests más confiables para la infección aguda VHB (134)(193); la IgG anti-HBc persiste por años y no ayuda en el diagnóstico en la hepatitis aguda B (136). Otros marcadores virales para VHB y anticuerpos no son utilizados en el diagnóstico de la infección aguda por VHB. Actualmente no hay un test para el diagnóstico definitivo de la hepatitis C aguda, ya que anti-VHC y ARN VHC pueden estar presentes tanto en la infección aguda como en la crónica por VHC. Anti- VHC es detectable con EIA-2 en sólo 57% de los casos agudos de VHC al inicio de la elevación enzimática mientras que ARN VHC es positivo esencialmente en todos los casos (195), aunque está presente en el 15% (157)(196). Al momento de la presentación clínica entre el 80 y el 90% tienen anti-VHC detectable (196). Los patrones que podrían soportar un diagnóstico de hepatitis aguda C son anti-VHC negativo pero ARN VHC positivo, o (si ARN VHC no fue testeado) los resultados de anti-VHC que se convierten de negativos en positivos dentro de un corto período de tiempo. El uso de anti-VHD para detectar la infección por virus delta debería ser limitado a pacientes con AgHBs positivo, particularmente si está acompañado por hepatitis aguda severa, factores de alto riesgo (abuso de drogas intravenosas, hemofilia) o por un patrón bifásico de enfermedad (197). Si un paciente con hepatitis B crónica se sobreinfecta con VHD, puede desarrollar un cuadro clínico que semeja injuria hepática aguda severa y puede evolucionar a falla hepática (197).
Manejo de pacientes sin causa obvia de injuria hepática aguda (Tabla XIII)
Injuria hepática tóxica e isquémica. Valores de AST o ALT superiores a 100 veces el valor normal son raros en la hepatitis viral (174)(175), pero son comunes tanto en la ingestión de toxinas, especialmente acetaminofeno (96)(179)(200), como en la injuria hepática isquémica (94)(95)(190). En la injuria hepática inducida por acetaminofeno, el pico de AST es superior a 3.000 U/L en el 90% de los casos (200). La injuria hepática isquémica o tóxica causa más del 90% de los casos de las injurias hepáticas agudas con actividad de AST > 3000 U/L (200a). Tanto en la injuria hepática tóxica como en la isquémica, las actividades de AST y ALT presentan típicamente un pico temprano (en las primeras 24 horas luego de la admisión) con actividad de AST inicialmente mayor que la ALT. Luego del pico, las actividades de ambas enzimas caen rápidamente; AST puede caer alrededor del 50% o más en las primeras 24 horas (199)(200) y declina más rápidamente que ALT debido a su corta vida media (175). La actividad de AST alcanza valores próximos al normal en promedio a los 7 días luego de la injuria (174). El tiempo de protrombina está más de 4 segundos por encima de los límites de referencia en el 90% de los casos (94)(96), y rápidamente cae luego que se alcanza el pico de AST (94).
Tabla XIII. Causas no comunes de injuria hepática aguda.

ANA - Anticuerpo anti nuclear; ASMA- Anticuerpo anti- mœsculo liso; UHB - virus de la hepatitis B; CMV-Citomegalovirus; EBV-Virus de Epstein-Barr.
Recomendaciones:
La evaluación inicial de injuria hepática aguda debe incluir una historia detallada de drogas y marcadores virales (IgM anti-VHA, IgM anti-HBc, HBsAg, y anti-VHC) (II B).
Debido a la necesidad de profilaxis post-exposición el tiempo para la detección de IgM anti-VHA debe ser < 48 horas (III C, E).
Considerando el costo-efectividad (basado en la prevalencia), los laboratorios pueden usar inicialmente anticuerpos totales para VHA y anti-Bc, determinando anticuerpos IgM sólo si uno o ambos son positivos, si las necesidades del tiempo de retorno pueden ser logradas (III E).
El diagnóstico de la infección aguda por VHC (en un paciente con un cuadro clínico de injuria hepática aguda) puede ser hecho presuntivamente por ser negativos los marcadores VHA y VHB, por exposición reciente, y por presentar anti-VHC negativo y ARN VHC positivo, o anti-VHC negativo en la presentación inicial con desarrollo de anti-VHC positivo dentro de 1-3 meses (III B).
El testeo para VHD debe estar limitado a pacientes con HBsAg positivo, curso clínico atípico, y alto riesgo para infección con VHD (II B, E).
La bilirrubina es menor que 34 µmol/L (2 mg/dL) en el 80% de casos de injuria tóxica o isquémica (94-96). La actividad de lactato deshidrogenasa (LDH) es a menudo superior a la de AST en el momento de la presentación para los casos de injuria hepática tóxica o isquémica (94)(199)(200), mientras que está aumentada inicialmente en sólo 55% de los casos de hepatitis viral, con valores promedio sólo ligeramente por encima del límite de referencia superior (175).
Otras causas. Raramente la enfermedad de Wilson y la hepatitis autoinmune (discutidas con más detalle como injurias hepáticas crónicas) pueden presentarse como injuria hepática aguda (Tabla XIII). La hepatitis E es endémica en algunas partes del mundo; los individuos con injuria hepática aguda que han viajado o residido en áreas endémicas deben ser testeados para anti-VHE. Varios virus distintos de los agentes clásicos (VHA, VHB, VHC, VHE) están asociados con hepatitis incluyendo Herpes Virus, citomegalovirus (CMV), enterovirus, coronavirus, reovirus (en neonatos), adenovirus, parvovirus B6 (en poblaciones pediátricas), virus varicela – zóster y virus de Epstein-Barr . La sífilis, la leptospirosis y toxoplasmosis también pueden causar injuria hepática, así como otros agentes infecciosos menos comunes. Raramente, otros desórdenes como linfoma, el síndrome de Budd-Chiari, y enfermedades veno-oclusivas pueden presentarse con un cuadro de injuria hepática aguda. En general, la injuria hepática asociada con estas etiologías también es inusual, o está asociada con un síndrome específico varicela de los pollos con virus de varicela-zóster, mononucleosis con virus de Epstein–Barr o citomegalovirus). La mayoría de los pacientes con otras causas infecciosas de injuria hepática tiene signos y síntomas que sugieren un agente particular. El diagnóstico específico de infección por otros agentes debe ser realizado cuando la etiología permanece desconocida después de haber excluido las causas más comunes, y cuando el establecimiento de un diagnóstico específico aparece clínicamente indicado. Puede producirse sobreinfección con otros virus de hepatitis en un paciente con otras formas de injuria hepática, por ejemplo pacientes con VHC crónica o hepatitis alcohólica pueden ser infectados ya sea con VHA o VHB y desarrollar una hepatitis aguda debido a la infección agregada. En la hepatitis crónica, un aumento agudo en las aminotransferasas con semejanza a la hepatitis aguda puede ocurrir con un clearance de AgHBe (208) o con emergencia de cuasi especies de VHC (209).
Recomendaciones:
En pacientes con marcadores virales negativos (AST inicial > 100 veces el límite superior del intervalo de referencia, debe ser sospechada exposición tóxica o isquemia (IIB).
En pacientes con marcadores virales negativos y niveles de enzimas 8-100 veces el límite superior de intervalo de referencia, los tests deben excluir la posibilidad de enfermedad de Wilson y hepatitis autoinmune (IIB).
El test para anticuerpos para hepatitis E se recomienda en aquellos individuos con serología negativas para otros virus e historia de viajes recientes o residencia en el área endémica (IIIE).
Los tests para otros agentes infecciosos (virus de Epstein-Barr y citomegalovirus, sífilis, toxoplasmosis) pueden ser usados si otras causas no son evidentes (IIB).
Monitoreo
Aminotransferasas - Las actividades de las aminotransferasas tienden a aumentar primero y presentan un pico cercano al comienzo de la aparición de la ictericia en la hepatitis viral, cayendo gradualmente a partir de ese punto (191). Las actividades tienden a caer lentamente en la hepatitis viral y en la alcohólica; AST y ALT disminuyen en promedio 11.7% y 10.5% por día, respectivamente, y permanecen elevadas 22 ± 16 y 27 ± 16 días, respectivamente (175). En la hepatitis A se produce un aumento secundario en las enzimas en un 5-10% de los casos antes de que las actividades retornen al valor basal, asociado con ARN VHA circulante y partículas virales en materia fecal, indicando potenciabilidad para la transmisión de la infección (210). Como se discutió antes, AST y ALT caen rápidamente luego de alcanzar el pico de actividades en la injuria hepática tóxica e isquémica. Una vez que las aminotransferasas han mostrado un patrón de disminución consistente no necesitan ser controladas nuevamente hasta que el paciente se haya recuperado clínicamente. El retorno de las aminotransferasas al valor normal no es un signo confiable de recuperación en la hepatitis B o C. En pacientes con infección crónica por VHC, el 49% de los casos tienen ALT normal en la visita inicial luego de la seroconversión que desarrolló aumento de ALT en el seguimiento subsecuente (211). En la hepatitis B, AST y ALT pueden retornar al valor normal a pesar de la persistencia de la infección (212).
Bilirrubina - La bilirrubina hace el pico después de la aminotransferasas, a menudo una semana y luego gradualmente decae. Un pico de bilirrubina de 257 – 342 µmol/L (15-20 mg/ dL) no es usual en hepatitis viral. Sólo del 10-12% de los pacientes con hepatitis viral tiene valores por encima de 257 µmol/L (15 mg/dL) y sólo 4% tiene valores pico sobre 342 µmol/L (20 mg/dL); la bilirrubina más alta es más común en la infección por VHB (175)(181). A medida que la bilirrubina total disminuye, la proporción de bilirrubina-d aumenta, a menudo alcanzando 70-80% de la bilirrubina total (213)(214). En adultos con hepatitis viral, la bilirrubina permanece elevada 30.3 ± 19,7 días luego de que se alcanzaron los niveles pico (175), pero clarifica más rápidamente en niños (181); la ictericia permanece más de 6 semanas en el 34% de los casos de adultos con VHB pero en sólo 15% de los casos de otras formas de hepatitis viral (181). Una elevación prolongada de la bilirrubina conjugada ocurre ocasionalmente con la hepatitis viral, particularmente con HVA, pero no significa un pobre pronóstico si la función sintética permanece intacta (215). No es común un aumento significativo de bilirrubina en la injuria hepática isquémica o tóxica. Una vez que la bilirrubina comenzó a disminuir, no hay razón para medirla nuevamente a menos que clínicamente la ictericia empeore.
Recomendaciones:
El tiempo de protrombina > 4 segundos por encima de los límites de referencia, bilirrubina > 257 µmol/L (15 mg/dL), o desarrollo de encefalopatía identifica a los pacientes de alto riesgo que requieren un monitoreo cuidadoso y la consideración de consulta con un gastroenterólogo o hepatólogo (IIB).
En pacientes con hepatitis B aguda, se debe realizar repetidamente la determinación de AgHBs dentro de los 6-12 meses; si es negativa y anti-HBs es positiva no se necesita seguimiento posterior (IIE).
En pacientes con hepatitis C aguda, ALT debe ser repetida periódicamente durante 1-2 años para asegurar la continuidad de los resultados normales. El clearance del virus debe ser confirmado con medidas cualitativas de ARN HCV (II B).
Pruebas de coagulación – El tiempo de protrombina elevado es un hallazgo común en la injuria hepática tóxica e isquémica, a menudo con resultados > 15 segundos ó 4 segundos por encima del límite superior del intervalo de referencia, antes de retornar rápidamente al valor normal. No hay datos sobre el grado de elevación que pueda afectar el pronóstico en la injuria hepática isquémica. Una elevación del tiempo de protrombina > 15 segundos, o más de 4 segundos por encima de los límites del intervalo de referencia en hepatitis viral o alcohólica es marcadora de enfermedad más severa (98)(99)(180).
Marcadores serológicos - En individuos con hepatitis B aguda AgHBs es el mejor indicador del clearance viral. Los pacientes que pierden AgHBs y desarrollan anti-HBs virtualmente nunca desarrollan recurrencia de injuria hepática, y pueden ser considerados como recuperados de la infección por VHB. En la infección aguda por VHC, la mayoría de los individuos nunca desarrollan un cuadro clínico de injuria hepática aguda (154)(211). El único marcador confiable del clearance de VHC es el ARN HCV repetidamente (en por lo menos dos ocasiones) negativo, usando tests cualitativos sensibles.
Referencias bibliográficas
174. Ellis G, Goldberg DM, Spooner RJ, Ward AM. Serum enzyme tests in diseases of the liver and biliary tree. Am J Clin Pathol 1978; 70: 248-58.
175. Rozen P, Korn RJ, Zimmerman HJ. Computer analysis of liver function tests and their interrelationship in 347 cases of viral hepatitis. Isr J Med Sci 1970; 6: 67-79.
175a. Hepatitis Surveillance Report No. 56. Atlanta: Centers for Disease Control and Prevention, 1995, 36p.
176. Whitehead MW, Hawkes ND, Hainsworth I, Kingham JGC. A prospective study of the causes of notably raised aspartate aminotransferase of liver origin. Gut 1999; 45: 129-33.
177. Anciaux ML, Pelletier AG, Attali P, Meduri B, Liguory C, Etienne JP. Prospective study of clinical and biochemical features of symptomatic choledocholithiasis. Dig Dis Sci 1986; 31: 449-53.
178. Fortson WC, Tedesco FJ, Starnes EC, Shaw CT. Marked elevation of serum transaminase activity associated with extrahepatic biliary tract disease. J Clin Gastroenterol 1985; 7: 502-05.
179. Mihas AA, Doos WG, Spenney JG. Alcoholic hepatitis – a clinical and pathological study of 142 cases. J Chronic Dis 1978; 31: 461-72.
180. Goldberg S, Mendenhall C, Anderson S, García-Pont P., Kieman T, Seeff L, et al. VA Cooperative Study on Alcoholic Hepatitis. IV. The significance of clinically mild alcoholic hepatitis – describing the population with minimal hyperbilirubinemia. Am J Gastroenterol 1986; 81: 1029-34.
181. Stewart JS, Farrow LJ, Clifford RE,Lamb SG, Coghill NF, Lindon RL, et al. A three-year survey of viral hepatitis in West London. Q J Med 1978; 47: 365-84.
182. Lednar WM, Lemon SM, Kirkpatrick JW, Redfield RR, Fields ML, Kelley PW. Frequency of illness associated with epidemic hepatitis A virus infections in adults. Am J Epidemiol 1985; 122: 226-33.
183. Gitlin N. Hepatitis B: diagnosis, prevention and treatment. Clin Chem 1997; 43: 1500-6.
184. McMahon BJ, Alward WL, Hall DB, Haymard WL, Bender TR, Francis DP, et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and sub sequent development of the carrier state. J Infect Dis 1985; 151: 599-603.
185. Hoofnagle JH. Hepatitis C: the clinical spectrum of disease. Hepatology 1997; 26(Suppl 1): 15S-20S.
186. Seeff LB, Wright EC, Zimmerman HJ, McCollum VA. Cooperative study of post-transfusion hepatitis, 1969-1974: incidence and characteristics of hepatitis and responsible risk factors. Am J Med Sci 1975; 270: 355-62.
187. Borsch G, Baier J, Glocke M, Nathusius W, Gerhardt W. Graphical analysis of laboratory data in the differential diagnosis of cholestasis: a computer-assisted prospective study. J Clin Chem Clin Biochem 1988; 26: 509-19.
188. Kenny-Walsh E, for the Irish Hepatology Research Group. Clinical outcomes after hepatitis C infection from contaminated anti-D immune globulin. N Engl J Med 1999; 340: 1228-33.
189. Vogt M, Lang T, Frosner G, Klinger C, Sendl AF, Zeller A, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood donor screening. N Engl J Med 1999; 341: 866-70.
190. Gitlin N, Serio KM. Ischemic hepatitis: widening horizons. Am J Gastroenterol 1992; 87: 831-6.
191. Tygstrup N, Ranek L. Assessment of prognosis in fulminant hepatic failure. Semin Liv Dis 1986; 6: 129-37.
192. Harrison PM, O'Grady JG, Keays RT, Alexander GJ, Williams R. Serial prothrombin time as prognostic indicator in paracetamol induced fulminant hepatic failure. BMJ 1990; 301: 964-8.
193. Noskin GA. Prevention, diagnosis, and management of viral hepatitis: a guide for primary care physicians. Arch Fam Med 1995; 4: 923-34.
194. Lemon SM, Brown CD, Brooks DS, Simms TE, Bancroft WH. Specific immunoglobulin M response to hepatitis A virus determined by solid phase radioimmunoassay. Infect Immun 1980; 28: 927-36.
195. Gretch DR, dela Rosa C, Carithers RL, Wilson RA, Williams B, Corey L. Assessment of hepatitis C viremia using molecular amplification technologies: correlations and clinical implications. Ann Intern Med 1995; 123: 3211-329.
196. Alter MJ, Margolis HS, Krawczynski K, Judson FN, Mares A, Alexander WJ, et al. The natural history of community acquired hepatitis C in the United States. N Engl J Med 1992; 327: 1899-905.
197. London WT, Evans AA. The epidemiology of hepatitis viruses B, C, and D. Clin Lab Med 1996; 16: 251-71.
198. Zimmerman HJ. Hepatotoxicology: The adverse effects of drugs and other chemicals on the liver. 2nd Edition. Philadelphia: J. B. Lippincot; 1999.
199. Fry SW, Seeff LB. Hepatotoxicity of analgesics and antiinflammatory agents. Gastroenterol Clin North Am 1995; 24: 875-905.
200. Zimmerman HJ, Maddrey WC. Acetaminophen (paracetamol) hepatotoxicity with regular intake of alcohol: analysis of instances of therapeutic misadventure. Hepatology 1995; 22: 767-73.
200a. Johnson RD, O'Connor ML, Kerr RM. Extreme serum elevations of aspartate aminotransferase. Am J Gastroenterol 1995; 90: 1244-5.
201. Shilsky ML. Wilson disease: genetic basis of copper toxicity and natural history. Semin Liv Dis 1996; 16: 83-95.
202. Steindl P, Ferenci P, Dienes HP, Grimm G, Pabinger I, Madl C, et al. Wilson's disease in patients presenting with liver disease: a diagnostic challenge. Gastroenterology 1997; 113: 212-8.
203. Berman DH, Leventhal RI, Gavaler JS, Cadoff EM, Van Thiel DH. Clinical differentiation of fulminant Wilsonian hepatitis from other causes of hepatic failure. Gastroenterology 1991; 100: 1129-34.
204. Crapper RM, Bhathal PS, Mackay IR, Frazer IH. "Acute" autoimmune hepatitis. Digestion 1986; 34: 216-25.
205. Amontree JS, Stuart TD, Bredfeldt JE. Autoimmune chronic active hepatitis masquerading as acute hepatitis. J Clin Gastroenterol 1989; 11: 303-07.
206. Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group. Hepatology 1993; 18: 998-1005.
207. Horwitz CA, Burke MD, Grimes P, Tombers J. Hepatic function in mononucleosis induced by Epstein-Barr virus and cytomegalovirus. Clin Chem 1980; 26: 243-6.
208. Liaw YF, Chu CM, Su IJ, Huang MJ, Lin DY, Chang-Chien CS. Clinical and histological events preceding hepatitis B e antigen seroconversion in chronic type B hepatitis. Gastroenterology 1983; 84: 216-9.
209. Yuki N, Hayashi N, Moribe T, Matsushita Y, Tabata T, Inove T, et al. Relation of disease activity during chronic hepatitis C infection to complexity of hypervariable region 1 quasispecies. Hepatology 1997; 25: 439-44.
210. Tong MJ, el-Farra NS, Crew MI. Clinical manifestations of hepatitis A. Recent experience in a community teaching hospital. J Infect Dis 1995; 171 Suppl 1: S15-8.
211. Inglesby TV, Rai R, Astemborski J, Gruskin C, Nelson KE, Vlahon D, et al. A prospective community-based evaluation of liver enzymes in individuals with hepatitis C after drug use. Hepatology 1999; 29: 590-6.
212. de Franchis R, Meucci G, Vecchi M, Tatarella M, Colombo M, Del Ninno E, et al. The natural history of asymptomatic hepatitis B surface antigen carriers. Ann Intern Med 1993; 118: 191-4.
213. Weiss JS, Gautman A, Lauff JJ, Sunaberg MW, Jatlow P, Boyer JL, et al. The clinical importance of a protein-bound fraction of serum bilirubin in patients with hyperbilirubinemia. N Engl J Med 1983; 309: 147-50.
214. Van Hootegem P, Fevery J, Blanckaert N. Serum bilirubins in hepatobiliary disease: comparison with other liver function tests and changes in the postobstructive period. Hepatology 1985; 5: 112-7.
215. Gordon SC, Reddy KR, Schiff L, Schiff ER. Prolonged intrahepatic cholestasis secondary to acute hepatitis A. Ann Intern Med 1984; 101: 635-7.














