Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
RIA. Revista de investigaciones agropecuarias
On-line version ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.43 no.1 Ciudad Autónoma de Buenos Aires Apr. 2017
ARTÍCULOS
Control químico de Pythium spp. en plántulas de soja
Grijalba, P.E.1; Ridao, A. Del C.2
1Universidad de Buenos Aires. Argentina. Correo electrónico: grijalba@agro.uba.ar
2Universidad Nacional de Mar del Plata. Correo electrónico: ridao.azucena@inta.gob.ar
Recibido 27 de julio de 2015
Aceptado 07 de septiembre de 2016
Publicado online 10 de mayo de 2017
RESUMEN
La podredumbre por Pythium en soja puede aparecer desde la germinación de la semilla hasta mediados de la época de crecimiento. Se evaluó la eficacia de control de cuatro fungicidas aplicados en forma preventiva en semillas de soja. Estas se colocaron en bandejas plásticas conteniendo sustrato comercial tindalizado inoculado con Pythium. Se efectuaron dos ensayos: A) A partir de los fungicidas recomendados para esta enfermedad en la Argentina: metalaxil-M y carbendazim+tiram y B) A partir de los fungicidas de amplio uso en Argentina: azoxistrobina y difenoconazol, pero no como curasemillas. Los tratamientos fueron asignados a las unidades experimentales (bandejas) de acuerdo a un diseño completamente aleatorizado con tres repeticiones por tratamiento. A los 21 días se evaluó la incidencia de la enfermedad por bandeja y se calculó el porcentaje de control de cada fungicida. Los resultados obtenidos se analizaron mediante un Análisis de Varianza y las medias fueron comparadas aplicando el Test DGC con un nivel de significancia del 5%. Metalaxil presentó aproximadamente un 100% de control mientras que para carbendazim+tiram fue solo del 4,30%. La aplicación tanto de azoxistrobina como de difenoconazol difirió significativamente de la de metalaxil con un control de 61% y 28,80% respectivamente. El control químico de la podredumbre por Pythium en plántulas de soja fue más eficaz con la aplicación del fungicida metalaxil de manera preventiva con respecto a los otros tres fungicidas probados.
Palabras clave: Fungicidas; Metalaxil; Oomycetes; Curasemillas; Glycine max L.
ABSTRACT
Pythium rot in soybean may appear from seed germination to the middle of the growing season. Effective control of four fungicides applied preventively in soybean was evaluated. These seeds were placed in plastic trays containing commercial substrate tyndallizated, inoculated with Pythium. Two trials were conducted A) Based on fungicides recommended for this disease in Argentina: metalaxyl-M and carbendazim + thiram and B) Based on fungicides widely used in Argentina: azoxystrobin and difenoconazole but not for seed treatment. The treatments were assigned to experimental units (trays) according to a completely randomized design with three replicates per treatment. After 21 days the incidence per pot was evaluated and the percentage of control of each fungicide was calculated. The results were analyzed by analysis of variance and the means were compared using the DGC Test with a significance level of 5%. Metalaxyl presented approximately 100% control while for carbendazim + thiram it was only 4.30%. The application of both azoxystrobin and difenoconazole differed significantly from metalaxil (61% and 28.80% control respectively). Chemical control of Pythium rot in soybean seedlings was more effective with the implementation of preventive fungicide metalaxyl with respect to the other three fungicides tested.
Keywords: Fungicides; Metalaxil; Oomycetes; Seed treatment; Glycine max L.
INTRODUCCIÓN
Mundialmente se considera que las enfermedades de la soja (Glycine max L.) son las responsables del 10-15% de las pérdidas ocasionadas en la producción de esta oleaginosa (Wrather et al., 2001). Las principales enfermedades de la raíz y base del tallo son producidas por un complejo de microorganismos del suelo. Pythium es uno de los principales agentes causales de la pudrición de semillas y raíces de pre y posemergencia. Su desarrollo se ve favorecido por un deficiente drenaje y la consecuente baja aireación del suelo, que permite la dispersión de las zoosporas. Se han citado muchas especies de Pythium que infectan soja, cada una tiene diferentes requerimientos de temperatura para crecer, germinar e infectar (ej. Hartman et al., 1999). La infección con P. aphanidermatum es más severa entre 30 y 35 °C y temperaturas por debajo de 23 °C son más favorables para la infección de P. ultimum (Thomson et al., 1971). Hasta el presente se han identificado 160 especies de Pythium (Abad, 2010). En Argentina, en 1956 Frezzi (1956) describió 16 especies nuevas y actualmente solo se hallan descriptas 17 (Ploper et al., 2010; Palmucci et al., 2011).
Recientemente se ha citado a P. irregulare, P. ultimum var. ultimum, P. sylvaticum, P. inflatum, P. debaryanum, P. rostratum, P. catenulatum y Phytopythium helicoides asociados a plántulas de soja (Grijalba et al., 2011 y 2014; Pastor et al., 2011). La mayor prevalencia de enfermedades de plántulas ocasionadas por especies de Pythium se ha asociado con el aumento en las prácticas de labranza reducida (Pankhurst et al., 1995). En Argentina, la rápida expansión del área con siembra directa pasó de nueve millones de hectáreas en 1999 a 25 millones en 2009 y se sigue mostrando un creciente interés por esta tecnología en la agricultura (Aapresid, 2009). Reducir el laboreo deja más superficie del suelo cubierto de restos de cosecha, lo que evita el rápido secado, como también impide el rápido aumento de temperatura del suelo en primavera, retardando la germinación y el crecimiento de las plántulas (Griffith et al., 1977; Van Doren y Triplett, 1973). El género Pythium pertenece a la familia Pythiaceae (Peronosporomycetes, ex Oomycetes), anteriormente considerados hongos, y que han sido reubicados en el reino Straminipila. Este género causa enfermedades en el cultivo de soja en todo el mundo y ocasiona serios problemas. El control de este patógeno se logra principalmente a través del tratamiento químico con curasemillas específicos y eficientes contra Peronosporomycetes. Por una parte, el metalaxil es un fungicida perteneciente a las fenilamidas que inhibe específicamente la síntesis de ARN ribosomal en Peronosporomycetes, pero si bien es muy eficiente se ha encontrado resistencia en varias especies de Pythium, incluyendo P. irregulare y P. ultimum. Por otra parte los resultados obtenidos con fungicidas como tiram y captan son inconsistentes. Además, la mayoría de los ensayos de eficacia de fungicidas se llevaron a cabo antes de la década de 1980 y hay escasa información sobre la eficacia de nuevos productos químicos, por ejemplo, las estrobilurinas (Weiland et al., 2014).
El objetivo del presente trabajo fue evaluar la respuesta de diferentes productos químicos formulados como curasemillas frente al ataque de Pythium spp. en semillas de soja. Específicamente, se evaluaron metalaxil, carbendazim+ tiram, difenoconazol y azoxistrobina.
MATERIALES Y MÉTODOS
Obtención y selección de los aislamientos
Los aislamientos fueron colectados en campos de las localidades de Pergamino y Balcarce durante los años 2009 a 2011. Se utilizó la técnica de trampa con plántulas de soja, aislando Pythium a partir de suelo con varios años de agricultura y principalmente soja en su historial. Raíces con síntomas de necrosis o de podredumbre se lavaron para remover partículas de suelo y se desinfectaron superficialmente con hipoclorito de sodio (al 1,5% de Cl activo) durante 30 segundos. Luego se lavaron con agua destilada estéril y se secaron con servilletas de papel. Dichas raíces se sembraron en medio PARP-APD (Agar Papa Dextrosado) (Jeffers y Martin, 1986) mediante la técnica de la burbuja o del agar invertido para evitar el desarrollo de bacterias (Schmitthenner, 1973). Después de 24-48 h, los aislamientos se transfirieron a nuevas placas de Petri con APD. Los aislamientos de Pythium spp. se identificaron mediante técnicas morfológicas y, en caso de dudas para su confirmación, se utilizaron técnicas moleculares (no descriptas en este trabajo, Levesque et al., 2004). Además se evaluó su patogenicidad in vitro e in vivo sobre plántulas.
Para inducir la formación de estructuras reproductivas de los aislamientos obtenidos, 3-4 secciones de 0,5 cm de diámetro de agar con micelio de 7 días de crecimiento, se colocaron en cajas de Petri que contenían agua destilada estéril con 15-20 trocitos de Agrostis sp. de 0,5 a 1 cm de longitud, hervidos durante 10-15 minutos. Después de 48- 72 h, los segmentos colonizados se observaron en microscopio óptico (Abad et al., 1994). La identificación y caracterización se efectuó teniendo en cuenta la morfología de las colonias en los medios APD y AV8 (Schmitthenner, 1973), y las estructuras vegetativas y reproductivas sexuales y asexuales (Frezzi, 1956 y 1977; Van der Plaats-Niterink, 1981; Dick, 2001).
Ensayos de patogenicidad
Se probó la patogenicidad de los aislamientos in vitro e in vivo según la metodología de Dorrance et al. (2004).
A. in vitro: cada aislamiento se sembró en el centro de cajas de Petri de 9 cm de diámetro conteniendo APD. Cuando las colonias crecieron hasta casi completar las cajas (2-3 días aproximadamente) se colocaron en cada una 10 semillas de soja previamente desinfectadas con hipoclorito de sodio (al 1,5% de Cl activo) durante 30 segundos. A los siete días desde la siembra se contaron las semillas y/o plántulas muertas.
B. in vivo: sustrato comercial (previamente tindalizado dos veces con vapor de agua durante una hora y regado hasta saturación) se colocó en macetas plásticas de 12 cm de diámetro hasta su mitad. Sobre el sustrato se puso el contenido de una caja de Petri de 9 cm, por aislamiento, desarrollado en APD durante 4 días a 22 °C. Luego se cubrió con un cm de espesor de sustrato tindalizado. Finalmente, se sembraron 20 semillas de soja a las que se agregó un centímetro de espesor de sustrato tindalizado. Las macetas inoculadas se mantuvieron durante 15 días a 20-22 °C hasta el momento de realizar el recuento de plántulas emergidas.
Eficacia de los diferentes fungicidas Sensibilidad in vitro
Los fungicidas utilizados fueron los recomendados para el control de esta enfermedad en soja (CASAFE, 2007): 1) Metalaxil con una dosis de 10 ppm en APD y 2) Carbendazim+tiram con una dosis de 100 ppm en APD (Dorrance et al., 2004). Se sembró un trocito de APD de 0,5 cm de diámetro de cada aislamiento en el centro de una caja de Petri de 9 cm. Se efectuaron cuatro repeticiones para cada tratamiento incluyendo los testigos en blanco que solo contenían APD. La variable respuesta fue el crecimiento micelial, medido en mm con regla.
Eficacia en semillas
Se efectuaron dos ensayos: A) con el uso de los fungicidas recomendados para esta enfermedad en la Argentina, con la aplicación para el ensayo de sensibilidad in vitro: metalaxil-M (35% p/v) con una dosis de 50 cm3/100 kg de semilla y carbendazim+tiram, 200 cm3/100 kg de semilla y B) con la aplicación de fungicidas de amplio uso en Argentina como azoxistrobina (10%) con una dosis de 250 cm3/100 kg de semilla y difenoconazol (3%), 300 cm3/100 kg de semilla; estos se formularon como curasemillas (de acuerdo a las indicaciones de la compañía química proveedora). En ambos ensayos, la semilla fue sembrada dos días después de su tratamiento con el método semihúmedo (Syngenta, 2014).
Sobre una capa de sustrato tindalizado en el fondo de una bandeja plástica (10 x 20 x 5 cm) se colocó inóculo de cada uno de los 10 aislamientos (aproximadamente 15 cc de APD colonizado), que fueron cubiertos con otra capa de sustrato tindalizado. Sobre esta última se sembraron 25 semillas de soja, las que se cubrieron con una nueva capa de sustrato tindalizado. Los testigos se trataron de igual forma, pero en uno se colocó APD sin micelio y en otro no se aplicó fungicida. Los tratamientos fueron asignados a las unidades experimentales (bandejas) de acuerdo a un diseño completamente aleatorizado con 3 repeticiones por tratamiento. Las evaluaciones se realizaron a los 21 días desde la siembra mediante el cálculo de incidencia de la enfermedad por bandeja y el porcentaje de control de cada fungicida. Los resultados obtenidos se analizaron mediante un ANOVA y las medias fueron comparadas aplicando el Test DGC con un nivel de significancia del 5% (Infostat, 2009). La eficiencia de los fungicidas se determinó calculando el porcentaje de control mediante la fórmula de Abbott (1925).
RESULTADOS
Obtención y selección de aislamientos para ensayos
Para el ensayo de sensibilidad in vitro, de los 114 aislamientos obtenidos se seleccionaron 40 (20 aislamientos de Pergamino y 20 de Balcarce) pertenecientes a las especies P. ultimum, irregulare y sylvaticum. Mientras que para los ensayos de eficacia de los formulados se seleccionaron 10 aislamientos con una patogenicidad del 100% in vitro y más de 80% in vivo de las especies de mayor prevalencia, cinco de P. irregulare y cinco de P. ultimum.
Sensibilidad in vitro
Con la dosis de 10 ppm de metalaxil in vitro, el 100% de los aislamientos fue inhibido, pero cuando el medio de cultivo contenía una dosis de 100 ppm de carbendazim+tiram inhibió solo al 40% de los aislamientos.
Eficacia en semillas
Ensayo A: el metalaxil controló eficazmente los diez aislamientos en forma conjunta, ya que presentó más plántulas emergidas en promedio que el resto de los tratamientos, e inclusive presentó el mismo número de plántulas emergidas que el testigo sin inocular. La mezcla de fungicidas carbendazim+tiram no generó ningún tipo de protección, ya que el testigo inoculado y el tratamiento con esta mezcla de fungicidas no presentaron una diferencia significativa. El metalaxil presentó un 95,70% de control mientras que carbendazim+tiram solo un 4,30% (tabla 1).
Tabla 1. Porcentaje de emergencia promedio y Porcentaje de control de 25 semillas de soja tratadas con fungicidas curasemillas y sembradas en suelo inoculado con Pythium spp.
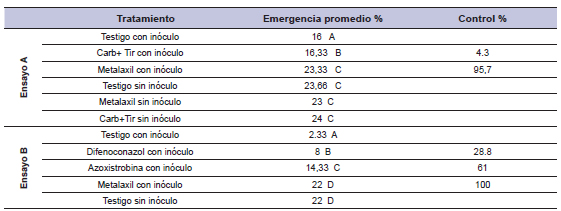
Carb+ Tir: Carbendazim + Tiram
Test DGC letras distintas indican diferencias significativas (p<=0,05).
Ensayo B: todos los tratamientos se diferenciaron estadísticamente del testigo inoculado en la cantidad de plántulas emergidas, metalaxil presentó un 100% de control comparable con el resultado del ensayo A) difenoconazol y azoxistrobina se diferenciaron estadísticamente entre ellos, con azoxistrobina se obtuvo la mayor cantidad de plántulas normales emergidas y un 61% de control mientras que difenoconazol solo controló un 28,80% (tabla 1).
DISCUSIÓN Y CONCLUSIONES
El metalaxil, fenilamida con acción sistémica y específico para Peronosporomycetes, y fungicida recomendado para Pythium (CASAFE, 2007) en el cultivo de soja en la República Argentina, presentó un muy buen nivel de control de los aislamientos patógenos tanto en los ensayos in vitro como en los realizados en semillas de soja. Por su parte, la mezcla de los fungicidas carbendazim+tiram que presenta tanto acción sistémica como de contacto no controló de manera eficaz a los mismos aislamientos de Pythium. Esta mezcla presentó solo un 40% de control en los ensayos in vitro y 4,30% en el realizado en semillas de soja. Por esta razón, no se aconseja para el tratamiento de semillas de soja que pueden ser atacadas por este patógeno en los primeros estadios del cultivo.
Por un lado, en referencia a los fungicidas de amplio uso en Argentina, pero no recomendados como curasemillas en el cultivo de soja, los resultados obtenidos coinciden con Reis et al. (2010) quienes indicaron que al ser Pythium un Peronosporomycete, los triazoles (inhibidores de la síntesis del ergosterol) no ofrecen una buena respuesta. La ruta bioquímica del ergosterol es una característica de la mayoría de los hongos (Ascomycetes, Deuteromycetes y Basidiomycetes), pero está ausente en los Peronosporomycetes (Peronospora, Plasmopara, Phytophthora, Pythium, etc). Estos últimos son insensibles a los triazoles, dado que no sintetizan el ergosterol, satisfaciendo sus necesidades por la absorción miceliar del compuesto a partir del sustrato. Esta diferencia es la base de la selectividad de los inhibidores de la biosíntesis de esteroles, que no se pueden utilizar para el control de las enfermedades causadas por Peronosporomycetes. Por otro lado, las estrobirulinas poseen un amplio espectro de control y cierto grado de absorción sistémica por las raíces, aumentando la protección de las plántulas y su acción fungicida resulta de la inhibición de la respiración mitocondrial en los hongos, debido a que previenen la transferencia de los electrones entre el citocromo b y el citocromo c. Estos fungicidas no son específicos para los Peronosporomycetes, pero pueden controlar al género Pythium, aunque con eficiencias relativamente bajas a medias, y dependen del momento de aplicación (acción preventiva). Dentro de este grupo químico, azoxistrobina de uso en tratamientos de semillas (DYNASTY ® 10 FS SEMILLERO – Syngenta, 2014) está recomendada para Plasmopara halstedii agente causal del mildiu del girasol, que también pertenece al reino Straminipila. Sin embargo bajo las condiciones de este ensayo el control de los aislamientos de Pythium utilizados fue intermedio y bastante menor que el producido por el tratamiento con metalaxil.
Por lo tanto, se concluye que el control químico de la podredumbre por Pythium en plántulas de soja fue más eficaz con la aplicación del fungicida metalaxil, de manera preventiva, con respecto a los otros tres fungicidas probados. Aun así, y dado que en varios países se han reportado cepas resistentes a metalaxil (Sanders, 1987; Porter et al., 2009; Van Jaarsveld et al., 2002; Weiland et al., 2014) se deberían utilizar otras técnicas de manejo para esta enfermedad, tanto químico como biológico, que provean un control adecuado. Sería necesario que las compañías químicas y los productores de soja focalicen la atención en utilizar alternadamente fungicidas eficaces con diferente modo de acción que prevenga el futuro desarrollo de aislamientos resistentes.
BIBLIOGRAFÍA
1. ABAD, Z. 2010. Symposium on Oomycete Pathosystems. Challenges in Understanding and Managing Oomycetes. Mayo 27 de 2010. Penn State University Pennsylvania, EUA. [ Links ]
2. ABAD, Z.G.; SHEW, H.D.; LUCAS, L.T. 1994. Characterization and pathogenicity of Pythium Species isolated from Turfgrass with Symptoms of Root and Crown Rot in North Carolina. Phytopathology 84: 913-921. [ Links ]
3. ABBOTT, W. S. 1925. A method of computing the effectiveness of an insecticide. J. Econ. Entomol. 18:265-267. [ Links ]
4. AAPRESID. 2009. Evolución de la superficie en siembra directa. (Período 77/01). (Disponible: www.aapresid.org.ar/apadmin/img/upload/evolucion.xls verificado: diciembre de 2010). [ Links ]
5. CÁMARA DE SANIDAD AGROPECUARIA Y FERTILIZANTES DE LA REPÚBLICA ARGENTINA (CASAFE). 2007. Guía de Productos Fitosanitarios. p. 2248. [ Links ]
6. DICK, M.W. 2001. Straminipilous Fungi: Systematics of the Peronosporomycetes including accounts of the marine straminipilous protists, the plasmodiophorids and similar organisms. Kluwer Academic Publishers. Países Bajos. p. 670. [ Links ]
7. DORRANCE, A.E.; BERRY, S.A.; BOWEN, P.; LIPPS, P.E. 2004. Characterization of Pythium spp. from three Ohio fields for pathogenicity on corn and Soybean and metalaxyl sensitivity. (Disponible: http://www.plantmanagementnetwork.org/pub/php/research/2004/pythium/ verificado: octubre de 2011). [ Links ]
8. FREZZI, M. J. 1956. Especies de Pythium fitopatógenas identificadas en la República Argentina. Revista de Investigaciones Agrícolas. 10 (2): 113-241. Eds. INTA. [ Links ]
9. FREZZI, M. J. 1977. Especies del género Pythium y Phytophthora fitopatógenas identificadas en Argentina. Boletín, serie didáctica 2. Inst. de Cs Agronómicas. UNCb. p. 96. [ Links ]
10. GRIFFITH, D.R.; MANNERING, J.V.; MOLDENHAUER, W.C. 1977. Conservation tillage in the eastern corn belt. J. Soil & Water Conservation, 32:20-28. [ Links ]
11. GRIJALBA, P.; PALMUCCI, H.; MOHS, A.; PASE, S. 2011. Identificación de especies de Pythium asociadas con plántulas de soja. 2.o Congreso Argentino de Fitopatología. Mar del Plata, Argentina. Del 01 al 03 de junio de 2011. p. 115. [ Links ]
12. GRIJALBA, P.; STECIOW. M.; RIDAO, A.C. 2014. Pythium Catenulatum y Phytopythium helicoides asociados a plántulas de soja. 3.er Congreso Argentino de Fitopatologia. 4-6 de junio 2014. San Miguel de Tucumán. p. 187. [ Links ]
13. HARTMAN, G.L.; SINCLAIR, J.B.; RUPE, J.C. 1999. 4th. Ed. Compendium Soybean Diseases. APS Press. Inc., St. Paul, MN. p.100. [ Links ]
14. INFOSTAT 2009. Software estadístico. Universidad Nacional de Córdoba (FCA-UNC). ((Disponible: www.infostat.com.ar verificado: junio de 2010). [ Links ]
15. JEFFERS, S.N.; MARTIN, S.B. 1986. Comparison of two media selective for Phytophthora and Pythium species. Plant Diseases 70:1038-1043. http://dx.doi.org/10.1094/PD-70-1038 [ Links ]
16. LÉVESQUE, C.A.; DE COCK, A.W.A.M. 2004. Molecular phylogeny and taxonomy of the genus Pythium. Mycological Research 108: 1363–1383.
17. PALMUCCI, H.E.; WOLCAN, S.E.; GRIJALBA; P.E. 2011. Status of the Pythiaceae (Kingdom Stramenopila) in Argentina. I. The Genus Pythium. Revista de la Sociedad Argentina de Botánica. 46 (3-4). [ Links ]
18. PANKHURST, C.E.; MCDONALD, H.J.; HAWKE, B.G. 1995. Influence of tillage and crop rotation on the epidemiology of Pythium infections of wheat in red-brown earth of south Australia. Soil Biol. Biochem., 27:1065-1073. [ Links ]
19. PASTOR, S.; FERRI, M.; SCANDIANI, M.M. 2011. Identificación de especies de Pythium spp. aisladas con trampas de plántulas de soja. 2.o Congreso Argentino de Fitopatología. Mar del Plata, Argentina. Del 01 al 03 de junio de 2011. p. 130. [ Links ]
20. PLOPER, L.D.; GONZÁLEZ, V.; NOME, S.F.; LAGUNA, I.G.; PÉREZ, B.A.; PIOLI, R.; RODRÍGUEZ PARDINA, P.; SCANDIANI, M.; DISTEFANO, S.; SILLÓN, M. 2010. Enfermedades de Glycine max (L.) Merrill (soja, soya, poroto soja, frijol soja). En: Atlas fitopatológico Argentino. VOL. 4, N.º 1. Marzo 2011. Eds: Nome, S.F.; Docampo, D.M.; Conci, L.R. y Laguna, I.G. Córdoba, Argentina. (Disponible: http://www.fitopatoatlas.org.ar/default.asp?hospedante=635 verificado: diciembre de 2014). [ Links ]
21. PORTER, L.D.; HAMM, P.B.; DAVID, N.L.; GIECK, S.L.; MILLER, J.S.; GUNDERSEN, B.; INGLIS, D.A. 2009. Metalaxyl-M-Resistant Pythium species in potato production areas of the Pacific Northwest of the U.S.A. American Journal of Potato Research 86: 315-326. [ Links ]
22. REIS, E.M; REIS, A.C.; CARMONA, M. 2010. Manual de fungicidas Controle químico de doencas de plantas. (en portuges) ISBN 97885-7515-464-9 Ed: Universidade de Passo Fundo, Passo Fundo , Brasil, p. 226. [ Links ]
23. SANDERS, P.L. 1987. Failure of metalaxyl to control Pythium blight on Kentucky golf courses. Phytopathology 77: 121. [ Links ]
24. SCHMITTHENNER, A.F. 1973. Isolation and identification methods for Phytophthora and Pythium. En: Millikan, D.F. Disease Workshop. University of Missouri, Columbia. 94:110. [ Links ]
25. SYNGENTA 2014. Protección de Cultivos. (Disponible: http://www.syngenta.com.ar/Cultivos/productos.aspx?produc=774 verificado: marzo de 2015). [ Links ]
26. THOMSON, T.B.; ATHOW, K.L.; LAVIOLETTE, F.A. 1971. The effect of temperature on the pathogenicity of Pythium aphanidermatum, P. devaryanum and P. ultimun on soybean. Phytopathology 61: 933-935. [ Links ]
27. VAN DER PLAATS-NITERINK, A.J. 1981. Monograph of the genus Pythium. Studies in Mycology N.o 21. Baarn, the Netherlands: Centraalbureau Voor Schimmelcultures, p. 242. [ Links ]
28. VAN DOREN, D.M.; TRIPLETT, G.B. 1973. Mulch and tillage relationships in corn culture. Soil science society of America proceedings. 37: 766-769. [ Links ]
29. VAN JAARSVELD, E.; WINGFIELD, M.J.; DRENTH, A. 2002. Effect of metalaxyl resistance and cultivar resistance on control of Phytophthora nicotianae in tobacco. Plant Dis. 86:362-366. [ Links ]
30. WEILAND, J.E.; SANTAMARIA, L.; GRÜNWALD, N.J. 2014. Sensitivity of Pythium irregulare, P. sylvaticum, and P. ultimum from forest nurseries to mefenoxam and fosetyl-Al, and control of Pythium damping-off. Plant Dis. 98: 937-942. [ Links ] [ Links ]














