Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
RIA. Revista de investigaciones agropecuarias
On-line version ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.43 no.3 Ciudad Autónoma de Buenos Aires Dec. 2017
ARTÍCULOS
Respuesta de hongos benéficos del suelo asociados a Lotus tenuis a la aplicación de glifosato
Druille, M.1; Acosta, A.1; Acosta, G.1; Rossi, J.L.1; Golluscio, R.A.1; Bailleres, M.2
1 Universidad de Buenos Aires. Facultad de Agronomía. Departamento de Producción Animal. Buenos Aires, Argentina. Correo electrónico: druille@agro.uba.ar
2 Chacra Experimental Integrada Chascomús. Ministerio de Agroindustria. INTA.
Recibido 15 de febrero de 2017
Aceptado 31 de mayo de 2017
Publicado online 22 de noviembre de 2017
RESUMEN
En los últimos años se está adoptando la práctica de promoción de Lotus tenuis a través de la aplicación de glifosato en pastizales de La Pampa Deprimida debido a su importante aporte en cantidad y calidad de forraje. Sin embargo, diversos estudios han demostrado que el uso de este herbicida puede ocasionar efectos no deseados en microorganismos benéficos del suelo. El objetivo de este trabajo fue evaluar el efecto de la aplicación de glifosato sobre los hongos micorrícicos arbusculares y hongos septados oscuros asociados a L. tenuis. En una pastura de L. tenuis se establecieron dos tratamientos: Lotus tenuis promovido y Lotus tenuis establecido. En el primer caso, la pastura se pulverizó en invierno (fines de agosto) con 3,5 l/ha de glifosato, mientras en el segundo tratamiento la pastura de L. tenuis no recibió la aplicación del herbicida. Los resultados demuestran que el número de esporas viables de hongos micorrícicos arbusculares fue un 52% menor, y el porcentaje de arbúsculos en plantas de L. tenuis un 40% menor, en el tratamiento Lotus tenuis promovido en relación con el tratamiento Lotus tenuis establecido. La colonización radical por hongos septados oscuros no fue afectada por la aplicación de glifosato. La pérdida de funcionalidad de la simbiosis micorrícica podría en el mediano plazo afectar no solo la producción de biomasa de L. tenuis, sino también la diversidad y productividad de todas las especies presentes en la comunidad vegetal. La información generada en este trabajo será de utilidad para rediseñar prácticas de manejo que permitan la producción de alimento con un uso sustentable de los recursos.
Palabras clave: Hongos micorrícicos arbusculares; Hongos septados oscuros; Herbicida promoción de Lotus tenuis.
ABSTRACT
In recent years, the Lotus tenuis promotion through glyphosate application has been adopted in Flooding Pampa grasslands, due to the important contribution in forage quantity and quality of this species. However, several studies have shown that the use of glyphosate can cause undesirable effects on beneficial soil microorganisms. The objective of this study was to evaluate the effect of glyphosate application on the arbuscular mycorrhizal fungi and dark septate endophytes associated to L. tenuis. Two treatments were applied in plots located in a L. tenuis pasture: promoted Lotus tenuis and established Lotus tenuis. In the first case, plots were sprayed in winter (late August) with 3.5 l/ha of glyphosate, while in the second treatment plots did not receive herbicide application. Our results demonstrated that the number of viable spores of arbuscular mycorrhizal fungi was 52% lower, and the percentage of arbuscules in L. tenuis plants was 40% lower in the Promoted Lotus tenuis treatment in relation to Established Lotus tenuis treatment. Root colonization by dark septate endophytes was not affected by glyphosate application. The loss of functionality of the mycorrhizal symbiosis might in the medium-term affect not only L. tenuis biomass production, but also the diversity and productivity of the complete plant community. The information generated in this study will be useful to redesign management practices that allow food production with a sustainable use of resources.
Keywords: Arbuscular mycorrhizal fungi; Dark septate endophytes; Herbicide; Lotus tenuis promotion.
INTRODUCCIÓN
La importancia de las especies del género Lotus como forrajeras radica en varios aspectos. Por un lado, poseen características nutricionales similares o superiores a las de alfalfa y trébol blanco (Escaray et al., 2012), lo que permite lograr una elevada respuesta animal (Acosta et al., 2012; Wen et al., 2002). Por otro lado, generan un impacto positivo en el sistema debido al aporte de nitrógeno derivado de la fijación biológica, pudiendo no solo aumentar la disponibilidad de N en el suelo, sino también facilitar el crecimiento de gramíneas que coexisten en el tapiz (Castro et al., 2009; Quinos et al., 1998). En el caso particular del L. tenuis, naturalizada en pastizales de La Pampa Deprimida, su importancia también radica en la tolerancia que posee a condiciones de anegamiento, sequía y ambientes salinossódicos (García y Mendoza, 2014; Teakle et al., 2010). La presencia de esta especie en el recurso garantiza forraje estival de calidad en ambientes donde otras leguminosas estivales no podrían prosperar.
Debido a las características mencionadas anteriormente, en los últimos años se está adoptando la práctica de promoción de L. tenuis a través de la aplicación de glifosato a fines de invierno (Bailleres y Sarena, 2011). Esta práctica reduce la competencia de otras especies vegetales en el momento de su implantación, permitiendo un aumento en la dominancia. Sin embargo, diversos estudios han demostrado que el uso de este herbicida puede afectar a microorganismos benéficos del suelo (Angelini et al., 2013; Druille et al., 2016; Reddy et al., 2001; Santos y Flores, 1995). Este grupo de microorganismos incluye hongos micorrícicos arbusculares (HMA) y hongos septados oscuros (HSO), quienes colonizan las raíces vegetales beneficiando a las plantas a través de distintas vías. Los HMA aumentan la disponibilidad de nutrientes poco móviles como el fósforo (P), mejoran las condiciones hídricas de las plantas, y otorgan protección contra patógenos (Smith y Read, 2008). Por su parte, los HSO benefician a las plantas a través de la síntesis de fitohormonas, aumentos en la mineralización de compuestos orgánicos y protección contra patógenos (Newsham, 2010). Considerando los ambientes marginales destinados a la producción de L. tenuis (suelos pobres en nutrientes, alternancia de excesos y déficits hídricos) tanto los HMA como los HSO cumplirían un rol fundamental en su crecimiento. El glifosato puede alterar a estos hongos a través de vías directas e indirectas (Druille et al., 2013). En el primer caso, las estructuras fúngicas presentes en el suelo (esporas e hifas externas) podrían verse afectadas al entrar en contacto con el herbicida, ya que la enzima EPSPS (inhibida por el glifosato) no solo se encuentra en las plantas, sino también en los hongos (Padgette et al., 1995). Debido a que las esporas e hifas externas son estructuras de propagación, una reducción de estas podría alterar la posterior colonización radical. La vía indirecta ocurriría si el menor flujo de carbohidratos hacia la raíz generado por el glifosato, perjudicara a los hongos que se encuentran colonizando la planta. Independientemente de las vías involucradas, una reducción en la funcionalidad de los HMA y HSO en el sistema podría conllevar a una disminución de la producción de L. tenuis, considerando su alta dependencia respecto a estos microorganismos(principalmente a los HMA) en ambientes marginales(Mendoza y Pagani, 1997; Wilson y Hartnett, 1998).
Existen evidencias de efectos negativos de la aplicación de glifosato sobre microorganismos benéficos del suelo, cuando es utilizado, por ejemplo, para promover Lolium multiflorum en pastizales de La Pampa Deprimida (Druille et al., 2015; Druille et al., 2016). Sin embargo, esta información no podría ser extrapolada a lo que ocurre durante las promociones de L. tenuis, debido a que el momento de la aplicación del herbicida en ambos casos es diferente (verano vs. invierno), impactando en distintos estadios del ciclo de vida de los microorganismos. Por lo tanto, es necesario estudiar el impacto particular de la promoción de L. tenuis sobre estos microorganismos si se desea realizar un uso sustentable del recurso forrajero. Hasta la actualidad, un solo estudio analizó el efecto de esta práctica de manejo sobre la comunidad bacteriana (Nieva et al., 2016), faltando información acerca del impacto sobre la comunidad fúngica del suelo. El objetivo de este trabajo fue evaluar el efecto de la aplicación de glifosato sobre los hongos micorrícicos arbusculares (HMA) y los hongos septados oscuros (HSO) asociados a Lotus tenuis.
MATERIALES Y MÉTODOS
Sitio de estudio y diseño experimental
El ensayo se realizó en el campo experimental de la Facultad de Agronomía de la Universidad de Buenos Aires (34º 37’ S, 58º 50’ W). El suelo fue clasificado como Argiudol típico, con 3,1% de MO, 3 ppm de P, pH de 5,5 y 0,3 dS/m de CE. La precipitación y la temperatura media anual son de 932 mm/año y 17,8 ºC, respectivamente. Sobre una pastura de L. tenuis implantada en abril de 2013 se establecieron dos tratamientos: Lotus tenuis promovido (LP) y Lotus tenuis establecido (LE). En el primer caso, la pastura se pulverizó con 3,5 l/ha de glifosato a fines de agosto de 2014. Las plántulas se restablecieron a partir de semillas presentes en el banco del suelo. En el tratamiento LE no se aplicó herbicida (control), y se realizó un corte de limpieza a 8 cm del suelo. Las unidades experimentales fueron parcelas de 1,05 m x 2 m de superficie, y se realizaron cuatro repeticiones por tratamiento. Sesenta días posaplicación del glifosato se recolectaron plantas de L. tenuis y su suelo asociado.
Mediciones realizadas
- Separación de esporas de HMA y estimación de viabilidad
Las esporas se extrajeron a partir de 50 g de submuestras de suelo secado al aire para cada muestra. Se utilizó la técnica de tamizado húmedo y decantación (Gerdemann y Nicolson, 1963) seguido por centrifugación en gradiente de sacarosa (Walker et al., 1982). Las esporas obtenidas se sumergieron en una solución de Bromuro de Tetrazolio (MTT) y se las incubó por 40 horas (An y Hendrix, 1988). La evaluación de viabilidad se realizó bajo microscopio estereoscópico contabilizando como viables aquellas esporas que presentaron tonalidades rosado-rojizas y como inviables a aquellas que permanecieron del color propio de la espora en la naturaleza o bien se tornaron negras durante la incubación en MTT.
- Colonización radical por HMA y HSO
Las raíces de L. tenuis se clarificaron en hidróxido de potasio (KOH) al 10% durante 15-20 minutos a 90 °C. Posteriormente se acidificaron en ácido clorhídrico (HCl) al 1% por 10 minutos a temperatura ambiente para luego ser teñidas con azul de tripano al 0,05% (Phillips y Hayman, 1970). Finalmente las raíces fueron lavadas y montadas en alcohol polivinílico para su observación con microscopio óptico (200x). Se determinó el porcentaje de colonización micorrícica total (hifas + vesículas + arbúsculos), la colonización por vesículas y la colonización por arbúsculos separadamente, y el porcentaje de hongos septados oscuros, de acuerdo a la metodología propuesta por Mc Gonigle et al.(1990).
Análisis estadístico
Se realizó un análisis de la varianza (ANOVA) para determinar el efecto del glifosato sobre el número total de esporas, porcentaje de viabilidad y número de esporas viables de HMA. Los atributos de la colonización (porcentaje de colonización radical total por HMA, porcentajes de arbúsculos y de vesículas y porcentaje de colonización por HSO) se analizaron mediante un análisis de la varianza multivariado (MANOVA) de tres vías. Cuando el MANOVA mostró resultados significativos, se utilizó el análisis univariado ANOVA para determinar cuál de las variables respuesta fueron las más afectadas por el tratamiento (Scheiner, 2001). Para los datos expresados en porcentaje se realizó una transformación angular (y = arcsen√x) antes de llevar a cabo cada análisis estadístico, con el objetivo de obtener varianzas homogéneas. El nivel de significancia se fijó en α = 0,05.
RESULTADOS
Número de esporas de hongos micorrícicos arbusculares (HMA)
La aplicación de glifosato no modificó el número de esporas totales de HMA (p = 0,9159); el promedio fue de 160 esporas/100 g de suelo seco (fig. 1A). Sin embargo, el porcentaje de viabilidad varió significativamente (p = 0,0093), es decir, un 50% menor en las esporas presentes en el tratamiento LP en relación con las esporas presentes en el tratamiento LE (fig. 1B). Como consecuencia, el número de esporas viables (que surge de la multiplicación de las dos variables anteriores) también se modificó entre tratamientos (p = 0,0346) (fig. 1C).
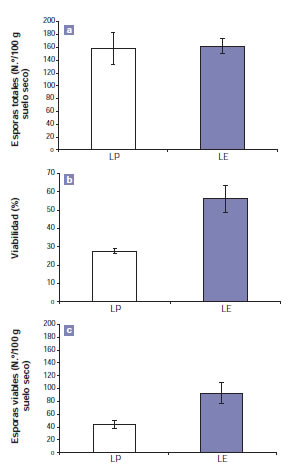
Figura 1. Número de esporas totales (A), porcentaje de viabilidad (B) y número de esporas viables (C) de HMA en el suelo asociado a Lotus tenuis promovido (LP) y Lotus tenuis establecido (LE). Las barras corresponden al error estándar. Los asteriscos indican diferencias significativas entre tratamientos.
Figura elaborada para la presente edición.
Colonización radical por HMA y HSO
La colonización radical total de HMA en plantas de L. tenuis no difirió significativamente entre tratamientos (p = 0,3246) (fig. 2). En relación con el porcentaje de arbúsculos, se detectó una reducción del 40% en el caso de plantas promovidas con el herbicida en relación con el porcentaje encontrado en plantas establecidas (p = 0,0394). Por último, el porcentaje de vesículas fue similar entre tratamientos (p = 0,5708). No se detectaron diferencias significativas en el porcentaje de raíz colonizada por HSO entre las plantas de L. tenuis establecidas y las promovidas a través de glifosato (p = 0,4633), es decir, un promedio de 48% (fig. 3).
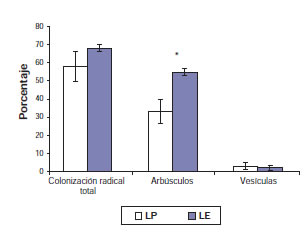
Figura 2. Porcentaje de colonización radical total, arbúsculos y vesículas de HMA en plantas de Lotus tenuis promovidas (LP) y Lotus tenuis establecidas (LE). Las barras corresponden al error estándar. Los asteriscos indican diferencias significativas entre tratamientos.
Figura elaborada para la presente edición.
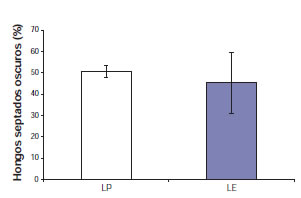
Figura 3. Porcentaje de colonización radical de HSO en plantas de Lotus tenuis promovidas (LP) y Lotus tenuis establecidas (LE). Las barras corresponden al error estándar.
Figura elaborada para la presente edición.
DISCUSIÓN
El número de esporas viables de HMA fue 52% menor en el tratamiento LP en relación con el tratamiento LE. El efecto del glifosato sobre la viabilidad de las esporas aparentemente no dependería del momento de la aplicación del herbicida dado que un efecto similar fue reportado con una aplicación al final del verano (Druille et al., 2015). Esto sugiere que la acción del glifosato mencionada anteriormente se ejerce en distintos estadios del ciclo de vida de estos microorganismos. La respuesta encontrada se debería al efecto directo del herbicida sobre las esporas presentes en el suelo. Esto último implicaría que si bien el glifosato se inactiva rápidamente debido a la degradación microbiana y adsorción a partículas edáficas (Giesy et al., 2000), el tiempo que permanece en la solución del suelo es suficiente como para generar efectos tóxicos en organismos no blanco. Es esperable que esta reducción en el número de esporas viables conlleve a una menor colonización radical teniendo en cuenta la importancia de estas estructuras como fuente de propágulo (Smith y Read, 2008).
Si bien la colonización radical total por HMA no varió entre tratamientos, el porcentaje de arbúsculos fue menor en el tratamiento LP. Esta respuesta coincide con lo reportado en trabajos previos realizados tanto en condiciones de invernáculo como a campo (Druille et al., 2016; Druille et al., 2013; Ronco et al., 2008). Los resultados obtenidos con este diseño experimental no permiten determinar las causas del efecto observado. Se requiere de estudios futuros para poder determinar si esta reducción se debe a un efecto directo o indirecto del herbicida y/o a la contribución de la diferencia de edades de las plantas entre tratamientos (plantas de 60 días en el tratamiento LP vs. plantas adultas en el tratamiento LE). Probablemente, esta reducción implica una pérdida en la funcionalidad de la simbiosis, considerando que los arbúsculos son las estructuras donde se realiza el intercambio de nutrientes entre la planta y el hongo (Smith y Gianinazzi-Pearson, 1988). Sin embargo, esta práctica de manejo no estaría comprometiendo el almacenamiento temporario de reservas de los HMA dado que el porcentaje de vesículas en raíces de L. tenuis no fue afectado por la aplicación de glifosato.
En nuestro estudio, el porcentaje de colonización radical por HSO en plantas de L. tenuis no mostró diferencias significativas entre tratamientos. Esta respuesta difiere de la encontrada por otros autores luego de aplicaciones reiteradas de glifosato para la promoción de Lolium multiflorum (Druille et al., 2016), lo cual indica que el efecto del glifosato sobre la colonización radical por HSO depende de múltiples factores. Entre ellos, podrían mencionarse la identidad de la planta hospedante, el momento de aplicación del herbicida y el número de aplicaciones de glifosato. La reiteración anual de esta práctica de manejo podría comprometer la producción y calidad futura del L. tenuis, considerando el importante rol de la simbiosis micorrícica en el establecimiento de plántulas y posterior crecimiento de las leguminosas (Van der Heijden, 2004; Wilson y Hartnett, 1997). Futuros estudios serán necesarios para entender los mecanismos involucrados, ya que las respuestas encontradas podrían deberse al principio activo del herbicida, a los productos de su degradación (ej. AMPA) o a cambios ocurridos en las propiedades biológicas y químicas del suelo. La información generada en este trabajo contribuye a la hora de rediseñar prácticas de manejo que permitan la producción de alimentos con un uso sustentable de los recursos.
AGRADECIMIENTOS
Este trabajo fue financiado por el Proyecto UBACyT, AG 101 Programación Científica 2014-2017. Los autores agradecen los valiosos aportes realizados por un revisor anónimo.
BIBLIOGRAFÍA
1. ACOSTA, A.; MIGUENS PIRAN, N.; ACOSTA, G.; ROSSI, J.L.; BAILLERES, M.; GOLLUSCIO, R.; SCHOR, A. (2012). Respuesta animal bajo pastoreo de Lotus tenuis con y sin suplementación de grano de maíz. Revista Argentina de Producción Animal, 32(1), 266. [ Links ]
2. AN, Z.Q.; HENDRIX, J.W. (1988). Determining viability of endogonaceous spores with a vital stain. Mycologia, 80(2), 259–261.
3. ANGELINI, J.; SILVINA, G.; TAURIAN, T.; IBÁÑEZ, F.; TONELLI, M.L.; VALETTI, L.; ANZUAY, M.S.; LUDUEÑA, L.; MUÑOZ, V.; FABRA, A. (2013). The effects of pesticides on bacterial nitrogen fixers in peanut-growing area. Archives of Microbiology, 195(10), 683–692.
4. BAILLERES, M.; SARENA, D. (2011). Promoción estival de Lotus tenuis. (Disponible: http://inta.gob.ar/documentos/puestaa-punto-de-tecnica-de-promocion-estival-con-lotus-tenuis-chacraexperimental-integrada-chascomus verificado: mayo de 2017). [ Links ]
5. CASTRO, R.E.; MOJICA, R.J.E.; PABÓN, J.L.M.; CARULLA, J.; CÁRDENAS, E. (2009). Nitrogen balance in grass and grass plus Lotus uliginosus pastures in the west region of the Bogotá savanna, Colombia. Revista Corpoica. Ciencia y Tecnología Agropecuarias, 10(1), 91–101.
6. DRUILLE, M.; CABELLO, M.N.; GARCÍA PARISI, P.A.; GOLLUSCIO, R.A.; OMACINI, M. (2015). Glyphosate vulnerability explains changes in root-symbionts propagules viability in pampean grasslands. Agriculture, Ecosystems & Environment, 202(0), 48–55.
7. DRUILLE, M.; GARCÍA-PARISI, P.A.; GOLLUSCIO, R.A.; CAVAGNARO, F.P.; OMACINI, M. (2016). Repeated annual glyphosate applications may impair beneficial soil microorganisms in temperate grassland. Agriculture, Ecosystems & Environment, 230, 184–190.
8. DRUILLE, M.; OMACINI, M.; GOLLUSCIO, R.A.; CABELLO, M.N. (2013). Arbuscular mycorrhizal fungi are directly and indirectly affected by glyphosate application. Applied Soil Ecology, 72, 143–149.
9. ESCARAY, F.J.; MENENDEZ, A.B.; GÁRRIZ, A.; PIECKENSTAIN, F.L.; ESTRELLA, M.J.; CASTAGNO, L.N.; CARRASCO, P.; SANJUÁN, J.; RUIZ, O.A. (2012). Ecological and agronomic importance of the plant genus Lotus. Its application in grassland sustainability and the amelioration of constrained and contaminated soils. Plant Science, 182, 121–133.
10. GARCÍA, I.; MENDOZA, R. (2014). Lotus tenuis seedlings subjected to drought or waterlogging in a saline sodic soil. Environmental and Experimental Botany, 98, 47–55.
11. GERDEMANN, J.W.; NICOLSON, T.H. (1963). Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Transactions of the British Mycological Society, 46(2), 235–244.
12. GIESY, J.P.; DOBSON, S.; SOLOMON, K.R. (2000). Ecotoxicological risk assessment for Roundup® herbicide. Reviews of Environmental Contamination and Toxicology, 167, 35–120.
13. MCGONIGLE, T.P.; MILLER, M.H.; EVANS, D.G.; FAIRCHILD, G.L.; SWAN, J.A. (1990). A New Method which Gives an Objective Measure of Colonization of Roots by Vesicular-Arbuscular Mycorrhizal Fungi. New Phytologist, 115(3), 495–501.
14. MENDOZA, R.E.; PAGANI, E.A. (1997). Influence of phosphorus nutrition on mycorrhizal growth response and morphology of mycorrhizae in Lotus tenuis. Journal of Plant Nutrition, 20(6), 625–639.
15. NEWSHAM, K.K. (2010). A meta-analysis of plant responses to dark septate root endophytes. New Phytologist, 190(3), 783–793.
16. NIEVA, A.S.; BAILLERES, M.A.; CORRIALE, M.J.; LLAMES, M.E.; MENÉNDEZ, A. B.; RUIZ, O.A. (2016). Herbicide-mediated promotion of Lotus tenuis (Waldst. & Kit. ex Wild.) did not influence soil bacterial communities, in soils of the Flooding Pampa, Argentina. Applied Soil Ecology, 98, 83–91.
17. PADGETTE, S.R.; KOLACZ, K.H.; DELANNAY, X.; RE, D.B.; LAVALLEE, B.J.; TINIUS, C.N.; RHODES, W.K. (1995). Development, identification, and characterization of a glyphosate-tolerant soybean line. Crop Cience, 35, 1451–1461.
18. PHILLIPS, J.M.; HAYMAN, D.S. (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 55, 158–161.
19. QUINOS, P.M.; INSAUSTI, P.; SORIANO, A. (1998). Facilitative effect of Lotus tenuis on Paspalum dilatatum in a lowland grassland of Argentina. Oecologia, 114(3), 427–431.
20. REDDY, K.N.; HOAGLAND, R.E.; ZABLOTOWICZ, R.M. (2001). Effect of Glyphosate on Growth, Chlorophyll, and Nodulation in Glyphosate-Resistant and Susceptible Soybean (Glycine max) Varieties. Journal of New Seeds, 2(3), 37–52.
21. RONCO, M.G.; RUSCITTI, M.F.; ARANGO, M.C.; BELTRANO, J. (2008). Glyphosate and mycorrhization induce changes in plant growth and in root morphology and architecture in pepper plants (Capsicum annuum L.). Journal of Horticultural Science & Biotechnology, 83, 497–505.
22. SANTOS, A.; FLORES, M. (1995). Effects of glyphosate on nitrogen fixation of free-living heterotrophic bacteria. Letters in Applied Microbiology, 20(6), 349–352.
23. SCHEINER, S. (2001). MANOVA: multiple response variables and multispecies interactions. En SCHEINER, S.M; GUREVITCH, J. (Ed.). MANOVA: multiple response variables and multispecies interactions. Oxford University Press. Nueva York. pp. 99–115.
24. SMITH, S.E.; GIANINAZZI-PEARSON, V. (1988). Physiological Interactions Between Symbionts in Vesicular-Arbuscular Mycorrhizal Plants. Annual Review of Plant Physiology and Plant Molecular Biology, 39(1), 221–244.
25. SMITH, S.E.; READ, D.J. (2008). Mycorrhizal Symbiosis, 3rd edition. Academic Press. Londres. [ Links ]
26. TEAKLE, N.L.; AMTMANN, A.; REAL, D.; COLMER, T.D. (2010). Lotus tenuis tolerates combined salinity and waterlogging: maintaining O2 transport to roots and expression of an NHX1-like gene contribute to regulation of Na+ transport. Physiologia Plantarum, 139(4), 358–374.
27. VAN DER HEIJDEN, M.G.A. (2004). Arbuscular mycorrhizal fungi as support systems for seedling establishment in grassland. Ecology Letters, 7(4), 293–303.
28. WALKER, C.; MIZE, C.W.; MCNABB JR, H.S. (1982). Populations of endogonaceous fungi at two locations in central Iowa. Canadian Journal of Botany, 60(12), 2518–2529.
29. WEN, L.; KALLENBACH, R.L.; WILLIAMS, J.E.; ROBERTS, C.A.; BEUSELINCK, P.R.; MCGRAW, R.L.; BENEDICT, H.R. (2002). Performance of steers grazing rhizomatous and nonrhizomatous birdsfoot trefoil in pure stands and in tall fescue mixtures. Journal of Animal Science, 80, 1970–1976.
30. WILSON, G.; HARTNETT, D. (1997). Effects of mycorrhizae on plant growth and dynamics in experimental tall grass prairie microcosms. American Journal of Botany, 84(4), 478. [ Links ]
31. WILSON, G.W.T.; HARTNETT, D.C. (1998). Interspecific variation in plant responses to mycorrhizal colonization in tallgrass prairie. American Journal of Botany, 85(12), 1732–1738.














