Introducción
La fijación del nitrógeno funciona en bacterias adaptadas a ambientes ecológicos y estilos de vida muy diversos. Sin embargo, todas poseen el sistema enzimático responsable de la reducción del nitrógeno, para lo cual requieren un nicho específico dentro de las células de órganos llamados nódulos 28.
Dichos nódulos son formados por las raíces de las leguminosas, como resultado de la penetración de rizobacterias donde se lleva a cabo la fijación de nitrógeno 17, sin descartar que existen otros lugares como el tallo de las plantas 28) donde este proceso se puede llevar a cabo.
Para la formación de nódulos es necesaria la síntesis y liberación de moléculas pequeñas por parte de las bacterias, las cuales son detectadas por la planta, provocándose la nodulación 13. Estas moléculas son denominadas factores Nod, que al ser detectados por las leguminosas inducen grandes cambios en el desarrollo de la planta, necesarios para la entrada de los rizobios en el hospedero (5.
Aproximadamente el 90% de las especies de plantas leguminosas pueden llegar a formar nódulos, aunque existe una especificidad marcada entre las especies de leguminosas y las cepas de Rhizobium17. Cada cepa de estas bacterias puede, por lo general, infectar a ciertas especies de leguminosas y no a otras.
Se denomina inoculación cruzada a todo el grupo de cepas de Rhizobium que pueden infectar a un grupo de especies próximas de leguminosas. Igualmente, las cepas efectivas forman nódulos mayores, rojizos y fijadores de nitrógeno que contienen un pigmento denominado “hemoglobina de los nódulos” la cual interviene en la fijación de nitrógeno 25.
La excreción de factores de crecimiento por parte de las raíces de las leguminosas permite el crecimiento de los nódulos10, de tal manera que las bacterias invaden los pelos radicales que presentan ruptura hasta llegar a la endodermis y al periciclo, a partir de lo cual se producen divisiones celulares y el nódulo crece rápidamente, aumentando el volumen en dirección a la superficie de la raíz.
Cuando las bacterias colonizan la superficie de la raíz, inducen a la formación de una curvatura de la raíz en las vellosidades de las puntas o rizado. Las bacterias quedan atrapadas dentro de la bolsa del rizo en donde la pared celular vegetal se degrada localmente, la membrana celular se invagina y el nuevo material deposita do es una mezcla de planta y bacterias13.
Además, en la superficie de la raíz se degradan las paredes celulares de la planta, permitiendo que los rizobios atrapados en los pelos de la misma, se desarrollen como una infección que crece dentro de las vellosidades de la raíz 1.
Las células corticales de la raíz son inducidas a un proceso de diferenciación que se observa por la ampliación de las células y en el sitio de infección o hilo, los rizobios se multiplican, pero permanecen confinados por la pared celular vegetal 12, lo cual se observa como un nuevo nódulo.
El número de nódulos en las leguminosas depende de varios factores, como la temperatura, la exposición a la luz, la presencia de nitrógeno y los niveles de CO2, determinando el almacenamiento de carbohidratos en la planta, favoreciendo la producción de nódulos 2.
La planta es la que controla principalmente el número de nódulos, mediante un mecanismo de autorregulación, el cual también es controlado por factores externos como la presencia de nitratos en el suelo.
Igualmente, la cantidad de nódulos depende de la fertilidad del suelo, es decir, de los nutrimentos minerales (P, K, Mg, Ca) presentes en él, todo ello relacionado con la eficiencia de la fijación de nitrógeno.
Por otra parte, diversos factores afectan la simbiosis, frenando la aparición de nódulos. Por ello, el número de nódulos depende de la familia o cepa de Rizobios y de las características genéticas de la planta. Sin embargo, cuando hay una necrosis en los tejitos de la planta, se reduce el proceso de nodulación y la efectividad de los microorganismos en la fijación de nitrógeno, reduciéndose el número de nódulos.
Por lo anterior, el objetivo del presente artículo es reconocer el potencial de nodulación de diferentes especies de leguminosas asociadas a pasturas de Brachiaria sp en el Centro de Investigaciones Macagual de la Universidad de la Amazonia (Colombia), que puede verse reflejado en el número de nódulos producidos por especie, para generar información que permita una selección adecuada de especies para la alimentación de bovinos en pastoreo, las cuales dinamizan el ciclo del nitrógeno y contribuyen al aumento en los niveles de producción animal.
Material y métodos
Debido a que el número de nódulos se relaciona con la inoculación de Rhizobium en las especies de leguminosas, se llevaron a cabo diferentes actividades que permitieron reconocer aspectos inherentes a la presencia de leguminosas en diferentes áreas de pastura, reconociendo su potencial de nodulación dados sus efectos sobre el crecimiento de la planta y la producción animal.
Identificación de especies de leguminosas presentes en pasturas
El estudio se realizó en el Centro de Investigaciones Macagual de la Universidad de la Amazonia, donde se llevó a cabo un muestreo de la cobertura de forma sistemática en 23 lugares; realizando lanzamientos en zig zag de un marco de 1 m2el cual permite cubrir tanto especies estoloníferas o rastreras y erectas11, debido a que las pasturas en el departamento de Caquetá presentan alta heterogeneidad a causa de la interacción con fragmentos de bosque, por lo cual este tamaño es necesario ya que se recomienda para pasturas no homogéneas y en áreas que presentan suelo descubierto 18.
En cada una de las 22 pasturas se llevaron a cabo 50 lanzamientos del marco19 en forma de zigzag sistemáticamente 9, a fin de cubrir la mayor cantidad de área debido a la misma heterogeneidad de la pastura con el fin de poder ubicar los sitios donde se encontraban las leguminosas dispersas en cada uno de los potreros 26) y lograr una estimación acertada del porcentaje de cobertura de las especies, lo cual puede estar relacionado con la cantidad de nitrógeno en el suelo 29, tallo de las plantas 28) donde este proceso se puede llevar a cabo.
Para la formación de nódulos es necesaria la síntesis y liberación de moléculas pequeñas por parte de las bacterias, las cuales son detectadas por la planta, provocándose la nodulación13. Estas moléculas son denominadas factores Nod, que al ser detectados por las leguminosas inducen grandes cambios en el desarrollo de la planta, necesarios para la entrada de los rizobios en el hospedero 5.
Aproximadamente el 90% de las especies de plantas leguminosas pueden llegar a formar nódulos, aunque existe una especificidad marcada entre las especies de leguminosas y las cepas de Rhizobium17. Cada cepa de estas bacterias puede, por lo general, infectar a ciertas especies de leguminosas y no a otras.
Se denomina inoculación cruzada a todo el grupo de cepas de Rhizobium que pueden infectar a un grupo de especies próximas de leguminosas. Igualmente, las cepas efectivas forman nódulos mayores, rojizos y fijadores de nitrógeno que contienen un pigmento denominado “hemoglobina de los nódulos” la cual interviene en la fijación de nitrógeno 25.
La excreción de factores de crecimiento por parte de las raíces de las leguminosas permite el crecimiento de los nódulos10, de tal manera que las bacterias invaden los pelos radicales que presentan ruptura hasta llegar a la endodermis y al periciclo, a partir de lo cual se producen divisiones celulares y el nódulo crece rápidamente, aumentando el volumen en dirección a la superficie de la raíz.
Cuando las bacterias colonizan la superficie de la raíz, inducen a la formación de una curvatura de la raíz en las vellosidades de las puntas o rizado. Las bacterias quedan atrapadas dentro de la bolsa del rizo en donde la pared celular vegetal se degrada localmente, la membrana celular se invagina y el nuevo material depositado es una mezcla de planta y bacterias13.
Además, en la superficie de la raíz se degradan las paredes celulares de la planta, permitiendo que los rizobios atrapados en los pelos de la misma, se desarrollen como una infección que crece dentro de las vellosidades de la raíz 1.
Las células corticales de la raíz son inducidas a un proceso de diferenciación que se observa por la ampliación de las células y en el sitio de infección o hilo, los rizobios se multiplican, pero permanecen confinados por la pared celular vegetal (12, lo cual se observa como un nuevo nódulo.
El número de nódulos en las leguminosas depende de varios factores, como la temperatura, la exposición a la luz, la presencia de nitrógeno y los niveles de CO2, determinando el almacenamiento de carbohidratos en la planta, favoreciendo la producción de nódulos 2.
La planta es la que controla principalmente el número de nódulos, mediante un mecanismo de autorregulación, el cual también es controlado por factores externos como la presencia de nitratos en el suelo.
Igualmente, la cantidad de nódulos depende de la fertilidad del suelo, es decir, de los nutrimentos minerales (P, K, Mg, Ca) presentes en él, todo ello relacionado con la eficiencia de la fijación de nitrógeno.
Por otra parte, diversos factores afectan la simbiosis, frenando la aparición de nódulos. Por ello, el número de nódulos depende de la familia o cepa de Rizobios y de las características genéticas de la planta. Sin embargo, cuando hay una necrosis en los tejitos de la planta, se reduce el proceso de nodulación y la efectividad de los microorganismos en la fijación de nitrógeno, reduciéndose el número de nódulos.
Por lo anterior, el objetivo del presente artículo es reconocer el potencial de nodulación de diferentes especies de leguminosas asociadas a pasturas de Brachiaria sp en el Centro de Investigaciones Macagual de la Universidad de la Amazonia (Colombia), que puede verse reflejado en el número de nódulos producidos por especie, para generar información que permita una selección adecuada de especies para la alimentación de bovinos en pastoreo, las cuales dinamizan el ciclo del nitrógeno y contribuyen al aumento en los niveles de producción animal.
Muestreo de raíces
En cada uno de los sitios donde se halló el marco de 1 m2 se evaluó la densidad de especies de leguminosas al interior del perímetro (Universidad Nacional de Córdoba, 2015). Posteriormente se llevó a cabo la metodología de recuperación de nódulos en campo planteada por otros investigadores 6, a través de la cual se separan las especies de leguminosas marcando un radio de aproximadamente 15 cm alrededor de la planta con una pala y cortando esta sección a una profundidad aproximada de 20 cm.
Siguiendo el método propuesto por otros investigadores 24, se usó una pala para levantar lentamente el conjunto de raíces de la planta, retirando cuidadosamente el material de la raíz con las manos, teniendo la precaución de no separar raíces secundarias de la planta, ya que se pueden encontrar nódulos en ellas que pueden ser aislados en el laboratorio tal y como lo mencionan otros investigadores15.
Las raíces fueron introducidas en bolsas de cierre hermético 4, debidamente rotuladas e identificadas, para ser almacenadas en un termo de poliestireno, con el fin de mantener sus condiciones físicas22 para el trabajo de laboratorio.
Extracción y recuento de nódulos
Para obtener la mayor cantidad de nódulos procedentes de las raíces de leguminosas muestreadas en el campo, se utilizó la metodología planteada por Prévost & Antoun 21, a través de la cual se utiliza una malla que se coloca debajo de cada muestra de raíz para atrapar los nódulos que puedan desprenderse de la raíz, se lavan cuidadosamente las raíces con un chorro suave de agua de grifo y posteriormente se separan para el secado sobre papel de filtro.
Posteriormente, se llevó a cabo un recuento de nódulos procedentes de cada una de las raíces de las plantas obtenidas en campo, a fin de obtener el número por especie y por pastura.
Resultados y Discusión
Especies de leguminosas asociadas a pasturas de Brachiaria
De las 23 pasturas muestreadas cuya área total correspondió a 149,14 ha, se encontró que solo el 56,5% de ellas contaban con presencia de leguminosas, correspondiente a las especies Desmodium sp, Pueraria phaseoloides, Galactia striata, Arachis pintoi, Estilosantes sp., Mimosapúdica y Centrosema sp. Las demás pasturas evaluadas no se incluyeron en el análisis ya que no presentaron leguminosas como ya se mencionó.
Tal y como se evidencia en la gráfica anterior, la distribución de las leguminosas sobre el total de la cobertura vegetal presente en las 13 pasturas donde fueron halladas (84,62 ha) es incipiente, ya que en ningún caso superó el 10% del área de cada pastura, obteniéndose un promedio general de cobertura de leguminosas de 2,89% lo cual es bajo, frente al total de las áreas de pastura (2,44 ha ocupadas por leguminosas).
Sin embargo, estas especies generan efectos positivos en los sistemas donde interactúan mejorando los niveles de nitrógeno en el suelo, con tendencia hacia el aumento de carbono en el suelo y la PPN (productividad primaria neta) como respuesta a la mejoría en la fertilidad del suelo 32 y al incremento en la capacidad fotosintética de las plantas por aumentos en los niveles de nitrógeno en su biomasa31, previniendo el proceso de degradación de las pasturas.
La especie con mayor porcentaje de cobertura promedio fue Arachis pintoi con 5,36% seguida de Stylosanthes sp. con 5%, Galactia striata con 3,89% y Pueraria phaseoloides con 2,62%. El resto se encontraron en un rango que no superó el 2% del área de la pastura.
Lo anterior, se relaciona con un bajo porte observado en las pasturas evaluadas, principalmente en aquellas con ausencia de leguminosas, ya que el crecimiento de la biomasa se estimula a través de la fijación de nitrógeno atmosférico ejercido por las leguminosas 25.

Figura 1 Porcentaje de cobertura de leguminosas identificadas en pasturas de Brachiaria sp. Izquierda: distribución de cobertura de las leguminosas identificadas sobre el 100% de las pasturas evaluadas. Derecha: cobertura de leguminosas identificadas superpuestas en el 10% del área de pasturas.

Figura 2 Distribución de la cantidad de nódulos presentes en las especies de leguminosas identificadas en las diferentes pasturas.
Tal y como sucede en la mayoría de pasturas tropicales, en la zona evaluada no se aplican abonos industriales debido a los altos costos que requiere la fertilización de grandes extensiones destinadas a pastoreo y por el rechazo que genera actualmente este tipo de productos frente a la relación estrecha que posee con las emisiones de GEI8) y NH330
Número de nódulos encontrados en las especies de leguminosas
Como resultado del conteo de nódulos de todas las especies leguminosas muestreadas, se encontró una cantidad mínima de 7 nódulos en raíces de un individuo de Centrosema sp. y en dos de Galactia striata ubicadas en diferentes áreas de pastura y un número máximo de 194 nódulos encontrados en raíces de plantas de un solo individuo de Desmodium sp como datos atípicos.
En la Figura 2 se puede observar que el número de nódulos en las diferentes especies de leguminosa presentó una media de 33 y una mediana de 22. Algunos indican que independientemente de la especie de leguminosa, un número aproximado de 15 nódulos en sus raíces20 refleja una función apropiada de las bacterias fijadoras de nitrógeno, con ajustes en la fisiología y el metabolismo de las plantas, en respuesta a una progresión simbiótica 13 evidenciada en la presencia de nódulos. Esto indica que la actividad fijadora de nitrógeno es mayor en las pasturas donde se encuentran leguminosas con alto número de nódulos.
Los casos con cantidad superior a 100 nódulos/ planta se encontraron en la especie Desmodium sp en dos individuos que presentaron 179 y 174 nódulos/ planta, ubicados en dos pasturas diferentes, valores que reflejan una inoculación satisfactoria y una condición de simbiosis eficiente; sin embargo es necesaria una mayor investigación para afirmar si esta situación representa equivalencia con una alta tasa de fijación de nitrógeno 20.
Según la Tabla 1, Desmodium sp fue la leguminosa que presentó mayor cantidad promedio de nódulos en sus raíces, lo cual coincide con previas investigaciones 7 halladas en el 39,1% de las pasturas evaluadas, seguida por Stylosanthes sp cuya frecuencia fue menor, encontrándose en el 8,6% de las pasturas.
Este resultado es superior al obtenido por otros investigadores23 que reportan un promedio de 8 nóludos por individuo en condiciones de sabana tropical brasileña, pero es inferior a los hallados por otros, quienes encontraron aproximadamente 54 nódulos por cada planta14. Sin embargo, a diferencia de estos dos estudios, el ejercicio llevado a cabo en las pasturas del Centro de Investigaciones Macagual no fueron estimuladas con productos químicos ni biológicos; es decir, que la nodulación ocurrió de forma natural en la pastura.
Cabe resaltar que, pese a la baja frecuencia ya mencionada dentro del estudio, esta especie presentó una alta abundancia en las pasturas donde se encontró.
Por otra parte, los individuos de Galactia striata ostentaron la mayor frecuencia en las pasturas evaluadas, pero la cantidad promedio de nódulos no presentó la misma característica; aun así, al igual que en los resultados obtenidos con Stylosanthes sp el número de nódulos refleja una adecuada fijación de nutrientes si se compara con otros casos donde se aplicaron soluciones nutritivas16) y ha sido indudable una cantidad de nódulos superior.
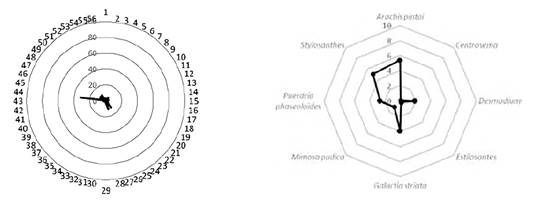
Tabla 1 Promedio de nódulos presentes en las especies de leguminosas halladas en cada una de las pasturas evaluadas.
Finalmente, la especie con menor cantidad de nódulos correspondió a Mimosa púdica, hallada solamente en el 4,3% de las pasturas evaluadas en la investigación, contrariamente a lo reportado por quien obtuvo una mayor cantidad de los mismos en sus raíces 27. Al igual que en casos anteriores, los valores superiores a la cantidad de nódulos encontrados en la investigación desarrollada corresponden al uso de estimulantes químicos o microbiológicos, aspecto que permite indicar que estos individuos introducidos en las pasturas presentan una relación directa entre el número de nódulos y su potencial de fijación de nitrógeno.
Cabe reiterar, tal y como se evidencia en la Tabla 1, que solo 13 de las 23 pasturas muestreadas presentaron leguminosas en su cobertura. Esta situación, a razón de que no todas presentan la asociación gramínea-leguminosa, considera que en la Amazonia colombiana se ha efectuado la conversión de bosque primario en pastizales para pastoreo, creados a partir de procesos de deforestación bajo la premisa de monocultivos de gramíneas, definidos como no apropiados, no viables e insostenibles 3.
Sin embargo, en los últimos años, algunos productores optaron por la asociación de gramíneas y leguminosas a fin de mejorar sus indicadores productivos y mitigar el proceso de degradación, razón por la cual pueden hallarse pasturas con características similares a las identificadas durante el muestreo.














