Introducción
Los rumiantes obtienen de los forrajes la energía necesaria para su metabolismo por fermentación microbiana de los tejidos vegetales 1. Elevadas ganancias diarias de peso vivo requieren de un gran consumo de forrajes y alta digestibilidad de las paredes celulares.
La organización estructural de los tejidos que integran los órganos de las plantas influyen sobre el consumo a través de su efecto sobre la tasa de pasaje por el rumen, del tamaño y naturaleza de la partícula producida, y además afecta la digestibilidad de la materia seca por medio de las características de la pared celular, las que determinan la disponibilidad de sus polisacáridos para los microorganismos del rumen 3,23.
Todos los forrajes están compuestos de un conjunto heterogéneo de tipos celulares, cada uno de los cuales tiene una pared celular con características únicas 6. En las hojas, las células están organizadas en tejidos especializados que definen tres sistemas: el dérmico, que comprende a la epidermis, una envoltura protectora externa que recubre el cuerpo de la planta; el vascular, compuesto por el xilema como conductor de agua y el floema como conductor de savia; y el fundamental, que incluye los tejidos básicos de la planta con distintos grados de especialización como es el caso del clorénquima y el esclerénquima 10) .
Este último, junto al xilema son los principales tejidos de sostén, con paredes gruesas y lignificadas 6) . La disminución de la digestibilidad en los forrajes está asociada al incremento de pared celular y a la lignificación de los tejidos a medida que maduran (16, 29) . Las paredes celulares muy delgadas (0,1 a 0,2 um), primarias y no lignificadas del clorénquima y floema, no constituyen un problema para su digestión 25) .
El xilema y el esclerénquima, tienen paredes celulares secundarias (de 1 a 3 um de espesor), lignificadas, y representan un obstáculo para su degradación en el rumen 24 . La proporción de los tejidos foliares, el espesor de las paredes celulares y el grado de lignificación pueden ser modificados por factores ambientales y el manejo agronómico.
Se ha observado que el adelanto de las fechas de siembras 14 , la fertilización nitrogenada y el adecuado suministro de agua 5 , tienen una relación positiva con la cantidad de tejidos no lignificados y la digestibilidad de los forrajes.
Los tejidos de baja digestibilidad se correlacionan negativamente con los tenores de proteína bruta y diestibilidad, positivamente con tenores de fibra y lignina 7 . Los porcentajes de tejidos foliares lentamente o no digestibles proporcionan una buena estimación del valor nutritivo de las especies forrajeras 9 .
Así, a partir de la década del 60 comienzan a realizarse estudios de evaluación de calidad forrajera basados en la estimación de la resistencia de los tejidos foliares a la acción de la microbiota ruminal 2 , ya que la determinación de los porcentajes de tejidos es una herramienta útil del mejoramiento genético al permitir una rápida selección de especies 9.
Las plantas en general, y en especial las gramíneas, presentan una importante tendencia a disminuir la digestibilidad de la materia seca producida en la medida en que avanzan en el estado de madurez, debido a alteraciones en la anatomía y en la composición de los tejidos 17 . Esas variaciones en la estructura anatómica podrían explicar los cambios observados en la digestibilidad a lo largo del ciclo de desarrollo de la planta y entre diferentes componentes de la misma 18 .
Cuantificar la proporción en que cada tejido se encuentra presente en las diferentes partes de la planta podría ser una alternativa para estimar la variación observada en la digestibilidad de la materia seca 21 . Sin embargo, la degradación varía entre especies, cultivares y/o entre las fracciones hoja y tallo, aún dentro de una misma fracción, según demostraron en varias especies C3 y C4 (20, 10) .
Estas diferencias se deben, en parte, a características anatómicas tal como el área ocupada por cada tejido en órganos de la planta (8,22). La cantidad de tejidos lignificados en láminas y tallos reducen la digestibilidad de las especies 19 .
El objetivo del presente trabajo fue evaluar la degradación de tejidos foliares de Paspalum notatum Flüggé, pasto horqueta, a diferentes tiempos de incubación ruminal en bovinos, en distintas épocas del año. Paspalum notatum es una gramínea perenne, de ciclo estivo-otoñal y un importante recurso de los campos naturales del Centro y Noreste Argentino, Sur de Brasil y Paraguay 13 .
Material y métodos
El material vegetal evaluado fue recolectado en un campo del nordeste argentino (latitud sur 27º 10’; longitud oeste 58º 57’). Las muestras de pasto horqueta (Paspalum notatum), se tomaron por medio de cortes con tijeras a 5 cm de altura de todo el material disponible en condición de pastoreo, dentro de un marco de 50 cm x 50 cm.
El método utilizado fue el de exclusión del pastoreo por medio de alambrado perimetral, con cortes a los 15, 30 y 45 días del corte de limpieza, en cada una de las estaciones del año. Las muestras de pastos, se colocaron en bolsas de papel limpias y puestas a secar en estufa de aire forzado a 60ºC durante 48 a 72 horas, luego fueron sometidas a procesamientos con una licuadora para obtener fracciones de 1,5 a 2,5 cm de longitud a efectos de simular la masticación.
Luego 5 g de material seco de las distintas muestras del pasto, se colocaron en bolsas de dacrón que fueron introducidas en el rumen en forma secuencial (120; 72; 48; 24; 12; 6; 3 y 0 horas), y retiradas al mismo tiempo.
De las muestras sometidas a degradación ruminal, y que fueron lavadas con agua fría hasta que el líquido efluente salió incoloro, se tomó una alícuota que se colocó en solución de formol aceto-alcohólica (FAA), para inhibir totalmente la actividad microbiana sobre el material y así conservar intacta su estructura.
De este residuo, se tomaron muestras para ser preparadas y observadas con microscopio electrónico de barrido (MEB). Del material fijado se realizaron cortes transversales de la lámina foliar de aproximadamente 1 mm de espesor. Los cortes obtenidos fueron deshidratados en una serie creciente de acetona para el secado a punto crítico.
Una vez seco el material se montó sobre una lámina de aluminio y posteriormente fueron recubiertas con una película de oro utilizando un metalizador marca Denton, en atmósfera de argón, observadas y obtenidas las microfotografías con microscopio electrónico de barrido marca JEOL LV-5800.
Sobre éstas se determinó el grado de degradación de los tejidos según el estado de las paredes celulares. Se establecieron cuatro categorías de acuerdo a trabajos previos (11, 12): D: altamente digerido, el tejido está ausente; DA: digestión avanzada, se observan restos de paredes sin digerir; PD: parcialmente digerido, las paredes muestran escasa digestión; ND: no digerido, las paredes no presentan signos de digestión y están intactas.
Resultados y discusión
En la época otoñal, las láminas foliares con 3 y 6 h de incubación ruminal no presentaron digestión apreciable de los tejidos vegetales, tanto de los fácilmente digestibles como el clorénquima (mesófilo) y floema, como de los pobres o lentamente digestibles: xilema, esclerénquima, vaina parenquimática y epidermis.
Luego de 12 h de incubación ruminal (Tabla 1), de las muestras que fueron cortadas a 15 días de crecimiento, la desaparición del mesófilo fue avanzado pero no se completó, y el floema comenzó a ser digerido en algunos haces. La vaina parenquimática de los haces vasculares permaneció intacta o apenas digerida en los haces mayores, mientras que en los haces menores su desaparición fue más importante.
La epidermis adaxial apareció intacta y en las zonas en que estaba ausente se debió a su desprendimiento, mientras que la epidermis abaxial presentó algún grado de digestión quedando en algunas células sólo sus paredes tangenciales externas y otras sin degradar. Al cabo

Tabla 1: Grado de digestión de los tejidos foliares de P. notatum según el tiempo de permanencia en el rumen (12, 24 y 48 horas), a diferentes edades de rebrote en otoño. Referencias: ND: no digerido, no hay pérdida de tejido con respecto a una hoja sin digerir. PD: parcialmente digerido, remoción parcial de ciertas regiones. DA: digestión avanzada, remoción significativa y general pero sin pérdida total. D: totalmente digerido, pérdida total.
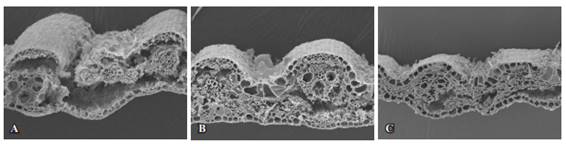
Figura 1: Fotomicrografías con MEB de cortes transversales de láminas foliares de P. notatum sometidas a digestión ruminal durante 48 h. Para cortes de 15 días (A), 30 días (B) y 45 días (C) en otoño. Aumentos 300x.
de 24 h los únicos tejidos que permanecieron sin digerir fueron el xilema, esclerénquima y la vaina del haz.
Despúes de 48 h de incubación, algunas células de la vaina parenquimática permanecieron sin degradar, en la zona adyacente a los casquetes de esclerénquima que se desprendieron. En algunas regiones estaban ausentes las paredes tangenciales internas de la epidermis abaxial. Solamente permanecieron los tejidos xilemáticos rodeados por algunas células de la vaina y casquete de esclerénquima abaxial (Figura 1A).
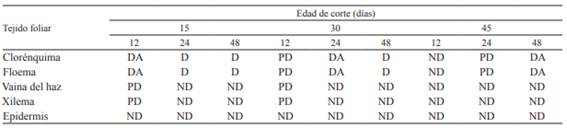
Tabla 2: Grado de digestión de los tejidos foliares de P. notatum según el tiempo de permanencia en el rumen (12, 24 y 48 horas), a diferentes edades de rebrote en invierno.
Referencias: ND: no digerido, no hay pérdida de tejido con respecto a una hoja sin digerir. PD: parcialmente digerido, remoción parcial de ciertas regiones. DA: digestión avanzada, remoción significativa y general pero sin pérdida total. D: totalmente digerido, pérdida total.
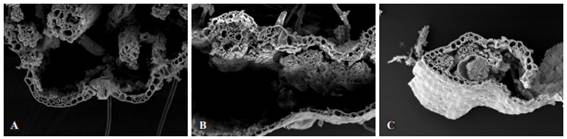
Figura 2: Fotomicrografías con MEB de cortes transversales de láminas foliares de P. notatum sometidas a digestión ruminal durante 48 h. Para cortes de 15 días (A), 30 días (B) y 45 días (C) en invierno. Aumentos 300x.
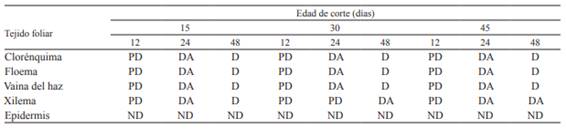
Tabla 3: Grado de digestión de los tejidos foliares de P. notatum según el tiempo de permanencia en rumen (12, 24 y 48 horas), a diferentes edades de rebrote en primavera. Referencias: ND: no digerido, no hay pérdida de tejido con respecto a una hoja sin digerir. PD: parcialmente digerido, remoción parcial de ciertas regiones. DA: digestión avanzada, remoción significativa y general pero sin pérdida total. D: totalmente digerido, pérdida total.
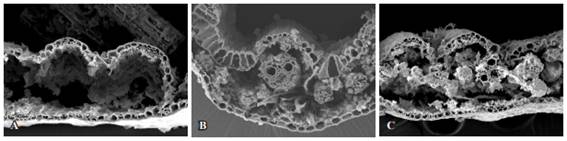
Figura 3: Fotomicrografías con MEB de cortes transversales de láminas foliares de P. notatum sometidas a digestión ruminal durante 48 h. Para cortes de 15 días (A), 30 días (B) y 45 días (C) en primavera. Aumentos 600x.
Para el corte de 30 días de rebrote, y a las 48 h de incubación, las paredes celulares del mesófilo y del floema fueron degradadas totalmente, y a las 24 h mostraron una degradación avanzada (Figura 1B).
Para el corte de 45 días (Figura 1C), en cambio solo mostró una digestión completa el clorénquima, el floema que a las 12 h de incubación se mostró indigestible, a las 48 h tuvo una degradación avanzada. Xilema y epidermis en estas dos edades de rebrote no sufrieron ataque microbiano por lo que se presentaron sin modificación en todos los horarios de incubación.
En invierno, en las láminas foliares con 3 y 6 h de incubación ruminal no se observó digestión apreciable de los tejidos vegetales, tanto de los fácilmente digestibles (clorénquima y floema), como de los pobres o lentamente digestibles (xilema, esclérenquima, vaina del haz y epidermis), para las distintas edades de corte. A las 24 horas solo permanecieron los tejidos xilemáticos (Tabla 2), rodeados por su vaina y el casquete de esclerénquima abaxial, dichas unidades de tejido se mantuvieron unidas únicamente por las paredes tangenciales internas de la epidermis abaxial.
Al cabo de 48 horas de incubación ruminal (Figura 2), los únicos tejidos que permanecieron indigeridos fueron xilema, esclerénquima y vaina del haz. Tampoco se observaron grandes diferencias respecto del estado de las láminas a las 24 h, excepto que los haces aparecieron solitarios, con presencia de uno solo de los casquetes esclerenquimáticos y las paredes exteriores de unas pocas células epidérmicas relacionadas a éstos. En esta especie estudiada, el mesófilo y el floema fueron digeridos en un 100% después de las 24 horas para l corte de 15 días y mostraron una digestión avanzada los cortes de 30 y 45 días (Tabla 2).
En la época primaveral (Tabla 3), para las tres edades de rebrote y para 12 h de incubación en el rumen, el clorénquima, floema y la vaina del haz fueron en todos los casos parcialmente degradados, sufriendo una degradación avanzada para el in situ de 24 h, observándose una digestión completa luego de 48 h de incubación.
En cuanto al xilema, para el rebrote de 15 días y a las 48 h de incubación fue degradado en su totalidad, en cambio para los rebrotes de 30 y 45 días a las 48 h de incubación, permaneció con una degradación avanzada (Figuras: 3 A, B y C). A las 72 h de incubación mostró una degradación total. La epidermis permaneció sin degradar aún a las 120 h de incubación.
En la época estival (Tabla 4), esta especie mostró un comportamiento similar que en la época primaveral, donde podemos observar que clorénquima, floema y vaina del haz, para las tres edades de corte y para el in situ de 12 h, fueron parcialmente digeridos, con degradación avanzada para el in situ de las 24 h, y ya a las 48 h de incubación presentaron una pérdida total de clorénquima y floema, comparada con una hoja sin digerir.
El xilema, en cambio, para el rebrote de 15 días, resultó ser indigerible a las 12 h de incubación, parcialmente digerible a las 24 h de incubación y a las 48 h (Figura 4), mostró una digestión avanzada. En los rebrotes de 30 y 45 días para todos los horarios de incubación fue indigerible. El mismo comportamiento los mostró la epidermis para todas las edades de rebrote y todos los horarios de incubación.
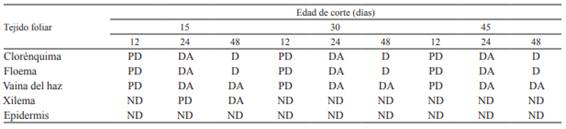
Tabla 4: Grado de digestión de los tejidos foliares de P. notatum según el tiempo de permanencia en rumen (12, 24 y 48 horas), a diferentes edades de rebrote en verano.
Referencias: ND: no digerido, no hay pérdida de tejido con respecto a una hoja sin digerir. PD: parcialmente digerido, remoción parcial de ciertas regiones. DA: digestión avanzada, remoción significativa y general pero sin pérdida total. D: totalmente digerido, pérdida total.
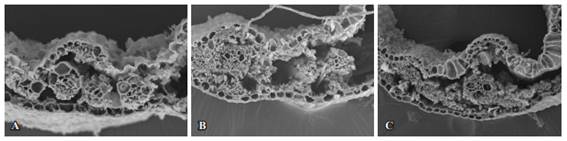
Figura 4: Fotomicrografías con MEB de cortes transversales de láminas foliares de P. notatum sometidas a digestión ruminal durante 48 h. Para cortes de 15 días (A), 30 días (B) y 45 días (C) en verano. Aumentos 300x.
La digestión de los tejidos foliares para P. notatum concuerdan mayormente con el patrón de digestión característico de gramíneas reportado previamente 13,15 donde observaron que en todas las especies, el mesófilo (clorénquima) y el floema habían desaparecido en más del 80% luego de 24 horas de incubación, el resto de los tejidos solo se vió afectado después de este tiempo, excepto tejidos como el xilema y la vaina interna del haz que no se degradaron.
La composición y organización molecular de las paredes celulares es la mayor determinante en la tasa y extensión de la degradación de las paredes celulares de células aisladas; sin embargo ese comportamiento no se observa in vivo, debido a que las células que integran los tejidos y la estructura de éstos puede tener más influencia en su degradación en el rumen que la propia composición química de sus paredes 28 .
La accesibilidad a los carbohidratos de las paredes celulares por la microflora del rumen está limitada por el arreglo estructural de cada tipo de tejido y por la química de las paredes celulares 4 . Así, tejidos altamente ordenados y de paredes secundarias lignificadas como el esclerénquima y el xilema tienen una doble barrera física y química que impide su digestión 28 .
Sin embargo, la pared secundaria lignificada en gramíneas puede ser digerida cuando se facilita el acceso de los microorganismos del rumen a ellas. La pobre digestibilidad es debida a los límites impuestos por la estructura. El conjunto formado por la laminilla media y la pared primaria, es el sitio donde comienza la deposición de lignina, que es indigestible 26, y constituye una de las limitantes mayores a la digestión de las gruesas paredes secundarias lignificadas.
A su vez, la laminilla media une las células adyacentes, consecuentemente las fibras forman grandes partículas multicelulares, muchas de las cuales no tienen extremos rotos, por lo que resultan completamente indigestibles 11 .
En trabajos donde se caracterizó la degradación de tejidos foliares de Elymus breviaristatus y E. scabriglumis en estado vegetativo y reproductivo durante 24, 48 y 72 h de digestión in situ, se observó que el clorénquima fue en todos los casos parcialmente degradado hasta las 48 h 19, similar a lo hallado en el presente trabajo. Las características histológicas del clorénquima y su arreglo estructural permiten su rápida degradación 7) . De allí que en el patrón secuencial de digestión sea uno de los tejidos que primero se digiere, habiéndose observado su degradación casi completa luego de 8 h de digestión en el rumen, y 12 o 24 h en varias Festucoideas 26 .
En estimaciones realizadas 19, el mínimo porcentaje de clorénquima degradado fue medido a las 24 h, alcanzando casi en todos los casos un 100% de degradación al término del ensayo a las 72 h. Nuestros resultados evidencian que en el corte de mayor edad estudiado (45 días), una digestibilidad total, en otoño, primavera y verano, no así en invierno donde solo observamos digestibilidad avanzada.
La diferencia en la tasa de degradación del clorénquima en las distintas edades, podría estar relacionado con la deposición diferencial de inhibidores de la digestión microbiana en las paredes de células cercanas, como la lignina. Las diferencias en el contenido relativo de tejido esclerenquimático de difícil digestión, y probablemente lignificado a medida que avanza la edad de la planta adyacente con el clorénquima, pueden ser parcialmente responsables de los resultados obtenidos en la degradación de este último tejido 19 .
Las características propias de las células esclerenquimáticas explican su resistencia física a la digestión 7, como lo observado en la especie estudiada aquí, y lo reportado para el agropiro criollo, el cual posee bajo porcentaje de este tipo de tejido 9,18. En base a caracteres histológicos se estudiaron las limitaciones estructurales de los distintos tejidos a la acción de la microbiota ruminal 28.
Los autores analizaron la relación entre la superficie de la pared celular de cada tejido y el volumen celular, la tasa de digestión bacteriana y la accesibilidad de éstas a la pared celular. En el caso del parénquima esclerénquima, la organización en bloques de fibras requiere mayor tiempo de difusión microbiana a través del tejido y el tiempo de degradación es mayor que en otros tejidos 7,27,30. Por lo tanto, es razonable encontrar una degradación más lenta del parénquima y esclerénquima que del clorénquima, tal como la mencionada en este estudio y lo reportado para el agropiro criollo 19. Sin embargo, en orden secuencial, el parénquima es de los primeros tejidos en ser degradado 21. El floema es uno de los tejidos vasculares que se menciona como de rápida digestión tanto para gramíneas de áreas templadas como tropicales 2,11,12.
En este trabajo el tejido evidenció una digestión parcial ya a partir de las 12 h en casi todas las épocas, con un comportamiento similar a Setaria lachnea (moha perenne) que luego de 24 h fue completamente degradado 12 y contrariamente a lo reportado para el agropiro criollo 19, que fue totalmente no degradado a las 24 h en todos los casos, aunque a las 48 h fue en general más degradado que el xilema y hasta el final de las 72 h permaneció degradado en forma parcial.
Las variaciones en el desarrollo de la planta y de tipo climáticas por cambios de humedad y temperatura, conlleva a variaciones químicas de las paredes de estas, que modifican el accionar de los distintos microorganismos ruminales, lo que hace que se modifique el aprovechamiento de la pastura por parte del animal.
La degradabilidad de tejidos como xilema, esclerénquima y vaina del haz, varió en la especie aquí estudiada. Trabajos realizados con Moha perenne, a la que incubaron durante 24 y 48 h en rumen, se observó que luego de 48 h de incubación, solo quedaron remanentes del xilema rodeado por la vaina Kranz y fragmentos de epidermis abaxial unidos a casquetes de esclerénquima 12.
En general, la vaina de Kranz, es digerible muy lentamente 2, pero es completamente degradable variando los tiempos de digestión 27. Resulta destacar la elevada proporción de vaina del haz en Setaria lachnea que está en relación con el mayor número de haces vasculares por lámina que presentan las especies C412.
Al respecto se hace hincapié en la importancia de los factores extramuros que estarían restringiendo dicho acceso 28. Estos autores citan como factores de este tipo a la cutícula, a capas de cera y a la laminilla suberizada de la vaina Kranz. Aspectos estos relacionados, en el caso de los dos primeros, con la epidermis adaxial y abaxial, y el tercero con la vaina Kranz. Tejidos que aparecen en mayor proporción en S. lachnea y que son los determinantes de la mayor cantidad de tejido digeridos lentamente o no digeribles 13.
En términos de porcentajes se mencionan valores de 13 a 32% de degradación de xilema en Poaceas tropicales luego de 48 h de digestión 29, datos que concuerdan en general, con estudios reportados sobre la proporción relativa de los distintos tejidos foliares, de gramíneas que integran los pastizales de la Provincia de Santa Fe 14; como ser Setaria cordobensis, Urochloa lorentziana, Pappophorum caespitosum, P. vaginatum, Sorghastrum pellitum, Sporobolus indicus y Paspalum plicatum, donde observaron que los porcentajes de los distintos tejidos foliares, la tendencia en la proporción y velocidad de digestión, coincide con la regla general reportada para las gramíneas 2,27,14, mesófilo y floema (rápidamente degradados), epidermis, vaina parenquimática del haz (lentamente degradados), esclerénquima (lentamente a no degradado), cutícula y xilema (no degradado).
Trabajos realizados con gramíneas invernales en el Uruguay, se califica como de buena digestibilidad, a aquellas que poseen en sus láminas menos del 15% de esclerénquima y más del 50% de clorénquima 10. Esta clasificación se basa, en el hecho de que, mientras el esclerénquima es un tejido considerado mayormente indigestible, el clorénquima es el tejido de máxima digestión en el rumen 2 .
La variación en la digestión de tejidos como xilema, esclerénquima y vaina del haz, responden tanto al estado fenológico como a la estación del año donde se realizó la toma de muestra. Los resultados obtenidos en capim-elefante 5 donde se estudiaron las alteraciones histológicas ocurridas en cultivares de capim-elefante en 4, 8 e 16 semanas de rebrote demostraron que la proporción de tejidos lignificados aumenta con la madurez del material, siendo más acentuado en tallos y láminas foliares.
La lignificación de la pared celular ocurre con el envejecimiento de las plantas, acompañando la reducción de áreas de degradación de tejidos. Esta variación en la degradabilidad de los tejidos ocurre según aumenta la edad de la planta y la disminución en la digestibilidad de la materia seca y proteína bruta de la especie bajo ensayo, es lo que lleva a sugerir que el porcentaje de tejidos digeribles lentamente y no digestibles es un buen estimador del valor nutritivo de gramíneas C3 y C419.
La epidermis, cuyas células pueden estar más cutinizadas con la mayor edad de la planta, también dificulta el acceso de microorganismos 20. Es probable que la diferencia mencionada en la degradación del tejido vascular se deba también al porcentaje lignificado de las células epidérmicas o a la presencia de cutícula en ellas. En las especies estudiadas, a las 12 h de exposición ruminal el parénquima y parte del tejido vascular habían comenzado a ser degradadas, pero la epidermis permanecía intacta.
En otras especies, tales como Cynodon dactylon y Festuca arundinacea la epidermis también permaneció sin degradar aún después de siete días de incubación 3, quizás debido a la presencia de compuestos fenólicos. Por el marcado engrosamiento observado en las paredes celulares de las especies en estudio, dicha presencia fue probablemente la causa de su permanencia sin degradar en el material incubado en rumen, coincidiendo con los reportes hechos por otros autores 4,19,26.
En conclusión, en términos generales las características anatómicas observadas, en las tres edades de corte y distintas estaciones fueron variables para esta especie. La organización estructural o anatomía de los órganos de las plantas como así sus tejidos constituyentes, además de incidir en el consumo, también influyen en la digestibilidad de la pared celular, proporcionando mayor o menor acceso de los microorganismos ruminales a los polisacáridos. Esto permite comprender la degradación preferencial, su relación con la calidad nutritiva y su comparación con otras especies de uso potencial en los sistemas de producción ganadera.
La determinación de la proporción de los tejidos, asociado a la definición de objetivos de manejo de la pastura podría ser una alternativa para mejorar los índices de producción, donde el forraje podría ser cosechado en el estado óptimo, con el máximo posible de tejidos de alta digestibilidad.














