Introducción
Numerosas condiciones clínicas, aparentemente sin relación, se han vinculado a la fisiopatología de la laminitis 5, todos los cuales en última instancia, dan lugar a una histopatología característica 25. Sin embargo, hasta la fecha no se ha logrado una teoría unificadora que explique la patogenia de la laminitis 23.
Previo a este trabajo hemos demostrado que la intoxicación causada por el veneno de serpientes del género Bothrops, de Argentina, causa un fallo celular que culmina con el desprendimiento de la unión dermo-epidermico en el casco del pie equino 2.
La intoxicación por Bothrops se caracteriza por sus efectos proteolítico, coagulante y hemorrágico con el desarrollo de un importante daño tisular caracterizado por dolor, edema, sangrado, ampollas, mionecrosis y dermonecrosis. La hemorragia que se presenta inicialmente es local, en el sitio de la mordedura y posteriormente a nivel sistémico. Las alteraciones más importantes son alteración en la coagulación, falla renal aguda, insuficiencia respiratoria aguda, shock and sepsis 6,8,30,28,12 y laminitis 1.
El veneno es de constitución compleja, entre cuyos componentes las proteínas más relevantes, metaloproteinasas y fosfolipasa A2, fueron aisladas y caracterizadas 10,11 . El veneno de Bothrops alternatus posee una metaloproteinasa, la que fue aislada y denominada baltergin, de 55 kDa baltergin, con importante actividad hemorrágica a nivel local y sistémico 12. Las metaloproteinasas del veneno de serpiente (SVMPs) juegan un relevante rol en la patogénesis de la intoxicación por Bothrops. Son proteinasas dependientes de zinc cuyo principal efecto tóxico se deben a la alteración del sistema hemostático. SVMPs induce la proteólisis de la lámina basal de micro vasos por la degradación de las principales proteínas de la matriz extracelular 3,4.
Del veneno de serpiente Bothrops alternatus del noreste argentino se aisló una proteína ácida con actividad de la Fosfolipasa A2 (PLA2) con una masa molecular de 14,2 kDa, llamado Ba SPII RP 10.
En el presente estudio, utilizamos este modelo de laminitis in vitro para investigar el rol de Fosfolipasa A2 y veneno de serpiente en la patogenia de la laminitis.
El modelo in vitro con explantes lamelares es una técnica válida para cribar numerosos factores causantes de laminitis. En el presente estudio, utilizamos este modelo de laminitis in vitro para investigar el rol de Fosfolipasa A2 y veneno de serpiente en la patogenia de la laminitis.
Material y métodos
Venenos
El veneno de las serpientes Bothrops alternatus adultas, se extrajo de 10 ejemplares de ambos sexos, cuyas edades oscilaron entre 8 a 10 años de edad. La extracción del veneno se llevó a cabo en el serpentario de la provincia de Corrientes, Argentina. La metodología utilizada fue manual mediante la técnica de masaje y presión sobre la zona de ambas glándulas, mientras sus colmillos eran colocados sobre recipientes de vidrios estériles cubiertas de telas de nylon. Posteriormente el veneno fue desecado y conservado a -20ºC hasta el momento de su utilización. Cuando fue necesario, el veneno se diluyó con solución salina tamponada con fosfato, pH 7,2.
Aislamiento y purificación
La enzima PLA2 se aisló hasta homogeneidad mediante tres pasos cromatográficos con las modificaciones descritas por Vidal y Stopani 29. Todos los pasos del procedimiento de purificación se llevaron a cabo a temperatura ambiente (25°C). El perfil de elución se controló a 280 nm y las fracciones activas de PLA2 se recogieron y utilizaron para explantes de cultivo. Para analizar la pureza de la enzima aislada, se realizó SDS-PAGE en geles en placa de poliacrilamida al 12% siguiendo el método de Laemmli 19. Los geles se tiñeron con azul brillante de Coomassie R-250. Los marcadores de masa molecular estándares fueron albúmina bovina (66 kDa), albúmina de huevo (45 kDa), gliceraldehído-3-fosfato deshidrogenasa (36 kDa), anhidrasa carbónica (29 kDa), tripsinógeno (24 kDa), inhibidor de tripsina (20 kDa), y α-lactoalbúmina (14,20 kDa). Los experimentos se realizaron de acuerdo con las pautas del Comité de Ética Animal de la Universidad de Queensland.
Obtención de explantes dermo-epidermico de pie equino
Se trabajó con un total de doce pezuñas de caballos normales, obtenidas de un matadero comercial de la ciudad de Brisbane, Australia. Estos fueron transportados en hielo seco a la sala de disección de la School of Veterinary Science de la University of Queensland, Australia. Se obtuvo de 8 a 10 explantes dermo-epidermico por cada miembro y cada experiencia fue acompañada de muestras controles. Los explantes median aproximadamente 6 mm por 6 mm y se extendían desde la pared interna de la pezuña a través de la unión laminar, hasta el tejido conectivo dérmico 25,26.
Incubación de veneno entero y PLA2 de B. alternatus en explantes de pie equino.
Los explantes previamente obtenidas del pie de equinos fueron acondicionadas en recipientes especiales para ser incubadas con medio de cultivo D-MEM (Dulbecco’s Modified Eagle Medium), para los controles y conteniendo 100 mg por ml de veneno entero, igual procedimiento se realizó para la incubación con 100 mg / ml de PLA2; en todas las muestras se agregó gentamicina 0.1 mg/ml. Las incubaciones se realizaron en estufa a 37ºC, 5% de dióxido de carbono, 95% de humedad, por 48 hs.
Microscopía electrónica de trasmisión
Las muestras fueron fijadas en glutaraldehído al 2,5% en tampón de cacodilato de sodio 0,067 M, pH 7,4, durante 4 horas y se almacenaron en tampón a 4ºC. El tejido se fijó posteriormente en tetróxido de osmio al 1% en tampón cacodilato durante 1 h a temperatura ambiente. Luego, en bloque en acetato de uranilo acuoso al 5% ya que este procedimiento tiende a extraer glucógeno. El tejido se deshidrató a través de una serie de alcoholes, se aclaró en óxido de propileno y se embebió en una mezcla de Epon-Araldita. Los bloques se cortaron con un cuchillo de diamante (Diatome) en un ultramicrótomo Reichert-Jung, se tiñeron con citrato de plomo 27 y se observaron en un microscopio electrónico Zeiss EM.
Resultados
Cultivo de explantes controles
La ultraestructura de explantes de unión dermo-epidérmicas del pie de equinos controles, fueron estudiadas a través de la Microscopia Electrónica de Trasmisión, con el objeto de obtener una mejor comprensión de la fisiopatología de la laminitis producida por componentes de venenos de serpientes. En la unión dermo-epidérmica se observó la membrana basal (MB), caracterizada por la coloración oscura de la lámina densa cercana al contorno de las células basales epidermales. Entre la lámina densa de la MB y el plasmalema de las células basales se encuentra la lámina lucida coloreada levemente. Las puntas de las láminas epidérmicas secundarias (LES) se caracterizan por ser redondeada y los núcleos ovalados, de las células epidérmicas basales, presentan su eje longitudinal en ángulo recto al eje longitudinal de la LES (Figura 1A). En cada plasmalema de las células basales se observó los hemidesmosomas, como placas intracitoplasmaticas (Figura 1B).
Cultivo de explantes con veneno entero y PLA2 de Bothrops alternatus
En los tejidos dermo-epidérmico de explantes de pie equino incubado con 100 µg de veneno entero de B.
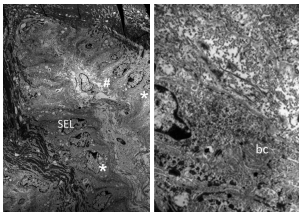
Figura 1 (A-B): microscopia electrónica de transmisión (MET) de láminas epidérmicas secundarias (LES) de pie equino control. A) Las LES están constituidas por células epidérmicas basales (*) y células parabasales. Se observa el extremo redondeado de las LES (flecha). B) Se observa la lámina densa (flecha) paralela a las células basales epidermales (bc). (TEM-Ax500-B) x100.
alternatus se observó el desprendimiento de la membrana basal de las láminas epidérmicas secundarias, presentándose como dos cordones bien delimitados de color oscuro (Figura 2 A) y en contacto entre sí en algunas zonas.
Entre cada cordón de MB se observó, en algunas áreas, tejido dérmico con sus vasos sanguíneos correspondientes. Al separarse, la MB del tejido laminar epidérmico, permaneció unido al tejido dérmico, presentándose con forma ondulada (Figura 2 B).
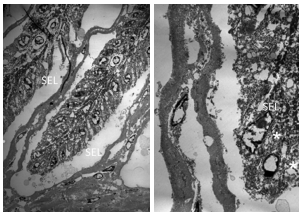
Figura 2 (A-B): explantes de láminas dermo-epidérmi-cas incubadas con 100 µg de veneno de Bothrops alternatus. Ultraestructura de la zona donde se encuentra la membrana basal (MB). A) Se observa 2 LES con separación de la MB, las cuales se muestran como 2 hebras bien definidas y oscuras (flecha). B) Se observa cambio en la forma de los núcleos de las células basales de las LES, presentándose ovalados, redondos o deformados (*). (MET- A) x1200 - B) x1500).
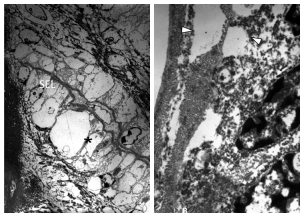
Figure 3 (A-B): Microscopia Electrónica de Transmisión (MET). Sección de laminillas epidérmicas secundarias (LES) de pezuña equina incubadas con 100 µg de PLA6 de veneno de Bothrops alternatus A) Se observa células epidérmicas basales de mayor tamaño que el control y en algunas se evidenció ausencia de núcleos y orgánulos citoplasmáticos (*). B) La BM no estaba unida a las células basales epidérmicas y los núcleos de las células basales se encontraban alargados y terminaban en forma aguzada (flecha). (MET - A) X 2000, B) X 2500).
En los explantes incubados con 100 µg de PLA2 de veneno de B. alternatus, las células basales epidérmicas presentaron alteraciones citoplasmáticas claramente evidenciadas por aumento de tamaño celular, con aspecto de células tumefactas, en algunas de ellas se observó vacuolas intracitoplasmáticas, ausencia de núcleos o restos nucleares (Figura 3 A y B). La membrana basal no se encontraba unida a las células basales epidérmicas y los núcleos de las células basales se encontraban alargadas y terminaban en forma aguda (Figura 3B).
Discusión
Microscopía electrónica de transmisión
Las células basales epidérmicas de las muestras de control se alinearon correctamente con núcleos ovalados en posición central. Sin embargo, las muestras incubadas con 100 µg de veneno de B. alternatus, mostraron células afectadas en su estructura con degeneración celular y gotitas lipídicas sueltas en el citoplasma. Los núcleos se encontraban deformados y mal posicionados de las células basales y parabasales. En contraste, las muestras incubadas con PLA2, las células basales epidérmicas mostraron anomalías citoplasmáticas y nucleares pero con separación leve de la unión dermoe-pidérmica y presente solo en algunas áreas de las LES.
Del mismo modo, la microscopía electrónica de transmisión nos permitió observar que las láminas dérmicas al separarse de la epidermis producen roturas proporcionando una clara evidencia de desprendimiento de la membrana basal. Sin embargo, las placas de unión entre las células basales epidérmicas (desmosomas) y las células parabasales no mostraron anomalías en nuestras condiciones experimentales.
Por otro lado, los hemidesmosomas que constituyen la placa de unión de las células basales a las MB se rompieron y en algunas secciones se superpusieron, evidencia clara de desprendimiento de la membrana basal. Sin embargo, en algunas secciones el BM permaneció intacto con la lámina lúcida, la lámina densa y la capa reticular aún distinguibles.
Estudios in vivo de otros autores mostraron lesiones similares a las mostradas en laminitis inducida por sobredosis de oligofructosa, se redujo el número de hemidesmosomas y aumentó la distancia entre la membrana basal densa y los hemidesmosomas 24. French & Pollitt 9 informaron lesiones de hemidesmosoma similares en el modelo de inducción de oligofructosa. Además, los estudios in vitro muestran que la falta de glucosa reduce el número de hemidesmosomas y provoca la desintegración del citoesqueleto de células basales. Sin embargo, los filamentos de anclaje del plas-malema que conectan las células basales con el BM no se vieron afectados 9.
Acción de PLA2 de B. alternatus en explantes de pie equino
Las fosfolipasas son un grupo diverso y ubicuo de enzimas descritas por primera vez en 1967, 17. Se demostró que inducen cambios en la composición de la membrana celular, activan cascadas inflamatorias y alteran las vías de señalización celular. Las PLA2 son constituyentes comunes de los venenos de serpiente Bothrops y este tipo de enzima se aisló de B. asper 13,20,21,16,22 de B. nummifer 14 B. jararacussu de Brasil 15,7 B. moojeni 21 B. alternatus de Argentina 10. Estas enzimas bothrópicas, incluida la que se utiliza aquí, no son capaces de degradar la membrana de los eritrocitos, aunque pueden hidrolizar los fosfolípidos de la membrana del músculo, induciendo su ruptura y posterior rabdomiólisis. Este comportamiento diferente de un mismo tipo de enzima, puede explicarse por la posibilidad de que la PLA2 aislada no acceda al sitio de hidrólisis de su sustrato en la membrana plasmática del epitelio basal, sino que provoque cambios en la organización de la membrana lipídica que inducen una alteración de la permeabilidad, como lo demuestra el aumento de la fragilidad osmótica en los eritrocitos 18. Por tanto, las células de los explantes expuestos a la fosfolipasa A2 están tumefactas, pero no necróticas. Los efectos de PLA2 del veneno de B. alternatus se pueden interpretar como un efecto sobre la permeabilidad de la membrana con un influjo de medio de cultivo que aumenta el tamaño del citoplasma y deforma el núcleo.
Conclusión
El presente trabajo estudia el efecto del envenenamiento por serpientes utilizando el modelo in vitro de laboratorio. Se utilizó un protocolo de explantes de pezuñas para estudiar la enfermedad de laminitis en el laboratorio in vitro por envenenamiento de serpientes, incluso en ausencia de vasculatura y suministro de sangre.
Asimismo, este modelo reprodujo los cambios patológicos en la anatomía de los cascos como los descritos para el pie de laminitis equina de diferente etiología sin tener que inducir el sufrimiento del animal.
Este estudio demostró que el veneno crudo y PLA2 indujeron laminitis de explantes de pezuñas con algunas diferencias histopatológicas creadas por las diferentes etiologías. Los resultados aquí obtenidos resaltan la importancia de considerar la complicada patología asociada a la laminitis equina tras el envenenamiento por B. alternatus.
Esta nueva información podría promover estudios que involucren nuevas terapias específicas para el tratamiento de esta condición discapacitante.
Este trabajo fue financiado por la Secretaría General de Ciencia y Técnica, Universidad Nacional del Nordeste, Argentina (Proyecto Nº 17BO17).














