Introducción
Las enfermedades en los cachorros caninos y sus índices de mortalidad presentan tasas variables en dependencia de algunos factores de predisposición intrínsecos (materno fetales) y también en dependencia de factores extrínsecos como factores ambientales e infecciosos que contribuyen al desarrollo de patologías neonatales. Las tasas de mortalidad en cachorros de entre 7-8 semanas se estima en aproximadamente 20% de neonatos nacidos vivos 27.
Uno de los factores que contribuye a estas altas tasas de mortalidad es el destete, etapa de transición nutricional a la que son sometidos los cachorros entre las 3-4 semanas de vida, los perros y otros animales sufren a menudo de estrés nutricional, ambiental, inmunológico y social, factores que pueden influenciar de manera negativa en la morfología y funcionalidad de la estructura intestinal del cachorro 36, estos cambios pueden tener repercusiones en la digestión y absorción de nutrientes importantes para la síntesis de proteínas necesarias para fortalecer el sistema inmunológico a nivel celular y humoral 14,26.
En todo el mundo las infecciones virales afectan a un alto número de cachorros caninos, principalmente a aquellos animales débiles e inmunodeprimidos, por ello se proporcionan defensas contra parvovirus canino a través de la vacunación temprana 5,10.
En un estudio realizado en Ecuador se determinaron las variantes de parvovirus (PVC) en cachorros infectados por esta enfermedad, determinándose tres variantes antigénicas en los animales en estudio con una prevalencia de PVC-2a 57,1 por ciento, PVC-2b 8,5 por ciento y PVC2c 34,3 por ciento, siendo este un problema muy serio ya que las vacunas utilizadas en la mayor parte de América Latina protegen solo para las variantes PVC-2a y PVC2b 9.
En varias especies de animales se ha determinado el papel fundamental de la nutrición, particularmente el rol que cumplen ciertos aminoácidos en el fortalecimiento y en la activación temprana del sistema inmune 3,19,20, de manera particular se ha establecido que tanto el glutamato como la glutamina tienen un efecto positivo en el sistema inmune de lechones en la etapa del destete 4.
En varios estudios se puntualiza su importancia en la activación de la señalización de las células de rapamicina (mTor) favoreciendo el recambio de enterocitos y manteniendo la estructura de la pared intestinal con enterocitos intactos, con menos espacios entre ellos y vellosidades intestinales más alargadas con criptas más profundas lo cual promueve una buena función 7,24.
Otro grupo de aminoácidos que ha demostrado fortalecer el sistema inmune humoral y celular son los aminoácidos de cadena ramificada (BCAAs: Leucina, Isoleucina y Valina) 33 , las células del sistema inmune podrían incorporar BCAAs a través de la síntesis de proteínas, expresar actividades de alfa-cetoácido-deshidrogenasa de cadena ramificada y decarboxilasa -por ejemplo la isoleucina- se encuentra en los linfocitos en los eosinófilos y neutrófilos, elementos hematológicos que son parte del sistema inmune celular 30 .
El objetivo del estudio fue determinar el comportamiento de los parámetros hematológicos y bioquímicos en cachorros caninos suplementados con glutamina, leucina, isoleucina y valina durante 90 días de tratamiento (30-120 días de edad).
Material y métodos
Lugar del estudio
El estudio fue de tipo experimental. Para esto se reclutaron 4 camadas de cachorros, los mismos que fueron alojados en el Centro Experimental Uyumbicho de la Universidad Central del Ecuador, ubicado en la Provincia de Pichincha, Parroquia de Uyumbicho, entre las coordenadas 23°23′00′′S 78°31′00′′O a 3725 m.s.n.m., la misma que presenta una temperatura promedio de 18.5°C y una humedad relativa de 87%.
Animales en estudio
Las camadas de cachorros aparentemente sanos (examen clínico veterinario) de 25 días de nacidos fueron obtenidas en hogares de zonas urbano marginales de la ciudad de Quito, provinieron de madres que se alimentaron durante su periodo de gestación y lactancia con una dieta mixta, en base a alimento balanceado comercial y dieta casera.
Se obtuvieron 31 cachorros: camada uno (C1) con siete hermanos (5 hembras; 2 machos); camada dos (C2) ocho hermanos (6 hembras; 2 machos); camada tres (C3) ocho hermanos (4 hembras; 4 machos) y la cuarta camada (C4) ocho hermanos (4 hembras; 4 machos). A su ingreso al centro de crianza los animales fueron identificados y registrados en un expediente clínico individual.
Desde su ingreso y semanalmente, fueron estimados a través de una exploración clínica completa la cual incluyó la valoración por camada y la valoración individual de cada cachorro. En la camada se valoró el comportamiento, la homogeneidad y la condición corporal asociada al estado nutricional. De manera individual a cada neonato se lo examinó empleando las técnicas básicas de exploración (observación, palpación, palmopercusión y auscultación).
Se descartó la presencia de lesiones externas y de ectoparásitos sobre la piel, se prestó especial atención a la valoración de los reflejos de deglución, de retiro, y de tos en los neonatos. En cada examinación, se evaluaron las constantes fisiológicas de manera individual, entre ellas la frecuencia cardiaca (FR), frecuencia respiratoria (FR), pulso (P) y temperatura (T), parámetros que se encontraban dentro de los rangos establecidos por Grundy (2006) 15.
Durante el tiempo que duró el experimento todos los cachorros fueron vacunados y desparasitados bajo el mismo esquema: vacuna Vanguard Plus® (Parvovirus-Cononavirus), 45 días de edad, Vacuna Vanguard Plus 5/L® (Distemper, Adenovirus Tipo 2, Parainfluenza, Parvovirus, Leptospirosis) 66 días, Vacuna Vanguard Plus 5/L®, 87 días y Vacuna Defensor® (Rabia), 108 días. Las desparasitaciones se realizaron con cada vacuna empleando un preparado comercial en base de embonato de pirantel (equivalente a 5 mg de pirantel base), 14.4 mg; febantel 15 mg; excipientes para 1 ml, a razón de 1 ml/kg de peso.
Dieta y suplementación
A la llegada, los cachorros tuvieron un período de adaptación de 5 días en los cuales se les suministró un sustituto de leche comercial mezclada con una dieta comercial premium para cachorros, la cual fue analizada y con la cual se alimentaron durante los 90 días que duró el experimento (ver Tabla 1).
La alimentación se realizó dos veces al día (de manera individual, en espacios separados) y la cantidad proporcionada fue calculada semanalmente de acuerdo a la cantidad recomendada por el fabricante según su peso corporal, cumpliendo con los requerimientos establecidos por la FEDIAF (Federación Europea de Fabricantes de Alimentos para Animales de Compañía, 2017) 11. El consumo de alimento fue registrado diariamente y los pesos semanalmente.
A partir de los treinta días (inicio del experimento) fueron suplementados con aminoácidos de acuerdo al tratamiento correspondiente así: grupo control (sin suplemento), tratamiento uno (T1: Glutamina 0,5 g/kg de peso), tratamiento dos (T2: BCAAs Leucina, Isoleucina y Valina proporción 2:1:1 a dosis de 0.25 g/kg de peso) y tratamiento tres (T3: Glutamina 0,5 gr/kg de peso - BCAAs 0,25 g/kg de peso).
Los suplementos empleados fueron: Glutamina (Glutapure ®), BCAAs ® (leucina, isoleucina y valina, proporción: 2.1.1) de la empresa Ultimate Nutrition, las dosis fueron calculadas de acuerdo al peso promedio semanal para cada tratamiento y fueron administradas de manera individual por vía oral en la ración de alimento de la mañana, aplicándose el mismo protocolo para todos los animales.
Toma de muestras y análisis sanguíneos
Las muestras se colectaron de la vena yugular con los animales en recumbencia esternal, se obtuvieron 3 mL de sangre entera a los 30 y 120 días de edad. Suavemente 1 mL de la muestra fue colocada y homogeneizada en un tubo MicroCollect® conteniendo EDTA (ácido etilen-diamino-tetra-acético), además, 2 mL de la muestra se colocaron en un tubo sin anticoagulante para la obtención de suero.
Las muestras se identificaron y colocaron en un cooler herméticamente cerrado, el cual preservó las mismas durante 60 minutos a una temperatura de 2-4°C mientras fueron transportadas al Laboratorio Clínico del Hospital Veterinario AllPets donde fueron analizadas.
Con la sangre entera se realizó un hemograma completo en un analizador hematológico (DF 50, Dymind,
bajo el principio de impedancia para determinación de células rojas y plaquetas y citometría de flujo para el análisis diferencial de células blancas), realizando el contaje total (WBC) e individual del leucograma, neutrófilos (Neu), linfocitos (Lin), monocitos (Mon), eosinófilos (Eos), basófilos (Bas).
Se evaluó el eritrograma con el contaje de células rojas (RBC), concentración de hemoglobina (HBG), volumen celular medio (MCV), cantidad de hemoglobina globular (MCH), concentración corpuscular media de hemoglobina (MCHC) y finalmente el plaquetograma con el contaje de plaquetas (PLT), volumen plaquetario medio (MPV), ancho de distribución de plaquetas (PDW) y el plaquetocrito (PCT).
Con los 2 ml de sangre colectada en el tubo de tapa roja (sin anticoagulante) se obtuvo suero, con el que se realizaron las pruebas bioquímicas en un analizador colorimétrico (Pointcare® V3, MNCHIP), se empleó un rotor para valorar y calcular: proteínas totales (TP), albúmina (ALB), globulinas (GLO), relación albúmina globulinas (A-G), bilirrubinas totales (TBIL), alanino aminotransferasa (ALT), aspartato aminotransferasa (AST), nitrógeno ureico sanguíneo (BUN), creatinina (CRE), relación BUN-CRE y glucosa (GLU).
Análisis Estadístico
El diseño empleado fue un esquema en bloques completamente al azar (DBCA), así el factor de bloque es la camada, dentro de cada camada de manera aleatoria se asignó a dos animales por tratamiento.
Los datos obtenidos se analizaron mediante estadísticas descriptivas, se realizó la prueba de normalidad ShapiroWilk (Kruskall Wallis para datos no paramétricos) y un ANOVA para verificar las variaciones entre tratamientos, posteriormente se realizó la prueba de Tukey para determinar las diferencias significativas, en el caso de datos no paramétricos se aplicó la prueba de Wilcoxon.
Un valor de α = 0.05 como nivel de significancia fue empleado para todas las pruebas de hipótesis. Los datos fueron analizados empleando el paquete estadístico R Studio, versión 1.4.1103.
Resultados
Al finalizar el estudio se evaluaron los cambios en el hemograma y en la bioquímica sanguínea después de la suplementación de 90 días de glutamina y BCAAs, estos resultados se presentan en las Tablas 2 y 3, respectivamente.
Así, se observó que en el leucograma los leucocitos (WBC) y sus componentes: neutrófilos (Neu), linfocitos (Lin), monocitos (Mon), eosinófilos (Eos) y basófilos (Bas) presentaron un efecto (p<0.05) en el bloque (camada), sin embargo, no presentaron diferencias (p>0.05) en relación al tratamiento a un intervalo de confianza del 95%.
Aun así, se determinó que los WBC del T2 (BCAAs) presentaron un promedio de 10.33 (109 / L), el cual es superior al grupo control y al T1 y T3, de igual manera se determinó que los caninos del T2 presentaron un mayor promedio de neutrófilos (7.17 109 / L) el cual es superior a los demás tratamientos (p=0.052) y de acuerdo a los resultados obtenidos en R, si se emplea un intervalo de confianza del 90% podría llegar a ser significativo (p<0.05), tal como se expresa en la Tabla 3.
Las comparaciones de los parámetros de la bioquímica sanguínea entre los tratamientos en estudio y el grupo control no mostraron diferencias ni interacciones (p<0.05) entre tratamientos o entre bloques, pero sí se observaron diferencias del promedio general de proteínas totales el cual fue superior a los valores de referencia citados por otros autores, tal como se muestra en la Tabla 3.
De igual manera con relación a estos valores, los tres tratamientos y el grupo control presentaron niveles ligeramente elevados de las enzimas hepáticas (TBIL, ALT, AST y GGT) y de los metabolitos renales (BUN y CREA).
Discusión
Son escasos los reportes de valores hematológicos de cachorros de 30 días (4 semanas) por lo que la presente investigación constituye un aporte significativo para los médicos veterinarios dedicados a este campo, así quienes deben atender a pacientes de esta edad no tendrán que interpretar los resultados del hemograma con valores hematológicos de animales adultos 2,6.
Los resultados hematológicos obtenidos a los 30 días de edad se comportaron de manera homogénea entre los tratamientos, y fueron acordes a los promedios y rangos de cachorros establecidos por otros autores 16,22,31,34.
La suplementación oral de glutamina y BCAAs por separado y en conjunto para evidenciar un efecto sinérgico, estos aminoácidos al ser empleados en cachorros caninos en la etapa del destete tal como se ha realizado en otras especies 17,23,37, teniendo en cuenta que esta
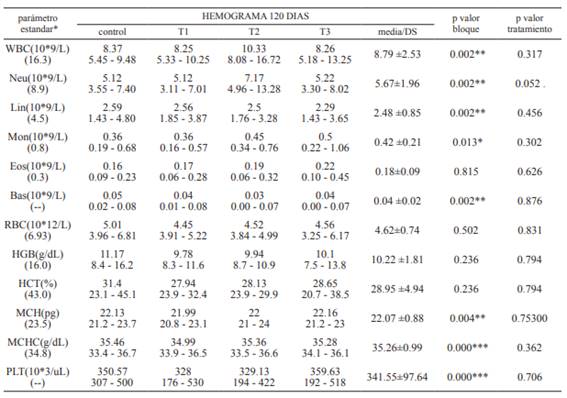
Tabla 2 Parámetros del hemograma por tratamiento a los 120 días de edad. *Rangos estándar cachorros 120 días: Von Dehn (2014). Significancia: 0 ‘***’ 0.001 ‘**’ 0.01 ‘*’ 0.05 ‘.’ 0.1 ‘ ’ 1
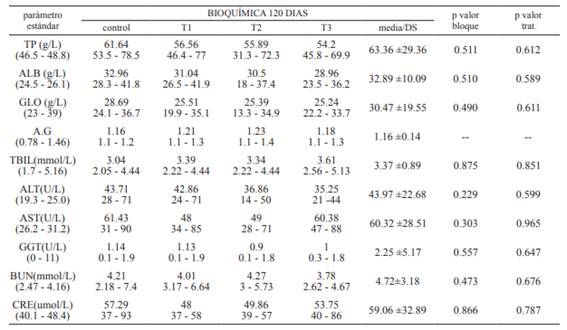
Tabla 3 Parámetros bioquímicos por tratamiento a los 120 días de edad *Rangos estándar cachorros 120 días: Brenten et al. (2016), Von Dehn (2014).
suplementación al momento del destete en cachorros no ha sido evaluada.
En la Tabla 2 se observa un incremento en el promedio de la población de leucocitos de los individuos que pertenecen al T2 (BCAAs), de la misma manera se determinó un promedio superior en el contaje de neutrófilos de este tratamiento en relación al grupo control y a los tratamientos 1 y 3 con los que a un IC del 90% mostró ser diferente (p<0.05), sin embargo el efecto sinérgico de los aminoácidos no fue observado en este estudio ya que los individuos de T1 y T3 no mostraron variaciones en referencia al grupo control, demostrando que la suplementación con glutamina por si sola y junto a los BCAAs no influencian en el desarrollo ni en el sistema inmunológico de los cachorros al destete.
Similares resultados se obtuvieron en un estudio en el cual se suplementó a ratones anoréxicos con glutamina y BCAAs, evidenciándose efectos en el desarrollo solo en los ratones suplementados con BCCAs 17, confirmando así la no esencialidad de la glutamina en animales cuyo requerimiento de este aminoácido se encuentre cubierto con el aporte nutricional adecuado 7,19.
Así, si la alimentación cumple con los requerimientos de glutamina para los cachorros en la etapa de desarrollo, el destete es un estresor fisiológico cuyas consecuencias en el sistema inmunológico y en el desarrollo de estos individuos. no podrán ser estabilizadas tras la suplementación de este aminoácido como sí se ha observado en estudios realizados en personas 37 y en perros 18, en donde la suplementación parenteral de glutamina en pacientes convalecientes ha demostrado eficacia en la disminución de los síntomas de algunas enfermedades que cursan con estados hipercatabólicos (sepsis, enfermedad inflamatoria intestinal, cáncer) y una disminución en el tiempo de convalecencia 29 al estimular la inmunidad celular de los mismos 18,20.
Los aminoácidos de cadena ramificada: leucina, isoleucina y valina han demostrado tener una influencia positiva en el sistema inmunológico de personas y animales 3,30. Estos corresponden a aminoácidos esenciales para el organismo, así el valor fisiológico de estas moléculas es motivo de estudio de muchos investigadores, principalmente se estudia su función y los efectos de suplementación en varias enfermedades como cáncer, diabetes e insuficiencia renal, enfermedades que se presentan actualmente en personas y animales 25.
Los BCAAs regulan la síntesis de proteínas por lo cual ejercen un efecto protectivo en pacientes con enfermedad hepática o en aquellos pacientes que cursan con cuadros de inmunodepresión 1,33, desde hace algunos años se ha evidenciado el efecto positivo de los BCAAs por ejemplo en animales que sufrieron varios tipos de trauma o infecciones, demostrando su efecto regenerativo e inmuno regulador tras su suplementación 1,4,12.
En otros estudios se determinó un efecto positivo de la suplementación de isoleucina en el sistema inmunológico 23, en donde al igual que en este trabajo se observó un incremento en el contaje de células blancas y de los neutrófilos en los animales del T2, sin embargo, en el estudio realizado por Mao et al. en 2018 23, realizado en cerdos al destete afectados por rotavirus se evidenció también un incremento en la población de linfocitos, lo cual se contrapone a lo encontrado en esta investigación en donde no se observaron diferencias (p<0.05) entre el grupo control y los tres tratamientos en estudio. Esta diferencia puede estar asociada a que en nues tra investigación los animales se mantuvieron en un entorno saludable durante los 90 días del experimento, lo cual pudo influir para que este grupo celular no pre sente variación entre los tratamientos.
Finalmente, en este trabajo se evaluó en los cacho rros el comportamiento de los parámetros de la bioquí mica sanguínea tras la suplementación de 90 días de glutamina y BCAAs determinándose que las proteínas totales en el grupo control y en los tres tratamientos en estudio fueron superiores a los rangos de referencia es tablecidos por varios autores para animales de esta edad, pero se resalta el incremento observado en los animales del T2, desde el día 30 al día 120, que fueron los que mostraron un mayor incremento en la concentración de las proteínas, coincidiendo con varios estudios en donde se indica un efecto positivo de la suplementación de BCAAs en la síntesis de proteínas 3,18,30,35.
Las transaminasas hepáticas ALT, AST y GGT presentaron niveles ligeramente superiores a los rangos establecidos en animales sanos por otros autores 2,16 tanto en el grupo control como en los tres tratamientos. Así, estos niveles no reflejan una toxicidad asociada a la suplementación de los aminoácidos en estudio, lo cual coincide con un estudio en el que se evaluó la toleran cia a la suplementación de BCAAs en seres humanos y cerdos en donde se concluyó que bajo un sustrato pro teico adecuado la suplementación era muy bien tolera da 1,32,34.
Los parámetros que evalúan la función renal (BUN y CRE) tuvieron un comportamiento similar a las tran saminasas hepáticas mostrando ligeros incrementos en el grupo control y en los tres tratamientos, descartando así que la suplementación con glutamina y BCAAs a las dosis empleadas en este estudio pudiesen llegar a producir un daño hepático o renal de los animales en estudio.
Conclusiones
La suplementación con BCCAs en cachorros ca ninos tiene un efecto positivo en la inmunidad celular de estos individuos, evidenciado por un aumento en la población de neutrófilos en los animales de este trata miento. Se pueden emplear tales suplementos en los cachorros por tiempos prolongados sin la evidencia de efectos negativos para su salud.
Se recomiendan futuros estudios en animales ali mentados con alimentos con restos de alimentos de casa o con alimentos económicos en los cuales una de ficiencia en el aporte de aminoácidos puede hacer más evidente el efecto de la suplementación de los aminoá cidos aquí estudiados.















