Introducción
La infección por Trypanosoma cruzi, agente etiológico de la enfermedad de Chagas, es una zoonosis compleja, transmitida por varias especies de triatominos hematófagos 20,30. El vector endémico del Cono Sur es Triatoma infestans, ampliamente distribuido en Argentina, Chile, Uruguay, Paraguay, Brasil, Bolivia, Perú y Ecuador. La especie es casi exclusivamente doméstica y se la conoce como vinchuca 19.
En Argentina, según cifras oficiales, se estima que existen -al menos- 1.600.000 personas infectadas por T. cruzi, cifra que representa casi el 4% de la población total del país 3. En el ciclo biológico de T. cruzi intervienen mamíferos como el hombre y animales domésticos (ciclo doméstico y peri-doméstico) o silvestres como roedores y carnívoros (ciclo selvático).
Para el caso de las comunidades rurales del noroeste argentino y gran parte del Gran Chaco donde el principal o único vector doméstico es T. infestans, los principales actores domésticos además de los humanos son los perros, los gatos y las gallinas. Los perros actúan como una de las principales fuentes de sangre para los T. infestans y presentan elevados niveles de prevalencia de infección en ausencia de medidas de control vectorial 6,15,16,18.
Más aún, estudios en comunidades tratadas con insecticidas residuales mostraron que los perros y gatos siguieron siendo los principales reservorios domésticos del parásito a largo plazo 5,6. Los perros se infectan de la misma forma que los humanos, por heces de los vectores contaminados con el parásito, el cual penetra a través de las mucosas y conjuntivas del animal. Igualmente, los perros ingieren los vectores, lo que constituye otro mecanismo de transmisión por vía oral, la cual ha demostrado ser muy efectiva en infección experimental y adjudicada en casos clínicos 4,29.
Desde el punto de vista epidemiológico el perro es el reservorio más importante, debido en gran parte, a su relación estrecha con el hombre, ya que la mayoría de las veces convive en el mismo domicilio 10.
Las vinchucas pican a los perros y al hombre, convirtiendo a los canes en una fuente de infección constante para el humano ya que son 14 veces más efectivos que los humanos para diseminar el protozoo causante de la enfermedad hacia sus vectores, promoviendo el mantenimiento del ciclo y la replicación del parásito. Ello lleva al establecimiento y diseminación de focos latentes de infección que perjudican tanto a las personas como a los pacientes animales 26.
En el medio rural la prevalencia de perros con T. cruzi está en el rango del 8 a 50% y a menudo excede las prevalencias encontradas en las respectivas poblaciones humanas. Además, pueden desempeñar un papel en el reinicio de la transmisión en áreas previamente rociadas, sirviendo como indicadores de transmisión re-emergente 8,14,24.
Por todo lo expuesto, el objetivo del presente trabajo fue diagnosticar la infección por T. cruzi en caninos residentes del Valle de Acambuco, Provincia de Salta.
Material y métodos
Área de Estudio.
El estudio se llevó a cabo en la localidad de Acambuco, Salta, Argentina. Acambuco es un valle que pertenece al municipio de Agüaray, departamento General José de San Martín. Figura 1. El valle de Acambuco, (22°10´2.53´´S; 63°54´38.22´´O) fue declarado Reserva Provincial de Flora y Fauna (Ley 5360/39) y suma una superficie aproximada de 8.266 hectáreas. En la zona del Valle de Acambuco existen dos comunidades rurales, Acambuco y El Chorrito 1.
Selección de Individuos.
Previa autorización y colaboración de los propietarios para la realización de la extracción de sangre, se analizaron 24 caninos domésticos, 22 correspondientes a vecinos del Paraje Acambuco y 2 de El Chorrito. Los caninos pertenecían a viviendas con antecedentes de infestación domiciliaria y fumigaciones posteriores.
Toma de muestra de sangre.
Para la toma de muestras de sangre de los canes, se realizaron visitas domiciliarias donde se solicitó autorización a los propietarios y se les explicó la importancia de conocer el estado de infección de su mascota. Las extracciones las llevó a cabo un médico veterinario local. Se realizó por punción de la vena cefálica anti-braquial, extrayéndose entre 3 y 5 ml de sangre; dejándose retraer el coágulo, se obtuvo el suero de las mismas, conservándose a -20ºC hasta su utilización en el procesamiento serológico; otros ml de sangre se colocaron en tubos con EDTA, para el diagnóstico con PCR.
Datos epidemiológicos.
Durante el proceso de toma de muestras, se realizó un breve interrogatorio al propietario de cada animal, consignando en una ficha: número de muestra, nombre y apellido del dueño, domicilio (nombre del paraje correspondiente ya que al ser pocas casas no están numeradas), nombre del animal,
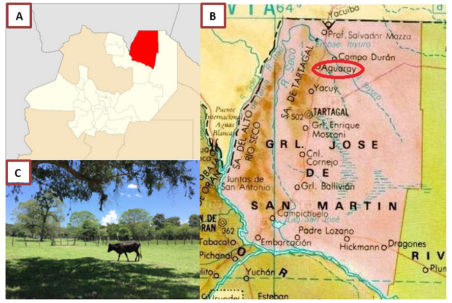
Figura 1 Área de estudio: A: departamento General José de San Martín, Provincia de Salta, Argentina; B: mapa geo-político donde se destaca el Municipio de Aguaray; C: fotografía del Valle de Acambuco.
sexo, tamaño, color del pelaje y/o signos particulares, edad, presencia de vinchucas, fecha del último rociado de la casa y presencia de cabras y/o gallinas. El estudio implicó dos instancias de muestreo en julio de 2016 y julio de 2017 en ambos parajes del Valle de Acambuco. Se llevó a cabo un muestreo aleatorio simple.
Pruebas serológicas.
Para la detección de los anticuerpos anti T. cruzi, se usaron las técnicas de hemaglutinación indirecta (HAI) y enzimo-inmuno-análisis (ELISA). La reacción de HAI se realiza enfrentando el suero del paciente con una suspensión de hematíes previamente sensibilizados con antígenos citoplasmáticos. Si en el suero del paciente existen anticuerpos anti T. cruzi estos van a producir aglutinación específica. Se analizaron los sueros extraídos de las muestras, según el protocolo del kit comercial HAI CHAGATEST-Wiener Lab (S.A.I.C., Rosario de Santa Fé, Argentina).
Ensayo inmuno-enzimático.
Fue un ELISA para la detección de anticuerpos contra Trypanosoma cruzi. La reacción de ELISA se basa en la formación de inmuno-complejos entre antígenos inmovilizados en un soporte y los anticuerpos presentes en el suero. Se utilizaron antígenos recombinantes del Kit Wiener Lab ELISA, anticuerpo secundario anti-inmunoglobulina canis conjugados con peroxidasa Sigma-Aldrich, siguiendo el protocolo descripto previamente por Binda y col., 2016 3. La absorbancia se leyó en un espectrofotómetro para placas de ELISA MR96A Mindray, método parasitológico (hemocultivo).
Protocolo.
Se utilizó el protocolo modificado por Mora y colaboradores 22. En un segundo muestreo, se obtuvieron 5 muestras de sangre, correspondientes a los canes que en el primer muestreo arrojaron resultados serológicos positivos o dudosos.
Método molecular
(reacción en cadena de la polimerasa). Se realizó extracción de ADN de las 24 muestras de sangre entera y de la fracción correspondiente al buffy coat (BC), mezclados previamente en proporción 1:1 con buffer Guanidina-EDTA. Llamamos BC a la interfase de glóbulos blancos, plaquetas y proteínas que se suspende encima de la capa de glóbulos rojos y por debajo del plasma. El ADN se extrajo por duplicado mediante el método de fenol-cloroformo y se dejó precipitando el ADN a -80°C con acetato de sodio-etanol. A partir del ADN extraído de sangre entera y del BC de las 24 muestras, se realizó PCR/Chagas convencional.
Amplificación.
Se llevó a cabo en un termociclador Techne 3000 siguiendo los parámetros de ciclado correspondientes al protocolo establecido por Mora y col. (2005), amplificando segmentos de 330 pb de k-ADN utilizando los primers #121 (5´-AAA TAA TGT ACG GG(T/G) GAG ATG CAT GA-3´) y #122 (5´-GGT TCG ATT GGG GTT GGT GTA ATA TA-3´) 21. La elección de estos primers se realizó en base al elevado número de copias (n>104) de su secuencia target y a la elevada sensibilidad para detectar la infección en estudios de campo 2,9,11,23.
Reacciones.
En todas las reacciones se usaron controles blanco, positivos y negativos. Como control negativo se usó sangre de canes (T. cruzi negativos testeados por serología) y sangre infectada con Leishmania sp. Los controles positivos correspondieron a sangre de canes T. cruzi positivos, tanto por serología como por PCR, obtenidos de un estudio anterior de nuestro grupo de trabajo 3 y para el blanco se utilizó agua estéril apta para PCR.
Corridas electroforéticas.
Las corridas electroforéticas de los productos de PCR se realizaron en gel de agarosa al 2% con buffer TBE (Tris Borato-EDTA) y se revelaron con Bromuro de Etidio (5-10 μg/ml). Los geles se fotografiaron en transiluminador UV, Maestrogen MLB-16 Ultrabright y se determinó el tamaño de los amplicones utilizando un marcador de peso molecular de 100 pb (Biodynamics).
Análisis estadístico.
Se realizaron descripciones en cifras absolutas y relativas, elaborándose tablas.
Resultados
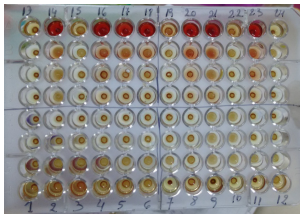
HAI: lectura de la placa de Hemaglutinación Indirecta. Como se puede observar en la placa (Figura 2), resultaron positivas (con la formación de un manto que cubrió más del 50% del pocillo, para diluciones ≥1/16), las muestras 9, 10 y 14. Y de interpretación dudosa, la muestra 21.
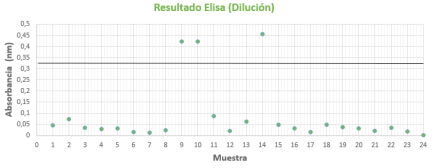
ELISA: puede observarse la Figura 3, resultando positivas las muestras 9, 10 y 14.
PCR: en la Figura 4, se observa una única muestra que amplificó la banda de 330 pb. Es la correspondiente al BC de la muestra de sangre del can 14 que resultó T. cruzi positivo por serología (HAI y ELISA).
HEMOCULTIVOS: todos los hemocultivos resultaron negativos.
ANÁLISIS ESTADÍSTICO: validación de una prueba diagnóstica.

Tabla 1 Validación de la prueba de HAI.VP: verdaderos positivos; FP: falsos positivos; FN: falsos negativos; VN: verdaderos negativos.
Se concluye que la prueba de HAI sirve de screening, pues al tener alta sensibilidad un resultado negativo excluye la enfermedad.
Discusión
La transmisión de T. cruzi en países endémicos depende de la confluencia de vectores, reservorios, parásitos y huéspedes (tanto personas como animales) en un solo hábitat. Gürtler demostró, en 1993, que cuando los perros infectados permanecen en áreas donde duermen sus dueños, la tasa de infección en insectos es significativamente mayor que cuando no lo hacen 14.
Años más tarde, el mismo investigador encontró que los perros contribuyen casi 3 veces más que los gatos a la transmisión doméstica de T. cruzi y que ambos animales (perros y gatos), hospedadores del parásito, contraen la infección unas 10 veces más rápido que los niños con los que cohabitan 16.
En el extenso trabajo de investigación de Castañera y col.7, llevado a cabo en perros de Amamá y localidades vecinas (Provincia Santiago del Estero) se investigó si el perro podría ser un eficaz centinela de la transmisión vectorial de T. cruzi en el contexto de Ia fase de vigilancia. La seroprevalencia global de T. cruzi en Ia población canina disminuyó del 65,0% (54/83) en 1992, antes de un rociado con deltametrina, al 38,5% (70/182) en 1994, y al 15.2% (36/237) en 1996 7.
Entre marzo de 2005 y junio de 2006 fueron recolectados, en dos barrios carenciados de la ciudad de Buenos Aires, sueros sanguíneos de 424 caninos, para luego ser 52 examinados por IFI y ELISA.
En ningún suero estudiado se detectaron anticuerpos específicos anti T. cruzi, hecho que resulta coincidente con la falta de evidencias de infestación y transmisión por triatominos en la zona (aun cuando los barrios se eligieron en base a la presencia de personas y caninos procedentes de áreas endémicas, así como a las características de las viviendas, que por su precariedad favorecían la proliferación de insectos, además de albergar perros y aves de corral en su interior, en estrecha co-habitación con el hombre) 25.
En la localidad de La Para, en Córdoba, Graiff y colaboradores 13, determinaron en 2009 una seroprevalencia de 11,1%, con ELISA e IFI, en 10 de 90 perros evaluados; en la provincia de Salta, Binda y col 3 realizaron análisis serológicos a 209 perros siendo 22 de la localidad de Rivadavia Banda Sur, 39 canes de San Carlos, 84 de Cafayate y 64 de la localidad de Embarcación, encontrándose anticuerpos anti-T. cruzi sólo en los canes de la localidad de San Carlos, 28,2% (11/39).
En Luján de Cuyo, una ciudad de Mendoza, de las 89 muestras tomadas a perros en 2016 y 2017, 12 resultaron positivas (13,5%) por HAI y ELISA 12. En la provincia de Chaco se registra un caso de una perra doméstica, diagnosticada por métodos parasitológicos, serológicos y moleculares 27.
En 2018, Ulon y col 28 hallaron una prevalencia del 54% (66 sueros positivos) al evaluar serológicamente a 122 caninos de un barrio periférico de la provincia de Corrientes.

Figura 4 Electroforesis en gel de agarosa de PCR de los BC de muestras T. cruzi dudosas y positivas por serología. M: Marcador de peso molecular de 100 pb. B: blanco. N: Control negativo. P: Control positivo. Calle 1 a 10: muestras Calle 10: Muestra 14.
En el presente trabajo, por primera vez, se estableció la presencia de caninos seropositivos a T. cruzi en la reserva de Acambuco. De los 24 perros examinados, 3 resultaron positivos por ambas pruebas serológicas, lo cual significa una seroprevalencia de infección del 12,5% (3/24).
Todos los caninos fueron negativos por PCR a partir del ADN extraído de sangre entera. Sin embargo, uno de ellos, fue positivo por PCR de la muestra de ADN obtenida a partir del buffy coat. Por otra parte, ninguna de las muestras de los canes que resultaron positivos por los métodos enunciados, permitió visualizar la presencia del parásito, luego de someterlas a cultivo. Estimamos que los perros están cursando la fase crónica de la enfermedad, considerando que se obtuvo serología positiva y PCR convencional negativa. Podría mejorarse la sensibilidad de la PCR obteniendo ADN del buffy coat.
A pesar de que no podemos concluir cuál es la vía de transmisión de T. cruzi en los perros (vectorial, oral o congénita), sí se pone de manifiesto el riesgo que representan los perros positivos a infecciones para T. cruzi, ya que actúan como reservorios en los domicilios y peridomicilios.
Al igual que otros autores 17, consideramos que la presencia de estos animales implica una fuente no controlada de parásitos que podrían (re)introducir al patógeno en este lugar, donde el ciclo doméstico se supone controlado o interrumpido. Por lo tanto, los programas de control de la transmisión de T. cruzi deberían considerar la incorporación de estrategias que incluyan los perros.
Es recomendable informar a los médicos veterinarios que tomen en cuenta la enfermedad de Chagas como un diagnóstico diferencial en perros, especialmente en esta reserva protegida y continuar con estudios sistemáticos, a nivel de comunidades, para determinar si la infección se encuentra distribuida en todo el departamento y cómo es su impacto en la salud de las personas que habitan el Valle.
Para estos estudios a campo sugerimos utilizar el método HAI como screening. Las distintas prevalencias halladas en estudios a nivel nacional sugieren que hay zonas que requieren una acción sanitaria inmediata.
Al mismo tiempo, las estimaciones se basan en situaciones epidemiológicas muy heterogéneas, lo cual enfatiza la importancia de llevar a cabo estudios en profundidad en áreas restringidas y poder así, brindar información adicional que permita una mejor comprensión del estado actual de la enfermedad de Chagas en Argentina.