Introducción
Argentina es un país que presenta una enorme heterogeneidad geográfica, su extenso territorio y la variedad climática existente, permiten producir diversidad de productos agrícolas. En este contexto, existe un conflicto constante entre dos aspectos: aumentar el volumen de la producción y preservar la salud de los consumidores del posible impacto colateral que esto conlleve. El empleo desregulado de plaguicidas en Argentina afectó, de diversas maneras, a diferentes aspectos de la sociedad.
El incremento en la utilización de los agroquímicos durante los últimos diez años produjo una crisis incuestionable en el país. Específicamente, hay una correlación entre el uso de plaguicidas tóxicos y un aumento de enfermedades peligrosas en comunidades rurales y su efecto en las acciones del gobierno 7.
Los peces se utilizan ampliamente para evaluar la salud de los ecosistemas acuáticos porque los contaminantes se acumulan en la cadena alimentaria y son responsables de los efectos adversos y la muerte en los sistemas acuáticos 15.
Por otro lado, los peces desempeñan diferentes roles en la red trófica, como la bio-acumulación de contaminantes ambientales y la bio-transformación de xenobióticos a través del metabolismo oxidativo dependiente del citocromo p450; también responden a mutágenos en bajas concentraciones 19.
Se ha comprobado que la reparación del ADN es más lenta en los peces que en los mamíferos 14,39. Por lo tanto, pueden usarse como organismos centinelas para estudios de bio-monitoreo, y las posibles lesiones podrían ser detectadas mediante la utilización de biomarcadores 22.
Las prácticas agrícolas que utilizan el glifosato afectan a los organismos “no blanco”, modificando la estructura y la funcionalidad de los ecosistemas de agua dulce 11,37. Por otro lado, el glifosato Atanor(®) acelera el deterioro de la calidad del agua, especial-mente cuando
se consideran los sistemas de agua de pequeño volumen 38.

Figura 1 Fotomicrografía de frotis sanguíneos de P. lineatus, a: eritrocitos normales; b y c: micronúcleos de diferentes tamaños; d: microcito; e: notched (muescas nucleares); f: brote nuclear; g: lobed (núcleos lobulados); h: núcleo en forma de ocho; i: blebbed evaginaciones); j: vacuola nuclear, k: núcleo con puente plasmático; l: binucleado.
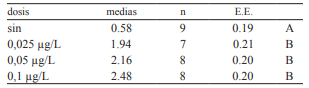
Tabla 1 Comparación de Tukey de micronúcleos y alteraciones morfológicas nucleares. Alfa = 0.05, DMS = 0.96131, Error= 0.3145, gl: 28 Medias con una letra común no son significativamente diferentes (p>0,05).
Por lo expuesto anteriormente, el objetivo del presente trabajo fue analizar la genotoxicidad del herbicida glifosato (Roundup Full II®), en células sanguíneas de ejemplares juveniles de Prochilodus lineatus a través de la determinación de la frecuencia de micronúcleos (MN) y alteraciones morfológicas nucleares.
Resultados
Se analizaron muestras provenientes de 32 animales, elaborándose dos frotis por cada uno. Se examinaron un total de 64.000 células, contándose 2.000 eritrocitos por individuo. De las 64.000 células observadas, 18.000 pertenecieron al tratamiento control y 46.000 a los grupos tratados. Se consideró la forma y estructura de los hematíes, a fin de determinar la frecuencia de micronúcleos y alteraciones morfológicas nucleares.
Las anormalidades nucleares eritrociticas detectadas en sangre periférica de P. lineatus fueron: micronúcleos, células binucleadas, lobulaciones nucleares (Lobed nuclei; blebbed nuclei), muescas nucleares (notched nuclei), vacuolas nucleares, microcitos, brotes y núcleos con puente plasmático (Figura 1).
Los datos sometidos al análisis de la varianza y comparados por el test de Tukey, mostraron que existe diferencia significativa entre los grupos control y tratado (Tabla 1). La comparación de los resultados nos permite visualizar el aumento de MN y AMN en los hematíes de los individuos que estuvieron en contacto con el herbicida en contraste con los del grupo control (Figura 2).
El análisis evidencia que la respuesta al agroquímico, expresada en el número de anomalías nucleares en los individuos tratados, es dosis dependiente. De esta manera, se aprecia como el incremento de la concentración del glifosato se relaciona con un aumento en la frecuencia de MN y AMN en los peces expuestos.
Discusión
El test de micronúcleos es una de las pruebas a corto plazo de mayor aplicación en toxicología genética, y se ha convertido en una de las más importantes implementadas por las entidades reguladoras de diferentes países para evaluar la mutagenicidad y la sensibilidad a xenobióticos 13,28.
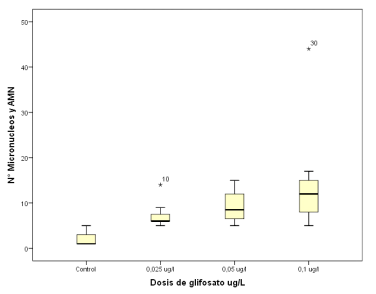
Figura 2 Box plot mostrando el número de MN y AMN en los grupos controles y tratados luego del periodo de exposición al agroquímico (Roundup ® Full II) durante siete días, exhibiendo diferencias significativas entre ambos grupos (p<0.05). Se puede observar que los grupos tratados presentan un mayor número de alteraciones, existiendo en estos una mayor variabilidad de la distribución de los datos, siendo el grupo conformado por 0,1 µg/L el de mayor dispersión.
Esta técnica está validada internacionalmente como bioensayo para evaluar genotoxicidad de sustancias, exposiciones agudas y crónicas, y es una de las más usadas para identificar agentes cancerígenos 5. Se considera que la prueba de MN es una forma efectiva de monitorear la presencia de xenobióticos en ambientes acuáticos 29.
Dada la sensibilidad de los peces a los agentes xenobióticos, en el presente trabajo los ejemplares de Prochilodus lineatus expuestos a las dosis de 0,1 ìg/l, 0,05 ìg/l y 0,025 ìg/l de glifosato (Roundup® Full II) durante siete días, mostraron en sus eritrocitos un aumento significativo en la frecuencia de micronúcleos y de alteraciones morfológicas nucleares. Similares resultados fueron observados en diferentes especies de peces expuestos al herbicida Roundup® en ensayos agudos como en crónicos, en los cuales se emplearon distintas concentraciones del agroquímico.
Asimismo, se evidenció en ejemplares de Tilapia rendalli sometidos a diferentes dosis (50 mg/L, 100 mg/L y 200 mg/L) del herbicida Roundup® durante un periodo agudo, un aumento en la frecuencia de micronúcleos y anormalidades nucleares 20.
Del mismo modo, se observó en individuos de Carassius auratus expuestos a varias concentraciones (5 ppm, 10 ppm y 15 ppm) de Roundup® en un ensayo agudo, un aumento en la frecuencia de MN y AMN en los tratados. Según los autores estos resultados son dependientes de la dosis empleada y de la duración del tratamiento 9.
Con las dosis de 58 mg/L y 116 mg/L de Roundup® durante un periodo de uno a tres días, Anguilla anguilla exhibió diversas anomalías nucleares, determinando el potencial efecto genotóxico del compuesto en estudio 21.
Experiencias realizadas en Colossoma macroporum con Roundup® empleándose dosis de 10 mg/L y 15 mg/L durante 96 h, determinaron que este compuesto podría inducir daño en el ADN en los especímenes expuestos, posiblemente por generar estrés oxidativo, que de persistir ese estímulo de manera crónica derivaría en alteraciones genotóxicas 3.
Así también, en individuos de Poecilia reticulata expuestos a Roundup® durante 24 horas y a las dosis de 1,41 ìl/L; 2,83 ìl/L; 4,24 ìl/L y 5,65 ìl/L, se observó un aumento en la frecuencia de MN y AMN, indicando que la cantidad de alteraciones estaba relacionada con las dosis utilizada 33.
Por otro lado, se identificó en especímenes de Ast-yanax sp, que estuvieron en contacto durante 72 horas a 65 ìg/L de Roundup®, una diferencia estadísticamente significativa en la frecuencia de MN entre los indivi-duos tratados con respecto a los controles 10.
Ejemplares de Piaractus mesopotamicus mostraron similares resultados a nivel sanguíneo luego de ser expuestos durante 96 horas a concentraciones sub-letales de Roundup® (2,75 mg/L). El análisis de los frotis reveló un incremento significativo de micronúcleos y alteraciones nucleares en los individuos tratados comparados con los controles 24.
Ensayos realizados con Roundup® en ejemplares de Astyanax altiparanae a concentraciones de 1,58 mg/L y 5 mg/L durante un periodo de cinco días, mostraron un aumento en la incidencia de MN y AMN en los individuos tratados con la dosis de 5 mg/L, los autores atribuyen esta respuesta a la posibilidad de que el Roundup® provoque el desencadenamiento de estrés oxidativo celular, lo cual de persistir en el tiempo, derivaría en notables lesiones citotóxicas y genotóxicas 35.
Experiencias realizadas con varios plaguicidas incluido el Roundup®, determinaron en la especie Astyanax sp el mayor potencial genotóxico de este herbicida frente a los demás agroquímicos en estudio. Los agroquímicos utilizados fueron Roundup® (glifosato) y Hexaron® (Diuron y Hexazinona).
Se realizaron varios tratamientos (Roundup® 0,006 ml/L-1 y 0,003 ml/L-1; Hexaron® 30 mg/L-1 y 15 mg/L-1, y mezcla: Roundup® 0,003 ml/L-1y Hexaron ® 30 mg/L-1) aplicando diferentes concentraciones de ambos compuestos. A través del test de MN y AMN se observó una acción genotóxica significativa en aquellos individuos sometidos al herbicida Roundup® y en los tratados con la mezcla de ambos compuestos.
Los autores postulan que esto podría ocurrir como consecuencia de un aumento de peróxidos lipídicos, los cuales alteran la integridad de las membranas celulares induciendo daño en el ADN por otros tipos de radicales de oxígeno 32.
Del mismo modo, en tratamientos crónicos efectuados en varias especies de peces (Rhamdia quelen, Astyanax bimaculatus, Ciprinus carpio) con Roundup® (1,58 mg/L y 3,16 mg/L), Folicur® (0,4 mg/L y 0,8 mg/L) y una mezcla de ambos plaguicidas (3,6 mg/L y 0,8 mg/L), se evidenció un aumento de MN y AMN en eritrocitos de los individuos expuestos al herbicida Roundup® y a la mezcla Roundup® - Folicur®; este trabajo refleja un notable sinergismo entre los compuestos cuando estos se adicionan al mismo tiempo en el agua.
Los resultados obtenidos a las dosis de exposición testeadas podrían deberse al potencial genotóxico del Roundup®, y la posible acción del mismo sobre los órganos hematopoyéticos de los teleósteos (riñón anterior y posterior). Se presume que el herbicida podría afectar la formación de eritrocitos, lo cual tendría relación directa con la manifestación de anormalidades nucleares 17.
Asimismo, la prueba de micronúcleo en especímenes de Prochilodus lineatus y Astyanax altiparanae expuestos a Roundup® durante 96 horas, no reveló daño mutagénico. La falta de diferencia significativa en los valores relativos de anormalidades nucleares en individuos tratados y controles se podría deber a las concentraciones y los tiempos testeados del agroquímico incapaces de producir alteraciones en el ADN. No obstante los autores no descartan el potencial tóxico del producto 6,12.
De igual manera, investigaciones realizadas con Roundup® en Corydoras paleatus durante tres, seis y nueve días a una concentración baja de Roundup® (0,00667 ml/L), no presentaron en los análisis hematológicos diferencia entre el grupo control y tratado, se atribuyen estos resultados a las condiciones experimentales y a la duración del ensayo 18.
Por otro lado, pruebas de laboratorio realizadas con peces, en donde se utilizó el glifosato en su forma pura, mostraron iguales resultados a los hallados en el presente trabajo (Roundup® Full II).
Además, tenemos que el análisis de los extendidos de sangre de especímenes de Ancistrus brevifilis expuestos por 96 horas a las dosis de 0,1 ppm, 3 ppm y 5 ppm de glifosato, revelaron que los animales sometidos a la dosis de 5 ppm presentaban una mayor frecuencia de MN y AMN, lo cual sería un indicativo de genotoxicidad en células sanguíneas 23.
También, se estudió durante 96 horas la acción de distintas concentraciones de glifosato (8,1 mg/L-1; 16,3 mg/L-1; 24,4 mg/L-1) en especímenes de Chana punctatus; transcurrido el periodo de exposición se determinó daño genotóxico en los individuos tratados 27, igualmente se evidenció en Danio rerio expuesto por 360 horas a 65 ìg/L de glifosato un aumento significativo en la frecuencia de MN, se sugirió que los peces tras absorber el compuesto desencadenarían como respuesta biológica la formación de MN 26.
Incluso, en líneas celulares diploides y triploides de peces se efectuaron estudios con glifosato en su forma pura. Las concentraciones usadas en los cultivos fueron de 80 mg/L, 240 mg/L, 400 mg/L, 560 mg/L, 720 mg/L, 880 mg/L, 1040 mg/L, los cuales se incubaron a 25ºC por 24 horas. La línea diploide mostró un mayor índice de MN y AMN, sin embargo, en ambas líneas, diploides y triploides se observaron también daños a nivel de la cromatina como condensación, retículo endoplasmático dañado y cuerpos apoptóticos.
Los resultados indicarían que el pesticida, en el rango de las concentraciones empleadas presentarían un potencial riesgo, ya que inhibe la proliferación celular y provoca lesiones citotóxicas y genotóxicas en líneas celulares de peces 30.
Otra formulación comercial a base de glifosato como ser el herbicida Panzer (glifosato 48%), fue empleado para determinar su posible potencial genotóxico en especímenes de Cnesterodon decemnaculatus. Estos peces estuvieron en contacto con el agroquímico por un breve lapso de tiempo (96 horas) y a diferentes concentraciones 3,9 mg/L; 7,8 mg/L y 11,8 mg/L. El análisis de los eritrocitos en los individuos tratados reveló un incremento en la tasa de MN y AMN, lo cual es un indicativo de que este herbicida presenta efectos genotóxicos 36.
Cabe mencionar que los micronúcleos aparecen en las células hijas, como resultado de daños inducidos en las células parentales. Los fragmentos cromosómicos que resultan de quiebras, pueden no ser incorporados en el núcleo principal de las células hijas después de la mitosis. Una membrana nuclear se formará alrededor del fragmento, el cual será visible como un pequeño (micro) núcleo separado del núcleo principal de la célula.
Los MN pueden, también, formarse a partir de un cromosoma entero cuando ocurre daño en el aparato mitótico de la célula, o en el propio cromosoma. En esta situación, el MN va a contener el centrómero del cromosoma, el cual puede ser detectado utilizándose sondas específicas 31.
En cuanto a las anormalidades morfológicas nucleares, se proponen que estas anomalías son rezagos anafásicos o fragmentaciones de puentes anafásicos que durante la telofase adquieren una envoltura nuclear independiente al núcleo principal 25. Sin embargo, otros estudios plantean un modelo donde la formación de las AMN ocurriría durante la interfase de la mitosis.
Estos autores realizaron estudios, empleando células COLO 320 DM de carcinoma colo-rectal en humanos, en el cual se amplificaron los dobles diminutos que no se integran al núcleo o a ningún cromosoma durante la mitosis, los cuales posteriormente son captados por la proteína nuclear en la fase S, todo esto acontecería durante la reconstitución de la envoltura del núcleo 34.
De esta forma, se observó que cuando la lámina B (capa interna nuclear) se reconstruye, da lugar a la aparición de brotes o prolongaciones nucleares, las cuales poseen un material genético que se replica y puede ser expulsado hacia el citoplasma con la forma de MN. Las AMN estarían compuestas por fragmentos cromosómicos acéntricos, muchos de ellos intersticiales, los cuales son difíciles de hallar en MN 16.
Por lo expuesto anteriormente, se podría inferir que las modificaciones en la morfología del núcleo se deberían a problemas que afectan la membrana nuclear interna, y los defectos en la misma podrían traer aparejado complicaciones o problemas en la mitosis o meiosis 1.
Estudios realizados mostraron que las alteraciones morfológicas nucleares son originadas por contacto con compuestos genotóxicos, dichas anomalías se detectaron inclusive en situaciones donde los micronúcleos no fueron inducidos 2. Diversos autores asocian la presencia de núcleos blebbed con efectos clastogénicos 4 y la aparición de células binucleadas sería un indicador de citotoxicidad 8.
Por lo tanto, las anormalidades morfológicas nucleares son hallazgos cuya importancia sería análoga a la de los micronúcleos, y tiene gran relevancia como herramienta en el monitoreo ambiental.
Conclusión
Los datos obtenidos en este trabajo nos permiten determinar la capacidad del glifosato de inducir a lesiones del material genético observables en eritrocitos periféricos, demostrando su potencial genotóxico y citotóxico.
La frecuencia de aparición de las lesiones evaluadas están intrínsecamente ligadas a la concentración de glifosato empleada.
De tal manera, que al aumentar la concentración del herbicida, el número de anormalidades también se eleva, determinando de esta manera la capacidad contaminante del glifosato y su potencial efecto deletéreo sobre el medio ambiente.














