Introducción
La babesiosis bovina es una enfermedad anemizante, causada por protozoarios del género Babesia, orden Piroplasmida, phylum Apicomplexa. De las especies que afectan al ganado bovino, B. bovis y B. bigemina son las de mayor importancia a nivel mundial por perjudicar severamente la rentabilidad de las empresas rurales.
Esta hemoparasitosis es transmitida por la garrapata común del bovino, Rhipicephalus microplus, ampliamente distribuida en las zonas tropicales y subtropicales del mundo 3 . Debido a su patogenicidad y extensión, las enfermedades hemotrópicas y sus vectores, se consideran uno de los principales factores limitantes para el desarrollo genético y zootécnico de los sistemas de producción bovina 1 .
El método inmuno-profiláctico aplicando un inmunógeno a base de microorganismos vivos atenuados, representa una herramienta importante utilizada en nuestro país. La vacunación con estos inmunógenos se encuentra indicada en animales de entre 4 a 10 meses de edad, ya que su aplicación en bovinos adultos o inmuno suprimidos podría producir la enfermedad en los animales inoculados, y en casos graves, la muerte de los mismos 14 .
Si bien, resultados no publicados del equipo de trabajo demuestran la ausencia de efectos no deseados de la vacuna ultracongelada, según organismos internacionales, las vacunas a partir de microorganismos vivos no se consideran completamente seguras 21 .
Como características generales, pese a ser efectivas, presentan numerosas potenciales desventajas, entre ellas las severas reacciones adversas sobre pacientes bajo cierto grado de estrés, riesgo de reversión de su estado de atenuación o de transmisión de otros patógenos, un sistema de producción laborioso y la vida media corta cuando se comercializa refrigerada 5,6,16,24 .
Como ventajas, las vacunas muertas tienen mayor margen de seguridad, los animales inmuno suprimidos no enferman, no existe riesgo de diseminación, libres de patógenos residuales y poseen condiciones menos exigentes de conservación.
Sus desventajas principales consisten en riesgo de alterar el inmunógeno protector, baja inmunogenicidad, lenta respuesta inmune, protección incompleta y de corta duración, por lo cual se hace necesario incorporar al protocolo varias dosis y/o adyuvantes 20 .
En la actualidad, se encuentran disponibles dos presentaciones de la vacuna viva para la profilaxis del complejo tristeza bovina, fresca y ultracongelada, ambas presentan ciertos inconvenientes. Así, en el primer caso el tiempo, por sus características extemporáneas es el factor limitante; y en el segundo caso, si bien la durabilidad de la vacuna es de dos años desde su elaboración, el requerimiento de termos de nitrógeno líquido dificulta su traslado y manipulación 2 .
Es por esto que la obtención de una tercera presentación deshidratada, que combine estabilidad en el tiempo y practicidad en su manipulación, y que, además sea segura en categorías adultas, redundaría en cuantiosos beneficios.
Por lo expuesto, el presente estudio propone una nueva presentación de la vacuna para la inmuno-profilaxis de la babesiosis bovina, basada en eritrocitos parasitados con B. bovis y B. bigemina, deshidratados por aspersión y formulados con un adyuvante, evaluando la actividad inmunogénica y respuesta clínica, así como los posibles efectos adversos.
Material y métodos
Cultivo y mantenimiento de cepas
Eritrocitos parasitados fueron obtenidos a partir de cultivos in vitro en fase estacionaria, mantenidos en condiciones de micro aerofilia de 48 h 23 . Los cultivos se iniciaron a partir de crioviales, conteniendo las cepas vacunales de B. bovis, R1A y B. bigemina S1A, proporcionados por el Laboratorio Litoral Biológicos S.R.L. (Puerto Tirol, Chaco), preservados con PVP disuelta en solución Vega y Martínez (VYM) 29 en una atmósfera de CO2 5%, O2 5% y balance de N2 90%. Los cultivos in vitro contienen un 10% de paquete globular (PG) y medio completo (MC) formulado con 60% de Medio 199 y 40% de suero normal bovino. El cambio de medio se realizó cada 24 h, desechando el sobrenadante (SN) que contiene residuos del metabolismo de los eritrocitos y protozoarios, y reemplazándolo con MC nuevo. Cada 48 h, se realizaron subcultivos para evitar el exceso de hemoparásitos. Una vez logradas parasitemias superiores a 10% y 7% para B. bovis y B. bigemina, respectivamente, los eritrocitos fueron centrifugados a 2.500 rpm durante 10 min a 4°C, desechando el SN y colectando el PG para su deshidratación.
Deshidratación por spray-drying
El PG mantenido a 4°C fue fraccionado en alícuotas y secado por aspersión en un Mini Spray Dryer Buchi B-290 (BÜCHI Labortechnik AG) de la Facultad de Ciencias Químicas (UNC), bajo condiciones controladas, a saber: temperatura de ingreso: 45°C, aspiración: 75%, bomba: 5%, nozzle cleaner: 2, rotámetro: 50 mmHg. Finalizada la deshidratación, el material se mantuvo a 4°C hasta su uso.
Ensamblado de adyuvante
La puesta a punto del proceso de ensamblado entre el adyuvante y el antígeno, se realizó en la cátedra de Farmacología y Toxicología, FCV-UNNE. Las muestras fueron preparadas mediante la incorporación de los componentes en tubos herméticamente cerrados, para lo cual se inició pesando el PG deshidratado parasitado con B. bovis y B. bigemina separadamente, en una cantidad equivalente a 1 x 10 8 eritrocitos parasitados. El adyuvante, palmitato de ascorbilo (ASC16), también fue pesado e incorporado al 2%, junto con el diluyente, dextrosa al 5%. Las suspensiones, así constituidas, fueron homogeneizadas en vórtex y luego calentadas a 80°C en un baño maría, hasta alcanzar la temperatura micelar crítica (TMC) y nuevamente homogeneizadas 25 . Finalmente, se las dejó en reposo hasta tomar temperatura ambiente, momento en el cual se produce el ensamblado del adyuvante incorporando el antígeno, formando así un gel. El mismo procedimiento fue aplicado a tubos sin eritrocitos parasitados, los cuales constituyeron el grupo control, conteniendo sólo adyuvante.
Inoculación
Se utilizaron n=12 terneros mestizos de Bradford, de entre 8 y 10 meses de edad, con serología negativa para anaplasmosis y babesiosis, provenientes de un establecimiento libre de garrapatas, “Estancia San Lorenzo”, localidad de Felipe Yofre, ubicado en Mercedes, Corrientes, Argentina. Los animales fueron distribuidos aleatoriamente en grupos de la siguiente manera: Grupo Control (GC): n=3 terneros sin inocular. Grupo Tratado 1 (GT1): n=3 terneros inoculados con ASC16. Grupo Tratado 2 (GT2): n=3 terneros inoculados con PG parasitados con B. bovis + ASC16. Grupo Tratado 3 (GT3): n=3 terneros inoculados con PG parasitados con B. bigemina + ASC16. Las inoculaciones se realizaron vía subcutánea (SC), con un intervalo de 15 días.
Control clínico
A partir de su estado de salud, se realizaron controles en busca de reacciones locales en el sitio de inoculación, medición de temperatura rectal (diariamente hasta el día 21, luego cada 7 días), determinación de hematocrito y parasitemia semanalmente. la segunda inoculación, los terneros fueron inspeccionados diariamente para evaluar.
Control de respuesta inmunogénica
Se tomaron muestras de sangre a los 30 y 60 días post-inoculación para titulación de anticuerpos por ELISA indirecto. Estas muestras fueron procesadas por la Estación Experimental de INTA - Rafaela.
Análisis estadístico
El análisis de los datos se realizó utilizando el programa Infostat/profesional versión 2006. Los cálculos de la estadística descriptiva determinaron media y desvío estándar de los datos evaluados, así como también, el análisis de la varianza (ANOVA) y la comparación de las medias por el test de Tukey utilizando un p<0,05.
Resultados y discusión
En el presente trabajo se logró la reactivación de cepas vacunales de B. bovis y B. bigemina en cultivos in vitro, así como su deshidratación por aspersión. Existen antecedentes de secado por esta técnica donde los eritrocitos no solo mantienen su viabilidad, sino que también logran ser funcionales en un nuevo hospedador 4 .
En un reporte anterior del equipo de trabajo, se discute el efecto de temperatura, adición de adyuvantes de secado y diferentes métodos de deshidratación que podrían explicar estos resultados 9 . Estos trabajos, son alentadores para continuar perfeccionando la técnica propuesta, en la búsqueda de un protocolo que permita la utilización de los merozoitos en forma deshidratada.
Por otro lado, en el presente trabajo se logró la formulación del inmunógeno, a partir de la incorporación del PG deshidratado al adyuvante, evidenciándose la formación de un gel homogéneo, de consistencia semisólida, firme y de una coloración marrón clara. La característica de viscosidad de la formulación permitió una adecuada aplicación por vía SC.
El adyuvante usado en el presente estudio, desarrollado por investigadores de la Facultad de Ciencias Químicas de la Universidad Nacional de Córdoba (FCQ-UNC), fue formulado para uso en humanos. El mismo, proporciona una liberación sostenida en el tiempo del antígeno in vivo e induce respuesta inflamatoria local per se, ofreciendo varias ventajas como bio-material: a) sus componentes son biodegradables; b) conserva sus propiedades antioxidantes; c) dispone de una estructura apropiada para transportar moléculas hidrofóbicas e hidrofílicas; d) es bien tolerado; e) es fácil de producir a gran escala y de bajo costo.
Esta estrategia adyuvante ha sido evaluada con buenos resultados en ratones de experimentación utilizando un antígeno proteico 25 , y hasta el presente estudio, no se habían realizado pruebas en otros animales. El ASC16 en la actualidad es utilizado sólo o en combinación con alfa-tocoferoles como estabilizantes para aceites en formulaciones farmacéuticas orales y productos alimenticios. También es utilizado como antioxidante en formulaciones con compuestos sensibles al oxígeno para administración oral y tópica 28 .
A partir del seguimiento diario de los terneros, se observó ausencia de reacciones tisulares locales en todos los grupos, sin presencia de inflamación, enrojecimiento, aumento de temperatura local o abscesos. Esto se contrasta con lo descripto por otros autores, quienes obtuvieron respuestas inflamatorias locales al usar el mismo adyuvante en ratones 25 así como al utilizar adyuvantes a base de aceite como el Adyuvante Completo de Freund (FCA) en bovinos 26 .
Durante el seguimiento de los grupos experimentales, todos los animales se mantuvieron en el rango considerado fisiológico para la especie, comprendido entre 38 a 39,5°C 27 (Figura 1), no encontrándose diferencia estadísticamente significativa entre los grupos analizados. Estos resultados coinciden con los expuestos por autores que obtuvieron medias de 38,9ºC ± 0,3 en bovinos vacunados con una vacuna muerta a base de exo-antígenos de B. bovis más saponina como adyuvante 13 .
Los resultados obtenidos por la técnica de microhematocrito evidenciaron la ausencia de anemia, manteniéndose durante todo el ensayo en el rango considerado fisiológico, comprendido entre 24% y 46% 27 (Figura 2).
El Test de Tukey realizado para esta variable comparando los días 0 y 60 post segunda inoculación, aplicando un p<0,05, evidenció que los Grupos Tratados 1 y 2 presentaron diferencias estadísticamente significativas en sus medias, arrojando valores de 34,73 ± 0,27 y de 31,50 ± 0,27 en cada caso, en contraste con las medias del Grupo Control y Grupo Tratado 4 quienes presentaron valores de 32,57 ± 0,27 y 32,97 ± 0,27, respectivamente.
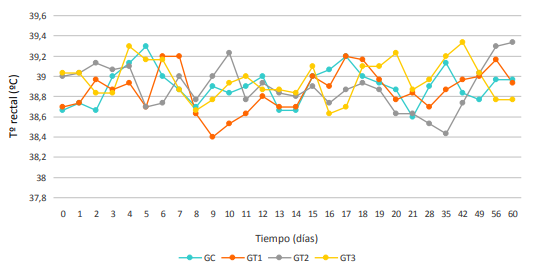
Figura 1 Media aritmética de la variable temperatura corporal, en los diferentes tiempos de muestreo, para cada grupo.
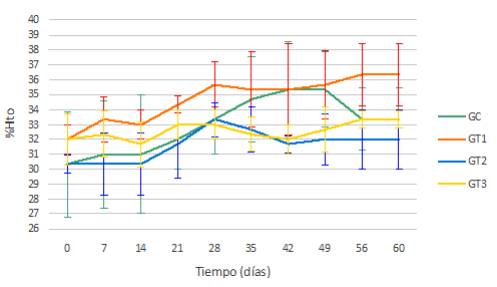
Figura 2 Media y desvío estándar para la variable % Hto, en los diferentes tiempos de muestreo, para cada grupo.
Esto no tiene una importancia clínica, debido a que el rango fisiológico de este parámetro es muy amplio y la variación registrada se mantuvo comprendida dentro del mismo.
En los frotis sanguíneos (extendido fino y gota gruesa) teñidos con Giemsa y observados al microscopio óptico no se pudo evidenciar la presencia de los hemoparásitos en estudio. Esto podría deberse a que el hemoparásito no sería viable para su replicación en el hospedador en su condición de re-hidratado.
Numerosos autores reportaron que, al utilizarse vacunas muertas o SN con exo-antígenos, las mismas no producen reacciones en el organismo, como fiebre, disminución del hematocrito o parasitemia, resultados que coinciden con los obtenidos en este trabajo 10,13,17,18,22.
La actividad inmunogénica, evaluada por técnicas de ELISA, evidenció a los 30 días post inoculación, la ausencia de titulación de anticuerpos frente a Babesia sp para todos los grupos. Sin embargo, al día 60, el 33% de los animales del GT3, presentó anticuerpos frente a B. bigemina, parásito contra el que fue inmunizado, manteniéndose los demás grupos negativos.
Si bien existe un porcentaje de positividad, estos resultados no coinciden completamente con reportes previos, donde al utilizar vacunas con exo-antígenos más Quil A saponina como adyuvante, obtuvieron una respuesta inmunitaria de tipo humoral a partir del día 21, detectada por ensayos de inmuno-fluorescencia indirecta (IFI) en todos los bovinos vacunados 10,13,17,18,22 y obteniendo una respuesta protectora frente al desafío realizado entre los 30 y 60 días post segunda dosis vacunal, con una cepa patógena 13,17,18,22.
El enzimo-inmuno análisis (ELISA) es la prueba de diagnóstico de elección para Babesia sp, debido a la objetividad en la interpretación de los resultados y a la capacidad de procesar grandes cantidades de muestra por día 11,15,21 . Sin embargo, el uso de títulos de anticuerpos como indicador directo de protección puede no ser apropiado 10 .
La respuesta de anticuerpos evaluada por la IFI y por la actividad de inhibición del crecimiento in vitro mostró que la sero-conversión se correlaciona con la actividad de neutralización in vitro, pero no con la inmunidad protectora in vivo 14 . En el presente estudio, no se realizó el desafío de los animales inoculados, lo cual podría haber arrojado mayor información sobre la respuesta al inmunógeno propuesto.
Ensayos evaluando diferentes coadyuvantes evidenciaron que con los antígenos de B. bovisy B. divergens, el FCA no es tan efectivo como la saponina 26 . De manera similar, el uso de un adyuvante a base de vitamina E no es efectivo con respecto a la inducción de inmunidad protectora por B. canis en caninos 12 .
Aunque ha habido pocos informes sobre el uso de otros adyuvantes, se demostró que el uso de Quil A saponina brinda una buena protección para tres especies diferentes de Babesia en bovinos. Usando ADN recombinante fusionada a proteínas de B. bovis se encontró que la Quil A saponina inducía niveles más fuertes de protección que el FCA o la saponina de grado comercial 26 .
Si bien aún no se cuenta con una presentación inmuno-profiláctica a base de microorganismos muertos para la babesiosis bovina, para la babesiosis canina existe una vacuna deshidratada, a base de SN de B. canis y B. rossi, que utiliza saponina como coadyuvante, Eurican® PIRO, la cual provee una inmunidad de 6 meses de duración 12 .
En el presente trabajo, sólo uno de seis terneros inoculados con hemoparásitos deshidratados demostró titulación de anticuerpos bajo la técnica de ELISA. Hasta el momento, a nivel mundial, no se ha logrado la puesta a punto de una vacuna muerta eficaz para la profilaxis de la babesiosis bovina.
Se ha preparado una vacuna muerta contra B. divergens a partir de la sangre de terneros infectados 30, pero se dispone de poca información sobre el nivel y la duración de la inmunidad que confiere. Existen antecedentes de otras vacunas experimentales conteniendo antígenos de Babesia sp y Anaplasma sp producidas in vitro 19 , pero no está claro cuál es el grado y la duración de la protección contra cepas heterólogas de desafío.
A pesar de la caracterización de distintas proteínas del parásito y del genoma de B. bovis 7 , así como de los considerables esfuerzos realizados a nivel internacional para lograr la identificación de antígenos candidatos a formar parte de la vacuna, las posibilidades de conseguir vacunas recombinantes contra Babesia spp siguen siendo escasas y hasta ahora no se ha comercializado ninguna vacuna de subunidades eficaz 8 .
En el presente estudio, de los seis individuos inmunizados (GT2 y GT3) solo un animal presentó anticuerpos específicos contra el hemoparásito inoculado. Si bien el porcentaje es bajo, no es del todo desalentador ya que, si un animal pudo reaccionar a la vacuna presentando títulos de anticuerpos específicos, se demuestra la presencia del poder antigénico de la misma.
Debemos tener en cuenta que esta alternativa inmuno-profiláctica es totalmente nueva, pero promisoria, y que por el momento se encuentra en las primeras fases de su investigación y experimentación en bovinos. Ensayos posteriores se realizarán para ajustarla dosis y someterlos a desafío con cepa patógena.














