Introducción
La medición de gases arteriales en el contexto clínico no solamente aporta datos del equilibrio ácido base en el paciente canino, también es posible establecer la presencia de disturbios en la fisiología respiratoria relacionados con la oxigenación y ventilación alveolar (Bach 2008, Irfan 2019). Estas alteraciones conllevan a un aumento en la morbilidad y mortalidad en escenarios clínicos (Rozanski 2015); así es que, aprovechando la disponibilidad actual de los recursos diagnósticos para el abordaje de los pacientes con hipoxemia (cómo los analizadores portátiles de gases sanguíneos), la interpretación de los gases arteriales debe ser de conocimiento general para el clínico de atención primaria en hospitales veterinarios (Haskins 2004, Bateman 2008). Esta revisión pretende ofrecer información relevante para la interpretación de gases arteriales en patologías respiratorias de caninos, de tal modo que sea de utilidad para su aplicación en la práctica diaria y contribuya al abordaje diagnóstico y monitoreo del animal hospitalizado con distrés respiratorio.
Fisiología de la función respiratoria. Los pulmones permiten el intercambio de gases de oxígeno (O2) y dióxido de carbono (CO2) entre la sangre y el aire atmosférico. El transporte de gases es esencial para el metabolismo celular y la sustentabilidad de los tejidos (Reminga y King 2016). Esta función biológica se cumple desde la ventilación, el intercambio de gases, el transporte y entrega eficiente de O2 hacia los tejidos y continúa con el metabolismo y eliminación de CO2. Así, la ventilación y la oxigenación son procesos distintos pero interdependientes para sostener la respiración (Reminga y King 2016).
Bajo el control de los centros respiratorios del tallo cerebral, la respiración espontánea usa energía para generar fuerza mecánica a través del diafragma y músculos intercostales responsables de la expansión pulmonar. Dicha expansión de la cavidad torácica crea un gradiente transpulmonar de presión negativa que conduce el aire atmosférico hacia los pulmones, consumando la inhalación que facilita la ventilación alveolar. Posteriormente, el ciclo respiratorio se completa una vez el músculo esquelético de la pared torácica se relaja y el aire es exhalado por un proceso pasivo, dadas las propiedades elásticas intrínsecas del pulmón en reposo y sano (Proulx 1999, Reminga y King 2016).
En condiciones normales, existe un desacople fisiológico entre la ventilación alveolar (V) y la perfusión capilar (Q) en el campo pulmonar. Esta diferencia ocurre por la distribución inequitativa de aire a través del parénquima y la perfusión no homogénea a través de todo el pulmón (Robinson 2012b, Reminga y King 2016, Irfan 2019). No obstante, dicho desacople fisiológico no impide la correcta ventilación y oxigenación totales. A la suma de estas unidades alveolares que no participan eficientemente en el intercambio gaseoso (porque están más perfundidas que ventiladas o más ventiladas que perfundidas) se les conoce como espacio muerto fisiológico. El espacio muerto anatómico corresponde a vías de conducción sin intercambio gaseoso, como las vías áreas altas, tráquea, bronquios principales, etc. (Proulx 1999). En condiciones de reposo los lóbulos pulmonares caudo-dorsales (en cuadrúpedos) suelen estar mejor perfundidos; en ejercicio, la distribución se modifica beneficiando la perfusión de las regiones dorsales totales de ambos hemitórax (Robinson 2012c). Por otro lado, las regiones pulmonares más ventiladas pueden cambiar en función de la frecuencia respiratoria, termorregulación y ejercicio del animal. En términos generales, en caninos se reconoce que la fracción de cada respiración que ventila el espacio muerto (anatómico y fisiológico) es aproximadamente el 33% (Robinson 2012c). Una descripción más detallada de este proceso fisiológico de intercambio de gases puede revisarse en Petersson y Glenny (2014).
En el contexto clínico, la función respiratoria puede ser evaluada a través de la interpretación de los gases arteriales del paciente; específicamente, evaluando la presión arterial de oxígeno (PaO2) y la presión arterial de dióxido de carbono (PaCO2), pues éstos son indicadores de la oxigenación y ventilación eficientes (Waddell 2013a). Para obtener estas variables, es necesaria una muestra de sangre arterial del paciente. Los accesos más comunes son las arterias femoral, safena, podal dorsal, auricular, lingual, braquial, radial o coxígea (Proulx 1999, Haskins 2004, Balakrishnan y Tong 2020). Ilkiw et al. (1991) concluyen que las muestras de sangre venosa periférica no son un sustituto de las muestras de sangre arterial cuando se debe evaluar la función respiratoria, aun cuando puedan ser equivalentes los valores del pH, PCO2 y bicarbonato (HCO3) en ciertas circunstancias (Ilkiw et al. 1991). Así también, DiBartola (2012) establece que la diferencia normal de pH arterio-venosa en perros está por encima de 0,04 (DiBartola 2012) mientras que Dalmau y Díaz (2008), reportan valores promedio de pH, HCO3 y PCO2 en sangre venosa de caninos sanos que no distan significativamente de los arteriales y que pueden ser tenidos en cuenta parcialmente para el análisis (Dalmau y Díaz 2008). No obstante, se debe tener presente que la diferencia arteriovenosa de PCO2 puede variar en función de mecanismos de hipercapnia instaurados patológicamente (Kadwa et al. 2022). Por esto, es mandatorio que una muestra de sangre arterial pueda obtenerse en el paciente con signos clínicos de enfermedad respiratoria, pues la PaO2 y la PvO2 (Presión venosa de O2) no son equiparables (Day 2002). Por otro lado, para el análisis de la perfusión general y el estatus ácido- base, es ideal obtener una muestra de sangre mixta venosa (arterial pulmonar, en su defecto, yugular) (Day 2002, Haskins et al. 2005). Estos hallazgos, han sido consistentes con estudios recientes en caninos que corroboran una equivalencia clínica del pH venenoso para la evaluación de disturbios ácido-base, mas no para la evaluación de la oxigenación y ventilación pulmonar, e incluso demuestran que la interpretación de PvCO2 puede no ser equivalente a la PaCO2 en contextos de hipoperfusión, y dependen de la extracción y reserva tisular de O2 o el grado de shunt capilar (Kadwa et al. 2022).
De forma complementaria, el efecto Bohr/Haldane es de importancia para establecer la forma y posición de la curva de equilibrio de O2 que regula la disponibilidad de éste hacia los tejidos (Malte et al. 2021). Los factores que desplazan la curva de disociación de hemoglobina hacia la derecha (como el pH más bajo, temperatura más alta, aumento de PCO2, aumento del 2,3- difosfoglicerato) están directamente relacionados con las condiciones dadas por el metabolismo de los tejidos, en consecuencia, habrá menor afinidad de la hemoglobina por el O2, lo cual facilita la difusión del O2 hacia los tejidos (Collins et al. 2015, Malte et al. 2021). Lo contrario se da durante el paso de la sangre por los capilares pulmonares, cuando la elevada PAO2 (presión alveolar de O2) aumenta la afinidad de la hemoglobina por el O2, desplazando la curva hacia la izquierda y contribuyendo a la fijación del oxígeno por la hemoglobina (Collins et al. 2015, Malte et al. 2021).
El efecto Haldane ocurre en capilares pulmonares donde la elevada concentración de O2 provoca que se reduzca la afinidad de la hemoglobina por el CO2, desplazando la curva hacia la izquierda, así la sangre no oxigenada que llega al sistema respiratorio capta O2 y cede el CO2. Por su parte, el efecto Bohr que ocurre en los tejidos, favorece la liberación de O2 por parte de la hemoglobina. Como se mencionó, este efecto es influenciado por los protones (H+) liberados por la disociación del ácido carbónico y por la formación de compuestos carbaminos o carbamatos (Jensen 2004, Malte et al. 2021).
PaCO2 y ventilación. La ventilación alveolar hace referencia al recorrido del aire atmosférico entrando y saliendo de los pulmones con el propósito principal de remover el CO2 del tracto respiratorio mientras ingresa O2 al mismo. La ventilación eficiente resulta del balance entre la producción y la eliminación de CO2 y por tanto depende del estado catabólico o anabólico del animal; un rango aceptado de PaCO2 a nivel del mar en caninos puede oscilar entre 32 y 43 mmHg (Rieser 2013). Mientras ocurra hipoventilación, la PaCO2 se acumulará (hipercapnia, PaCO2 > 43 mmHg) y en tanto que exista hiperventilación, la PaCO2 se reducirá (hipocapnia, PaCO2 < 32 mmHg) (Haskins 2004); así, es correcto asumir que la PaCO2 puede modificar el patrón respiratorio y por ende la ventilación alveolar (Haskins 2004). Si el movimiento de aire a través de los pulmones alcanza un nivel significativamente deficiente (PaCO2 > 60 mmHg), además la PaO2 se reducirá en sangre generando hipoxemia (Haskins 1989; Irfan 2019).
En circunstancias fisiológicas, la PvCO2 es 4-6 mmHg mayor que la PaCO2 dado que el lecho venoso recibe directamente el CO2 producido por los tejidos (Haskins et al. 2005); de ahí, se deduce que el PvCO2 sea útil también para evaluar la función ventilatoria (Waddell 2013a, Gonzalez y Waddell 2016). No obstante, en contextos clínicos como anemia severa, hipoperfusión, congestión pasiva periférica o hiperventilación por compensación a hipercapnia crónica, la diferencia entre PvCO2 y PaCO2 aumenta, reflejando una habilidad menor de la hemoglobina para transportar el CO2 y no necesariamente la ventilación reducida (Haskins 2004, Hopper y Powell 2013, Hopper 2017).
Ahora bien, tanto la hipercapnia como la hipoxia pueden ser estimuladores de la tasa ventilatoria. En la hipercapnia, el CO2 acumulado en la sangre cruza la barrera hematoencefálica con facilidad alterando el pH intersticial cerebral, lo cual activa quimiorreceptores del centro respiratorio en la medula oblonga (Núcleo retrotrapezoide) modificando la tasa ventilatoria; incluso pequeñas alteraciones del PaCO2 pueden variar la ventilación/ minuto, por eso, la PaCO2 es el principal conductor de la ventilación (Wall 2001, Robinson 2012a, Rieser 2013). Además, dado que el CO2 es aproximadamente 20 veces más soluble que el O2, es más fácil para el paciente mantener el CO2 normal en presencia de una enfermedad pulmonar (Waddell 2013a, Balakrishnan y Tong 2020). No obstante, una PaCO2 mayor a 60 mmHg se relaciona con acidosis respiratoria severa y una PaCO2 menor a 20 mmHg se asocia con alcalosis respiratoria severa que deteriora la oxigenación cerebral por vasoconstricción y reducción del flujo sanguíneo (Haskins 1989, 2004). En la hipoxia, la tasa ventilatoria se modifica de forma no linear, pues el estímulo de la ventilación es escaso en la hipoxemia leve (>70 mmHg), mientras que la hipoxemia moderada (60-70 mmHg) a severa (< 60 mmHg) son detonantes fuertes para incrementar la ventilación; ésta activación es mediada por las células glómicas tipo I del cuerpo carotideo, que al despolarizarse por la reducción en la PaO2 envían una señal aferente simpática al centro respiratorio para modificar la tasa ventilatoria eficientemente (Robinson 2012a). Así también, es importante entender que la ventilación se requiere para llevar a cabo la oxigenación, por tanto, la hipoventilación severa y sostenida resulta en una reducción de la PAO2 y por ende la PaO2 (Sarkar et al. 2017).
Por otra parte, la PaCO2 es proporcional a la producción metabólica de CO2 (VCO2) e inversamente proporcional a la ventilación alveolar (VA); esta relación se expresa como PaCO2 = (VCO2/VA) (Day 2002, Hopper 2017). De ahí se entiende que una elevación en la PaCO2 ocurre por mayor producción de CO2 o por reducción en la VA secuela de un evento sistémico o extrapulmonar (Wall 2001). A su vez, la VA depende del volumen/minuto (o ventilación/minuto), es decir, el volumen de aire que recorre los pulmones cada minuto expresado en frecuencia respiratoria (FR) multiplicado por volumen tidal (VT) (Robinson 2012a). Entonces, el incremento de la PaCO2 es resultado de mecanismos de hipoventilación (Bateman 2008), mientras que la reducción de la PaCO2 es producto del aumento en la ventilación, especialmente si el volumen tidal se eleva aumentando la profundidad respiratoria, pues se ventilan áreas eficientes de intercambio y, en menor grado, si la frecuencia respiratoria sube, dado que la ventilación en ese caso se incrementa mayormente en el espacio muerto anatómico (Proulx 1999). Lo anterior, de forma práctica se comprende al observar la relación entre las ecuaciones (Dalmau et al. 2014):
Ventilación/minuto = volumen tidal (VT) x frecuencia respiratoria (FR)
VT x FR = (volumen alveolar x FR) + (volumen del espacio muerto anatómico x FR)
De ahí, también se comprende que cualquier patología que aumente el volumen del espacio muerto anatómico o disminuya el volumen alveolar, reducirá el intercambio gaseoso (porque reduce el volumen tidal, y por ende la ventilación/minuto), y según la severidad y tiempo de evolución, producirá hipercapnia con probable acidosis respiratoria (Dalmau et al. 2014); el efecto opuesto, con hipocapnia y la subsecuente alcalosis respiratoria, ocurrirá en caso de que se reduzca el volumen del espacio muerto anatómico o se aumente el volumen alveolar (Dalmau et al. 2014). Aun así, una lesión de la membrana alveolo capilar que limite la difusión de gases por el desacople entre la ventilación y perfusión en patologías respiratorias severas, puede ser un mecanismo que produzca hipercapnia pese al incremento leve en la frecuencia respiratoria o el volumen tidal compensatorios; no obstante también habrá hipoxemia a causa de la patología primaria pulmonar (Bateman 2008) y la hipercapnia será consecuencia y no causa de la falla respiratoria (Falla respiratoria tipo 1 con hipoxia tardía; Tabla 3). Otra excepción importante son los eventos fisiológicos que modifican la ventilación alveolar, como el ejercicio y la polipnea térmica (termorregulación) (Dalmau et al. 2014).
Adicionalmente, la eliminación de CO2 depende de la cantidad del gas entregado al alveolo (ventilación alveolar) y de la cantidad de espacio muerto fisiológico; esta relación puede expresarse en función de la ecuación VE = VDS + VA, donde VE es el volumen de aire espirado en un minuto, VDS, la cantidad de aire contenida en alveolos sin intercambio gaseoso y VA representando el aire contenido en áreas de intercambio eficiente, es decir, la ventilación alveolar (Proulx 1999). Este cálculo no es usualmente obtenido en contextos clínicos, pero se espera que sea menor a medida que mecanismos de hipoventilación (con la subsecuente hipercapnia) se activen en el paciente y viceversa.
En esta línea de ideas, la hipocapnia representa un incremento del volumen/minuto removiendo eficientemente el CO2 del lecho capilar pulmonar, por tanto, se podría interpretar como un indicador de función pulmonar adecuada y que el mecanismo subyacente a la anormalidad tiene su origen fuera del sistema de intercambio gaseoso pulmonar (Tabla 1) (Bateman 2008). No obstante, en contadas ocasiones no es esta la interpretación, pues la hipoxemia severa (aguda) o el tromboembolismo pulmonar, pueden ser causas de hipocapnia compensatoria cuyo mecanismo de enfermedad primario podría alojarse en el parénquima pulmonar.
Por otro lado, la falla ventilatoria se caracteriza por la PaCO2 cercana a 60-70 mmHg (hipercapnia) con acidosis respiratoria en detrimento del esfuerzo respiratorio del paciente; ésta puede desencadenarse por un estímulo inadecuado de la ventilación (hernias discales cervicales, defectos de pared torácica, etc.) o una enfermedad severa del parénquima pulmonar que limite el volumen tidal, reduciendo la compliancia pulmonar (Rozanski 2015) (Tabla 1).
Conviene además recordar que la hipoventilación no induce hipoxemia significativa en un pulmón sano, no así en un pulmón patológico, donde la hipoxemia puede ser severa subsecuente a la hipercapnia (Sarkar et al. 2017); una característica de la hipoxemia inducida por hipoventilación es que es fácilmente responsiva a la terapia con oxígeno.
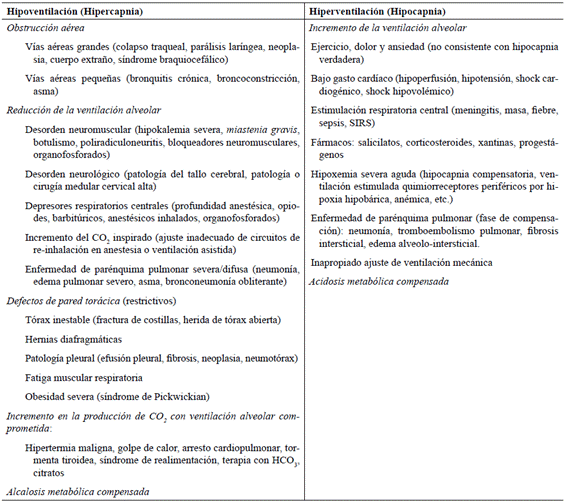
Adaptado de (Haskins (2004), Johnson (2008a, 2008b), Rieser (2013), Waddell (2013b) y Hopper (2017).
Tabla 1. Causas descritas de alteración en la PaCO2 en caninos señalando hipoventilación (elevación de PaCO2, hipercapnia) e hiperventilación (reducción de la PaCO2, hipocapnia).
PaO2 y oxigenación. La oxigenación se refiere al proceso de difusión de oxígeno desde el alvéolo hacia el capilar (Bateman 2008) y puede valorarse a través la PaO2 obtenida desde una muestra arterial. La PvO2 no es útil para deducir la función pulmonar de oxigenación adecuada en un paciente (Haskins 2004); las mediciones seriadas de PvO2 sirven para inferir la habilidad de los tejidos para extraer el O2, mas no para evaluar la oxigenación (Balakrishnan y Tong 2020). A nivel del mar, un valor aceptable de PaO2 oscila entre 80 y 110 mmHg para los caninos, y a groso modo, un valor menor a 80 mmHg se considera hipoxemia leve, una PaO2 entre 80 y 60 mmHg hipoxemia moderada y un valor inferior a 60 mmHg es catalogada como hipoxemia severa que requerirá ventilación asistida (Haskins 2004, Bach 2008, Balakrishnan y Tong 2020); No obstante, el efecto de la presión barométrica a moderada y alta altitud sobre el nivel del mar, modifica los rangos esperados para caninos aclimatados y así también los valores críticos para identificar hipoxemia.
La presión inspirada de O2 (PiO2) a nivel del mar es cercana a 150 mmHg, mientras que la presión alveolar de O2 (PAO2) es cercana a 100 mmHg; esencialmente este descenso ocurre porque a medida que el aire es inhalado, la tensión de O2 se reduce por el efecto del vapor de agua presente en las vías aéreas para humidificar el aire ingresando (presión de vapor de agua aproximada: 47 mmHg) (Robinson 2012c). Así, la PAO2 aproximada del paciente se obtiene a partir de la ecuación de gas alveolar: ((PB - PH20) FiO2) - (PaCO2/RQ), donde PB representa la presión barométrica, PH2O la presión de vapor de agua en las vías aéreas, FiO2 la fracción de oxígeno inspirada y RQ el cociente respiratorio (Proulx 1999, Day 2002, Miller 2007, Balakrishnan y Tong 2020). El RQ (radio de CO2 producido y O2 consumido) es un factor constante que compensa la composición de la dieta y el metabolismo de los nutrientes; así, el valor promedio frecuentemente aplicado para carnívoros es 0,8 (Bach 2008). Esta ecuación es útil en contextos clínicos para estimar el mecanismo probable de hipoxia. Una vez la PAO2 alcanza su valor máximo dentro del alveolo, se crea un gradiente que dirige el O2 hacia el lecho capilar, pues la presión de O2 de la sangre que retorna al pulmón es cercana a 40 mmHg. El movimiento de O2 desde el alveolo, cruzando la membrana basal alveolar y alcanzando el lecho capilar, es conocido como difusión. Estando en el capilar, el O2 se combina con hemoglobina hasta saturarle mientras el gradiente de O2 entre el alvéolo y el capilar se equilibra (Rieser 2013). Este mecanismo denota la importancia de una cantidad de hemoglobina suficiente y funcional para la oxigenación de tejidos (Manning 2002) y es influenciado por la curva de disociación de hemoglobina como se explicó previamente (efecto Haldane).
La hipoxemia, puede estimular los quimiorreceptores centrales e influenciar el patrón respiratorio cuando PaO2 es menor a 60 mmHg a nivel del mar. Además, los quimiorreceptores en los cuerpos carotideos, ubicados cerca de la bifurcación de la carótida, son sensibles a la caída de O2 arterial y activan los mecanismos centrales que estimulan la ventilación. El control voluntario de la respiración por influjo cortical y estimulación local de receptores J pulmonares, también pueden modificar en cierto grado la ventilación pulmonar (Wall 2001, Rieser 2013).
Una falla en la oxigenación puede combinarse con una falla ventilatoria (hipoxia con hipercapnia) cuando existe una reducción severa de la compliancia pulmonar por una patología en el parénquima pulmonar y el paciente no puede mantener el esfuerzo respiratorio para un intercambio de gases efectivo, dado que la presión inspiratoria se eleva hasta la fatiga; el incremento en la frecuencia y profundidad respiratoria puede mantener relativamente normal el volumen/minuto por un periodo corto de tiempo, hasta que la falla respiratoria ocurre por caída permanente del volumen tidal (Rozanski 2015).
En condiciones de enfermedad, cualquier deterioro en la función de la barrera alveolocapilar reducirá la PaO2 y se establecerá hipoxia sistémica. La hipoxia puede resultar de cinco mecanismos principales de falla en la oxigenación: baja concentración de oxígeno inspirada, hipoventilación, alteración en la difusión, discordancia entre la ventilación/ perfusión o desvíos (shunts) anatómicos intrapulmonares y/o cardíacos (Day 2002, Bateman 2008, Balakrishnan y Tong 2020). Algunas patologías en las que subyacen estos mecanismos se enlistan en la Tabla 2. Resulta interesante resaltar que los caninos con sobrepeso u obesidad tienden a mantener PaO2 menores (86,9 ± 11,4 mmHg) en comparación a individuos en peso normal (96,8 ± 4,8 mmHg) sin demostrar hipercapnia ni hipoxia verdadera (Pereira-Neto et al. 2018).
Por otra parte, existen varias formas útiles para determinar la efectividad de la carga de oxígeno en la sangre a través de los pulmones (Bateman 2008), entre las más utilizadas en contextos clínicos se mencionan la PaO2, la saturación arterial de oxígeno (SaO2) y el contenido arterial de O2 (CaO2); así también, para estimar el grado de hipoxia, los radios PaO2/FiO2, Sa/FiO2 y el gradiente alveolar-arterial G(A-a) O2, son los cálculos más comunes (Bach 2008).
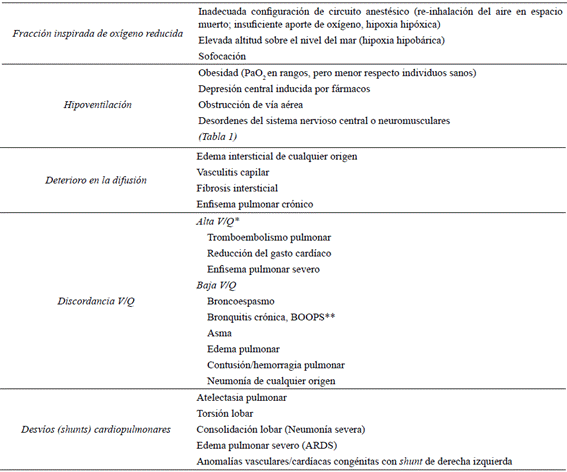
Adaptado de Haskins (2004) Bach (2008), Rieser (2013) y Pereira-Neto et al. (2018).
Tabla 2. Mecanismos de hipoxia relacionados con situaciones clínicas probables en pequeños animales.
Saturación arterial de O2 (SaO2 y SpO2). La saturación arterial de hemoglobina con O2 (SaO2) está relacionada con la PaO2 y por tanto ofrece información relativa a la oxigenación de una forma precisa según el método de obtención (Proulx 1999). Ésta puede ser medida a través de una muestra arterial (cooximetría, SaO2) o de forma no invasiva (oximetría de pulso, SpO2); ambos métodos arrojan resultados similares mientras no coexistan formas anormales de hemoglobina (metahemoglobina, carboxihemoglobina, etc.) y la técnica esté bien ejecutada en el paciente abordado (Rieser 2013). Así también, la correlación entre SaO2 y SpO2 es adecuada y por ende, la oximetría de pulso se considera una técnica práctica para el monitoreo continuo y no invasivo de la oxigenación en caninos (Fairman 1992). Si bien la PaO2 obtenida de sangre arterial es la prueba de oro para evaluar la habilidad de oxigenar de un paciente, la correlación entre la SpO2 y la PaO2 se acepta en entornos clínicos prácticos en cuyo caso una punción arterial no sea posible; dicha relación es sigmoidea y se describe por la curva de disociación de oxi-hemoglobina. Una SpO2 de 95% se corresponde con una PaO2 superior a 80 mmHg, mientras que una SpO2 de 90% puede correlacionarse con PaO2 cercana a 60 mmHg. Consecuentemente, una SpO2 menor a 95% a nivel del mar podría relacionarse con hipoxia leve. Pese a esta utilidad práctica, la curva se aplana cercano a una SpO2 de 97%, así pues, no es posible establecer la equivalencia de PaO2 cuando la SpO2 llega a 97-100%, porque podría oscilar entre 100 o 500 mmHg según la FiO2 suministrada al paciente. No obstante, su fácil disponibilidad, la naturaleza no invasiva y aceptable correlación con PaO2 son ventajas de su uso rutinario en escenarios clínicos (Gonzalez y Waddell 2016). Adicionalmente, esta puede ser usada en contextos donde no esté disponible la medición de gases arteriales o en la atención del paciente hipóxico inestable, en el cual la manipulación para la muestra arterial puede ser perjudicial. No obstante, es importante tener en cuenta que la SpO2 puede arrojar una medición inexacta en áreas en constante movimiento, pigmentadas, secas, con hipoperfusión significativa, por el incremento sostenido de presión venosa central, ictericia, hipotermia o anemia severa; adicionalmente, esta técnica no puede diferenciar entre carboxihemoglobina y metahemoglobina (Proulx 1999). También, es valioso reconocer que son necesarias más investigaciones para corroborar la correlación en mención, pues un estudio reciente sugirió que el SpO2 no reemplaza la PaO2 en caninos respirando FiO2 ambiental, en quienes se halló una correlación cercana al 0,52 (p<0,0001); este estudio también identificó que la precisión de un valor de SpO2 <93% para detectar PaO2 <80 mmHg tenía una sensibilidad del 55% y especificidad del 68,8% (Farrell et al. 2018).
Contenido arterial de O2 (CaO2). La cantidad de O2 contenido en la sangre puede calcularse a partir de la PaO2, la SaO2 y la hemoglobina; la ecuación que expresa esta relación es: CaO2 = O2 unido a hemoglobina + O2 disuelto en el plasma (Manning, 2002). El O2 unido a la hemoglobina resulta del producto entre hemoglobina, SaO2 y 1,34 a 1,36 ml. Este último valor es un rango que representa la cantidad en mililitros de O2 que un gramo de hemoglobina saturada al 100% puede transportar (Day 2002, Manning 2002, Haskins et al. 2005). El oxígeno disuelto en el plasma corresponde al producto de la PaO2 y 0,003 (que representa el O2 disuelto en el plasma expresado en decimal y es llamado Coeficiente Bunsen). Por supuesto, es evidente con este cálculo que la anemia afecta más el CaO2 que la hipoxemia en si misma (Day 2002). Un ejemplo práctico se explica más adelante. Este cálculo, enfatiza la importancia de la capacidad de la hemoglobina en transportar O2, ya que el contenido de O2 es principalmente dependiente de la concentración de hemoglobina y la SaO2 (Manning 2002); los valores esperados de CaO2 en caninos sanos oscilan entre 13 y 20 g dl-1 (130 - 200 g L-1) (Day 2002).
Relación PaO2/FiO2. La relación PaO2/FiO2 es útil para reconocer la hipoxemia y determinar la severidad de la falla en la oxigenación (o indirectamente, grado de shunt intrapulmonar), así también, se reconoce como un indicador fiable de respuesta a la terapia con oxígeno (Day 2002). Se puede calcular obteniendo el cociente entre la PaO2 (aportada por los gases arteriales medidos en el paciente) y la FiO2. En la respiración espontánea, la FiO2 ambiental se aproxima a 21%, dada la proporción de O2 en la mezcla de gases del aire inspirado (Rieser 2013). Si el cociente es mayor a 400, la oxigenación se considera normal; si el resultado es entre 400 y 300, está deteriorada y si resulta menos de 200 indica una disfunción pulmonar severa (Wilkins et al. 2007, Bateman 2008). Otros autores consideran que un rango aceptable de oxigenación eficiente es un valor de PaO2/FiO2 superior a 350 (Pelt et al. 1991), lo cual, es relevante para su interpretación en elevada altitud.
Adicionalmente, este cálculo es útil para el monitoreo del paciente con suplemento de O2, pues el valor esperado de la PaO2 debe ser entre 4 a 5 veces la FiO2 aportada. Entonces, un paciente con una FiO2 de 40% y la PaO2 superior a 160 mmHg está siendo responsivo a la terapia con oxígeno correlacionando también un PaO2/FiO2 de 400 (Rieser 2013). Su estimación continua, más que un valor específico en un momento de tiempo es más útil para monitorear la respuesta al tratamiento con oxígeno. No obstante, en estos casos se debe tener presente que valores normales mientras se supere la FiO2 ambiental no excluyen disfunción pulmonar en curso (Carver et al. 2016). Pues, dada la naturaleza de la ecuación matemática, el radio PaO2/FiO2. no evalúa el efecto del PaCO2 en el paciente y por tanto, valores normales de PaO2/FiO2 pueden detectarse en un paciente hipercápnico a una FiO2 ambiental. Dicho efecto se reduce a medida que la FiO2 aumenta y es prácticamente nulo a FiO2 >50%. Otra consideración es que el PaO2/FiO2 puede ser influenciable por el gasto cardíaco y el consumo de O2 (Pelt et al. 1991).
Harris y Massie (2019) desarrollaron un modelo matemático para calcular los valores del gradiente alveolar- arterial G(A-a)O2 y la relación PaO2/FiO2 en humanos durante el periodo perioperatorio. Tanto en el modelo como en la validación clínica, ambos índices reflejan de forma apropiada la estimación del empeoramiento de la función pulmonar cuando la barrera de difusión está deteriorada (Harris y Massie 2019); no obstante, ambos índices son influenciables por la FiO2 y, por tanto, ninguno debería interpretarse de forma aislada en el paciente. Actualmente, el radio PaO2/FiO2 hace parte de los criterios de diagnóstico de VetALI (Acute Lung Injury, por sus siglas en inglés; Injuria pulmonar aguda) si PaO2/FiO2 es menor a 300 mmHg y VetARDS (Acute Respiratory Distress Syndrome, por sus siglas en inglés; Síndrome de distrés respiratorio agudo) si PaO2/FiO2 es menor a 200 mmHg, como evidencia de hipoxemia por intercambio de gases ineficiente (Wilkins et al. 2007).
Relación SaO2/FiO2 y SpO2/FiO2. Existe una buena correlación entre la PaO2 y la SaO2 en caninos con oxigenación normal (Carver et al. 2016) o hipoxémicos (Calabro et al. 2013); así que, el índice SaO2 /FiO2 ha surgido como una alternativa para monitorear la oxigenación a diferentes niveles de FiO2 (Carver et al. 2016). El valor de SaO2 debe ser obtenido de muestras arteriales, por tanto, pese a la buena correlación con PaO2/ FiO2, permanece la limitación de ser una técnica impráctica o poco factible en algunos pacientes cuya punción arterial esta proscrita. Así pues, calcular este radio con la SpO2 obtenida por oximetría de pulso, representa una opción para caracterizar la tendencia a la oxigenación en pacientes en quienes la punción arterial no es viable (Calabro et al. 2013). Un estudio piloto en caninos hipoxémicos sugirió que SpO2/FiO2 es un marcador confiable y no invasivo de la oxigenación y puede ser una alternativa al PaO2/FiO2 (Calabro et al. 2013); incluso, en medicina humana se ha demostrado que este radio puede ser un criterio valido para definir ALI o ARDS y también logra predecir el pronóstico (Rice et al. 2007, Bilan et al. 2015). Otro estudio que evaluó la correlación entre PaO2/FiO2 y SpO2/FiO2 en caninos ventilados, identificó una correlación de 0,76 (p<0,0001) en la población estudiada, con una equivalencia en puntos de corte para SpO2/FiO2 de 188 y 223 si la PaO2/FiO2 es 200 y 300, respectivamente (Farrell et al. 2018). No obstante, son necesarios estudios adicionales para corroborar esta promisoria relación en pacientes caninos a una FiO2 ambiental o durante la terapia con O2. Como se mencionó antes, el efecto de la hipercapnia sobre la oxigenación en estos índices no puede ser evaluado y, por tanto, existe una limitación importante en su interpretación mientras el animal respire aire ambiental; pues en este escenario un PaO2/FiO2 bajo puede representar una falla en la oxigenación por patología pulmonar y/o algún mecanismo de hipoventilación que no se reconozca por medio de la interpretación única del índice (Farrell et al. 2018).
Gradiente alveolar-arterial (G(A-a)O2). El gradiente alveolar-arterial determina la diferencia entre las presiones de oxígeno entre el alveolo y el capilar (Balakrishnan y Tong 2020; Pelt et al. 1991); como la concentración de oxígeno es mayor en el alveolo que en el capilar, se establece un gradiente de presiones a favor de la difusión de O2 al capilar (Robinson 2012c, Irfan 2019). Un sistema de ventilación y oxigenación ideal teóricamente tendría un valor cercano a 0 mmHg, no obstante, dado el desvío de sangre hacia áreas no ventiladas (pleura, bronquios, etc.), la presencia de desvíos (shunts) anatómicos, la heterogeneidad entre V/Q y la baja solubilidad de O2, este valor no suele obtenerse en pacientes reales (Irfan 2019, Balakrishnan y Tong 2020). El valor adecuado de G(A-a)O2 en condiciones normales debe ser menor a 15 mmHg (Bateman 2008; Day 2002; Miller 2007), aunque es aceptable entre 15-25 mmHg para otros autores (Bach 2008); en humanos, se ha estimado que su valor aceptado puede incrementar incluso hasta 30 mmHg en individuos mayores de edad (Pelt et al. 1991). Esta tendencia es plausible también en caninos senior o geriátricos sin enfermedad pulmonar, pese a que no se han hallado diferencias estadísticas comparando con adultos sanos. Su cálculo se obtiene de restar la PaO2 a la PAO2 (revisar ecuación de gas alveolar, examinada previamente). De esta ecuación también es posible deducir que los movimientos entre PAO2 y PaCO2 son inversos, es decir que si ocurre hipoventilación alveolar (y la PaCO2 se eleva) la PAO2 se reducirá y viceversa (Robinson 2012c).
Una forma común de simplificar la ecuación, basado en los valores que se mantienen constantes a baja altitud, es: PAO2= 150 - PaCO2/0,8; pues a baja altitud, la presión barométrica es cercana a 760 mmHg, la presión de vapor de agua es 47 mmHg a 37°C y la FiO2 se mantiene en 21%; así pues, despejando, el valor obtenido es 150 (Bach 2008). No obstante, esto no es generalizable para condiciones de moderada y alta altitud, pues la presión barométrica disminuye significativamente.
Valores elevados del G(A-a)O2 son indicativos de lesión en el parénquima pulmonar suficiente para explicar hipoxemia (Bach 2008, Balakrishnan y Tong 2020, Ceccherini et al. 2020), señalando así una deficiencia en la oxigenación. Además, también se considera una medida indirecta de la correcta ventilación/oxigenación (Bach 2008). Su utilidad subyace en identificar el mecanismo probable de la hipoxia, recordando que están descritos cinco principales: reducción de la FiO2, hipoventilación, deterioro en la difusión, discordancia V/Q y shunts cardiopulmonares patológicos (Tabla 2); de este modo, clínicamente es útil para descartar la hipo o hiperventilación como causa primaria de la hipoxia (Balakrishnan y Tong 2020), pues la PaCO2 no contribuye al establecimiento del gradiente alveolo-arterial en la membrana alveolo-capilar (Pelt et al. 1991) y por ende, el valor de G(A-a)O2 será normal en el paciente con hipoxia por hipoventilación. A diferencia del radio PaO2/FiO2, es conveniente que el de la membrana alveolo capilar no presente alteraciones morfológicas severas (fibrosis, infiltración neoplásica, inflamación crónica, etc). Otra consideración importante en la interpretación del G(A-a)O2 medido durante la terapia con O2, es que su valor es altamente influenciable por la FiO2 y por ende, no debe interpretarse como un indicador fiable de la función pulmonar mientras la FiO2 sea variable (Pelt et al. 1991). Si este índice se emplea dentro del monitoreo de la oxigenoterapia, es necesario mantener la FiO2 continua para aportar un valor pronóstico (Pelt et al. 1991).
Otra de las utilidades de la medición del G(A-a) O2 es diferenciar entre falla ventilatoria y falla en la oxigenación (Irfan 2019). En caso de que el movimiento de aire atmosférico a través de los pulmones sea deficiente, los gases arteriales evidenciarán hipoxemia (<PaO2), hipercapnia (>PaCO2) y un cálculo del G(A-a)O2 normal, acompañado de una reducción en el volumen/minuto (Figura 1). De forma opuesta, cuando exista una falla en la oxigenación por deterioro de la barrera alveolo-capilar, claramente la PaO2 cae, mientras que la PaCO2 tiende a caer progresivamente en fases iniciales (hiperventilación) hasta elevarse con la progresión de la falla respiratoria (hipoventilación), mientras que el G(A-a)O2 va tendiendo también a incrementarse en conjunto con el volumen/ minuto (Irfan 2019) (Tabla 3). Por esto, si el G(A-a) O2 es normal en un paciente hipoxémico, se asume que el mecanismo de la hipoxia es extrapulmonar (baja concentración de oxígeno inspirada o hipoventilación), clasificándole en falla respiratoria tipo 2 (Bach 2008, Irfan 2019). Pero si el G(A-a)O2 está elevado, el mecanismo de la hipoxia ocurre por falla en la difusión, discordancia V/Q o shunts de derecha-izquierda y se corresponde con una falla respiratoria tipo 1 (Bateman 2008, Irfan 2019) (Tabla 3).
Para diferenciar entre estos últimos se debe evaluar la respuesta a la suplementación con oxígeno (Bach 2008) a una FiO2 superior a 100% (alcanzada con máscaras de G(A-a)O2 sea evaluado en pacientes con FiO2 ambiental reservorio a flujos altos de O2 a 15 L min o con presión-1 (21%), superior a 100% o en su defecto, una FiO2 continua (Pelt et al. 1991, Day 2002, Bach 2008). No obstante, en algunos contextos clínicos, se ha utilizado como indicador del restablecimiento del intercambio eficiente de gases en la membrana alveolo-capilar en respuesta al aporte de O2 con Presión Positiva continua (CPAP), toda vez que los valores basales previo a la oxigenación se reduzcan posterior al soporte con oxígeno en FiO2 estable (Ceccherini et al. 2020). Esta respuesta, será más notoria mientras la estructura positiva continua) y posteriormente con una FiO2 cercana a 28% (lograda con cánula nasal a 100 ml kg-1 min-1, cámara/ máscara nasal a 6 Lmin-1 o caniles diseñados para el aporte de O2 y sus respectivas válvulas venturi acopladas) (Manning 2002). Recientemente, se ha descrito también la aplicación de Presión Positiva Continua en la vía área (CPAP) con métodos no invasivos como cascos respiratorios regulando flujos entre 30 y 40% de FiO2 y mejorando los índices de oxigenación (Ceccherini et al. 2020).

Adaptado deIrfan (2019) y Sarkar et al. (2017).
Tabla 3. Relación entre la PaO2, PaCO2 y G(A-a)O2 para la clasificación de tipos de falla respiratoria.
Desde un punto de vista complementario, el G(A-a)O2 resulta útil en un paciente hiperventilando o hipoventilando; por ejemplo, un canino con una PaO2 de 80 mmHg (hipoxia) y una PaCO2 de 20 mmHg (hipocapnia) está hiperventilando. Si en este paciente, el cálculo del G(A-a)O2 resulta en 38,5 (elevado) se podría inferir que el incremento de la tasa respiratoria se debe a la compensación de un proceso primario pulmonar. De forma opuesta, un paciente con una PaO2 de 67 mmHg (hipoxia) y PaCO2 de 55 mmHg (hipercapnia) con un G(A-a)O2 de 11,5 (normal), se podría inferir que la hipoventilación y subsecuente hipoxemia, es causada por una alteración distinta a una enfermedad primaria del parénquima pulmonar que curse con hipoventilación y su origen más probable es extrapulmonar (ver Tabla 1) (Rozanski 2009). Es importante enfatizar que, aunque en este caso se excluirían patologías primarías pulmonares, no se deben excluir patologías intratorácicas (pared torácica, espacio pleural, mediastino, músculos respiratorios, etc.). También, es útil recordar que la hipoventilación prolongada puede conllevar a la atelectasia de algunas áreas del pulmón, lo cual implicaría eventualmente un aumento del G(A-a)O2 (Sarkar et al. 2017). Así también, en un mismo paciente pueden coexistir mecanismos de hipoventilación y de deterioro en la difusión o desacople V/Q; por ejemplo, los pacientes con politraumatismo pueden manifestar neumotórax combinado con contusión pulmonar o hemorragia, deteriorándose su habilidad de ventilar, más también de oxigenar. En estos casos, la correlación de imágenes tomadas por tomografía computarizada y la disfunción de los índices de función pulmonar evaluados a través de gases arteriales es buena (Kirberger et al. 2019) y pueden identificarse mecanismos de hipoventilación y deterioro en la oxigenación simultáneos.
Ahora, revisando ejemplos clásicos de cada mecanismo de hipoxia, el cálculo del G(A-a)O2 resulta útil para identificarlos. Por ejemplo, la escasa FiO2 redunda en una PAO2 reducida y por tanto una PaO2 baja que estimula la ventilación y reduce la PaCO2; no obstante, el G(A-a)O2 permanece normal. Las causas asociadas a una FiO2 reducida pueden ser una conexión insuficiente en de O2 en un paciente anestesiado o cambios bruscos de presión barométrica (elevada altitud sobre el nivel del mar) (Bach 2008).
En el mecanismo de hipoventilación (hipercapnia) el G(A-a)O2 no incrementa, dado que la PAO2 y por tanto la PaO2 se reducen proporcionalmente al incremento de la PaCO2 y PACO2. Causas de hipoventilación en caninos y felinos incluyen la administración de fármacos depresores del centro respiratorio, entidades neuromusculares que deterioren el movimiento de los músculos torácicos que asisten la ventilación, injurias de pared costal, cavidad pleural u obstrucción de vía aérea alta (Bach 2008) (Tabla 1).
El deterioro en la difusión ocurre cuando hay un inadecuado movimiento de gases entre el alveolo y el lecho capilar a causa de una anormalidad en la membrana basal alveolar, la pared capilar o el intersticio; usualmente asociado al engrosamiento de la membrana alveolo-capilar (enfermedad intersticial difusa), pérdida de la superficie alveolo-capilar (enfisema, vasculitis) o gasto cardiaco elevado con reducción del tránsito de eritrocitos en el lecho capilar pulmonar (ejercicio). Dado que ocurre un mecanismo de falla para el intercambio de gases, el G(A-a) O2 sube. La respuesta esperable a un aumento de FiO2 a 100% será una elevación de la PaO2 inicial >50 mmHg, pese a que el grado de hipoxia es leve y en ocasiones imperceptible (DiBartola 2012). Patologías asociadas a este mecanismo son edema, fibrosis, infiltración inflamatoria o neoplásica en el intersticio, vasculitis o enfisema. Esta anormalidad precede a un grado más severo de falla en el intercambio gaseoso y puede manifestarse con signos clínicos leves o insidiosos que pueden no ser identificados fácilmente a través del examen físico (Bach 2008).
La discordancia entre la V/Q ocurre a causa de la ausencia de ventilación o perfusión en algunas regiones del pulmón donde la falla en la difusión de gases avanza. Así pues, el G(A-a)O2 incrementa y se acompaña de bajo PaO2 y PaCO2 variable. Un ejemplo de discordancia con índice V/Q alto son entidades donde se incremente la compliancia pulmonar (enfisema) o cuando se reduzca la perfusión pulmonar (tromboembolismo); en este último caso ocurre un adecuado suplemento de O2 al alvéolo en presencia de perfusión anormal (DiBartola 2012). Éste tipo de hipoxia es parcialmente responsiva al incremento de la FiO2 pero en menor medida que la respuesta observable en la falla en la difusión, pues la FiO2 a 100% eleva la PaO2 inicial <50 mmHg (Bach 2008); de forma opuesta, en la discordancia con bajo índice V/Q existe una ventilación anormal en presencia de una irrigación adecuada, especialmente por un incremento significativo en la resistencia aérea; algunas patologías asociadas pueden ser asma, fibrosis, edema, contusión o neoplasia pulmonar. En estos casos la respuesta a la suplementación con O2 es subóptima (Bach 2008).
Los shunts cardiopulmonares hacen referencia al paso de sangre venosa desoxigenada desde el lado derecho del corazón hacia la circulación sistémica, sin la adecuada saturación de hemoglobina con oxígeno en el lecho pulmonar, así que la PaO2 baja se acompaña de PaCO2 inicialmente baja (hiperventilación) que progresa a ser normal y posteriormente se eleva, acompañándose de un G(A-a)O2 anormalmente elevado; Algunas causas asociadas a este mecanismo de hipoxia son atelectasia, edema alveolar de cualquier origen, consolidación pulmonar o anomalías congénitas vasculares; dado el mecanismo de falla, no es usual que la terapia con FiO2 a 100% sea suficiente para elevar la PaO2 de forma aceptable (Bach 2008).
Finalmente, es importante considerar que existen otros factores que pueden influenciar el G(A-a)O2 además de una alteración de la membrana alveolo-capilar. Estos son: el gasto cardíaco, la curva de disociación de hemoglobina, el grado de consumo de O2, la diferencia arterio-venosa del contenido de PCO2 y como se mencionó anteriormente, la FiO2 (Pelt et al. 1991).
Falla respiratoria. Cuando el sistema respiratorio pierde su habilidad de oxigenar y/o ventilar, ocurre una falla respiratoria (hipoxemia, hipercapnia o ambas) (Ceccherini et al. 2020). En función del mecanismo, la falla respiratoria se clasifica en tipo 1 cuando la oxigenación se ha deteriorado (hipoxemia) o tipo 2 cuando la ventilación no puede mantenerse (hipercapnia) (Mirabile et al. 2023). La falla respiratoria puede instaurarse por patologías del tracto respiratorio alto o bajo, de la pared torácica, músculos involucrados en la respiración y/o en las vías nerviosas periféricas o centrales que controlan la respiración (Irfan 2019, Mirabile et al. 2023).
Las características de la falla respiratoria tipo 1 son la presencia de hipoxemia (PaO2 <60 mmHg) combinada con PaCO2 normal o baja. El G(A-a)O2 puede ser normal en caso de mecanismos de hipoventilación alveolar o reducción de la presión inspirada de oxígeno atmosférico. El G(A-a)O2 será elevado cuando el mecanismo subyacente sea un defecto de difusión, discordancia entre V/Q o shunt de derecha a izquierda, como se mencionó previamente (Mirabile et al. 2023).
Las características de la falla respiratoria tipo 2 son la presencia de hipercapnia (PaCO2 >45 mmHg) con un pH menor a 7,34 por causa de una alteración ventilatoria (inhabilidad de eliminación) o por sobreproducción de CO2 (condición de baja frecuencia en caninos). Adicionalmente, la PaO2 puede ser normal o reducida. Algunos mecanismos involucrados en la alteración ventilatoria son la depresión del centro respiratorio, alteración de la transmisión neurológica, muscular o neuromuscular, patologías de la pared torácica y/o ventilación del espacio muerto. En el caso de la sobreproducción de CO2, los mecanismos subyacentes pueden ser el síndrome de realimentación, sepsis, tirotoxicosis o fiebre alta en escenarios donde el incremento compensatorio de la ventilación no pueda instaurarse (Mirabile et al. 2023).
A modo de síntesis, en la Figura 1 se ofrece un algoritmo del abordaje diagnóstico general al evaluar un paciente canino con distrés respiratorio; así también, en la Tabla 4 se presenta un ejemplo concreto.
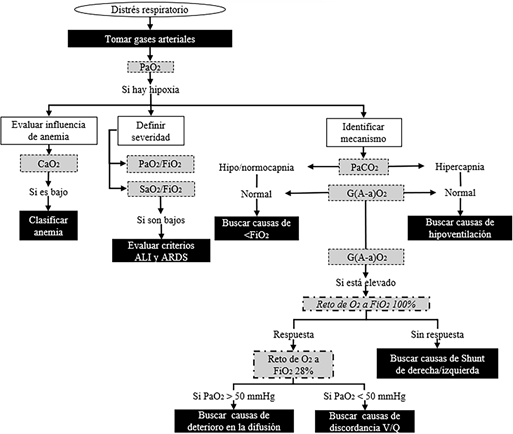
Figura 1 Algoritmo diagnóstico de un paciente canino con distrés respiratorio en relación con la interpretación de los gases arteriales. Modificado de (Bach 2008).
Efecto de la altitud sobre el nivel del mar y la interpretación de gases arteriales. Una de las investigaciones que han demostrado el efecto de la altitud sobre las presiones de gases arteriales en caninos fue el trabajo de Hsia et al. (2007); el grupo sometió a caninos Foxhound machos jóvenes a condiciones simuladas de altitud durante cinco meses, antes de la maduración somática. Posteriormente los animales fueron mantenidos en condiciones de baja altitud. Estos investigadores concluyeron que las condiciones de altitud pueden mejorar permanentemente el intercambio gaseoso pulmonar, la función hemodinámica y la eficiencia metabólica del ejercicio (Hsia et al. 2007). Adicionalmente, Ravikumar et al. (2009) realizaron un estudio morfométrico en caninos de la misma raza sometidos a iguales condiciones de altitud simuladas por un periodo de cinco meses. Después de tres años de retornar a las condiciones de baja altitud, realizaron un estudio morfométrico pulmonar, encontrando remodelación acinar persistente con redistribución de elementos del tabique alveolar que condujeron a mayor distensibilidad pulmonar y una modesta reducción en la resistencia de la barrera de difusión gas-sangre. Con esto, sugirieron una adaptación estructural pulmonar remanente en la vida adulta después del crecimiento en etapa juvenil en condiciones de altitud (Ravikumar et al. 2009). No obstante, este campo de la medicina interna en caninos aun requiere una miríada de investigaciones adicionales para confirmar dicha posibilidad.
La fracción de oxígeno inspirado (FiO2) en la atmósfera a cualquier altitud, se refiere al contenido de O2 en el aire, es decir un 20,93% (aproximando, 21%) de los gases atmosféricos (Davis y Hackett 2017). No obstante, la presión inspirada de oxígeno (PiO2) en el ambiente resulta del producto entre la presión barométrica y la concentración del gas en la atmosfera (0,21); de aquí, se entiende que a medida que se reduzca la presión barométrica por mayor altitud, la PiO2 en el aire ambiental es menor (mientras la FiO2 permanece estable a 0,21) y por tanto, será menor la PAO2 y PaO2 a medida que se eleva la altitud (Montes de Oca et al. 2010, Davis y Hackett 2017).
En consecuencia, uno de los mayores retos en la evaluación de la oxigenación a través de los gases arteriales, es el efecto de la altitud sobre el nivel del mar y los cambios en la presión barométrica subsecuentes. Dado que la concentración efectiva de oxígeno en la atmósfera disminuye a mayor altitud (PiO2), la PaO2 normal o esperada se reduce con la altitud y así también la interpretación para detectar anormalidades en la oxigenación se modifica (Miller 2007, Bateman 2008).
Este evento es de suma importancia al interpretar la PaO2 como una medida del oxígeno disponible en la sangre, pues a nivel del mar la hipoxemia se define objetivamente con un PaO2 <80 mmHg (Bach 2008). No obstante, a moderada y alta altitud, presiones por debajo de este valor son comunes en pacientes sanos (Trujillo et al. 2014). Por tanto, la relación entre PaO2 y FiO2 no se conserva en animales aclimatados a la altitud (Bach 2008); la norma aceptada de dicha relación a nivel del mar implica una elevación de la PaO2 de cuatro a cinco veces mayor al valor de la FiO2, es decir que para una FiO2 de 21% se espera un valor de PaO2 mínima de 84 mmHg (Bach 2008). Así también, una diferencia ostensible entre estos valores en relación con la altitud se evidencia al comparar datos de hipoxemia aguda critica a nivel del mar (PaO2 <60 mmHg) y valores obtenidos en caninos sanos adaptados a la altitud, con rangos normales oscilando entre 56,8 ± 5,54 mmHg (Trujillo et al. 2014). Es evidente entonces que los valores de referencia entre nivel del mar (<500 msnm), baja (500 - 2000 msnm), moderada (2000 - 3000 msnm), alta (3000 - 5500) y gran altitud (>5500) (Bergeron et al. 2012) deben ser ajustados conforme cambia la presión barométrica, pues un valor de PaO2 de 56,8 mmHg (a FiO2 21%) no implica hipoxemia severa a moderada altitud en un canino sano.
A nivel del mar, caninos con valores de PaCO2 por debajo de 32 mmHg y por encima de 43 mmHg se corresponden con mecanismos de hiperventilación o hipoventilación, respectivamente (Haskins 2004). Estos valores, adaptados a moderada altitud se corresponden con PaCO2 más bajos de forma compensatoria, con rangos reportados de 23,9 - 31,9 mmHg (Trujillo et al. 2014), lo cual implica la necesidad de redefinir los puntos de corte para clasificar la hipocapnia e hipercapnia asociadas a disturbios acido base respiratorios primarios y así también, los puntos de corte críticos para las distintas intervenciones terapéuticas en el abordaje de caninos residentes a moderada altitud. Incluso, lo anterior también influye en la interpretación de los disturbios ácido base metabólicos para los cálculos de la compensación, dado que el rango menor de PaCO2 también repercute en la reducción compensatoria del HCO3. Este hecho resalta la necesidad de ajustar los rangos de referencia de gases arteriales y venosos a la altitud.
Adicionalmente, los cambios en PaO2 con la altitud, también modifican los índices de evaluación de función pulmonar por gasometría arterial. Por ejemplo, una PaO2/ FiO2 o SaO2/FiO2 dadas en moderada altitud, probablemente indiquen un menor grado de shunt pulmonar y una forma menos severa de enfermedad que esos mismos valores en baja altitud; así que los valores de PaO2/FiO2 o SaO2/ FiO2 normales disminuyen conforme se reduce la presión barométrica con la altitud (Pérez-Padilla 2004). Así pues, la fiabilidad de los índices de vet-ALI y vet-ARDS aplicados en pacientes residentes a moderada altitud es cuestionable, siendo claro que estos rangos requerirían ajustarse. Adicionalmente, otros índices de evaluación de la oxigenación usados en la práctica clínica, como el G(A-a) O2, pueden ser influenciados por modificaciones en la FiO2 y potencialmente por la altitud (Pérez-Padilla 2004). No obstante, la correlación entre PaO2, SaO2 y PaO2/FiO2 o SaO2:FiO2, se espera permanezcan de forma independiente de la presión barométrica.
Teniendo en cuenta que la PiO2 es menor conforme la altitud se eleva sobre el nivel del mar, en la medicina humana se han propuesto varios métodos para ajustar los valores de PaO2/FiO2 en el paciente al rango estándar o modificando el rango de referencia para la correcta interpretación en altitud (Montes de Oca et al. 2010). El ajuste de estos valores para caninos ha sido poco estudiado y aún no se encuentra definido. Partiendo de que la relación entre PaO2/FiO2 y el grado de shunt pulmonar es inversamente proporcional (aunque no perfectamente proporcional cuando se compara con la altitud), es probable que sea más preciso ajustar el rango de referencia, en vez del valor obtenido en el paciente (Pérez-Padilla 2004). A medida que el grado de shunt pulmonar aumenta, el PaO2/FiO2 alcanza valores similares a una meseta con poca influencia de la altitud; no obstante, mientras el grado de shunt sea leve, los valores de PaO2/FiO2 obtenidos en diferentes altitudes pueden diferir significativamente y son influenciados por las variaciones en la PiO2 (Pérez-Padilla 2004).
Un método práctico para ajustar el rango de PaO2/ FiO2 a la altitud, es la ecuación de West, donde: PaO2/FiO2 ajustada = PaO2/FiO2 (presión barométrica/760 mmHg); el producto de este cálculo arroja valores de PaO2/FiO2 más bajos y correspondientes a un grado mayor de shunt pulmonar pero más cercano al verdadero, interpretándose en el contexto de los rangos estandarizados a baja altitud en pacientes con hipoxia (West y Wagner 1980). No obstante, este cálculo no ha sido validado en medicina humana o veterinaria y es probable que requiera mayor confirmación matemática, dado que la relación entre PaO2/ FiO2 y el grado de shunt pulmonar no es perfectamente linear (Jibaja et al. 2020). Otro método, posiblemente más preciso, es calcular rangos de referencia locales ajustando los puntos de corte de acuerdo con la presión barométrica local (Montes de Oca et al. 2010) o bien redefinir los rangos de referencia por niveles de altitud, asumiendo puntos de corte más bajos a medida que la PiO2 se reduce. Dado este contexto, se evidencia la necesidad de diseñar estudios representativos con el objetivo de validar rangos de referencia de dichos parámetros de función pulmonar en distintas poblaciones de caninos a diferentes altitudes para su correcta interpretación.
Conclusión
La evaluación de la función pulmonar a través de la gasometría arterial constituye una herramienta diagnóstica relevante y con aplicaciones en el abordaje de patologías respiratorias primarias o secundarias del tacto respiratorio; este método diagnóstico mejora la comprensión de la patología subyacente y facilita el monitoreo del paciente, así como la evaluación de la respuesta a la terapia. Así también, es predictor del pronóstico. Por tanto, su uso se ha extendido a la práctica de la clínica diaria en los caninos y constituye un foco de interés de investigaciones en curso.
















