I. INTRODUCCIÓN
Los coanoflagelados son microorganismos unicelulares pertenecientes al grupo de las eucariotas que se encuentran en aguas dulces y ambientes marinos 1.Tal como indica su nombre, estos poseen un collar o cono de microvellosidades que rodean a un único flagelo, el cual constituye su motor de autopropulsión 2. Además, éstas células poseen relevancia ecológica, ya que al ser bacteriovoros, contribuyen en la disponibilidad de materia orgánica y el ciclo de carbono en ambientes acuosos. Por otra parte son considerados los ancestros más cercanos en la evolución animal 3-5.

Fig. 1: A izquierda se grafican los micronadadores lentos y rápidos. El círculo con línea de puntos sobre el micronadador rápido corresponde al cuerpo del micronadador lento. Debajo de los mismos se muestran las trayectorias reales de los lentos (tortuosas) y rápidos (rectas). En el centro, se tiene un sketch del microdispositivo propuesto y simulado. El mismo posee No= 6 obstáculos que separan las cámaras 1 y 2. Su dimensión es de 3x6 mm y dentro del mismo se esquematiza el círculo de inoculación. En el panel derecho, se agranda la abertura de ancho lg (flecha grande). Las flechas grises indican el sentido fácil de transporte celular. Para mejor visualización los puntos que representan los micronadadores están magnificados 4 veces de su tamaño real y simulado.
Este trabajo se enfoca en la especie Salpingoeca Rosetta, la cual se puede encontrar agrupada en colonia (rosetas o en cadena) o en forma unicelular. En esta última bajo determinadas condiciones ambientales, que pueden ser replicadas en cultivo in vitro, coexisten dos poblaciones con morfología y dinámica de nado muy distintas: los micronadadores rápidos y lentos (Fig. 1). Los micronadadores rápidos describen trayectorias más rectilíneas y poseen cuerpos más elipsoidales con un collar de microvellosidades reducido en comparación con los micronadadores lentos que dibujan trayectorias tortuosas, con cuerpos más esféricos y de mayor tamaño(ver Tabla 1).
Una particularidad que engloba a esta especie es el aumento o disminución en la probabilidad de fusión celular de gametas o células sexuadas debido a la variación en la disponibilidad de nutrientes de su ambiente. En otras palabras, bajo hambruna estos microorganismos tienden a unirse para preservar su supervivencia y su información genética de tal forma que cumplen con la función de gametas masculinas y femeninas. En la actualidad, se desconoce si existe alguna conexión entre el tipo de micronadador y el tipo de gameta 6.
Haciendo foco en su individualidad, separar y concentrar ambas poblaciones ayudaría a realizar estudios genéticos para entender la función de cada micronadador, y en un futuro, el de las colonias. Si bien se han explorado numéricamente algunas configuraciones de dispositivos de separación 7, éstos no son reproducibles experimentalmente debido al gran tamaño dimensional y las limitaciones de observación mediante técnicas microscópicas.
Este trabajo explora los fenómenos de transporte celular en microdispositivos reales para determinar los parámetros geométricos que permitan una optimización en la separación celular. El dispositivo microfluídico planteado posee micro-obstáculos asimétricos quasi 2D, que generan una ruptura de simetría y una dirección de nado preferencial. Esto junto a la diferencia en la dinámica de los micronadadores, se espera que conjuntamente contribuyan a dar lugar a una separación de ambas poblaciones en un tiempo experimental realista. Es decir, en un tiempo en el cual se preserve la salud del modelo biológico y sea factible para el manejo del operador de laboratorio.
En la sección II se específica el microdispositivo y el modelado. En la sección III se presentan los resultados teóricos. Por último en la sección IV se darán las conclusiones y detalles del trabajo a futuro.
II. FÍSICA DEL MODELO BIOLÓGICO Y METODOLOGÍA
El objetivo de las simulaciones es representar la dinámica de ambas poblaciones de coanoflagelados bajo confinamiento. Para ello, se propone un modelo fenomenológico cuasi-2D siguiendo las consideraciones del trabajo de J. Sparacino et al. 7.
Las siguientes ecuaciones de movimiento para ambos micronadadores, corresponden a un modelo hidrodinámico lineal de Stokes. Son resueltas en simultáneo con la dinámica de Langevin en dos dimensiones, confinadas en un microdispositivo.
Donde ri = (˙ xi, ˙ yi)) es la velocidad resultante del centro de masa del i-ésimo coanoflagelado, R es el radio del nadador y n es la viscosidad del medio. Ú es la velocidad del cambio de dirección de nado y Dr es el coeficiente de difusión rotacional.
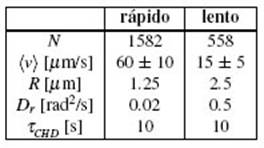
Siguiendo las consideraciones del trabajo de J. Sparacino et al. 7, la dirección de nado, θ, tiene dos contribuciones. Una para cada paso temporal y la otra es regida por una distribución de Poisson con un tiempo medio de cambio de dirección, tchd, aleatorio entre -n, n. Este último es un valor fenomenológico y realista obtenido de análisis de datos de experimentos previos 8 como lo son el radio del microorganismo R, el tiempo medio de cambio de dirección, tchd , y la velocidad media, (v), de la Tabla 1.
TABLA 1: Parámetros de la movilidad utilizados en las simulaciones para ambas poblaciones. Siendo N el tamaño poblacional, (v) la velocidad media, R el radio del cuerpo del nadador, Dr el coeficiente de difusión rotacional y τCHD
el tiempo promedio de cambio de dirección.
El microdispositivo utilizado en las simulaciones, consiste en un rectángulo de 3 x4.5mm, con vértices redondeados de radio interno 100.5nm, unido con un medio círculo de radio interno 1.5mm (ver panel central de la Fig. 1). La sección rectangular contiene No medios círculos de radio lf puestos en serie con un ancho de pared ww y de obstáculos Wf, separados por una abertura fija lg tal como se visualiza en el zoom superior derecho de la Fig. 1.
Este arreglo de obstáculos permite dividir la sección rectangular en dos cámaras; la cámara 1 representada con un fondo blanco, con un área A1, y la cámara 2 con un fondo azul con un área A2. La finalidad de estos obstáculos es poder, a través de la ruptura de simetría y gracias al nado celular por las paredes, separar ambas poblaciones 7.
En el trabajo de J. Sparacino et al. 7 se propuso un microdispositivo similar; manteniendo el número de obstáculos (No = 10), se varió el tamaño del área a través del radio de los obstáculos R o o el tamaño de las aberturas lg, respetando la ley de escala. Se consideraron tamaños de dispositivos (entre 500 nm a 10000 nm) demasiado grandes en relación a la resolución espacial para detectar una célula (del orden de las micras). Por otro lado, el sistema modelado impide la inoculación experimental ya que no cuenta con un acceso para la inoculación de células.
El presente trabajo se centra en un microdispositivo con un tamaño límite de cámara, siendo de un ancho fijo L x = 3 mm y un largo fijo L y = 6mm. A su vez, se agrega una cámara de inoculación para facilitar la inserción de la población al microdispositivo. Se representa la condición inicial en la Fig. 1.
Dada la restricción en el ancho de la cámara, el radio de los obstáculos, l f , está dado por Ec. (3).
con No el número de obstáculos, lg tamaño de la abertura y Wf el ancho de pared del obstáculo. De esta manera se puede estudiar el efecto de ruptura de simetría en la rectificación variando el número de obstáculos No.
Los dispositivos que generan un efecto ratchet son denominados rectificadores y son aquellos que pueden direccionar a una población, en este caso de microorganismos, sin la necesidad de utilizar campos externos o gradientes. Una forma de medir la eficiencia de este efecto es a través de la rectificación, que se define como el cociente entre las densidades de la cámara 2 y la cámara 1, Ec. (4).
Con Ni(t) el número de coanoflagelados en la cámara i en un tiempo t tal que dividido A¡-, se obtiene su densidad pi(t).
Este cociente se utilizó durante todo este trabajo para cuantificar el factor de concentración, de algún tipo de nadador, en la cámara 2 y permitiendo así comparar la variación del efecto ratchet para distintos parámetros. En particular, si r = 1, es decir p1 = p2, se dice que el dispositivo no rectifica y por lo tanto, no existe una dirección preferencial que separe y concentre a la población.
Para obtener una mejor estadística de la rectificación, se promedia entre m realizaciones con las mismas condiciones iniciales pero distintas semillas (inicializadores) del generador de números pseudo-aleatorios utilizado en el modelo fenomenológico. Luego, para encontrar el valor medio de la rectificación se tiene que descartar el período de transición para promediar solo en el estado estacionario. Es decir, 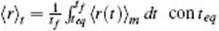 el tiempo correspondiente al inicio del estado estacionario y tf el tiempo final de corrida.
el tiempo correspondiente al inicio del estado estacionario y tf el tiempo final de corrida.
Para realizar las simulaciones, los parámetros del microdispositivo a utilizar en este trabajo, consisten en un barrido de No = 2-20 obstáculos con lf según la Ec. (3) tal que se mantenga un ancho máximo Lx = 3 mm y un largo máximo Ly = 6mm, junto con una abertura lg = 10^m y un ancho tanto de pared como de obstáculo, ww=Wf = 50^m. No todos los valores de No utilizados son relevantes para ser replicados en laboratorio, sino que su finalidad es dejar en evidencia el efecto de este parámetro (No) en los resultados de la rectificación. En una segunda instancia, con No=6, para los micronadadores rápidos, se varía el tiempo medio de cambio de dirección (tchd = 2-10 s) y, por otro lado, el porcentaje de mezcla de población con 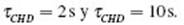
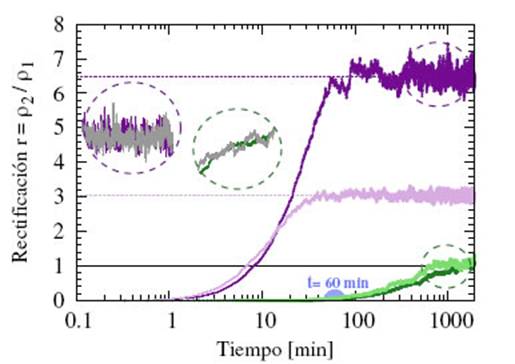
Para resolver la Ec. (1) se utilizará el método de Euler con un paso At = 0.0001s aproximando el cuerpo de los micronadadores por discos de radio R (Tabla 1). Para simplificar el análisis, las dos poblaciones de coanoflagelados se simulan por separado, dado que se estudia un sistema muy diluido. Los valores de rectificación no presentan diferencias significativas a los obtenidos con poblaciones mezcladas (zoom circular en la Fig. 2).
III. RESULTADOS DE LAS SIMULACIONES
Rectificación vs. número de obstáculos
En la Fig. 2 se observa la rectificación en función del tiempo para los micronadadores lentos (verde) y los micronadadores rápidos (violeta) tanto para 6 como 20 obstáculos. Se puede notar que para tiempos mayores a 60 min (círculo celeste), las curvas de rectificación de células rápidas alcanzan estados estacionarios con un factor de concentración entre 3 y 6 veces más en la cámara 2 que en la cámara 1. Mientras que las células lentas aún no han alcanzado a pasar a la cámara superior, y por lo tanto, muestran valores de rectificación cercanos a cero.
FIG. 2: Rectificación en función del tiempo para No = 6 (colores oscuros) y No = 20 (colores claros) para micronadadores lentos (verde) y micronadadores rápidos (violeta). En los círculos a izquierda se muestran las rectificaciones de una población de micronadadores rápidos y lentos simulados en conjunto (color gris) y por separado (color) para No = 6.
Estos resultados muestran que existe una clara ventana de tiempo experimental, independiente de No, que permite extraer una población casi pura de micronadadores rápidos en un intervalo de tiempo Ai = 60 min. Para el caso de los micronadadores lentos se puede notar que inclusive con tiempos de simulación de 30h, aún no alcanzan el estado estacionario y no rectifican. Este resultado lleva a poner el foco del análisis en la población de los micronadadores rápidos, debido a que tiempos mayores a 5h, se producen cambios biológicos como falta de nutrientes, división celular, entre otros.
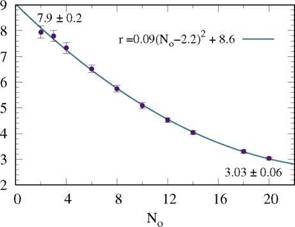
Seguidamente, se realiza la simulación para una misma población de micronadadores rápidos, variando No de 2 a 20 obstáculos. En la Fig. 3, se muestra la rectificación en función del número de obstáculos, alcanzando un valor máximo, r = (7.9 ± 0.2), para No = 2 y un valor mínimo, r = (3.03 ± 0.06), para No = 20. Estos resultados describen una relación cuadrática entre No y la rectificación (ver ajuste en Fig. 3).
En cuanto a la diferencia en los valores de rectificación según el número de obstáculos se tienen distintos factores, dependientes entre sí, para analizar: ruptura de simetría, número de canales a atravesar y largo de pared a recorrer.
Al proponer un microdispositivo de ancho fijo, la restricción en su geometría implica que al disminuir No se deba colocar obstáculos de mayor tamaño, aumentando el efecto de ruptura de simetría, y por lo tanto, una dirección de nado preferencial. Luego, si se considera que la mayoría de los micronadadores tipo pusher prefieren nadar cerca de las paredes 9, 10, entonces al aumentar l f , se genera mayor camino a recorrer para el nadador. En cambio, si el l f tendiera a cero, hay menos camino para recorrer pero el número de aperturas sería cada vez mayor generando más posibilidades de paso de una cámara a la otra. En otras palabras, dependiendo del número de obstáculos, se aumenta o disminuye la probabilidad de pasar de una cámara a otra, y por lo tanto, varían los valores de rectificación.
Fig. 3: Rectificación de nadadores rápidos vs. el número de obstáculos del microdispositivo. La función de ajuste está incluida en la figura. Se indica, para No = 2 y No = 20, la media y el error de la rectificación.
La evidencia experimental nos indica que toda población tiene respuestas cambiantes en su movilidad frente a distintos quimioatractantes, gradientes de oxígeno, distribución heterogéneas de alimentos, etc. Esto se ve reflejado en la frecuencia de cambio de dirección de nado t chd , es decir el aumento o disminución de tiempo en que el microorganismo se mueve en forma aproximadamente lineal, permitiendo encontrar ambientes más favorables. De esta manera resulta interesante estudiar la rectificación simulando grupos celulares con diferentes capacidades de reacción a los estímulos 8, 11, 12.
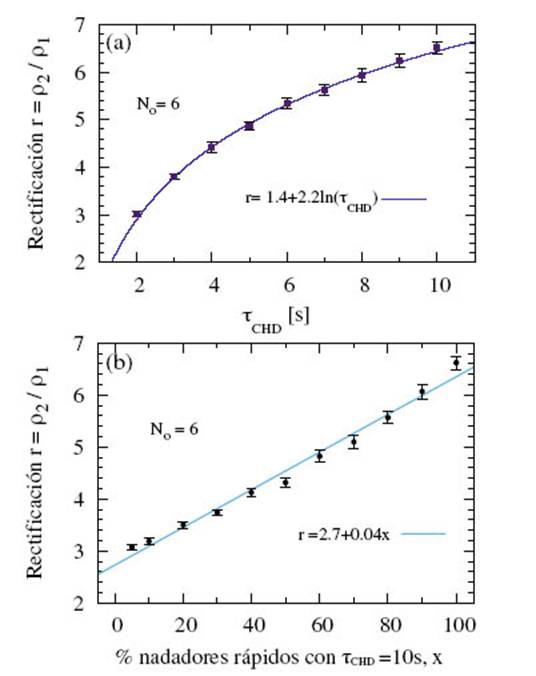
FIG. 4: (a) Rectificación de micronadadores rápidos vs. T CHD . (b) Rectificación vs. el porcentaje de población de nadadores rápidos con t chd = 10 s. Para (a)-(b), No = 6 y se muestran las funciones de ajuste.
En la Fig. 4(a) se presenta la rectificación en función de tchd para una población N de micronadadores rápidos con No = 6. Se observa que los valores de rectificación pueden ser ajustados a una función logarítmica dependiente de t chd . Además entre t chd = 2s y t chd = 10s, la diferencia entre las rectificaciones supera el 100%. Por otra parte, teniendo en cuenta que la intensidad de estos cambios puede no ser homogénea en una población celular, se analiza la rectificación en función de una respuesta de taxis heterogénea. Para producir ese efecto, se varía el porcentaje de población con t chd = 10s y T CHD = 2s.
La Fig. 4(b) muestra la rectificación en función del porcentaje de población heterogénea de nadadores rápidos con t chd = 10s y t chd = 2s en un microdispositivo con No = 6. Los resultados muestran un crecimiento lineal con una tasa de variación constante. Esto evidencia que las poblaciones celulares con mayor porcentaje de individuos sensibles a los cambios del ambiente, rectifican de manera más eficiente.
IV. CONCLUSIONES
Este trabajo ha planteado un modelo fenomenológico que resulta eficiente para representar cualitativamente la dinámica de coanoflagelados. Se utilizaron parámetros geométricos funcionales para una futura fabricación y manejo del microdis-positivo sin perder los detalles a nivel microscópico. Como así también, se ha agregado una condición de inoculación práctica para la realización del experimento.
Además se propusieron diversos microdispositivos para concentrar y separar con éxito a una población mixta de coanoflagelados. Esto se logró en una ventana de tiempo realizable experimentalmente de 60min. Resultando independiente de la geometría específica propuesta, es decir, de 6 a 20 obstáculos. Con respecto a los valores de rectificación se obtuvo un factor de eficiencia de 6.5 para 6 obstáculos, más del doble del valor obtenido para 20 obstáculos.
Aprovechando las ventajas de las simulaciones, se extendió el análisis de la rectificación para un amplio rango de números de obstáculos, No. Los resultados presentaron un incremento en la rectificación a medida que disminuye No, con un valor máximo de eficiencia de casi 8 para 2 obstáculos.
Se estudió la rectificación frente a distintos comportamientos biológicos por respuestas de taxis teniendo en cuenta los casos en el que la conducta fuera homogénea o heterogénea en la población. Se observó en ambos casos, que las poblaciones con mayor t chd rectifican más.
En resumen, en este trabajo se obtuvo un microdispositivo capaz de separar y concentrar con un factor de eficiencia mayor a 3 y en un tiempo experimentalmente realizable para un rango de modelos biológicos. Esto incentiva la realización de experimentos con distintas poblaciones en el microdispositivo para cuantificar y comparar los fenómenos de transporte en la búsqueda de generar distintas aplicaciones biotecnológicas.