INTRODUCCIÓN
En las últimas décadas en Argentina, el avance de la frontera agrícola y los cambios en el uso de la tierra produjeron numerosas consecuencias económicas y ambientales (Kruge & Quiroga, 2012; Ridley, 2012) que han llevado a la pérdida de varios servicios ecosistémicos como el ciclado de nutrientes, la regulación del clima y el agua, los servicios de polinización y la regulación de malezas, plagas y enfermedades (Power, 2010; Palm et al., 2014).
Dichos procesos de expansión y cambio están caracterizados por la predominancia de un sistema agrícola con una tendencia al mono-cultivo de soja [Glycine max (L). Merr.] (Aizen et al., 2009; Wingeyer et al., 2015), lo que provoca un escaso aprovechamiento de los recursos (agua, radiación solar y nutrientes) reduciendo su eficiencia y productividad (Caviglia et al., 2004; Novelli et al., 2011), por lo cual numerosos autores sostienen que prácticas de manejo tendientes a aumentar el número de cultivos por año, como por ejemplo la inclusión de cultivos cobertura (CC) en la secuencias, aumentan la eficiencia de uso de los recursos y promueven un mayor aporte de residuos al suelo restauran-do algunos de los servicios ecosistémicos pérdidos (Novelli et al., 2011; Novelli et al., 2017; Pinto et al., 2017; Caviglia et al., 2019).
Por otra parte, el avance de la frontera agrícola ha provocado una concentración de las producciones pecuarias en menos superficie y con una alta generación de residuos (Gange, 2016). Debido a que estos residuos son capaces de estimular a los microorganismos del suelo y aportar nutrientes para los cultivos (Pérez et al., 2008; Londoño, 2017), se han implementado prácticas de manejo que tienden a utilizarlos como fuente de nutrientes o como enmiendas orgánicas. El 43% de las granjas avícolas de Argentina se concentran en la provincia de Entre Ríos (Fuente: Ministerio de Producción de Entre Ríos, 2016), siendo la costa del Uruguay la que concentra el 70% de las granjas de producción de carne aviar y la costa del Paraná la que concentra el 70% de las granjas de producción de huevos de la provincia ( Fuente: Ministerio de Producción de Entre Ríos, 2009), por lo que la cama de pollo, un subproducto de la crianza de pollos parrilleros y la gallinaza, un derivado del excremento de las aves ponedoras, son utiliza-dos como enmiendas orgánicas en algunos sistemas agrícolas de la región de manera creciente
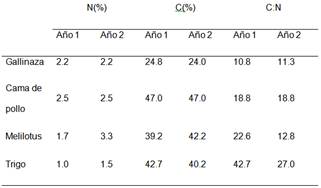
En el sistema de siembra directa, predominante en Entre Ríos y en Argentina, los residuos aéreos de cultivos y de enmiendas orgánicas son dejados en superficie, los cuales se degra-dan liberando nutrientes al suelo (Smith, 1993; Kruger & Quiroga, 2012; Basanta et al., 2008, 2012; Alvarez & Quiroga, 2012; Piñeiro et al., 2014; Pinto et al., 2017). La tasa de descom-posición de esos residuos y la cantidad de nutrientes liberados al suelo están, en parte, reguladas por la relación C:N de los mismos. Los residuos de leguminosas poseen alto contenido de N y por lo tanto baja relación C:N, mientras que los residuos de gramíneas poseen una alta relación C:N (Baker et al., 2001; Mayer et al., 2003; Gentry et al., 2001). De manera similar, las enmiendas orgánicas derivadas de la producción avícola poseen alto contenido de N en su com-posición y en consecuencia, una baja relación C:N.
Las entradas de C y N al suelo a través de la descomposición de los residuos son las que regulan la abundancia y actividad de los microorganismos (Kuzyakov, 2010) y condicionan las estructuras de las comunidades microbianas del suelo (Wall et al., 2019; Ashworth, 2017b). Por lo cual, la cantidad y composición de los residuos de cultivos y enmiendas orgánicas aportadas al suelo influyen directamente sobre los microorganismos del mismo, promoviendo su abundancia y su diversidad funcional (Nair & Ngouajio, 2012; Albiach et al., 2000).
Los microorganismos celulolíticos y nitrificadores del suelo están asociados al ciclado del C y N. Los celulolíticos actúan sobre la celulosa descomponiéndola en sustancias menos complejas, este proceso se denomina actividad celulolítica o celulolisis (Bell et al. 2009; Noe, 2012). Esta actividad metabólica cobra importancia en la descomposición de los residuos aportados al suelo, debido a que están compuestos por celulosa, lignina y otros polifenoles. Los residuos les proporcionan energía y nutrientes a los microorganismos celulolíticos afectando directamente su abundancia y actividad (Voroney et al., 1989; Toresani et al., 1998; Noe, 2012). Por otra parte, los nitrificadores cumplen un rol muy importante en el ciclado del N, estos son pocos abundantes y diversos y obtienen energía a partir de la oxidación del amonio (Adair & Schwartz, 2008; Bollmann et al., 2011). Se ha reportado que la actividad y la abundancia de los microorganismos nitrificadores están afectadas por la composición y tipo de residuos aportados al suelo (Yao et al., 2011).
Aunque es ampliamente conocido que tanto los microorganismos nitrificadores como los celulolíticos son clave en los procesos de trasformación de los nutrientes en el suelo, aún no está claro como se ve afectada la dinámica de estos microorganismos, especialmente su abundancia y actividad, cuando se aportan residuos en superficie provenientes de los cultivos de cobertura y enmiendas orgánicas de diferente composición en condiciones de ausencia de cultivos.
Si bien es ampliamente conocido el efecto de la presencia de raíces sobre la dinámica de los microorganismos del suelo, un enfoque experimental sin cobertura vegetal viva permitiría una identificación más clara de los efectos de la adición de los residuos, tanto de cultivos de cobertura como de enmiendas orgánicas, sobre la abundancia y actividad de los micro-organismos nitrificadores y celulolíticos.
El objetivo de este trabajo es conocer cómo se ven afectadas la actividad y abundancia de los microorganismos nitrificadores y celulolíticos, en dos profundidades de suelo, cuando se aportan enmiendas y residuos aéreos de CC de diferente composición en superficie y en ausencia de cultivos.
MATERIALES Y MÉTODOS
Experimento
Se llevó a cabo un experimento durante dos años consecutivos, desde septiembre de 2014 hasta abril de 2015 (Año 1, periodo que abarca 208 días) y desde octubre de 2015 hasta abril de 2016 (Año 2, periodo que abarca 210 días), en un campo de la estación experimental de INTA Paraná (-31º 50,9 'S; -60º 32,3' W), provincia de Entre Ríos (Argentina) sobre un suelo Argiudol ácuico, serie Tezanos Pinto (Plan Mapa de Suelos, 1998; Soil Survey Staff, 2010) bajo siembra directa desde 1998. Al inicio del experimento la concentración de N y C del suelo (0-0.02m) fue de 0.13 y 1.65%, respectivamente, mientras que la relación carbono: nitrógeno fue de 11.79 y el pH 6.2.”
Los tratamientos incluyeron la adición de diferentes residuos aplicados sobre la superficie del suelo durante dos años consecutivos (Año1 y Año 2): dos residuos de cultivos de cobertura y dos enmiendas orgánicas. Los residuos de cultivos de cobertura fueron trigo (Triticum aestivum L.) y Melilotus (Melilotus albus Medik) obtenidos de cultivos de cobertura cultivados en otros lugares, mientras que las enmiendas orgánicas se compostaron de desperdicios de aves y estiércol obtenidos de producciones comerciales de la zona. También se incluyó un tratamiento testigo sin adición de residuos. Se utilizó un diseño de bloques completos al azar con cuatro repeticiones. Se respetó la misma ubicación del tratamiento dentro del bloque durante los dos años.
En cada parcela se adicionaron 5 t C ha-1 de residuos por año, por lo tanto, la cantidad total de materia seca de los residuos agregados anualmente varió de 12 a 12,5 t ha-1 para residuos de cultivos de cobertura, de 20,2 a 20,8 t ha-1 para la gallinaza, mientras que la cantidad de cama de pollo agregada fue de 10,7 t ha-1 en ambos años.
Las enmiendas orgánicas se compostaron previamente para reducir su carga bacteriana, mientras que los residuos de los cultivos se cortaron, secaron en estufa a una temperatura de 40 °C y se almacenaron hasta la adición. El compostaje se realizó colocando ambas enmiendas en forma de parva, se controló la temperatura periódicamente hasta que la misma descienda e iguale a la temperatura ambiente y se mantenga en el tiempo, considerando en este momento la estabilización de la misma. Los residuos se añadieron el 24 de septiembre de 2014 (año 1) y el 1 de octubre de 2015 (año 2).
El experimento se mantuvo libre de cultivos y malezas durante el período de dos años, ya que no se sembraron cultivos de verano y las malezas se eliminaron utilizando métodos manual y químico.
Información climática
La información sobre las precipitaciones diarias ocurridas, la temperatura media del aire y la temperatura media del suelo a 0.05m de profundidad durante el periodo del experimento (año 1 y año 2) fue obtenida del Observatorio Agrometeorológico de la EEA Paraná del INTA. El experimento se encontraba a menos de 150 m de distancia del observatorio.
Caracterización de los residuos aportados
El contenido de nitrógeno total (N) y el carbono total (C) de los residuos se determinó mediante combustión seca utilizando un autoanalizador LECO TRU SPEC (Leco Corp., St. Joseph, MI, EE. UU.) (Tabla 1)
Muestreo de suelos
Se realizaron muestreos de suelo a 0-0,05 m y a 0,05-0,2 m de profundidad para determinar la actividad y abundancia de los microorganismos nitrificadores y celulolíticos en tres momentos en cada año de experimentación (Tabla 2).
A una alícuota de la muestra se le determino el contenido de humedad mediante el método gravimétrico. El resto de las muestras fueron secadas al aire, molidas y tamizadas por 2 mm. Luego se guardaron en heladera para su conservación hasta realizar las determinaciones de actividad y abundancia de microorganismos nitrificadores y celulolíticos.
Determinaciones microbiológicas
La actividad nitrificadora se determinó mediante incubación aeróbica (24 h en NH4 + 1,5 mM y 1 mM de tampón de PO4) y cuantificación de nitrato (Verchot et al., 2003; Ceccherini et al., 2008; Noe y Abril; 2013). Se suspendieron dos sub-muestras de suelo de 20 g en 50 ml de tampón (NH4 + 1,5 mM y PO4- 1 mM).
Para una sub-muestra, la fase líquida se extrajo y se cuantificó el nitrato inmediatamente (nitrato inicial), mientras que, en la segunda sub-muestra se incubó, a temperatura ambiente, en un recipiente cubierto con papel film con agitación (100 rpm) durante 24 h y se cuantificó el contenido de nitrato final. El contenido de nitrato inicial y final se determinó mediante espectrometría (Bremmer, 1965). La actividad nitrifica-dora se determinó como la diferencia entre los valores de concentración de nitrato incubados (finales) e iniciales. Los resultados se expresaron como miligramos de NO3- por gramo de suelo (mg NO3 g-1).
La actividad celulolítica se determinó a través de la actividad de la enzima β-glucosidasa. Se cuantificó como la producción de glucosa a partir de un sustrato con exceso de celobiosa después de 24 horas de incubación (Alef & Nannipieri, 1995; Vázquez et al., 2004). Dos sub-muestras de suelo de 20 g se suspendieron en 50 ml de tampón con celobiosa y azida sódica (NaN3 0,2% p / v) (Alef & Nannipieri, 1995).
De manera similar a la actividad nitrificadora, se incubó una sub-muestra durante 24 h con agitación, mientras que la otra sub-muestra se analizó inmediatamente (glucosa inicial). Ambas sub-muestras se filtraron con papel de filtro y el contenido de glucosa se determinó utilizando el método de coloración total del azúcar (Robertson et al., 1999). La cantidad de glucosa formada por la enzima β-glucosidasa se determinó como la diferencia entre la cantidad de glucosa en la sub-muestra incubada y el valor inicial. Los resultados se expresaron como miligramos de glucosa por gramo de suelo (mg g-1).
La abundancia de nitrificadores y celulolíticos en muestras de suelo se determinó mediante el método del número más probable (NMP) en medios líquidos específicos utilizando la tabla de Mc Grady para tres (3) diluciones (Lorch et al., 1995). Del extracto resultante de 1 g de suelo en 0.1 l de agua destilada y esterilizada, se utilizaron diez diluciones seriadas, es decir, 10-2, 10-3 y 10-4 para nitrificadores y 10-6, 10-7, 10-8 para celulolíticos. El medio líquido específico para nitrificadores fue una base mineral más 0,5 g L-1 SO4 (NH4)2 como la única fuente de nitrógeno (N) (Lorch et al., 1995). El medio líquido específico para microorganismos celulolíticos fue una base mineral (Lorch et al., 1995) y un trozo de papel de filtro estéril como fuente de energía y carbono (C). El período de incubación, a 28-30 ºC, fue de 21 días para los nitrificadores y de 15 días para los celulolíticos.
Análisis estadístico
Para evaluar el efecto de los tratamientos sobre la abundancia y la actividad de los nitrificadores y celulolíticos, se utilizó un ANOVA. Las medias dentro de cada factor se compararon utilizando la prueba de Duncan (α = 0,05).
Para evaluar e interpretar mejor las complejas interacciones entre factores y variables se realizaron dos análisis de componentes principales (ACP). En uno de los ACP, se incluyeron los tratamientos en las dos profundidades y la actividad y abundancia de microorganismos nitrificadores y celulolíticos, y el contenido inicial de nitratos y glucosa en todos los momentos de muestreos de los dos años.
Por otra parte, para evaluar el efecto de la composición de los residuos aportados y las relaciones entre variables se realizó un ACP utilizando los resultados solo del muestreo más cercano a la aplicación de los residuos de cada año y en la profundidad 0-0.05 m. En el mismo se incluyeron las variables aporte de nitrógeno y relación C:N de los residuos, actividad y abundancia de microorganismos celulolíticos y nitrificadores, el contenido de nitrato y glucosa inicial determinados para la profundidad 0-0,05 m a los 43 dda del Año 1 y 34 dda del Año 2 . En este último ACP no se incluyó el aporte de carbono por parte de los residuos debido a que la cantidad de residuos adicionada fue la misma para todos los tratamientos (5 t C ha-1). En ambos ACP, sólo los dos componentes principales (CP1 y CP2) se presentaron en un gráfico cartesiano. En este gráfico, los vectores con ángulos cercanos a 0º representan correlaciones positivas entre las variables, mientras que los vectores con ángulos cercanos a 180º representan variables correlacionadas negativamente y los vectores con ángulos de 90° indican que no existe correlación entre las variables. Este método permite discriminar los tratamientos dependiendo de su ubicación entre los cuadrantes del bi-plot.
Los análisis estadísticos se realizaron utilizando el software InfoStat (Di Rienzo et al., 2010).
RESULTADOS Y DISCUSIÓN
Condiciones climáticas
La precipitación acumulada en el Año 1, desde la adición de los residuos hasta el último muestreo, fue de 876mm. Hubo tres eventos de precipitaciones superiores a 50 mm (Figura 1a). En el Año 2, la precipitación acumulada fue de 794mm con cinco eventos de precipitaciones mayores a 50mm (Figura 1b). La temperatura media diaria del aire durante el experimento estuvo entre 13 y 30 °C (Año 1) y entre 12 y 38 °C (Año 2) (Figuras 1a. y 1b).
La temperatura promedio del suelo durante los dos años de experimentación a 0,05 m de profundidad fue similar, i.e. 22,2 °C en el Año 1 y 22 °C en el Año 2.
Humedad de suelo
La humedad del suelo sólo mostró diferencias entre momentos de muestreo (P = 0,0031), no así entre profundidades y tratamientos estudiados (Figura 2).
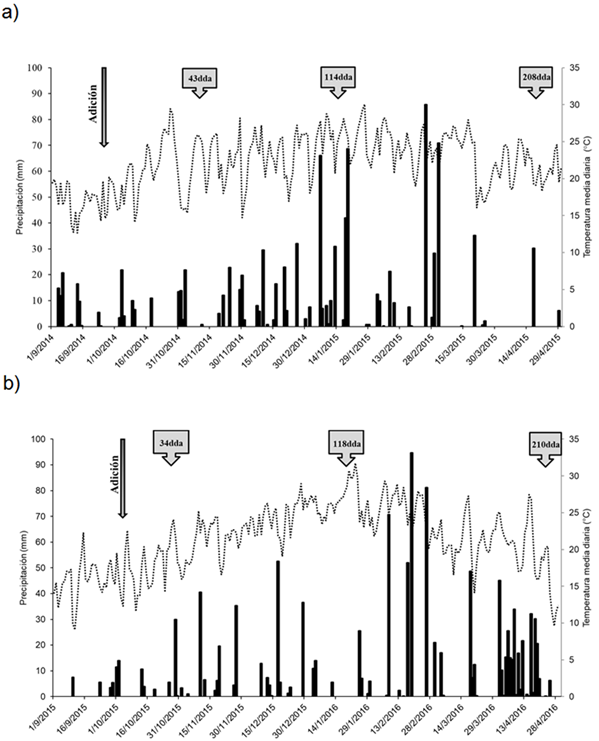
Figura 1 Figure 1 Precipitación diaria (barras) y temperatura media diaria del suelo a 0.05 m de profundidad (línea continúa punteada) desde la adición de los residuos (flecha descendente) hasta el último muestreo de suelos para a) año 1 y b) año. La flecha indica el momento de adición de los residuos y los cuadros con flecha indican los momentos de muestreo de suelo en días desde la adición de los residuos (dda) Daily rainfall (black bars) and mean soil temperature at 0.05m depth (dotted line) during the experimental period in a) year 1 and b) year 2. The arrows incate the moment of residues addition and the boxes with arrow indicate soil sampling date in days after residues addition (dda). For additional references see Table 1

Figura 2 Figure 2 Contenido de humedad del suelo en diferentes fechas de muestreo (43, 114, 208 días después de la adición [dda] del Año 1 y 34, 118 y 210 dda del Año 2), después de la adición de los residuos. Las barras de error muestran el error estándar de la media. Soil water content in different sampling dates (43, 114 and 210 d after residues addition in year 1 and 34, 118 y 210 after residues addition in year 2). Error bars indicate standard error of the mean.
Actividad nitrificadora
Durante los dos años de experimentación, los valores de actividad nitrificadora estuvieron entre 0,01-0,54 mg NO3 g-1 en la profundidad de 0-0,05 m y entre 0,001-0,18 mg NO3 g-1 para la profundidad 0,05-0,20 m, i.e. el rango de variación fue mayor en la menor profundidad. Se encontró para la actividad nitrificadora una fuerte interacción entre tratamientos, profundidades y momentos de muestreo evaluados (P < 0.0001). Al analizar cada profundidad y momento se encontró que en ambas profundidades los tratamientos se diferenciaron entre sí en los momentos 114 dda y 208 dda en el primer año de experimentación (Año 1) y en todos los momentos de muestreo del segundo año de experimentación (Año 2) (Figura 3a y b).
En la profundidad 0-0.05 m, el aporte de gallinaza mostró mayor actividad nitrificadora en el primer año (Año 1) con respecto al resto de los tratamientos a los 114 dda, al igual que a los 34 dda y 118 dda del segundo año (Año 2), destacándose que a los 118 dda del Año 2 ambas enmiendas orgánicas mostraron valores significativamente mayores (P < 0.005) con respecto al resto de los tratamientos evaluados. Sin embargo, a los 208 dda del primer año, el trigo fue el que presentó la mayor actividad nitrificadora (Figura 3a).
En la profundidad 0,05-0,2 m los tratamientos mostraron diferencias significativas (P < 0.05) en la actividad nitrificadora, en casi todos los momentos de muestreo excepto en el inicial del primer año de estudio (43 dda) (Figura 3b). En el primer año (Año 1) de experimentación a los 114 dda, los tratamientos cama de pollo, gallinaza y el testigo mostraron los mayores valores de actividad nitrificadora con respecto al resto de los tratamientos, sin embargo, a los 208 dda, los tratamientos cama de pollo y melilotus mostraron mayor actividad nitrificadora respecto el resto de los tratamientos. En el Año 2, a los 34 dda, el testigo mostró los menores valores de actividad nitrificadora respecto al resto de los tratamientos que no difirieron entre sí. Por otro lado, a los 118 dda y 210 dda la actividad nitrificadora fue significativamente (P < 0,03) mayor en el tratamiento gallinaza (Figura 3b).
Abundancia de microorganismos nitrificadores
La abundancia de microorganismos nitrificadores durante los dos años de experimentación mostró un rango similar de valores entre profundidades, i.e. entre 2,5 y 8 log g-1 para la profundidad 0-0,05 m y entre 2,9 y 8 log g-1 para la profundidad 0,05-0,20 m. Se encontró una interacción significativa entre tratamientos, profundidades y momentos de muestreo evaluados (P < 0.006).
En la profundidad 0-0,05 m, las diferencias entre los tratamientos en cuanto a la abundancia de microorganismos nitrificadores se verificó a los 114 y 208 dda del Año 1 y a los 34 y 210 dda del Año 2 (Figura 4a).
Por otra parte, en la profundidad 0.05-0.2 m, en el año 1, si bien no hubo diferencias significativas entre los tratamientos, la adición de enmiendas (cama de pollo y gallinaza) mostraron valores de abundancia levemente mayores con respecto al resto de los tratamientos en los momentos 114 y 208 dda. (Figura 4b). Además, en los muestreos del año 2, a los 118 dda los tratamientos cama de pollo, melilotus y trigo mostraron valores significativamente mayores con respecto al resto. Sin embargo, a los 210 dda, los tratamientos cama de pollo y gallinaza fueron los que mostraron los menores valores (Figura 4b).
La actividad celulítica mostró diferentes valores entre las profundidades (P < 0,0001), con valores medios de 0,07 y 0,05 mg g-1 para 0-0,05 m y 0,05-0,2m, respectivamente. Además, se detectó triple interacción entre tratamientos, profun-didades y momento de muestreo (P < 0.01). Sólo hubo diferencias significativas entre tratamientos en la profundidad 0-0,05 m, en la que el tratamiento gallinaza mostró el mayor valor de actividad en casi todos los momentos de muestreo excepto a los 208 dda del Año 1 y 34 dda del Año 2 (Figura 5a). En la profundidad 0,05-0,2 m (Figura 5b) los tratamientos mostraron diferencias significativas, excepto a los 43 dda del Año1, sin mostrar un patrón claro y definido en los diferentes momentos de muestreo.
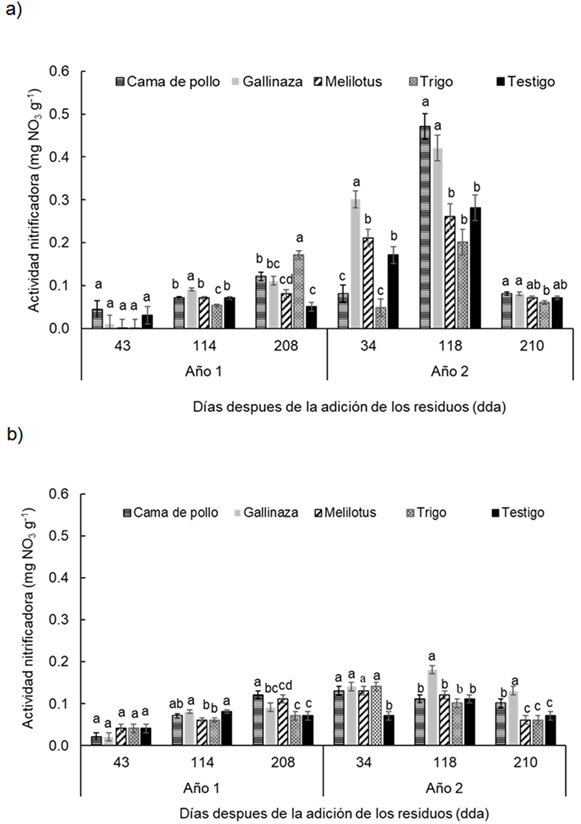
Figura 3 Figure 3 Actividad nitrificadora en diferentes fechas de muestreo (43, 114, 208 días después de la adición [dda] del Año 1 y 34, 118 y 210 dda del Año 2), después de la adición de los residuos en: a) 0-0.05 m y b) 0.05-0.20 m de profundidad del suelo en un experimento realizado durante dos años consecutivos en Paraná, Argentina (-31° 50,9′; -60° 32,3′). Diferentes letras sobre las barras indican diferencias significativas entre los tratamientos dentro de cada fecha de muestreo según la prueba de Duncan (α = 0,05). Las barras de error muestran el error estándar de la media. Activity of nitrifiers in different sampling dates (43, 114 and 210 d after residues addition in year 1 and 34, 118 y 210 after residues addition in year 2) at a) 0-0.05 m and b) 0.05-0.20 m soil depth in a experiment carried-out during two consecutive growing season at Paraná, Argentina (-31°50.9′S; -60°32.3′W). Different letters indicate significant differences between treatments according to Duncan's test (α = 0.05). Error bars indicate standard error of the mean. For further references see Table 1
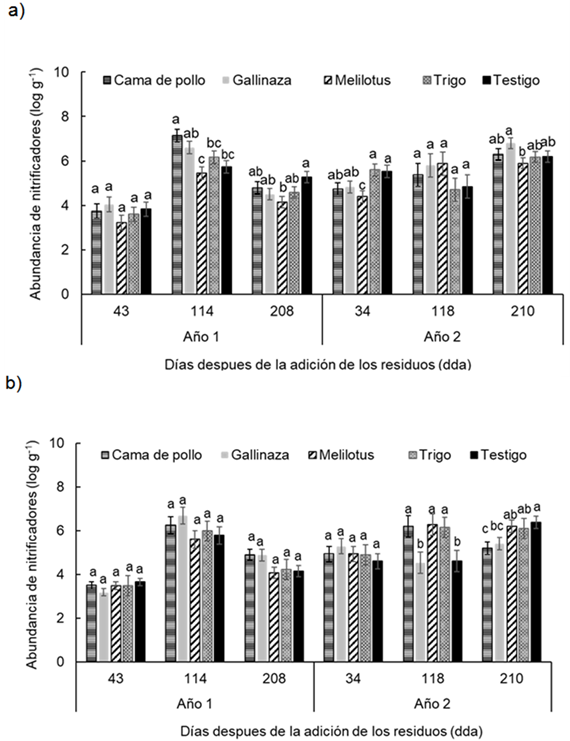
Figura 4 Figure 4 Abundancia de nitrificadores en diferentes fechas de muestreo (43, 114, 208 días después de la adición [dda] del Año 1 y 34, 118 y 210 dda del Año 2), después de la adición de los residuos en: a) 0-0.05 m y b) 0.05-0.20 m de profundidad del suelo en un experimento realizado durante dos años consecutivos en Paraná, Argentina (-31° 50,9′; -60° 32,3′). Diferentes letras sobre las barras indican diferencias significativas entre los tratamientos dentro de cada fecha de muestreo según la prueba de Duncan (α = 0.05). Las barras de error muestran el error estándar de la media. Abundance of nitrifiers in different sampling dates (43, 114 and 210 d after residues addition in year 1 and 34, 118 y 210 after residues addition in year 2) at a) 0-0.05 m and b) 0.05-0.20 m soil depth in a experiment carried-out during two consecutive growing season at Paraná, Argentina (-31°50.9′S; -60°32.3′W). Different letters indicate significant differences between treatments according to Duncan's test (α = 0.05). Error bars indicate standard error of the mean. For further references see Table 1
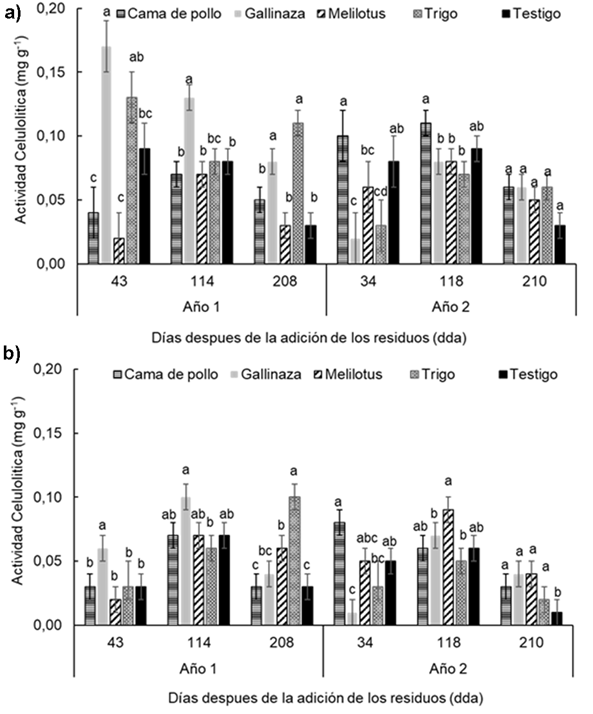
Figura 5 Figure 5 Actividad celulítica en diferentes fechas de muestreo (43, 114, 208 días después de la adición [dda] del Año 1 y 34, 118 y 210 dda del Año 2), después de la adición de los residuos en: a) 0-0.05 m y b) 0.05-0.20 m de profundidad del suelo en un experimento realizado durante dos años consecutivos en Paraná, Argentina (-31° 50,9′; -60° 32,3′). Diferentes letras sobre las barras indican diferencias significativas entre los tratamientos dentro de cada fecha de muestreo según la prueba de Duncan (α = 0,05). Las barras de error muestran el error estándar de la media. Cellulolytic activity in different sampling dates (43, 114 and 210 d after residues addition in year 1 and 34, 118 y 210 after residues addition in year 2) at a) 0-0.05 m and b) 0.05-0.20 m soil depth in a experiment carried-out during two consecutive growing season at Paraná, Argentina (-31°50.9′S; -60°32.3′W). Different letters indicate significant differences between treatments according to Duncan's test (α = 0.05). Error bars indicate standard error of the mean. For further references see Table 1.
Abundancia de microorganismos celulolíticos
En el conjunto de los datos, la abundancia de los microorganismos celu-lolíticos mostro diferencias significativas entre las profundidades estudiadas (P < 0,025), aunque con valores muy similares. En la profundidad 0-0.05 m la abundancia de celulolíticos mostró valores entre 5,78 y 9,46 log g-1 y para la profundidad 0,05-0,2 m los valores fueron entre 5,48 y 9,46 log g-1. Por otra parte, la abundancia de micro-organismos celulolíticos mostró una interacción significativa entre tratamientos y profundidades evaluadas (P < 0,033) (Figura 6ayb). Los tratamientos sólo se diferenciaron en la profundidad 0,05-0,2 m, siendo el melilotus y el trigo los que presentaron el mayor valor con respecto al resto de los tratamientos (Figura 6b).
Relación entre factores y variables
Debido a que no hubo un patrón claro y definido en el comportamiento de las variables microbiológicas a través de los diferentes momentos de muestreo, las relaciones entre factores y variables se estudiaron utilizando un análisis de com-ponentes principales (ACP). Este análisis, en el que se incluyeron todos los trata-mientos y las variables medidas en las dos profundidades y diferentes momentos de muestreo, demostró que el 79,5 % de la variabilidad de los datos estuvo explicada por los componentes principales 1 y 2 (CP1 y CP2). En el biplot presentado en la Figura 7 se puede observar que los tratamientos se comportaron de manera diferente en las dos profundidades estudiadas, estos fueron separados por el CP1. El CP2 permitió separar los tratamientos por composición de residuos, agrupando a la gallinaza en los valores negativos del eje, al trigo en los valores positivos del eje y a la cama de pollo y el melilotus cercano al valor 0 del CP2. Además, estos resultados muestran que el contenido de nitrato inicial y la actividad nitrificadora estuvieron fuertemente relacionados entre sí, lo que se refleja en los ángulos agudos entre los vectores, y que ambas variables se vincularon fuertemente con el tratamiento cama de pollo en la profundidad 0-0,05 m.
Por otra parte, tanto la abundancia de microorganismos nitrificadores como de los microorganismos celulolíticos, la actividad celulolítica y el contenido de glucosa inicial estuvieron fuertemente asociados y vinculados a los tratamientos trigo y testigo en 0-0,05 m, mientras que los tratamientos gallinaza y melilotus en esa profundidad no se vincularon con las variables estudiadas (Figura 7). La humedad del suelo no mostró una fuerte asociación con las demás variables estudiadas, pero estuvo más vinculada a todos los tratamientos en la profundidad 0.05-0,20 m (Figura 7).
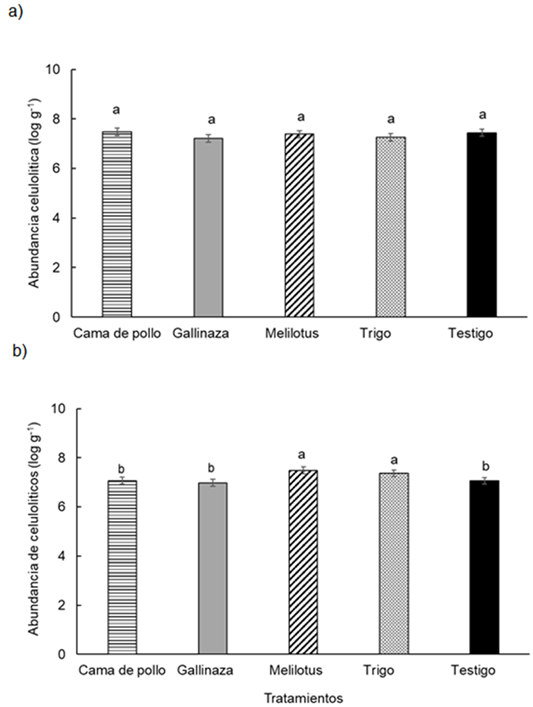
Figura 6 Figure 6 Abundancia de microorganismos celulolíticos en función de los diferentes tratamientos en: a) 0-0,05 m y b) 0,05-0,20 m de profundidad del suelo en un experimento realizado durante dos estaciones de crecimiento consecutivas en Paraná, Argentina (-31° 50, 9'; -60° 32,3'). Diferentes letras indican diferencias significativas entre los tratamientos según la prueba de Duncan (α = 0,05). Las barras de error muestran el error estándar de la media. Abundance of celulolityc microorganisms in different treatments at a) 0-0.05 m and b) 0.05-0.20 m soil depth in a experiment carried-out during two consecutive growing season at Paraná, Argentina (-31°50.9′S; -60°32.3′W). Different letters indicate significant differences between treatments according to Duncan's test (α = 0.05). Error bars indicate standard error of the mean. For further references see Table 1.
Impacto de la composición de los residuos sobre las variables en el primer muestreo
Con el fin de capturar el efecto de la composición inicial de los residuos aplicados, se realizó un ACP donde se incluyeron las variables en el momento de muestreo más cercano al momento de adición para cada año. Las variables consideradas en la profundidad 0-0.05 m a los 43 y 34 dda, i.e. los más cercanos al momento de adición en cada año, fueron: aporte de nitrógeno (N), relación C:N de los residuos, actividad y abundancia de microorganismos celulolíticos y nitrificadores; el contenido de nitrato (NO3 -) y glucosa inicial. Este biplot mostró que el 91,3 % de la variabilidad de los datos estuvo explicada por los CP1 y CP2. El contenido de inicial de nitrato, la actividad nitrificadora, la relación C:N y el aporte de N por parte de los residuos tuvieron mayor peso sobre el CP1, mientras que las variables actividad y abundancia de celulolíticos, abundancia de nitrificadores tuvieron mayor peso sobre el sobre el CP2 (Figura 8). Además, se verificó una fuerte asociación negativa entre la relación C:N con el aporte de N de los residuos, la actividad nitrificadora y el contenido inicial de glucosa.
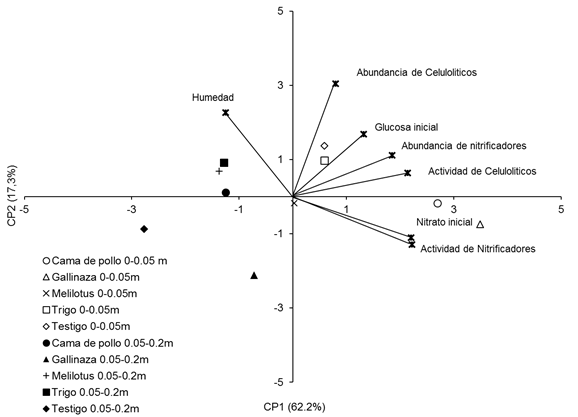
Figura 7 Figure 7 Análisis de componentes principales de variables microbiológicas del suelo y los tratamientos en dos profundidades de suelo: 0-0,05 m y 0,05-0,20 m. Principal component analysis on soil microbiological variables and treatments at 0-0.05 m and 0.05-0.20m depth. Nitrato inicial: Intial soil nitrates concentration, Glucosa inicial: Initial glucose concentation, Actividad de celulolíticos: Cellulolityc activity, Actividad de nitrificadores: Nitrifier activity, Humedad: Soil Mosture. For further references see Table 1.
Los tratamientos fueron separados por su relación C:N a través del CP1, reflejando la similitud entre los tratamientos cama de pollo y melilotus con un C:N promedio de 18 y 17, respectivamente y el fuerte contraste entre trigo (relación C:N 35) y gallinaza (relación C:N 11) (Figura 8).
DISCUSIÓN
El foco de este trabajo estuvo puesto en evaluar el efecto de los aportes de enmiendas orgánicas y residuos aéreos de cultivos de cobertura (CC) sobre la abundancia y actividad nitrificadora y celulítica sin la intervención de cultivos vivos.
En efecto, la presencia de cultivos puede afectar el ambiente del suelo, principalmente disponibilidad de N inorgánico y agua. Una aproximación experimental sin cobertura vegetal viva permitiría identificar con mayor claridad la dinámica de los microorganismos celulolíticos y nitrificadores para una mejor comprensión de los procesos de nitrificación y celulolisis asociados al aporte de residuos de diferente composición. Los resultados obtenidos muestran que, en el promedio de los tratamientos, solo la actividad nitrificadora y celulolítica mostraron diferencias entre profundidades, con mayores valores en la profundidad 0-0,05 m, lo que coincide con lo informado por Asworth et al. (2017). Contrariamente, la abundancia de los microorganismos nitrificadores y celulolíticos fueron similares entre profundidades. Aunque está documentado que en los primeros centímetros del suelo el desarrollo de los microorganismos se ve favorecido (Doran, 1980; Toresani et al., 1998), esta similitud en las abundancias de ambos microorganismos podría estar asociada a la falta de raíces, las cuales liberan exudados que son fuente de carbono (C) y energía para los microorganismos (Gregorutti & Caviglia, 2019; Baudoin et al., 2003), así como también al contenido de humedad, que fue similar en ambas profundidades.
Por otra parte, el estudio de la relación entre los tratamientos y las variables mediante un análisis de componentes principales (ACP) permitió discriminar, de manera integradora, los principales efectos de los tratamientos estudiados en dos profundidades del suelo, en los diferentes momentos de muestreo sobre la actividad y la abundancia de los microorganismos nitrificadores y celulolíticos (Figura 7).
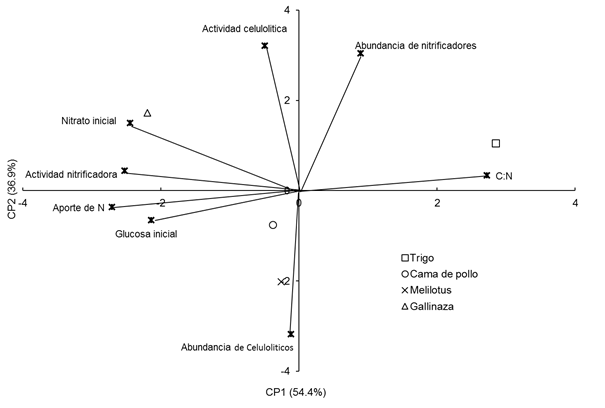
Figura 8 Figure 8 Análisis de componentes principales de variables y tratamientos en la profundidad de muestreo de 0-0,05 m a los 43 y 34 días desde la adición de los residuos en el Año 1 y 2, respectivamente. Principal component analysis on variables and treatments at 0-0.05 m depth in sampling date 43 d after residues addition in year 1 and 34 d after residues addition in year 2. For further references see Table 1 and caption of Figure 7.
En dicho análisis, se encontró una fuerte relación entre el contenido de nitrato y la actividad nitrificadora; y ambos, negativamente asociados a la humedad del suelo, lo cual coincide por lo reportado por Gregorutti & Caviglia, (2019) quienes sugirieron que esta relación negativa podría deberse a que los microrganismos nitrificadores, altamente dependientes de O2 para realizar el proceso de nitrificación, hayan encontrado condiciones óptimas de tensión de 02 para desarrollar su actividad con bajos contenidos de humedad en el suelo. Sin embargo, otros autores han reportado que la actividad microbiana está muy afectada por la humedad del suelo, la composición de la biomasa y la mineralización de la materia orgánica nativa (Paul, 2007; Banerjee et al., 2016).
Los resultados del ACP también demostraron que los tratamientos estuvieron más asociados a las variables estudiadas en la profundidad 0-0,05 m, lo cual indicaría que en la profundidad 0-0.05 del suelo la actividad de los microorganismos se ve más beneficiada por la descomposición de los residuos aportados, lo cual coincide con algunos autores que han reportado que en los primeros centímetros del suelo se ve favorecido el desarrollo de los microorganismos (Doran, 1980; Toresani et al., 1998). Además, los tratamientos se asociaron con la humedad en la profundidad 0,05-0,2 m. Estos resultados coinciden con los obtenidos en un experimento a campo con aportes aéreos y de raíces cultivos de cobertura, donde dichos aportes se asociaron fuertemente a la humedad del suelo en profundidad 0,05-0,20m (Gregorutti & Caviglia, 2019). Por otra parte, el CP2 permitió separar los tratamientos por su composición (relación C:N), lo cual coincide con numerosos reportes que demuestran que la composición y la cantidad de los aportes influyen sobre la dinámica de los microorganismos (Bending et al, 1998; Andrade et al., 2003; Li et al., 2018). Se encontró una fuerte asociación entre los contenidos de glucosa inicial, la abundancia de los microorganismos nitrificadores y celulolíticos; la actividad celulolítica y el tratamiento de trigo en los primeros 5 cm del suelo (Figura 7), que indicaría que los residuos con mayor contenido de C en relación al N en sus restos, como el trigo (C:N promedio = 34,5), podrían haber estimulado el crecimiento de los microorganismos celulolíticos con liberación de glucosa.
Los resultados encontrados permiten afirmar que los tratamientos se comportaron de manera diferente en función de la profundidad de estudio y que podrían asociarse a una u otra variable en función de su composición, caracterizada en este trabajo a través de la relación C:N. A raíz de lo cual se estudió la relación entre los tratamientos y variables solo en la profundidad 0-0,05m y se incluyó en el análisis, la relación C:N de los residuos aportados (Figura 8). Este análisis permitió una marcada separación de los tratamientos atribuible a la relación C:N de los residuos, lo que reafirma el concepto de que la composición del residuo afecta de manera diferente a los microorganismos estudiados. La fuerte asociación entre el aporte de gallinaza con la menor relación C:N, respecto a los demás tratamientos, y el contenido inicial de nitratos coincide con lo reportado por Andrade et al.(2003), quienes informaron que la actividad de los microorganismos se vio promovida por el contenido de N del residuo, aumentando la producción de nitratos.
La mayoría de los estudios sobre la dinámica de los microorganismos del suelo han sido realizados con presencia de cultivos vivos (Denef, et al., 2006; e.g. Frasier et al., 2016), donde la cobertura vegetal viva tiene un efecto amortiguador en el suelo con respecto a varios aspectos clave, como la humedad del suelo, el N-NO3- del suelo, la temperatura del suelo y la absorción de N a través de sus raíces. Las raíces que crecen activamente en el suelo son aporte de continuo de carbono a partir de sus exudados (Denef, et al., 2006), los cuales son fuente de energía y carbono ( C) fácilmente disponible para los microorganismos del suelo. Se ha documentado que mantener una rizósfera activa favorece el crecimiento desarrollo y la diversidad de microorganismos del suelo, así como también el ciclado del N y C del suelo (Frasier et al., 2016).
El enfoque experimental utilizado en este trabajo, sin cultivos o cobertura vegetal viva durante dos años, permitió comprender el rol individual que cumple sólo el residuo que queda en superficie, ya sea proveniente de una enmienda orgánica o de la parte aérea de los cultivos de cobertura luego de la supresión de los mismos, sin considerar el rol de las raíces y conocer el efecto puro de la composición de los mismos sobre las variables microbiológicas estudiadas.
El conocimiento de los factores que gobiernan servicios ecosistémicos clave del suelo como el ciclado de C y N y de sus procesos asociados como la celulolisis y la nitrificación se está volviendo cada vez más necesario para el diseño de agroecosistemas sustentables basados en la presencia de residuos en superficie, como los sistemas predominantes de siembra directa de Argentina.
Asimismo, este trabajo permitió conocer aspectos novedosos de la dinámica de microorganismos celulolíticos y nitrificadores utilizando residuos provenientes de una actividad pecuaria creciente en la región, i.e. la avicultura. El agregado de residuos provenientes de producciones animales en confinamiento se está volviendo cada vez más común en la zona agrícola de Argentina, por lo que los conocimientos originales sobre las consecuencias de la utilización de tales residuos, debidamente compostados, sobre la dinámica microbiana es fundamental para acompañar un proceso de creciente adopción de la práctica de adición.
Conclusiones
El efecto de los residuos aportados sobre las variables estudiadas fue diferente según la profundidad y momentos en los que fueron analizados, siendo más marcado el efecto de la composición del residuo aportado en la profundidad 0-0,05 m. Aportes de residuos con baja relación C:N, como las enmiendas orgánicas, se asociaron más fuertemente al contenido de nitrato inicial y la actividad nitrificadora. En contraste, la adición de residuo de trigo, con alta relación C:N, tuvo mayor impacto sobre la glucosa inicial, abundancia de microorganismos celulolíticos y nitrificadores y la actividad celulolítica.
Contrariamente, en la profundidad 0,05-0,20 m la composición del aporte, en general no afectó las variables microbiológicas.
Este trabajo permitió conocer mejor el efecto puro de la adición del residuo aéreo de cultivos de cobertura y de la adición de las enmiendas orgánicas, sin la intervención del aporte de las raíces, sobre la dinámica de microorganismos celulolíticos y nitrificadores. Tales conocimientos son clave para la implementación de agroecosistemas en siembra directa, basados en la presencia de residuos en superficie.