INTRODUCCIÓN
Se consideró tradicionalmente que la anatomía del miocardio estaba conformada por haces de músculos espiralados, pero éstos nunca fueron descritos en consideración a su fisiología. Richard Lower in 1669 consideraba que el miocardio producía un movimiento de torsión relacionado con las fibras helicoidales que componían sus fibras. Expresaba que el corazón ejercía un movimiento similar a “estrujar una toalla” y no como se consideró desde Harvey, que era debido a la expresión radial ventricular con el símil de “cerrar un puño”. 1
Andrés Vesalio en su obra “De Humanis Corporis Fabrica” (1543), se refirió a la dificultad en discernir las capas que componen el miocardio. Expresaba textualmente: “Sea cual fuese la manera en que realices la disección de la carne del corazón, tanto si está cruda como cocida…, a duras penas puedes arrancar una porción de un solo tipo de fibra, porque tienen direcciones múltiples y distintas, sobre todo transversales”.2
Puntualizaba también esta situación, más de tres siglos después, J.B. Pettigrew (1864): “De la complejidad de la disposición no necesito hablar más que Vesalius, Haller y De Blainville,; todos confesaron su incapacidad para descifrarla”.3 R.F. Shaner en 1923 relata que “el miocardio está constituido por dos músculos aplanados en forma de 8. Dichos músculos se enrollan en dirección opuesta en sístole, vaciando su contenido”.4
Discernimos que la falta de una disección anatómica y análisis histológico adecuado del miocardio ha impedido entrever su real estructura-función. Interpretaciones recientes ostentan opiniones controvertidas, fundamentalmente entre los modelos desarrollados de banda y malla. Torrent-Guasp 5,6 a partir de 1973 consideró al miocardio como una banda muscular cardíaca, demostrando en múltiples disecciones que está constituido por un conjunto de fibras musculares retorcidas sobre sí mismas que asemejan una cuerda, aplanada lateralmente, que al dar dos vueltas en espiral define un helicoide que delimita los dos ventrículos. Maclvear 7,8 interpreta que las paredes ventriculares se hallan constituidas por una red intrincada tridimensional de cardiomiocitos. Este modelo en malla implica que los cardiomiocitos se disponen con angulaciones en forma radial y longitudinal.
La reflexión inevitable que surge es que, para efectuar la torsión, el miocardio debería realizarlo sobre un punto de apoyo al igual que un músculo esquelético lo hace en una inserción firme ¿Existe en el corazón esta estructura? Si es real este apoyo, ¿cómo se insertan las fibras del músculo cardiaco en dicha estructura? ¿Se puede diferenciar de los trígonos?
Esta situación de estudio tiene correlación con una estructura cardíaca que presenta características notables: la de ser una bomba aspirante-impelente de un tamaño equivalente a un puño humano y un peso promedio de 270 gramos, que impulsa de 4 a 6 litros/ minuto a una velocidad de 300 cm/s. Su eficacia permite expulsar el 70% del contenido ventricular izquierdo con sólo un 12% de acortamiento en su unidad contráctil, el sarcómero.
El objetivo de este trabajo es demostrar mediante disecciones macroscópicas y estudios microscópicos que el miocardio es un músculo continuo, único y de disposición helicoidal que necesita un punto de apoyo a modo de palanca. Todas estas consideraciones anátomo funcionales investigadas pueden ayudar tanto en los procesos para cuantificar la gravedad de los procesos mórbidos como en las estrategias terapéuticas. 9
MATERIAL Y MÉTODOS
Disección miocárdica en dieciocho corazones: a) diez corazones bovinos de dos años de edad con un peso de 800-1000 g; b) ocho corazones humanos :un embrión de 23 semanas de gestación, uno de una persona de 10 años de edad con un peso de 250 g y seis en adultos con un peso promedio de 300 g.
Análisis histológico e histoquímico de muestras anatómicas. La histología se realizó con hematoxilina-eosina, técnica de tinción tricrómica de Masson y secciones de cuatro micras. Como buffer se utilizó formalina al 10%. Todas las muestras se sometieron a análisis histológico e histoquímico con tinción de azul alcián, marcador fiable para identificar la presencia de ácido hialurónico, como mecanismo antifricción, e incluso proporcionar una valoración semicuantitativa.
Estudios con imágenes. Los corazones de bovino fueron analizados con tomografía computada, resonancia nuclear magnética y radiología simple. Un paciente pudo ser estudiado con tomografía.
Los corazones examinados fueron provistos por la morgue y por matarifes. El corazón a disecar se debe someter a ebullición en agua durante dos horas a la que es conveniente agregar ácido acético (15 cc por litro). Este paso permite que el miocardio quede libre de las aposiciones grasas, volviendo más fácil y prolija la disección. Luego se secciona la aorta y la arteria pulmonar a unos tres centímetros de sus nacimientos y se las separa del adosamiento que estos vasos poseen entre sí, para luego incidir en forma longitudinal a nivel del surco interventricular, las fibras superficiales que se extienden por la cara anterior de los ventrículos en forma transversal. Entre las aurículas y los ventrículos hay simplemente tejido conjuntivo, lo que permite separar con sencillez dichas cámaras, dada la desnaturalización que establece el calor. 10
La maniobra clave para lograr el desenrollamiento miocárdico consiste en introducirse en el surco interventricular anterior en forma roma, lo cual permite dejar en el lado izquierdo del operador el extremo del miocardio que corresponde a la arteria pulmonar y a su contigüidad con la pared libre del ventrículo derecho (segmento derecho). A continuación se ejerce tracción hacia el mismo lado izquierdo, maniobra que deja a la arteria pulmonar totalmente liberada del resto del miocardio. Esta disección del miocardio descubre al fulcro por debajo y delante de la aorta en un plano inferior al trígono derecho y nacimiento de la arteria coronaria derecha, sin continuidad con la válvula aórtica e insertado como un elemento complementario entre aorta y miocardio. Esta estructura, lugar de apoyo del extremo inicial y final del músculo cardiaco es de consistencia más rígida que el trayecto entre los trígonos.
Se debe entender que al desplegar el miocardio, separando la arteria pulmonar y el cordón pulmotricuspídeo (anterior) del segmento ascendente (posterior), se pierde la visión de su integridad anatómica homogénea y funcional. Esta conjunción entre nacimiento y terminación del músculo cardíaco en el fulcro cardíaco constituye un punto de encuentro entre segmento derecho y segmento ascendente, origen y fin del miocardio. De este modo ambos extremos se hallan ubicados en un mismo punto, estando el origen de las fibras del miocardio en un plano anterior a las de su terminación.
La prosecución en la disección del miocardio implica encontrarse con toda la extensión del segmento derecho, el inicio del segmento izquierdo, y en el límite posterior de la cavidad ventricular derecha, con el ángulo diedro constituido por el septum interventricular y la pared libre del ventrículo derecho (segmento derecho). El próximo paso (el más delicado) consiste en posicionarse en el ángulo diedro mencionado anteriormente, entre las fibras del ventrículo derecho y las intraseptales. Esta separación del ventrículo derecho permite ingresar en la parte ventral del tabique. Luego se diseca la parte dorsal del tabique para desmontar y separar la aorta.
Finalmente, en forma roma se separa el plano muscular del segmento descendente del correspondiente al segmento ascendente que conduce al fulcro cardíaco en contigüidad con la aorta, a la derecha del operador, permitiendo extenderlo en toda su longitud. Al poder desenrollar al miocardio en un grosor similar en toda su extensión se evidencia que es único y continuo, y no una construcción heurística.
RESULTADOS
Hemos encontrado en todos los corazones humanos y bovinos estudiados un núcleo subyacente al trígono derecho, cuya estructura histológica ósea, condroide o tendinosa depende del ejemplar analizado (Figuras 1, 2 y 3). El análisis microscópico reveló en los corazones una matriz osteocondral trabecular (fulcro) con líneas segmentarias en bovinos (Figuras 1 y 2). En el corazón humano de diez años se halló una zona central en el fulcro formado por tejido condroide (Figura 4 A). En el feto se encontraron áreas precondroides en un estroma mixoide (Figuras 4 B). En los corazones humanos adultos, el análisis histológico reveló una matriz similar a la de un tendón. Todos los corazones estudiados presentaban inserción miocárdica en la estructura rígida del fulcro (Figuras 2 y 5). No se encontraron miocardiocitos ni en el trígono izquierdo ni derecho ni en la base de las válvulas.
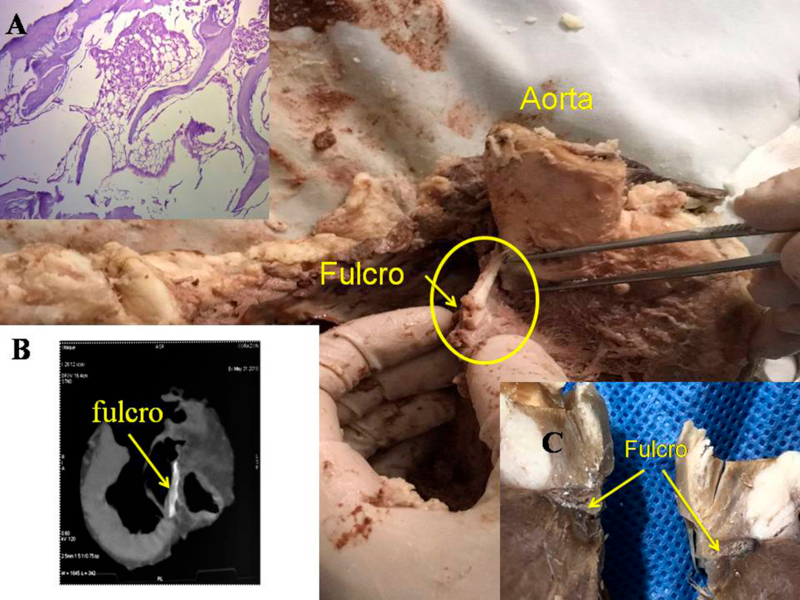
Fig. 1 Fulcro cardíaco (corazón bovino). A. Trabécula ósea madura que configure el tejido del fulcro cardíaco. Técnica de hematoxilina-eosina (10x); B. En el área señalada con la flecha se observa imagen adyacente a la raíz aórtica sobre el septum interventricular (tomografía computada); C. Otra vista del fulcro.
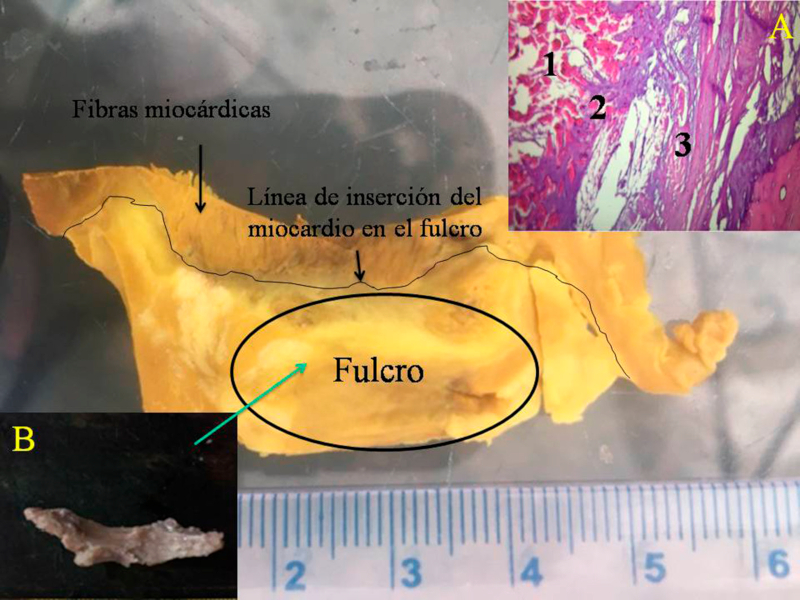
Fig. 2 Obsérvese la línea de inserción de las fibras miocárdicas en el fulcro de un corazón bovino. Histología de la inserción (A). 1. Fibras miocárdicas y estroma mixoide. 2. Cintas miocárdicas en un estroma condroide (inserción). 3. Tejido cortical óseo del fulcro. Técnica hematoxilina-eosina(15x). B. pieza resecada.
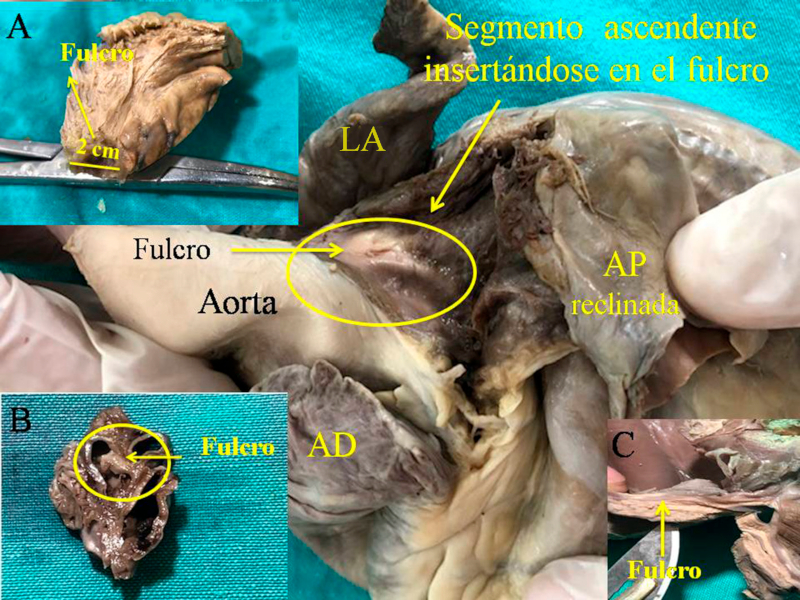
Fig. 3 Fulcro cardíaco (corazón humano). A. 10 años de edad; B. Embrión humano de 23 semanas de gestación; C. Fulcro resecado perteneciente a un corazón humano adulto.
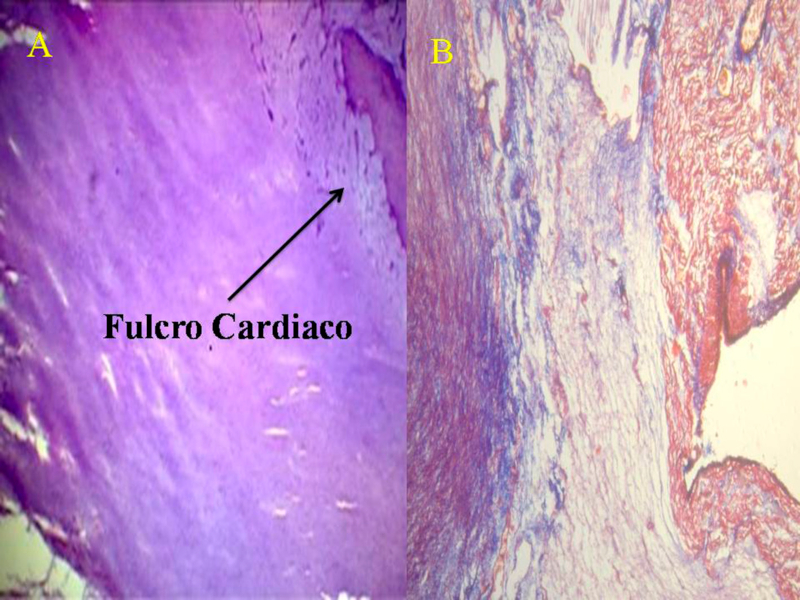
Fig. 4 A. Corazón humano de 10 años de edad. Zona central: área del fulcro formada por tejido condroideo. Técnica hematoxilina-eosina (15x). B. Areas azuladas precondroideas en un estroma mixoide en feto de 23 semanas de gestación. Técnica tricrómica de Masson (15x).
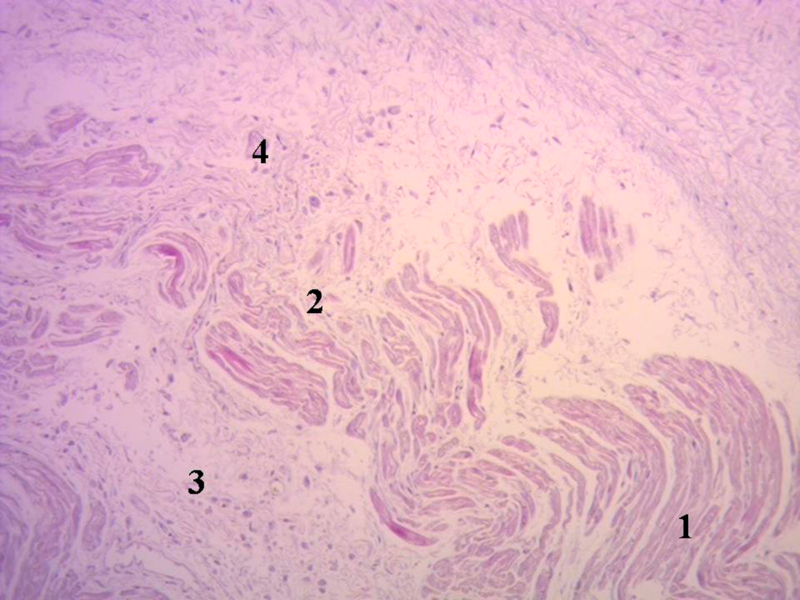
Fig. 5 Miocardiocitos festoneados penetrando en una matriz fibrocolágena (corazón humano adulto). 1. Miocardiocitos, 2. Deshilachamiento de miocardiocitos; 3. Miocardiocitos atróficos, 4. Matriz fibrocolágena. Técnica hematoxilina-eosina (15x).
Este punto de unión implica, como en cualquier músculo esquelético, su capacidad para lograr el soporte necesario y también para actuar como cojinete o almohadilla, evitando que la fuerza de rotación ventricular, ya sea por torque o esfuerzo de torsión se transfiera a la aorta, disipando así la energía producida por el movimiento del músculo helicoidal y evitando la constricción o flexión aórtica durante la eyección sistólica.
Las imágenes radiológicas evidenciaron el núcleo osteo-condroide hallado en la disección, observándose la misma morfología y tamaño análogo (Figura 1). En la tomografía de un paciente estudiado hemos encontrado que el análisis de la región descrita como fulcro cardíaco en las disecciones realizadas, tiene una intensidad en unidades Hounsfield por encima de 110 UH, mientras que el músculo adyacente tiene unidades por debajo de 80 UH. En este paciente, en el área descrita como fulcro, se halló un promedio de 132 ± 4,5 UH y en las áreas adyacentes al músculo miocárdico entre 47,96 ± 12,5 y 77.59 ± 21,64 UH.
DISCUSIÓN
En la investigación realizada se halló en todos los corazones de bóvidos y humanos un núcleo de naturaleza ósea, condroide o tendinosa que hemos denominado fulcro cardiaco. Hacia este se orientan y en él se insertan las fibras del segmento derecho y del segmento ascendente, origen y fin del músculo cardíaco.
La existencia de esta formación, denominada os cordis, en bóvidos, ovejas y chimpancés es un hecho mencionado en la literatura veterinaria, sin ninguna connotación fisiológica.11 Se lo ubica en el mismo sitio en el que nosotros hemos hallado e investigado a esta estructura tanto en bóvidos como humanos. Más allá de su mera alusión en los bóvidos nunca se le asignó ninguna función ni significado de su presencia, y asimismo carece de descripción en el ser humano.
En los corazones humanos analizados los hallazgos son sorpresivos desde la interpretación, partiendo de la base que es lógico considerar su presencia en toda la cadena evolutiva de los mamíferos. Se debe considerar que esta estructura, al analizarse en los distintos especímenes, tiene en común su función de dar sostén al miocardio para poder generar la potencia que necesita cualquier músculo, la cual es diferente en los distintos mamíferos. Por lo tanto su presencia es constante en todos los corazones analizados tanto de bóvidos como humanos, pero su característica estructural es distinta. Y esta diferencia en el análisis íntimo del fulcro cardíaco está indudablemente relacionada con la resistencia que debe oponer a la acción del músculo cardiaco en corazones de portes diferentes.
Un hecho que satisface la lógica de la estructura y mecánica del miocardio es haber hallado en el corazón humano, con la misma localización y similar morfología triangular mencionada en distintas especies, este amarre de las fibras miocárdicas de característica inequívoca a la simple observación y palpación. Sin embargo el análisis histológico en el corazón humano de adulto reveló una matriz similar a un tendón. En este punto, surgen preguntas fundamentales. ¿Por qué el fulcro humano tiene características similares a un tendón, a pesar de que cumple la misma función de amarrar el miocardio a un sostén que tienen las otras especies? ¿Por qué no tiene la misma estructura del corazón humano fetal o infantil?
La interpretación que tenemos es que quizás el fulcro de característica ósea en bovino, chimpancé, oveja y embrión humano, sea un órgano vestigial propio de la evolución de los mamíferos. Se debe entender como estructura vestigial la retención durante el proceso de evolución de atributos genéticamente determinados que han perdido parte o la totalidad de su función ancestral en una especie determinada. Debido a este hecho lo hallamos en el proceso inicial de la gesta humana, pero luego desaparece su carácter óseo, quedando referido a una matriz tendinosa suficiente para conseguir la inserción del miocardio para cumplir con una potencia muscular inferior a otros mamíferos de mayor envergadura. Recordemos que en los bovinos el fulcro hallado en esta investigación es de naturaleza ósea.
El miocardio es un músculo continuo y helicoidal, tal es el resultado de su disección. La función cardiaca no se puede explicar con una conformación en malla. Al respecto, el trabajo de Maclver 7 expresa: “Ninguno de los estudios histológicos del miocardio que conocemos, por el contrario, ha proporcionado ninguna evidencia de un origen e inserción como se describe para la supuesta banda miocárdica única” y “Ninguna de estas investigaciones ha proporcionado ninguna evidencia de una alineación de los cardiomiocitos que sigue el curso de la banda miocárdica única”. En primer lugar, el fulcro cardiaco que hemos investigado en corazones humanos y animales, describe el apoyo cardíaco que daría pie a la disposición muscular única, continua y en hélice que presenta el miocardio.
Con respecto a la segunda conclusión de dicho autor, en la secuencia del análisis histológico del miocardio desplegado se demuestra la orientación longitudinal, de acuerdo a la continuidad de los segmentos que tiene su conformación espacial, tanto en la cara interna como en la externa de cada segmento. Dichas orientaciones resultan paralelas en ambas superficies (interna y externa) en cada uno de ellos. Ningún segmento de la histología secuencial en la continuidad longitudinal del miocardio presenta una disposición en malla. En la cara externa de la parte distal del segmento descendente, al girar a nivel del ápex y transformarse en ascendente, los miocardiocitos generan en los cortes planimétricos una arquitectura disímil a la cara interna en su orientación, único sitio donde sucede esta situación. En el resto la orientación es siempre paralela. En el ápex, el trayecto en espiral de las fibras miocárdicas que se desplazan desde la periferia hacia el centro determina una torsión en donde las fibras subepicárdicas se vuelven subendocárdicas, superpuestas como las tejas en un techo, que es lo que evidencia la imagen comentada. Esto se asemeja a la cinta de Moebius dado el cambio progresivo de la angulación en las fibras transformándose de epicárdicas en endocárdicas.
Se puede observar que el miocardio no se estructura como una malla sino en forma de músculo continuo. 12 El concepto que se ha esgrimido de malla fue elaborado a través del plegamiento de la hélice miocárdica al superponer sus segmentos.
También se ha realizado un análisis histológico sobre los trígonos tratando de hallar cardiomiocitos en ellos, como posibilidad de la inserción del miocardio en dichas estructuras. En nuestra investigación solo se observó tejido colágeno sin cardiomiocitos en los trígonos, confirmando que el fulcro es el sostén del músculo cardiaco, tanto en su inicio como en la terminación.
El miocardio no puede estar anatómicamente suspendido y libre en la cavidad torácica porque le sería imposible eyectar la sangre del corazón a una velocidad de 300 cm/s. Debía haber un sitio de amarre que, hallado, lo denominamos fulcro cardiaco. En ese punto de apoyo las fibras musculares están obligadas inevitablemente a entramarse con el fulcro, el cual de naturaleza conectiva, condroide u ósea, mostró en nuestras investigaciones anatómicas e histológicas dicha inserción, sujetándose tanto al inicio como al fin del músculo cardiaco.
En el fulcro halla el corazón el punto fijo que le permita la mecánica de la torsión muscular. La rotación opuesta del ventrículo izquierdo de la base y del ápex 13,14 permite el desarrollo de presiones elevadas que reducen la tensión, exactamente como “estrujar una toalla”. Esta mecánica, hallada en ratones y humanos, 15,16,17,18 facilita la expulsión del contenido hemático con la fuerza necesaria en un tiempo acotado para irrigar con suficiencia todo el organismo.
Limitaciones
Los especímenes humanos estudiados fueron escasos porque es difícil obtener corazones intactos y bien conservados para una disección meticulosa. Creemos que el trabajo debe ampliarse con un mayor número de corazones humanos, adultos y especialmente niños. Nuestra investigación se limitó a dieciocho corazones, ocho humanos y diez bovinos.















