INTRODUCCIÓN
La sarcoidosis es un trastorno inflamatorio multisistémico de etiología desconocida, que se caracteriza por la formación de granulomas no caseificantes que pueden afectar diferentes órganos. 1) (2 La tasa de afectación cardíaca por sarcoidosis es variable y oscila entre el 20% y el 75%. Los granulomas en la sarcoidosis cardíaca (SC) se pueden encontrar en cualquier parte del corazón, pero el ventrículo izquierdo, el tabique interventricular y el músculo papilar son los más frecuentemente comprometidos. 2 La prevalencia del compromiso cardíaco clínicamente evidente es ~5%, y es una de los principales causas de muerte relacionada con la enfermedad. Los pacientes con SC pueden comenzar con una lesión miocárdica asintomática seguida de insuficiencia cardíaca congestiva, taquiarritmia ventricular, trastornos de la conducción o muerte cardíaca súbita. El diagnóstico precoz del SC es un factor clave para implementar estrategias específicas para mejorar el pronóstico. Los criterios de diagnóstico actuales se basan en las pautas modificadas del Ministerio de Salud y Bienestar de Japón (JMHW) publicadas en 2006 y revisadas en 2017, y en la declaración de consenso de expertos de Heart Rhythm Society (HRS) publicada en 2014. 3) (4 Ambos implican la demostración histológica o la integración de características clínicas y de imagen de relevancia. Sin embargo, el diagnóstico preciso de la SC sigue siendo un desafío debido a las limitaciones de los criterios clínicos existentes y al bajo rendimiento diagnóstico de la biopsia endomiocárdica por la afectación parcheada del músculo cardíaco. Dado que la sarcoidosis puede afectar el miocardio y causar inflamación, edema, fibrosis y remodelación, las técnicas de imagen no invasivas pueden ser de utilidad clínica para detectar todo el espectro de esta enfermedad. 5
En las células inflamatorias, el metabolismo de la glucosa se encuentra aumentado y puede ser detectado por el aumento de la captación de la 18F-Fluordesoxiglucosa (FDG) a través de la tomografía por emisión de positrones integrada con tomografía computada (PET/TC). 6) (7) (8 Con esta técnica podemos documentar la presencia o ausencia de inflamación activa del miocardio, por lo cual hay un creciente interés en la utilización de la PET/TC para el diagnóstico y potencial guía al tratamiento en pacientes con sospecha de SC. 7) (8) (9 El protocolo actual recomendado por la Sociedad Americana de Cardiología Nuclear (ASNC) y de Medicina Nuclear (SNMMI) 8) (10 es la realización de un estudio PET/TC cardíaco tanto del metabolismo con FDG como de la perfusión miocárdica en reposo para poder evaluar los componentes de la SC: el inflamatorio y el fibrótico.
Estudios recientes sugieren combinar los hallazgos de la PET/TC con los patrones de realce tardío de la resonancia magnética cardíaca (RMC) para incrementar la sensibilidad diagnóstica de esta patología. 11) (12) (13) (14
El objetivo del presente estudio fue evaluar el valor complementario de la RMC y la PET/TC para establecer la posibilidad de padecer SC e inflamación activa del miocardio en pacientes con sospecha de SC.
MATERIAL Y MÉTODOS
Se analizaron en forma retrospectiva 6 pacientes consecutivos (4 hombres y 2 mujeres) referidos a nuestro servicio PET entre diciembre de 2018 y julio 2020 con sospecha de SC para evaluar inflamación miocárdica. Todos los pacientes realizaron una dieta rica en grasas y baja en carbohidratos 36 hs previas al estudio PET, más 12 horas de ayuno. Se efectuó un estudio de perfusión miocárdica en reposo gatillado con 13N Amonio (0,17 mCi/kg) y a continuación se inyectaron 0,11 mCi/kg de FDG con adquisición de las imágenes cardíacas y de cuerpo entero a la hora de su administración. Todas las imágenes PET se alinearon con una TC de baja dosis y se corrigieron por atenuación (Figura 1). Las imágenes de perfusión en reposo se interpretaron en base a un score de perfusión de suma de 0 a 4 (0: Normal y 4: Ausencia de captación). Para la evaluación de la captación de FDG se utilizó un puntaje de 0 a 4 por método visual (0: Ausencia de captación, 1: Difusa, 2: Focal en difusa, 3: Focal y 4: Multifocal), para cada uno de los 17 segmentos analizados. Además se realizó un análisis semicuantitativo de las imágenes a través del cálculo de valor de absorción máxima de FDG en el área anormal (SUVmáx). En base a la combinación de los hallazgos entre la perfusión miocárdica y la captación de FDG se describieron los siguientes patrones PET 8: 1. Normal: Perfusión normal con ausencia de captación de FDG, 2. Inespecífico: Perfusión normal con captación difusa de FDG, 3. Inflamación: Perfusión anormal con captación focal de FDG (patrón PET mismatch), 4. Fibrosis: Perfusión anormal con ausencia de captación de FDG.
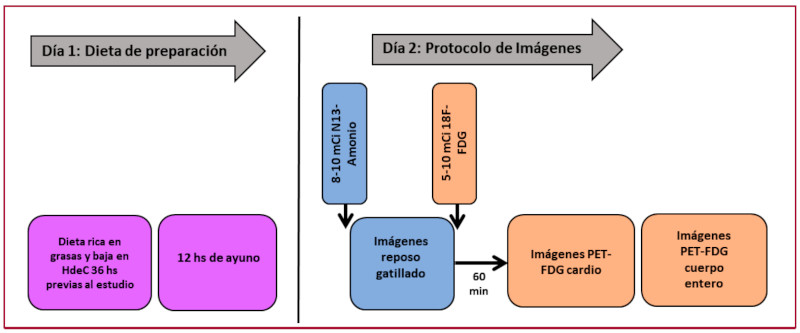
Fig. 1 Protocolo PET/TCEste esquema muestra el protocolo de estandarización de la dieta en los pacientes enrolados en el estudio como así el protocolo de imágenes utilizado para la realización de la tomografía por emisión de positrones integrada con tomografía computada (PET/TC).
A todos los pacientes se les realizó una RMC clínicamente indicada con administración de gadolinio, previo al estudio PET. La presencia y el patrón de realce tardío fue clasificado como: subendocárdico, intramiocárdico, subepicárdico y parcheado. La probabilidad de SC por RMC fue: no (<10%) en ausencia de realce tardío, posible (10-50%): área focal de realce en presencia de diagnósticos alternativos más probables a la SC (por ejemplo, hipertensión pulmonar), probable: (50-90%) áreas multifocales de realce compatibles con SC sin poder descartar otros diagnósticos como la miocarditis, y alta probabilidad: (>90%) áreas multifocales de realce compatibles con patrón de SC en ausencia de diagnóstico alternativo. 14.
Luego de interpretar las imágenes de los estudios PET y de RMC, se combinaron ambos resultados para calcular la probabilidad de padecer SC: no (<10%), posible (10-50%), probable (50-90%) o altamente probable (>90%). El diagnóstico final para cada paciente fue asignado en base a la combinación de los estudios RMC-PET, la revisión de los datos clínicos y otros estudios diagnósticos complementarios. 12) (14) (15
Todos los pacientes firmaron un consentimiento informado previo a la realización del estudio PET y de la RMC.
RESULTADOS
Las características de la población se presentan en la tabla 1. La edad media fue de 60 ± 9 años. El 50% de los pacientes estaban internados al solicitarse la RMC y el estudio PET. Ninguno de los pacientes tenía antecedente de infarto agudo de miocardio. La media de la fracción de eyección ventricular izquierda por PET-gatillado: 42 ± 15%. Tres de los 6 pacientes tenía lesiones no significativas en las arterias epicárdicas por cinecoronariografía, 2 lesiones moderadas y una paciente antecedente de angioplastia a la arteria descendente anterior. Todos los pacientes obtuvieron una adecuada supresión fisiológica de la utilización de glucosa luego del cumplimiento estricto de la dieta. Se pudo interpretar las imágenes de FDG-PET en el 100% de los pacientes.
Tabla 1 Características de la población
| Variables | Pacientes n=6 |
|---|---|
| Demográficas | |
| Edad (años) | 60 ± 9 |
| Hombre | 4 |
| Mujer | 2 |
| Antecedentes clínicos | |
| Sarcoidosis sistémica | 3 |
| IAM previo | 0 |
| Enfermedad coronaria no significativa | 3 |
| Lesiones moderadas | 2 |
| Angioplastia a la arteria DA | 1 |
| RMC previa | 6 |
| Realce tardío | 5 |
| FEVI basal por PET gatillado (%) | 42 ± 15 |
| Biopsia extracardíaca/endomiocárdica | 3 |
Abreviaturas: IAM: Infarto agudo de miocárdico, DA: Descendente anterior, RMC: Resonancia magnética cardiaca, FEVI: Fracción de eyección del ventrículo izquierdo, PET: Tomografía por emisión de positrones.
El 50% de los pacientes referidos al estudio PET presentaban antecedente de sarcoidosis sistémica (grupo: Con SS), en un caso confirmado por biopsia extracardíaca y en los otros 2 pacientes por diagnóstico clínico. Se sospechó SC en 2 de ellos por taquicardia ventricular no sostenida documentada en el ECG Holter y en el restante por disfunción ventricular izquierda y miopericarditis. El 67% de este grupo presentó realce tardío en la RMC. En un paciente el realce era intramiocárdico inferolateral basal y en el otro parcheado (categorías: posible/probable, respectivamente). Las imágenes PET cardio-dedicadas mostraron los siguientes patrones: 2 pacientes con patrón normal y 1 paciente con patrón de fibrosis. En la adquisición de cuerpo entero, una paciente presentó adenopatías con leve a moderada actividad metabólica (SUVmax: 4,1) en ambos hilios y en el mediastino y en los otros 2 pacientes se observó compromiso ganglionar supra e infradiafragmático, con un incremento difuso de la captación de 18F-FDG en la médula ósea en uno de los casos (SUVmax: 3,6).
Del otro 50%, con sospecha de SC aislada (grupo: Sin SS), 2 pacientes padecían de insuficiencia cardíaca descompensada y taquicardia ventricular no sostenida y una paciente presentó fibrilación auricular de alta respuesta en contexto de disfunción ventricular izquierda. Todos los pacientes de este grupo presentaron en la RMC realce tardío extenso y parcheado a predominio intramiocárdico, presentándose a la miocarditis como diagnóstico diferencial (categorías: probable para SC). Las imágenes PET mostraron los siguientes patrones: 1 paciente presentó patrón normal, 2 pacientes patrón inespecífico (SUVmáx: 1,27± 2,02), (Figura 2). Las imágenes de cuerpo entero no mostraron captación patológica de FDG. Sólo en un paciente se detectó un incremento difuso de captación de FDG en la glándula tiroides (SUVmax: 5.3) como hallazgo incidental.

Fig. 2 Ejemplos del valor complementario de la RMC con los patrones PETSe ejemplifican a través de 3 casos los patrones combinados de resonancia magnética cardíaca (RMC) y de tomografía por emisión de positrones (PET) en la sospecha de SC de los pacientes de nuestro estudio.Abreviaturas: MC: motivo de consulta, Dx: diagnóstico, ICC: insuficiencia cardíaca congestiva, Tto: tratamiento, ETT: ecocardiograma transtorácico, MP: motilidad parietal, L-M: leve a moderado, FSVI: función sistólica del VI, SC: sarcoidosis cardíaca, TC: tomografía computada.
Con la combinación de los patrones de perfusiónFDG PET y el realce por RMC se reclasificó a los pacientes: 50% de los pacientes tuvo menos del 10% de probabilidad de padecer SC y el otro 50% se clasificó como posible (Figura 3). Ninguno de los 6 pacientes recibió tratamiento inmunosupresor.
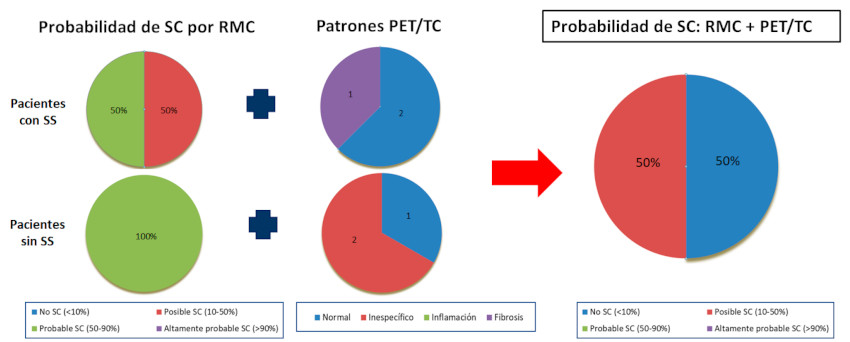
Fig. 3 Reclasificación de probabilidad de SC por RMC + PET/TCDistribución de la probabilidad de sarcoidosis cardíaca (SC) basada en la resonancia magnética cardíaca (RMC) y los hallazgos de los patrones de la tomografía por emisión de positrones (PET). Se muestra en el panel de la derecha la probabilidad de sarcoidosis cardíaca (SC) al combinar ambos métodos.Abreviaturas: SS: sarcoidosis sistémica, TC: tomografía computada.
A 3 de los 6 pacientes de nuestro estudio se les realizó una biopsia endomiocárdica (BEM). En 2 pacientes la BEM fue inespecífica y en otro positiva. Los 3 pacientes presentaron realce tardío en la RMC mientras que la PET mostró patrón normal e inespecífico en los pacientes con BEM inespecífica. En el paciente con BEM positiva el patrón PET fue de fibrosis (sin inflamación activa del miocardio pero con defectos de perfusión miocárdica).
DISCUSIÓN
El principal hallazgo del presente estudio es que en nuestro grupo de pacientes la combinación de la RMC con la PET reclasificó la posibilidad de padecer SC. Sumando los hallazgos de los patrones de imágenes PET/ RMC al cuadro clínico, a otros estudios de imágenes disponibles y a información histopatológica, ninguno de los pacientes recibió tratamiento inmunosupresor.
Los criterios diagnósticos para la SC se basan en las guías de la sociedad Japonesa y en la del Ritmo cardíaco, los cuales involucran a la demostración histológica de la SC por BEM y a la integración de datos clínicos con patrones específicos en estudios complementarios con imágenes. 3) (4 Modalidades de avanzada como la RMC y el PET con FDG surgen como nuevas herramientas para mejorar la precisión diagnóstica de esta entidad, ambas recientemente incorporadas a dichas las guías 3) (4. En general, la PET con FDG tiene mayor sensibilidad y la RMC mayor especificidad en el diagnóstico de SC. 7) (11) (13 Cuando combinamos ambas técnicas para diagnosticar SC la sensibilidad es del 94%. 12 Es importante remarcar que pocos estudios existen en la literatura que comparen la sensibilidad y la especificidad de la combinación de ambas modalidades en la evaluación de la sospecha de SC. Probablemente esto esté vinculado al hecho de que en esta patología no existe un patrón oro contra el cual comparar los hallazgos de los estudios de imágenes. 12) (13
Vita y col. 14 publicaron recientemente el valor complementario de este enfoque multimodal, con el que categorizaron en posibilidades diagnósticas para SC a 107 pacientes con sospecha de SC. Los autores reportaron que el 85% tenía realce tardío en la RMC mientras que el 76% tenía captación patológica de FDG. Entre los pacientes con realce tardío, el 66% tenía captación anormal de FDG lo que sustenta la hipótesis de que la sola presencia de realce tardío no pueda ser utilizada como guía terapéutica antiinflamatoria. En nuestra población, el 83% de los pacientes tuvieron realce tardío en la RMC y el 67% no presentó captación de FDG en el estudio PET, indicando ausencia de inflamación activa en el miocardio. Nuestros hallazgos refuerzan el concepto del papel complementario de ambas técnicas en la evaluación de la sospecha de SC.
Aunque varios patrones de realce tardío por RMC pueden ser observados en pacientes con SC, los hallazgos más habituales son multifocales y parcheados. Los hallazgos típicos en pacientes con SC incluyen al realce subepicárdico e intramiocárdico junto al septum basal, muchas veces con extensión a la inserción del ventrículo derecho y a la pared inferolateral. Si bien no hay un patrón específico por RMC para el diagnóstico de SC, la extensión del realce tardío es un marcador pronóstico importante. 11) (14) (16
Los estudios de PET para el estudio de esta entidad, de acuerdo con las guías de ASNC y SNMMI, deben incluir tanto un estudio de perfusión miocárdica en reposo como de FDG para diferenciar los diferentes patrones de la enfermedad. 8 Utilizamos a la FDG para obtener imágenes de inflamación en la sarcoidosis porque la captación de FDG se encuentra aumentada en las regiones del miocardio con alta densidad de macrófagos. Este incremento en la captación de FDG se debe a que los macrófagos presentan elevados niveles de proteínas GLUT y de hexoquinasa. 5) (17) (18 Al combinar el estudio de perfusión miocárdica con el de FDG, la PET permite evaluar todo el espectro de la SC (desde el miocardio normal, pasando por la inflamación activa, hasta la fibrosis sin inflamación). 5,8 Es importante remarcar que la evaluación combinada de perfusión e inflamación posee valor pronóstico. 8) (9) (12) (14) (19 Estudios recientes mostraron que el valor pronóstico de la captación anormal de FDG parece ser mayor cuando se asocia a defectos de perfusión miocárdica. 8) (12) (14 Debe remarcarse la importancia clínica de identificar defectos de perfusión y una captación anormal de FDG por el miocardio, porque estos pacientes se encuentran con un riesgo muy elevado de muerte y de arritmias ventriculares en comparación con pacientes que presentan un estudio PET normal 19) (20. Específicamente, los pacientes que presentan patrón PET mismatch y captación de FDG en el ventrículo derecho, tienen el peor pronóstico 20. Esto implica que, en parte, la precisión diagnóstica del estudio con FDG dependerá de la adecuada supresión fisiológica de la utilización de glucosa por el miocardio normal, la cual se obtiene con una dieta apropiada baja en carbohidratos y alta en grasas. 20) (21 22) (23 En nuestro estudio, los pacientes realizaron una dieta de supresión previa al examen PET, obteniendo imágenes de excelente calidad en todos los participantes. Por lo cual, los hallazgos de nuestro estudio no pueden ser atribuidos a factores técnicos por preparación inadecuada del paciente. Siguiendo las recomendaciones de las guías, todos los pacientes fueron analizados según los patrones combinados de la perfusión miocárdica con 13N Amonio con los de FDG y se decidió la terapéutica considerando el contexto clínico de los pacientes junto a otros estudios complementarios. 8) (14
Limitaciones del estudio
Nuestro estudio tiene varias limitaciones: 1) Como describimos previamente, la RMC y el estudio PET con FDG evalúan procesos patológicos diferentes: fibrosis, vía realce tardío en el primero e inflamación a través de la captación FDG por los macrófagos en el segundo. 24 Es importante enfatizar que ninguna de las dos técnicas es específica para diagnosticar fibrosis o inflamación causada por SC. 20) (22) (24) (25) (26) (27) (28 La miocarditis, la necrosis y la hibernación miocárdicas, entre otras patologías, pueden presentar patrones similares a los descriptos en la sospecha de SC por ambas modalidades. 14) (20 Por lo cual, la información obtenida tanto por la RMC como por la PET debe ser siempre interpretada dentro del cuadro clínico del paciente y en el contexto de otros estudios complementarios. 2) El n de nuestra población es bajo por lo cual no podemos realizar comparaciones estadísticas entre los 2 grupos de pacientes analizados (i.e.: con SS y sin antecedente de SS). 3) Si bien nuestra población de pacientes es pequeña, al ser la SC una patología poco prevalente, nuestros hallazgos proveen relevante información diagnóstica de acuerdo con publicaciones previas.
CONCLUSIONES
En nuestra población de pacientes con sospecha de SC e inflamación, realizamos un estudio PET luego de la RMC para calcular probabilidades de padecer SC. Luego de combinar los patrones de realce tardío por RMC y los patrones de perfusión/FDG por PET, ninguno de los pacientes recibió tratamiento inmunosupresor. En ausencia de un patrón oro, se sugiere que el diagnóstico de SC se base en probabilidades de acuerdo a patrones de imágenes y cuadro clínico específicos para eventualmente guiar la terapéutica.
Declaración de conflicto de interés
Los autores declaran que no tienen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/Material suplementario).














