INTRODUCCIÓN
La insuficiencia cardíaca (IC) afecta entre 1-2% de la población adulta. Se subdivide de forma clásica en dos fenotipos según la fracción de eyección del ventrículo izquierdo (FEVI), la IC con FEVI levemente reducida o preservada, y la IC con FEVI reducida (IC FEVIr). La terapia de resincronización cardíaca (TRC) está indicada principalmente en pacientes con FEVIr que presentan un remodelado cardíaco importante, con dilatación de cavidades y alteraciones de la conducción ventricular, asociadas fuertemente con un pronóstico pobre. 1-5
La TRC busca corregir la disincronía cardíaca con la estimulación de ambos ventrículos para lograr una activación y trabajo contráctil que se acerquen más a lo fisiológico. 6,7 La presencia de un complejo QRS con duración >120 mseg en individuos con IC con FEVIr se detecta en 25-50%, y la presencia de bloqueo completo de rama izquierda (BCRI) en un 15-27%. 8-10 El mayor beneficio se ha observado sumado al tratamiento médico en pacientes sintomáticos, en clase funcional (CF) II-III de la New York Heart Association (NYHA), que se encuentran en ritmo sinusal, y presentan FEVI ≤35%, con QRS de más de 150 mseg de duración y morfología de BCRI. 1,2
Esta técnica ha demostrado su capacidad para optimizar la función cardíaca y reducir las dimensiones cavitarias (remodelado reverso), mejorar síntomas, proveer mayor bienestar y reducir las hospitalizaciones por IC y la mortalidad, cuando el paciente es apropiadamente seleccionado. 11-15 El grado de este remodelado reverso se ha relacionado de forma directa con disminución de la mortalidad y hospitalizaciones. 16-18 Para evaluar la respuesta (si bien las definiciones son heterogéneas) se utilizan distintos parámetros clínicos, como la mejora de la CF NYHA, tasa de hospitalizaciones por IC y mortalidad. Las medidas más comúnmente utilizadas para medir el impacto estructural y funcional son ecocardiográficas, y valoran la presencia y magnitud del remodelado reverso de las dimensiones del ventrículo izquierdo (VI), típicamente mediante el volumen de fin de sístole y la mejoría en la FEVI. Se acepta como una respuesta “positiva” (aunque el valor de corte varía en distintos registros) una reducción del 15% o más en los volúmenes o diámetros ventriculares y el aumento de la FEVI de al menos un 10%. Se ha acuñado el término de “hiper respondedores” para referirse a aquellos pacientes en los que el volumen ventricular se reduce un 30% o más, o que logran mejorar su función sistólica, con FEVI por encima del 50%. Estos pacientes sufren aún menos hospitalizaciones por IC y tienen una sobrevida más prolongada. 19
Aún con estas consideraciones, y con las múltiples mejoras técnicas relacionadas con los estudios de imagen, técnica de implante y disponibilidad de dispositi vos más modernos y confiables, entre 20 y 40% de los pacientes no responden de manera favorable a la TRC (”no respondedores”).
Esto mantiene la inquietud por detectar nuevos marcadores de respuesta, más exactos y a la vez ampliamente accesibles y de fácil interpretación. 16,20 La inducción del denominado remodelado eléctrico reverso se ha descrito como otra potencial herramienta para valorar la respuesta a la TRC; se manifiesta como el acortamiento del QRS, y representa una reducción en el tiempo de activación ventricular nativa (intrínseca). 21-23 Sin embargo, son escasos los reportes que evalúan su utilidad y existen datos controversiales acerca de su asociación con la respuesta clínica y estructural, aunque mayoritariamente se lo ha asociado al remodelado estructural y hasta se ha propuesto como un parámetro rápido, sencillo y de bajo coste para predecir la respuesta positiva a la TRC. 24-27 Nuestra experiencia pretende evaluar el remodelado eléctrico como potencial parámetro de respuesta en pacientes con TRC.
OBJETIVO
Analizar el remodelado eléctrico reverso intraventri cular como parámetro de respuesta a la TRC en individuos con implante al menos hace 6 meses.
MATERIAL Y MÉTODOS
Población
Se incluyeron pacientes vivos portadores de IC crónica, tra tados en el Centro Cardiovascular Universitario del Hospital de Clínicas de Montevideo, entre 2015 y 2021, mediante el implante de un resincronizador cardíaco, con o sin desfibrila dor asociado (TRC-D y TRC-P respectivamente) en al menos 6 meses previos. Todos los pacientes eran portadores de BCRI permanente al momento del inicio de la TRC. El BCRI se definió según las recomendaciones de AHA/ACCF/HRS. 28 Todos ellos se encontraban en CF II o III de la NYHA al momento del implante y contaban con indicación de TRC de acuerdo con las pautas establecidas por la Sociedad Europea de Cardiología. 1,2
Se excluyeron los pacientes que fueran dependientes de marcapasos o se encontraran en ritmo no sinusal al momen to del implante o del control, o que tuvieran implantado un resincronizador como upgrade de un marcapasos con estimulación ventricular derecha previa. También se excluyeron aquellos que presentaran morfología del QRS no BCRI, como bloqueo completo de rama derecha (BCRD). 1,2 Tras aplicar los criterios de inclusión y exclusión se reclutó un total de 23 pacientes. En la Figura 1 se observa el diseño del estudio.
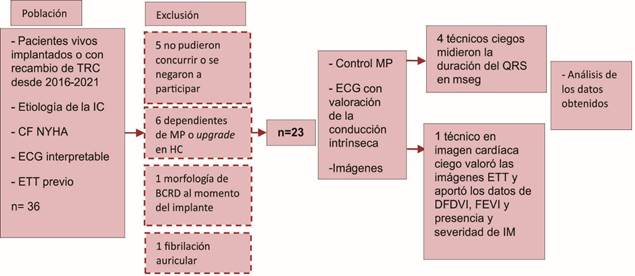
Fig. 1 Diseño del estudio. BCRD: bloqueo completo de rama derecha, DFDVI: diámetro de fin de diástole del ventrículo izquierdo, ECG: electrocardiograma, ETT: ecocardiograma transtorácico FEVI: fracción de eyección del ventrículo izquierdo, HC: historia clínica, IC: insuficiencia cardíaca, IM: insuficiencia mitral, MP: marcapasos, NYHA: New York Heart Association, TRC: terapia de resincronización cardíaca.
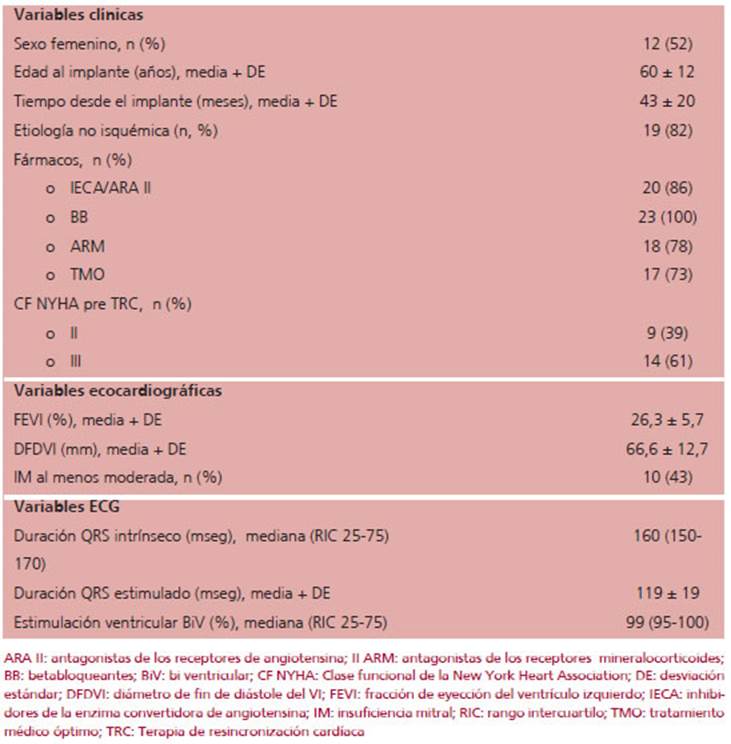
Variables clínicas
Se obtuvieron datos clínicos, ECG, estructurales y funcionales al momento del implante, a partir de lo volcado en la historia clínica y el informe del procedimiento en cada paciente. Además, se registraron los datos obtenidos del control ambulatorio (Figura 1), incluyendo una breve anamnesis sobre la mejoría clínica subjetiva tras la TRC, clase funcional de la NYHA actual y detalles del tratamiento médico farmacológico.
Control del dispositivo, registros y medidas ECG de superficie
A partir de la historia clínica de cada paciente se obtuvo el ECG más cercano previo a la fecha del implante del TRC (complejo QRS “pre TRC”, Figura 1). El día que el paciente concurrió al nuevo control se interrogó el dispositivo con programadores. De allí se extrajo el porcentaje de estimulación biventricular (%BiV). Se registraron dos nuevos ECG de 12 derivaciones estándar por cada paciente, con un electrocardiógrafo FUKUDA DENSHI CARDIMAX FX-2111, calibrado con velocidad del papel a 25 mm/s y a un voltaje de 0,1 mV por mm. El primero de los ECG se registró con el dispositivo de TRC con estimulación con la programación habitual del paciente (QRS estimulado). Para valorar la activación ventricular intrínseca (QRSi post TRC) se registró un segundo ECG a los 5 minutos de suspender de forma transitoria la estimulación, programando el dispositivo a modo de TRC apagado (ODO) o a demanda (VVI) a una FC de 40 ciclos por minuto. Luego del registro, el dispositivo se reprogramó a la configuración previa del paciente.
En estos ECG se constató la presencia o no de ritmo sinusal. Se solicitó a tres electrofisiólogos y un cardiólogo clínico con formación en electrofisiología que midieran la duración de los complejos QRS (mseg) en la que consideramos las derivaciones más representativas, ocultando cualquier dato que pudiera identificar a los pacientes, y asegurando que quienes medían los complejos QRS desconocieran la respuesta a la TRC.
Variables estructurales (ETT)
Se tomó de la historia clínica previa del paciente el informe del ETT más cercano a la fecha al implante del TRC y previo al mismo. De estos informes se obtuvieron los datos de la FEVI pre TRC, el diámetro de fin de diástole del ventrículo izquierdo (DFDVI pre TRC), y la presencia y grado de insu ficiencia valvular mitral (IM pre TRC).
El mismo día del nuevo registro ECG, y tras interrogar el dispositivo, se realizó a cada paciente un nuevo ETT, con un equipo de ultrasonido General Electric Vivid iQ, con un transductor de 3,5 MHz, de acuerdo con las recomendaciones de las directrices de la Sociedad Americana de Ecocardiografía. Se adquirieron imágenes en ventanas paraesternal izquierda y apical de cuatro y dos cámaras, con Doppler color. Un ecocardiografista, también ciego a los datos clínicos, interpretó las imágenes obtenidas, calculó la FEVI mediante método de Simpson biplano (FEVI post TRC), midió el DFDVI y definió la presencia y severidad de la insuficiencia mitral (IM post TRC).
Definición de respuesta a la TRC
Se clasificó al paciente como “respondedor clínico” y/o “respondedor estructural” con base en los criterios más comúnmente utilizados para evaluar la respuesta a la TRC 13,16,29-31, según los cuales:
- “Respondedor clínico”: quien presentó mejoría subjetiva y mejoría (descenso) de por lo menos un nivel de clase funcional de la NYHA respecto al establecido previo al implante.
- “Respondedor estructural”: quien presentó disminución de los diámetros del VI de al menos un 15% y/o aumento de la FEVI de al menos un 10%.
- “Hiper respondedor”: quien presentó disminución de los diámetros del VI de un 30% y/o normalización de la FEVI.
Análisis estadístico
La distribución normal de los datos se verificó mediante la prueba de normalidad de Anderson-Darling. Se presentan las variables continuas como media ± desviación estándar (DE) o mediana ± rango intercuartilo (RIC) 25-75%, según corresponda. Las variables categóricas se presentan con frecuencias absolutas y relativas. Para evaluar los cambios obtenidos en la variable continua de interés QRSi en respues ta a la TRC (análisis pre-post TRC) se utilizó prueba t o test de Wilcoxon para datos apareados, según correspondiera. Además, se procedió a comparar el comportamiento de la variable continua ΔQRSi (QRS post TRC - QRS pre TRC en mseg) entre los grupos de pacientes respondedores vs no respondedores (test de t pareado o test de Mann-Whitney, según correspondiera). Estos análisis se realizaron para la respuesta e hiper respuesta clínica-estructural (CE) en toda la muestra y en determinados subgrupos de pacientes (mujeres vs. hombres, QRS basal ≥150 mseg vs. <150 mseg, mujeres con QRS basal >150 mseg vs QRS <150 mseg, pacientes con vs. sin mejoría de la IM). Se consideró un valor p < 0,05 como estadísticamente significativo. Para todos los análisis de construcción de gráficas se utilizó el software GraphPadPrism versión 9.0.
Consideraciones éticas
Se respetaron los principios de la declaración de Helsinki y sus más recientes enmiendas para experimentación en humanos. Todos los pacientes evaluados fueron informados telefónicamen te acerca del estudio, previo a concurrir. Al momento de realizar la evaluación presencial se obtuvo consentimiento informado escrito en todos los pacientes. El estudio y el consentimiento informado entregado a los pacientes fueron previamente aprobados por el comité de ética del Hospital de Clínicas.
RESULTADOS
Características de la población
Se incluyeron un total de 23 pacientes. Las variables clínicas, ecocardiográficas, vinculadas al dispositivo implantado y electrocardiográficas presentan se en cuentran en la Tabla 1.
Los pacientes de toda la muestra presentaron una distribución similar por sexo, 12 de ellos eran mujeres (52%). El tipo de cardiopatía subyacente fue isquémica en 4 pacientes (18%) y no isquémica en 19 (82%). La edad al momento del implante fue de 60±12 años mientras que la edad al momento del control fue 64±12 años. La media de seguimiento desde el implante hasta el control fue 43 ± 20 meses, con un rango de 7 a 96 meses.
Se observó una alta tasa de cumplimiento de las medidas de tratamiento médico entre los pacientes; 73% de ellos recibían tratamiento simultáneo con betabloqueantes (BB), inhibidores de la enzima convertidora de angiotensina (IECA) /antagonistas de los receptores de angiotensina II (ARAII) /sacubitril valsartán, y antagonistas de los receptores mineralocorticoides (ARM). Todos los pacientes recibían BB al momento del control.
La duración del complejo QRS intrínseco previo a la TRC fue de 160 (150-170) mseg y posterior a la TRC de 160 (140-160) mseg. Nueve pacientes (39%) presentaron al menos una disminución de 10 mseg en la duración del QRSi. La máxima reducción fue de 40 mseg, y ocurrió en tres pacientes. Ocho pacientes mostraron aumento del QRSi y en seis se mantuvo igual.
Análisis de la respuesta a la TRC
En la Tabla 2 se caracterizan los pacientes respondedores a la TRC. Encontramos que 21 pacientes (91%) de nuestra serie fueron “respondedores clínicos”. El ΔQRSi en este grupo fue de -4,7 ± 20,4 mseg. En lo estructural-funcional, tanto el DFDVI como la FEVI mostraron mejoría en respuesta a la TRC durante el control realizado. El DFDVI disminuyó de 66,6 ± 12,7 mm pre TRC a 61,7 ± 12,9 mm post TRC, con un descenso de más del 15% en 7 pacientes (30,4%). La FEVI aumentó de 26,3 ± 5,7% a 41,6 ± 13,4%; un aumento mayor al 10% ocurrió en 16 pacientes (70%).
Quince (65%) de los pacientes fueron considerados “respondedores”, al tener en cuenta tanto criterios estructurales como clínicos. El DFDVI se redujo significativamente, desde 64,6 ± 8,7 mm a 59,8 ± 7,5 mm y la FEVI aumentó de 25,5 ± 6,8% inicial a 40,6 ± 9,5% (Tabla 2). Encontramos 9 pacientes (39%) con comportamiento “hiper respondedor”. Todos ellos presentaron también respuesta clínica.
Como se ilustra en la Tabla 2, el análisis pre-post TRC en el total de los pacientes arrojó que la duración del QRS no mostró una variación significativa tras la TRC.
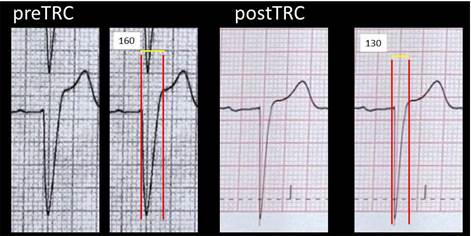
En la Figura 2 se ilustra un caso de la muestra, con medidas del QRSi antes y después de la TRC de un paciente “respondedor”.
Análisis de subgrupos
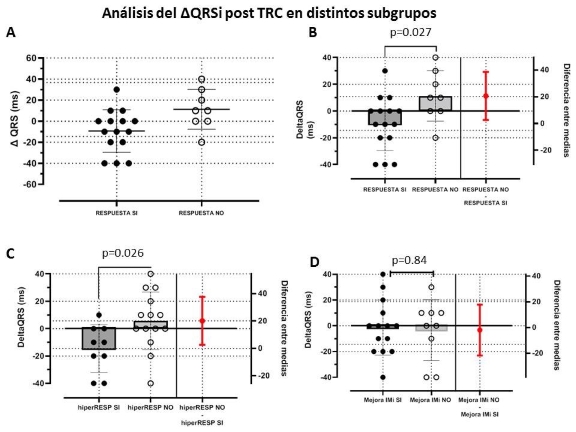
Existió una tendencia en la variación de la duración del QRSi tras la TRC en el subgrupo de mujeres, aunque sin alcanzar significancia estadística (p = 0,056, Figura 3B). Los cambios en la duración del QRSi no fueron mayores en quienes partían de un QRS basal ≥150 mseg (p = 0,65, Figura 3C). Cuando analizamos el subgrupo de mujeres que partieron de un QRS ≥ 150 mseg previo a la TRC se observó una disminución significativa del QRSi (p = 0,0195, Figura 3D).
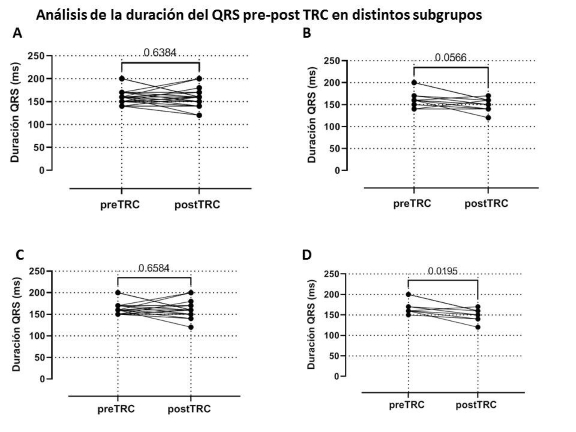
Fig. 3 Se muestran las diferen cias en el QRSi pre y post TRC en toda la población (A), en el subgrupo de mujeres (B), individuos que partían de un QRS ≥ 150mseg (C) y de mujeres que partían de un QRS 150 mseg (D). TRC: terapia de resincronización cardíaca
No hubo asociación del cambio en la duración del QRSi pre y post TRC con la etiología no isquémica (p = 0,72) ni con la edad. (p = 0,78).
Comprobamos un ΔQRSi de - 9,3 ± 20,7 mseg en el grupo de “respondedores” por criterios clínico-estructurales y de 11,25 ± 18,9 mseg en el grupo de no respondedores (p =0,027). Esta diferencia fue algo más acentuada en el grupo de “hiper respondedores”, con un ΔQRSi de -14,44 ± 17,40 mseg (p = 0,026). No hubo asociación significativa del ΔQRSi con la mejoría de la IM (p = 0,84). (Figura 4)
DISCUSIÓN
Hasta donde sabemos, nuestra experiencia es la prime ra en caracterizar el fenómeno de remodelado eléctrico reverso en pacientes que reciben TRC a nivel local y regional.
Observamos una disminución en la duración del QRSi tras la TRC de por lo menos 10 mseg en nueve pacientes de la serie, si bien no tuvo significancia estadística. En estudios observacionales similares al nues tro, la reducción del QRS fue significativa, en general asociada a un aumento de la FEVI. 21 El análisis de subgrupos arroja que el ΔQRSi muestra una asociación con la respuesta clínico-estructural, más aún en aquellos pacientes que demostraron “hiper respuesta” a la TRC. Aún con las limitaciones del tamaño muestral, nuestros hallazgos permiten plantear la hipótesis de que el acortamiento del QRS va de la mano del remodelado reverso del VI, al mejorar la fisiología del sistema de conducción intraventricular. Se requieren nuevas investigaciones para evaluar esta hipótesis.
Demostramos una tendencia al mayor remodelado eléctrico en mujeres que presentaban un QRS inicial más ancho. Esto se encuentra en consonancia con lo observado para las definiciones tradicionales de respuesta. 1,31-33
Los mecanismos por los que ocurre el remodelado eléctrico reverso no son del todo conocidos. Podría postularse que las mejoras en el tamaño de las cavidades favorecen una conducción más rápida por el miocardio inespecífico. También se ha postulado que esto puede suceder por recuperación parcial o total del propio sistema de conducción especializado. 22,33,34 Otro posible efecto relacionado con la TRC es la disminución de la fibrosis cardíaca. 35 El interrogante de fondo también compete a los mecanismos fisiopatológicos del BCRI y sus múltiples variantes fisiológicas y anatómicas, un patrón electrocardiográfico que puede traducir una interrupción absoluta de la conducción por la rama izquierda del haz de His o un enlentecimiento por la misma, que podría resultar en una sobreexpresión de la rama derecha. 36
El punto de corte a utilizar para definir el remodelado eléctrico es aún menos uniforme. Sebag y col. enrolaron de manera prospectiva 85 pacientes con indicación de TRC, y evaluaron variables clínicas, ecocardiográficas y electrocardiográficas antes y a los 12 meses de la TRC. Encontraron puntos de corte de 19 y 18 mseg, con sensibilidad y especificidad de 86/60% y 84/60%, respectivamente, para vincular el ΔQRSi con la repuesta clínica y ecocardiográfica, respectivamente. Tras el análisis multivariado, un ΔQRSi ≥20 mseg resultó ser un predictor independiente de respuesta ecocardiográfica. 26
Demostramos una tendencia a la disminución del QRS nativo asociada a la mejoría de la IM, sin alcanzar significancia. El estudio de Karaca y col. encontró que el remodelado eléctrico reverso se asocia con la mejoría de la IM y la geometría del aparato valvular mitral. 34 Los autores plantean que, adicionalmente a la mejora secundaria por el ya conocido remodelado ventricular, la reversión de la disincronía de los músculos papilares sería responsable de un beneficio importante asociado a la TRC, y estaría en la base de la mejoría clínico-funcional.
Se requieren futuras investigaciones prospectivas para evaluar la respuesta clínica, estructural y eléctrica en varias subpoblaciones específicas de pacientes sometidos a TRC, en un intento por comprender mejor la fisiopatología de sus efectos. Consideramos que esto cobra mayor relevancia y que ameritará nuevos estudios para conocer si el remodelado eléctrico reverso es similar o más acentuado en la era de la estimulación del sistema específico de conducción. 37,38