INTRODUCCIÓN
La preeclampsia (PE) es una de las principales causas de morbimortalidad perinatal en todo el mundo y en general los trastornos hipertensivos del embarazo (THE) son responsables de hospitalizaciones frecuentes, morbilidad materna-fetal y prematuridad; afectan aproximadamente al 10% de todos los embarazos. 1 Asimismo, la PE se asocia con numerosos trastornos en la descendencia de hijos de madres con THE, fundamentalmente hipertensión arterial, diabetes y obesidad. 2 Los resultados adversos asociados a la PE pueden ser prevenibles; es la utilización temprana de ácido acetil salicílico (AAS) la estrategia más eficaz. Ensayos aleatorizados que incluyeron a más de 60 000 mujeres embarazadas demostraron que la aspirina tomada en la dosis adecuada (≥150 mg al día) e iniciada antes de las 16 semanas de gestación podría prevenir la mayoría de los casos de PE, particularmente los de inicio temprano y graves de la enfermedad tanto materna como fetal. Sin embargo, el tratamiento con AAS posterior a esta semana de gestación, no ha demostrado tener beneficios materno-fetales. Por lo tanto, existe una necesidad urgente de identificar mujeres con riesgo de desarrollar preeclampsia que podrían beneficiarse de la profilaxis temprana en el comienzo del embarazo con AAS. 3 Las adaptaciones hemodinámicas durante el embarazo normal permiten cumplir con mayores demandas metabólicas para satisfacer los requisitos fetales. 4) (5 En el primer trimestre y en el tercero la hemodinamia materna fisiológica es similar a la de una mujer no embarazada. 6) (7 Sin embargo, en el segundo trimestre, ante la demanda metabólica la presión arterial (PA) disminuye como consecuencia de la dilatación vascular, lo que a su vez conduce a un aumento del gasto cardíaco debido al aumento de la frecuencia cardíaca y volumen sistólico, con disminución de la resistencia periférica (RP) lo cual genera un fenotipo de hiperdinamia. 8 Sin embargo, si este patrón hemodinámico se presenta en el primer trimestre, puede aumentar el riesgo del desarrollo de PE. De modo que poder detectar comportamientos inadecuados en los patrones hemodinámicos al principio del embarazo, podría predecir muy tempranamente el desarrollo de PE para optimizar la oportunidad terapéutica con el AAS.
El estándar de oro para la evaluación del gasto cardíaco y la resistencia vascular periférica es la medición por termodilución mediante el catéter de Swan Ganz (hemodinamia invasiva), que no es aplicable a individuos “sanos” y menos aún a embarazadas como métodos complementarios rutinarios. La ecocardiografía se ha empleado para dilucidar las adaptaciones cardiovasculares durante el embarazo. Sin embargo, las mediciones requieren mucho tiempo, son exigentes desde el punto de vista técnico y dependen del investigador. 9 Por esta razón la hemodinamia no invasiva evaluada por cardiografía de impedancia (CGI) ha ganado terreno, y sobre todo en la evaluación de la embarazada. 10) (11) (12 Clásicamente, los fenotipos hemodinámicos del embarazo se han definido solo con el comportamiento de dos variables, índice cardíaco y resistencia vascular, 6) (7 pero la información de la fisiología circulatoria no se limita solo a estas dos variables hemodinámicas y podían identificarse con técnicas no invasivas fenotipos ocultos al tener en cuenta otras variables que también pueden ser determinadas con CGI. 13 La inteligencia artificial (IA) se utiliza ampliamente en el campo médico y el aprendizaje automático, y tiene el potencial de revolucionar la atención médica, tanto en población general como en embarazadas, 14 ya que podría proporcionar diagnósticos más precoces y precisos, aliviar la carga de trabajo de los médicos, reducir costos y proporcionar análisis de referencia para poder ser interpretados por los diferentes especialistas actuantes durante el embarazo. 15) (16 La IA con machine learning (ML) podría proporcionar la clave para desbloquear el potencial de la evaluación con CGI y velocidad de onda del pulso carotídeo femoral (VOPcf) en el embarazo, 17 y permitiría agregar marcadores hemodinámicos no invasivos, más allá del índice cardíaco (IC) y de la RP en la hemodinamia gestacional como clásicamente se ha descripto. Esto puede proporcionar información adicional relevante para los resultados al principio del embarazo y también puede usarse como instrumento predictivo de enfermedades asociadas y generar un algoritmo de predicción de PE clínicamente relevante que tenga implicancia en optimizar al inicio la indicación de AAS. 18 Por lo tanto, los objetivos del presente estudio fueron: 1- generar un modelo, mediante IA, de patrones fenotípicos hemodinámicos no invasivos para la predicción de PE en el primer trimestre en embarazadas de alto riesgo, y 2- evaluar patrones ocultos más allá de la RP y el gasto cardiaco (GC), que consideraran otras variables hemodinámicas de flujo, resistencia, contractilidad, fluido, función sistólica, eficiencia energética del ventrículo izquierdo y distensibilidad arterial en la predicción de PE.
MATERIAL Y MÉTODOS
Fueron evaluadas embarazadas de alto riesgo entre las 10-16 semanas de gestación, en forma consecutiva derivadas del servicio de Obstetricia (Hospital San Martín, La Plata) a la Unidad de Enfermedades Cardiometabólicas para evaluación de la PA. Se llevó a cabo desde enero de 2016 hasta octubre de 2022 un protocolo preestablecido de evaluación de la PA y hemodinamia no invasiva, incluyendo en dicho estudio aquellas mujeres que completaron su embarazo; se determinó como punto final el desarrollo de evento final combinado: PE, eclampsia o síndrome HELLP. Se excluyó a las embarazadas con tratamiento antihipertensivo farmacológico, valvulopatías previas, cardiopatías congénitas, fibrilación auricular y/o diálisis.
Se realizaron CGI y VOP carotídeo femoral (Zlogic 1.20b, Aortic 3.10, Exxer, Argentina) y el mismo día se colocó un monitoreo ambulatorio de presión arterial (MAPA), (Spacelabs 90207, USA). 19 La CGI se realizó con la paciente en decúbito supino y a los 3 minutos de adaptación posicional de pie, con la obtención del promedio de al menos 10 latidos consecutivos, con canal simultáneo de carotidograma para resolver alguna ambigüedad del punto B y punto X. 11 Los parámetros hemodinámicos que se midieron fueron: de fluidos: índice de descarga sistólica (IDS) (mL/lat/m2), debe decir: índice cardíaco (IC) (L/min/m2); de poscarga: índice de resistencia vascular (IRV) (dyn*seg*cm-5), índice de complacencia arterial (ICA) (mL/mmHg/m2); de contractilidad: índice de velocidad (IV) ((1000*seg)-1), índice de aceleración cardíaca (IAC) ((100*seg2)- 1), cociente tiempo sistólico (CTS) (%), cociente de tiempo eyectivo (CTE) (%), índice de trabajo sistólico (ITS) (Kg*m/ m2), índice de Heather (IH) (ohm/seg2); de nivel de fluido torácico: contenido de fluido torácico (CFT) (Kohms-1); e < de rendimiento cardiovascular: elastancia arterial (Ea) (mmHg/ mL), elastancia ventricular de fin de sístole (Ees) (mmHg/ mL); acoplamiento ventrículo arterial (AC); de distensibilidad arterial: VOPcf (m/seg). Esta última se midió inmediatamente posterior al estudio con CGI con tonometría de aplanación, en carótida y femoral izquierdas con la distancia carótida femoral medida con pediómetro y promedio de tres registros consecutivos con al menos una corrida de 10 latidos por cada uno de los mismos. El MAPA se realizó por un período de 24 hs, definiendo los períodos de día y noche de acuerdo con el diario del paciente. Se consideró como válido aquellos estudios con >70% de registros y al menos 1 por hora.
Análisis estadístico
Los datos se recopilaron con software de gestión de base de datos relacional (Filemaker 12,0v1, USA) que permitió exportar los datos de interés a planilla de Microsoft Excel 2010 para ser analizada con estadística descriptiva, para lo que se utilizó MedCalc® 22.009 (Belgium). Los resultados se expresaron como media, desviación estándar (DE), error estándar (EE) e intervalo de confianza de la media (IC95%),o mediana e intervalo de confianza de la mediana (IC95%), según test de normalidad de D´Agostino-Pearson. Para la comparación entre grupos se realizó test de t no apareado o prueba de Mann-Whitney no apareada según la distribución fuera normal o no. Las variables cualitativas fueron expresadas como porcentajes y la comparación entre grupos se realizó con test de Chi2 o de Fisher según corresponda. La significancia estadística se estableció con valor de p < 0,05. Para el muestreo de entrenamiento por aprendizaje automático se utilizó árbol de clasificación j48 (Weka 3.8.6, Universidad de Waikato, New Zealand). La clasificación de las instancias se evaluó con el índice Kappa de Cohen como índice de bondad de ajuste del modelo completo. Se entiende que el modelo es apropiado si este valor es ≥ 0,7. Para indicar el error de estimación cometido se utilizó el error absoluto medio, en que valores más bajos indican que el modelo es más apropiado. Para evaluar la capacidad del modelo en detectar los eventos (PE) se utilizó el área bajo la curva ROC y la precisión del mismo se describió como porcentaje de instancias bien clasificadas.
Consideraciones éticas
Todas las participantes dieron el correspondiente Consentimiento Informado oral y escrito para acceder a participar del presente estudio, aprobado por Comité De Ética en Investigación, Hospital San Martín de La Plata (HSMLP2022/0079).
Patrocinador
Este trabajo forma parte del protocolo de investigación titulado: “Machine Learning para predicción de preeclampsia por hemodinamia no invasiva en embarazo de alto riesgo” y que fue financiado por el Ministerio de Salud de la Provincia de Buenos Aires a través del Programa de Becas Julieta Lanteri otorgados desde la Dirección de Investigación y Cooperación Técnica de la Dirección Provincial de Escuela de Gobierno en Salud “Floreal Ferrara”. Registrado en la Comisión Conjunta de Investigaciones en Salud (CCIS) (EX-2023-20132598-GDEBA- CCISMSALGP).
RESULTADOS
Se registraron 1155 embarazadas de alto riesgo con estudios vasculares no invasivos, de las cuales, luego de aplicar los criterios de selección y exclusión, quedaron 112 para modelizar por aprendizaje automático, 17 de ellas con PE (15,18%). La edad promedio fue 30 años, sin diferencia entre grupos con y sin PE. La duración del embarazo fue de terminación precoz, con mediana de 35 semanas las embarazadas con PE y 38 aquellas sin PE (p = 0,007). Entre las que tuvieron PE la frecuencia de preeclampsia temprana fue baja (n = 3, 17,64%), en la mayoría fue tardía (n = 14, 82,35%). La PA en MAPA de 24 hs no presentó diferencias entre los grupos en los promedios de 24 hs, diurno y nocturno (Tabla 1). Las variables hemodinámicas no tuvieron diferencias significativas entre los dos grupos, aunque hubo tendencia a mayor ITS (p = 0,06) e IH (p = 0,05) en las que tuvieron PE, variables relacionadas con la contractilidad del ventrículo izquierdo. También la poscarga, evaluada con el IRV (p = 0,05) fue mayor en aquellas con PE (Tabla 2). El CFT fue mayor en las que tuvieron PE (p = 0,02) (Tabla 2). La rigidez arterial por VOPcf no demostró diferencias. El evento final combinado (n = 17) generó un algoritmo supervisado por árbol de clasificación donde se detectó un patrón predictivo con 5 variables hemodinámicas no invasivas (Figura 1). El Nodo principal fue el ICA, y fueron nodos secundarios: IC, ITS, CTE y el IH. Se observó que el CTE y el IH, que tenían diferencias entre PE y no PE, fueron seleccionadas por el algoritmo de aprendizaje automático. Sin embargo, el CFT se excluyó del algoritmo por no agregarle capacidad predictiva y para poder optimizar la dimensionalidad en la modelización. Del total de 112 instancias con modelo de entrenamiento se clasificaron correctamente el 93,75%; el modelo fue apropiado con un adecuado estadístico Kappa de 0,70 y con error absoluto medio bajo, de 0,23. El valor predictivo positivo (VPP) fue alto, 0,94; y el negativo (VPN), bajo, 0,35. La capacidad del modelo para la detección de variables hemodinámicas predictoras de PE fue alta, con un área bajo la curva ROC de 0,93.
Tabla 1 Variables de edad, semanas de embarazo y promedios de presión arterial (mmHg) por MAPA de 24 hs, día y nocturno, por presencia de evento o no de preeclampsia (PE).
| Variable | PE (n=17) | No PE (n=95) | |||
|---|---|---|---|---|---|
| Mediana | IC95% | Mediana | IC95% | P* | |
| Edad | 30 | 25,01-36,98 | 31 | 29,00-33,00 | 0,928 |
| Semanas de embarazo | 35 | 34,00-37,00 | 38 | 37,00-38,00 | 0,007 |
| PAS MAPA 24 hs | 120,5 | 113,58-131,10 | 118,5 | 116,00-119,45 | 0,329 |
| PAD MAPA 24 hs | 73 | 69,79-77,52 | 69 | 68,00-71,45 | 0,072 |
| PAS MAPA día | 124 | 116,00-131,62 | 122 | 120,00-125,00 | 0,363 |
| PAD MAPA día | 77 | 73,58-81,31 | 74 | 72,54-75,00 | 0,068 |
| PAS MAPA noche | 108 | 104,00-121,93 | 109 | 108,00-111,00 | 0,494 |
| PAD MAPA noche | 65 | 59,79-70,00 | 61 | 59,00-63,00 | 0,144 |
MAPA: monitoreo ambulatorio de presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PE: preeclampsia
Tabla 2 Diferencias entre variables hemodinámicas en pacientes con y sin PE. En negrita variables por aprendizaje automático
| Variable | PE (n=17) | No PE (n=95) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mediana | IC95% | Mediana | IC95% | P | |||||||
| CFT | 44,91 | 41,43-49,87 | 41,46 | 39,78-43,49 | 0,026 | ||||||
| CTE | 36,28 | 35,71-39,25 | 35,99 | 35,08-36,67 | 0,21 | ||||||
| CTS | 32,15 | 26,07-36,03 | 32,54 | 31,25-33,71 | 0,748 | ||||||
| IAC | 291,37 | 196,82-382,56 | 314,48 | 279,68-351,57 | 0,529 | ||||||
| IC | 4,71 | 4,25-5,01 | 4,66 | 4,39-4,97 | 0,951 | ||||||
| ICA | 1,31 | 1,11-1,40 | 1,47 | 1,35-1,54 | 0,1 | ||||||
| IDS | 62,51 | 46,56-71,98 | 62,48 | 59,71-69,38 | 0,641 | ||||||
| ITS | 6,65 | 5,07-7,02 | 5,55 | 5,27-5,91 | 0,065 | ||||||
| IRV | 1684,63 | 1542,56-1912,82 | 1507,83 | 1412,24-1586,64 | 0,054 | ||||||
| EA | 1,04 | 0,91-1,27 | 0,96 | 0,92-1,06 | 0,204 | ||||||
| EES | 1,34 | 1,17-1,56 | 1,25 | 1,21-1,32 | 0,169 | ||||||
| AC | 0,75 | 0,66-0,89 | 0,74 | 0,71-0,78 | 0,932 | ||||||
| Media | DE | EE | IC95 % | Media | DE | EE | IC95 % | p | |||
| IH | 18,12 | 4,11 | 0,99 | 16,00-20,23 | 20,96 | 5,69 | 0,58 | 19,80-22,12 | 0,052 | ||
| IV | 117,12 | 23,43 | 5,68 | 105,07-129,17 | 123,96 | 25,92 | 2,65 | 118,68-129,24 | 0,312 | ||
| VOPcf | 6,42 | 1,12 | 0,28 | 5,82-7,02 | 6,09 | 1,03 | 0,1 | 5,87-6,31 | 0,25 | ||
AC: acoplamiento ventrículo arterial; CFT: contenido de fluido torácico; CTE: cociente de tiempo eyectivo; CTS: cociente tiempo sistólico; DE: desviación estándar; Ea: elastancia arterial; EE: error estándar de la media; Ees: elastancia ventricular de fin de sístole; IAC: índice de aceleración cardíaca; IC: índice cardíaco; ICA: índice de complacencia arterial; IDS: índice de descarga sistólica; IH: índice de Heather; IRV: índice de resistencia vascular ITS: índice de trabajo sistólico; IV: índice de velocidad; PE: preeclampsia; VOPcf: velocidad de onda del pulso carótido femoral
DISCUSIÓN
La evaluación hemodinámica no invasiva ya se ha realizado en el embarazo con resultados confiables. 20 Sin embargo, la mayoría de los trabajos publicados hicieron evaluaciones en el segundo y tercer trimestre de embarazo. Nosotros observamos que el IC no tiene diferencia aunque el IRV es más alto entre semanas 10 y 16 en las que después tuvieron PE (p = 0,05), a diferencia de trabajos previos que describen hiperdinamia en el primer trimestre como predictor de PE 21) (22, en el presente trabajo este comportamiento no se observó, aunque es de destacar la tendencia hemodinámica inadecuada que tuvieron las pacientes con PE en este rango de 10 a 16 semanas de edad gestacional. Lo mismo se interpretó con respecto a la rigidez arterial, ya que la VOPcf no demostró diferencia, porque se ha observado que la VOPcf aumenta en la PE. 17) (23 Por otro lado, las variables de contractilidad (ITS, con p = 0,06, e IH con p = 0,05) demostraron tendencia estadística a aumento en las pacientes que desarrollaron PE, y fueron coherentes con su selección con el árbol de clasificación por el algoritmo de ML, demostrando que, a diferencia del IC y el IRV clásicamente evaluados se pudieron determinar patrones ocultos con otras variables, 13, que se detectaron en un rango precoz de edad gestacional.
La IA se utiliza ampliamente en el campo médico y el ML se utiliza cada vez más en la atención sanitaria, la predicción y el diagnóstico como método para determinar prioridades 24. Hay trabajos previos que utilizan la IA con ML en PE con hemodinamia no invasiva. 25 Los algoritmos más frecuentemente utilizados fueron con Deep Learning con redes neuronales y los árboles de clasificación para la detección de patrones ocultos en grandes volúmenes de datos. En el presente trabajo elegimos árbol de clasificación ya que es más fácil de razonar, a diferencia de las redes neuronales donde los pesos sinápticos configuran una interpretación más compleja y no emulable. El árbol de clasificación también es fácilmente emulable para la programación posterior en bases de datos para su utilización en la realidad hospitalaria. El reconocimiento de patrones ayuda a predecir y tomar decisiones para el diagnóstico y la planificación del tratamiento. 26 En cuanto a las limitaciones, debido a que es más frecuente la derivación de embarazadas desde la semana 20, el tamaño de la muestra que quedó seleccionada no fue suficiente para analizar con un modelo de regresión logística la predicción de PE. Sin embargo, se demuestra la ventaja del ML, en que se pudo detectar un patrón hemodinámico relacionado con la misma. Esto sugiere que la IA trabajó complementándose con la estadística tradicional, teniendo el potencial de revolucionar la atención médica en el embarazo al proporcionar diagnósticos más precisos, lograr mejores oportunidades terapéuticas, reducir costos de atención médico hospitalaria y mejorar la interpretación entre especialistas. 27 Otra limitación es que no se pudo realizar validación interna del algoritmo a la fecha del análisis. Sin embargo, el reclutamiento de embarazadas continúa con la posibilidad de concretarlo. En nuestro trabajo, la IA pudo detectar un patrón con cinco variables hemodinámicas no invasivas que no fueron las clásicas (IC e IRV) y que pudieron predecir el desarrollo de PE en etapas precoces del embarazo. Se observa que el nodo con el que comienza es, ICA y los secundarios en su mayoría fueron de contractilidad (IH, CTE, ITS). Esto sugiere que la relación poscarga versus contractilidad se altera ya precozmente, entre semanas 10-16 y que todavía no repercute en las elastancias arterial y ventricular; su relación no afecta al acoplamiento ventrículo arterial y mantiene un rendimiento cardiovascular adecuado (AC = 0,75 en las pacientes con PE, Tabla 2). 28) (29) (30) (31 La identificación de embarazadas con comportamientos hemodinámicos que caractericen la PE entre semanas 10 y 16 donde la oportunidad terapéutica es óptima para la indicación de AAS, puede aprovecharse mejor programando el patrón hemodinámico generado por el ML en la bases de datos o historias clínicas electrónicas que en forma automática y oportuna avisen sobre la indicación de AAS con implicancia en el riesgo materno y su descendencia en el futuro desarrollo.
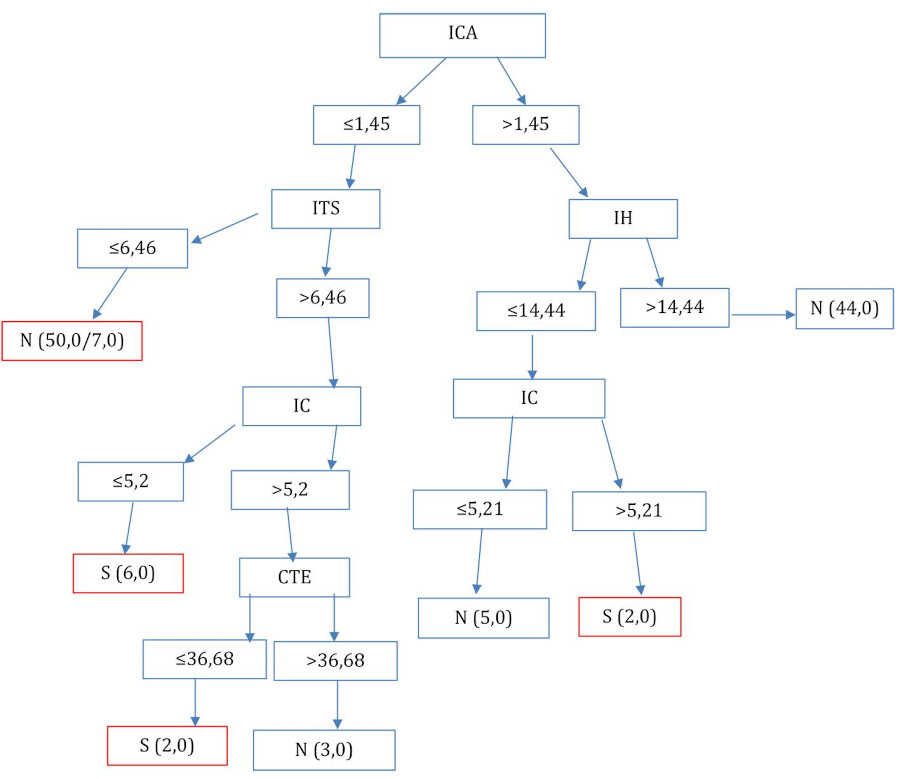
Fig. 1 Algoritmo por aprendizaje automático con hemodinamia no invasiva en embarazadas entre semana 10 a 16 con criterios de alto riesgo. Ganancia de información de variables hemodinámicas con PE en rectángulo rojo CTE: cociente de tiempo eyectivo; IC: índice cardíaco; ICA: índice de complacencia arterial; IH: índice de Heather; ITS: índice de trabajo sistólico; N: no; S: sí
CONCLUSIÓN
Las variables ICA, IC, ITS, CTE e IH predijeron un patrón precoz de riesgo en nuestra muestra para el desarrollo de PE por ML entre semanas 10 a 16 de embarazo, con una excelente discriminación y precisión, de forma no invasiva, segura y bajo costo. La valoración precoz de variables hemodinámicas en forma no invasiva sería útil como herramienta para optimizar la oportunidad terapéutica de indicación de AAS en el embarazo de alto riesgo.















