INTRODUCCIÓN
El remodelado ventricular adverso es un elemento fisiopatológico clave en el desarrollo de insuficiencia cardíaca tras un evento coronario agudo. Es un proceso que involucra cambios en la geometría, volumen y función del ventrículo izquierdo (VI), y es determinante de la morbimortalidad cardiovascular. 1
El remodelado adverso del VI señala la mala adaptación del corazón a los cambios mecánicos y neurohormonales en la regulación del tamaño, la forma y la función ventricular. El crecimiento de los miocitos secundario a un mayor suministro de sangre (p. ej., durante el embarazo, el crecimiento o el entrenamiento deportivo) se considera fisiológico y reversible. El remodelado adverso después de un infarto agudo de miocardio (IAM), al contrario, confiere un mayor riesgo de insuficiencia cardíaca y disminuye significativamente la supervivencia. 2),(3
El tratamiento farmacológico busca mejorar la mecánica de contracción, por ejemplo, con reducción de poscarga con vasodilatadores, y ajustar los mecanismos moleculares de remodelado. 4 Identificar predictores clínicos, bioquímicos e imagenológicos de remodelado podría determinar nuevos objetivos de tratamiento. En este sentido, el conocimiento de las variables que exponen al paciente infartado a un mayor riesgo de remodelado, podría representar una oportunidad para ajustar el tratamiento e incrementar la utilidad del seguimiento.
La magnitud del IAM ha sido descripta como predictor de remodelado adverso en modelos animales; el estudio gatillado de perfusión miocárdica con tomografía computarizada por emisión de fotón único, o gated- SPECT (por su denominación en inglés) es un método apropiado para cuantificar la magnitud y territorio de la escara necrótica. 5),(6 El análisis de pacientes con infartos de pequeña y mediana extensión que evolucionan con deterioro de la fracción de eyección ventricular izquierda (FEVI), podría arrojar información adicional acerca de la evolución a remodelado adverso.
Los objetivos de nuestro trabajo fueron: a) evaluar la prevalencia de FEVI disminuida y factores asociados en una población de pacientes derivados para estudios de gated-SPECT, y b) definir la prevalencia de remodelado adverso y factores asociados en el subgrupo de pacientes con carga necrótica intermedia a baja.
MATERIAL Y MÉTODOS
Población estudiada
Realizamos un análisis retrospectivo de pacientes consecutivos que se realizaron perfusión miocárdica gated-SPECT durante el año 2017.
La realización de las imágenes estuvo indicada por el médico de cabecera debido a una de las siguientes razones en pacientes con y sin enfermedad coronaria conocida: 1) síntomas de angina o enfermedad coronaria sospechada, 2) anomalías en el electrocardiograma (ECG) sospechosas de enfermedad coronaria, 3) anormalidades durante una prueba de esfuerzo, 4) trastornos de conducción intraventricular que requirieron una prueba de estrés farmacológico, 5) nuevo inicio de síntomas con enfermedad de las arterias coronarias conocida o infarto de miocardio reciente, 6) anomalía en el movimiento de la pared ventricular demostrada por otra modalidad de imagen. Todos los pacientes incluidos tenían más de 18 años.
Se consideraron criterios de exclusión la presencia de enfermedad valvular significativa, o arritmias significativas que impidieran una adecuada sincronización electrocardiográfica. Se registraron los factores de riesgo coronario y el estado clínico.
Protocolo de adquisición gated-SPECT
Se obtuvo una historia clínica detallada antes de la prueba de esfuerzo. Los pacientes que realizaron ejercicio lo hicieron hasta el límite de los síntomas, según el protocolo de Bruce. Se registró la frecuencia cardíaca basal, presión arterial y el ECG de 12 derivaciones al comienzo de cada etapa y en la recuperación. En los pacientes que realizaron estrés farmacológico se utilizó dipiridamol administrado por vía intravenosa a razón de 0,56 mg/kg en un lapso de 4 minutos con inyección de radiofármaco al tercer minuto post inyección de acuerdo con pautas de la American Society of Nuclear Cardiology (ASNC). 7
Se realizó un protocolo de un solo día con tecnecio-99m metoxiisobutilisonitrilo (99mTc-MIBI) en estrés y reposo, con una cámara gamma dedicada de doble cabezal en un ángulo de 90° (sistema de cámara Ventri; GE Medical Systems, Milwaukee, Wisconsin, EE.UU.). Las imágenes se adquirieron entre 30 y 45 minutos después de una inyección venosa en reposo, y entre 15 y 20 minutos después del ejercicio máximo. La actividad administrada fue de 8-12 mCi en la primera inyección (reposo o estrés) y de 24-36 mCi en la segunda inyección (estrés o reposo), según las pautas de la ASNC arriba citadas.
Análisis y cuantificación de las imágenes
Se obtuvieron datos en una matriz de 128 × 128 para 32 proyecciones en formato “step and shoot”. El análisis de la SPECT se realizó por consenso de tres observadores experimentados (C.C., O.M y N.P.) según el modelo de 17 segmentos del ventrículo izquierdo de la American Heart Association. 8 Para ello, se realizó una reconstrucción en proyecciones de eje largo y corto perpendicular al corazón, seguida de un análisis cuantitativo automatizado de las imágenes de perfusión en formato de mapa polar (normalizado al 100 %). El análisis cuantitativo automatizado se utilizó como complemento a la interpretación visual semicuantitativa. Los segmentos se puntuaron visualmente del 0 al 4 según la actividad del trazador en cada segmento. Se calcularon los puntajes totales de captación de MIBI tanto para las imágenes en reposo como para las de ejercicio, es decir, score de suma estrés (SSE), score de suma reposo (SSR) y score de diferencia (SD) entre el SSE y el SSR. Se consideró necrosis a un SSR mayor que o igual a 2. La estimación del porcentaje de miocardio necrótico se realizó mediante la fórmula SSR/68 x 100 de acuerdo con literatura previa. 9 La determinación del volumen de fin de diástole (VFD), de fin de sístole (VFS) y fracción de eyección del ventrículo izquierdo (FEVI) se realizó mediante el software QGS versión 2015.2. Se utilizó la imagen gatillada para evaluar el movimiento regional parietal para la discriminación entre defectos de perfusión y artefactos por atenuación. Ante la sospecha de atenuación del tejido blando después de la adquisición inicial en posición supina, se adquirieron imágenes en posición prono.
Definición de remodelado adverso
Se consideró FEVI disminuida a un valor menor que 50 % en la adquisición de reposo.
Se consideró remodelado adverso a la conjunción de FEVI disminuida con porcentaje de miocardio necrótico menor que 20 %.
Análisis estadístico
Para la búsqueda de asociaciones se realizó análisis multivariado por regresión logística. Las variables dependientes fueron FEVI disminuida en el primer análisis, y remodelado adverso en el segundo. Las siguientes variables fueron tenidas en cuenta para búsqueda de asociación: edad, género masculino; hipertensión; dislipidemia; tabaquismo o ex tabaquismo; diabetes; porcentaje de miocardio necrótico. Se estableció por curva ROC un punto de corte de necrosis miocárdica que se asociara significativamente a disfunción ventricular y se incluyó en el modelo como variable dicotómica. En cuanto al resto del análisis estadístico, las variables continuas con distribución normal se expresaron como media y desviación estándar (DE) y fueron comparadas con prueba de Student. Las variables continuas con distribución no Gaussiana se expresaron como mediana y rango intercuartílico (RIC) y se compararon con la prueba no paramétrica de Mann-Whitney. Las variables categóricas se expresaron como proporciones y fueron comparadas utilizando la prueba exacta de Fisher. Se consideró significativo un valor de p < 0,05. Los cálculos estadísticos fueron realizados con Epi InfoTM 7.2.2.2.
Consideraciones éticas
Se trata de un trabajo observacional, es decir, sin ninguna intervención adicional en los pacientes más que los estudios solicitados por los médicos de cabecera con posterior análisis de datos registrados. En nuestra institución, los pacientes firman un consentimiento informado en el que aceptan la posibilidad de que los datos vinculados a los resultados de sus estudios sean utilizados en forma anónima para fines científicos. El análisis de datos y confección del artículo fue realizado con cegamiento respecto a la identidad de los pacientes.
RESULTADOS
Se incluyeron 1902 pacientes. La media de edad fue de 63 ± 11 años; el 12 % tenía antecedente clínico de IAM y el 29 % de revascularización miocárdica (Tabla 1). La prevalencia de FEVI disminuida fue del 8 % (n =148). Se estableció por curva ROC un punto de corte de 6,6 % de miocardio necrótico como el umbral de mayor precisión para diagnosticar disminución de FEVI, con área bajo la curva (ABC) 0,872, IC 95% 0,832-0,912 (Figura 1). En el análisis multivariado, las variables independientemente asociadas a disfunción ventricular fueron el género masculino (OR 2,50; IC 95% 1,30-4,90, p = 0,005), la diabetes (OR 1,83; IC 95% 1,12-3,00, p = 0,01), y la extensión de necrosis mayor que 6,6 % (OR 39; IC 95 % 25-61,28, p= 0,00001) (Tabla 2).
Tabla 1 Características basales de la población
| Variable | n = 1902 |
|---|---|
| Edad, años, media ± DE | 63 ± 11 |
| Sexo masculino, % (n) | 66 (1263) |
| HTA, % (n) | 57 (1082) |
| DLP, % (n) | 49 (933) |
| DBT, % (n) | 18 (350) |
| TBQ, % (n) | 9 (167) |
| IAM, % (n) | 12 (235) |
| Revascularizados (ATC o CRM), % (n) | 29 (544) |
| FEVI miocárdica (%), media ± DE | 65 ± 14 |
| FEVI disminuida, % (n) | 8 (148) |
| Necrosis en SPECT, % (n) | 16 (285) |
| Carga necrótica baja, % (n) | 10 (197) |
DBT: diabetes DE: desviación estándar DLP: dislipidemia; FEVI: fracción de eyección ventricular izquierda; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; TBQ: tabaquismo

Fig. 1 Curva ROC para estimación de umbral de porcentaje de miocardio necrótico para generar disfunción ventricular: El punto de corte de 6,6 % obtuvo la mayor precisión para disminución de FEVI (sensibilidad: 78 %, especificidad: 93 %, ABC 0,872, IC 95% 0,832-0,912).
Tabla 2 Factores asociados a FEVI disminuida
| OR | IC 95% | p | |
|---|---|---|---|
| Edad | 0,99 | 0,97-1,01 | 0,501 |
| Género masculino | 2,50 | 1,30-4,90 | 0,005 |
| HTA | 0,87 | 0,50-1,30 | 0,501 |
| DLP | 1,30 | 0,84-20,00 | 0,204 |
| DBT | 1,83 | 1,12-3 | 0,010 |
| TBQ | 0,53 | 0,22-1,26 | 0,204 |
| Necrosis mayor que 6,6 % | 39 | 25-61,28 | < 0,001 |
DBT: diabetes DLP: dislipidemia; HTA: hipertensión arterial; IC: intervalo de confianza; OR: odds ratio; TBQ: tabaquismo
En el subgrupo de pacientes con carga necrótica menor que 20 % (n = 197), la prevalencia de remodelado adverso fue del 25 % (n = 50). El análisis multivariado arrojó que la diabetes (OR 2,83; IC 95% 1,31-6,1 p = 0,007) y el género masculino (OR 5; IC 95% 1,1 -22,9, p = 0,007) tuvieron asociación independiente con remodelado adverso (Tabla 3).
Tabla 3 Factores asociados a remodelado adverso
| OR | IC 95% | p | |
|---|---|---|---|
| Edad | 1,01 | 0,98-1,05 | 0,202 |
| Género masculino | 5,00 | 1,10-22,90 | 0,007 |
| HTA | 0,70 | 0,33-1,47 | 0,501 |
| DLP | 1,60 | 0,75-3,44 | 0,199 |
| DBT | 2,83 | 1,31-6,10 | 0,007 |
| TBQ | 0,84 | 0,25-2,74 | 0,199 |
DBT: diabetes DLP: dislipidemia; HTA: hipertensión arterial; IC: intervalo de confianza; OR: odds ratio; TBQ: tabaquismo
DISCUSIÓN
Los hallazgos más significativos de nuestro estudio fueron que la diabetes y el género masculino se asociaron en forma independiente con disminución de la FEVI. Esta asociación también se verificó en el subgrupo de pacientes con carga necrótica baja. Es lógica la disfunción ventricular en pacientes con necrosis extensa. Por eso intentamos dilucidar algún factor que llevara a disfunción ventricular en pacientes con necrosis no extensa (menor que el 20 %). La prevalencia de este último fenómeno, que definimos como remodelado adverso, fue en este grupo del 25% (n = 50). Ante infartos de magnitud similar, algunos pacientes de nuestra cohorte evolucionaron hacia remodelado adverso y otros mantuvieron volumen y FEVI conservados, con poca o ninguna alteración, y la diabetes fue un factor independientemente asociado a este fenómeno (Figura 2).
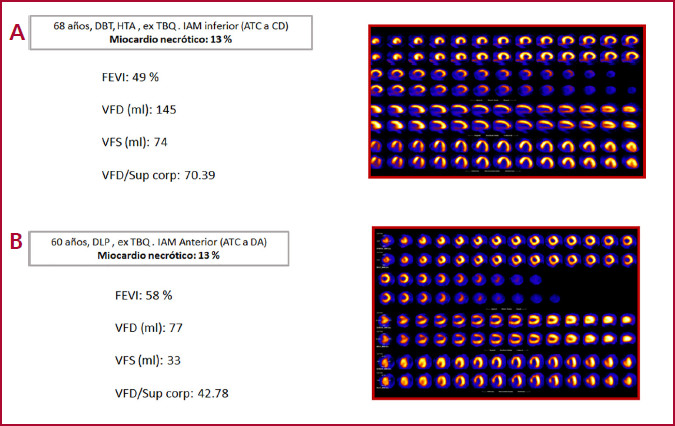
Fig. 2 A. Paciente diabético con infarto inferior (porcentaje de miocardio necrótico: 13 %), aumento de las dimensiones del VI y disfunción ventricular. B. Paciente no diabético con infarto anterior de igual magnitud (porcentaje de miocardio necrótico: 13 %), con dimensiones del VI y FEVI conservadas. ATC: angioplastia transluminal coronaria; CD: arteria coronaria derecha; DA: arteria descendente anterior DBT: diabetes; DLP: dislipidemia; FEVI: fracción de eyección ventricular izquierda; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; TBQ: tabaquismo; VFD: volumen de fin de diástole; VFS: volumen de fin de sístole
Nuestros resultados son consistentes con lo reportado por diversos autores en la literatura. Luego de un IAM, la incidencia de insuficiencia cardíaca entre pacientes con diabetes es un 60-70 % más alta que en pacientes sin diabetes. 10
En la década de los 80, Jaffe y cols. describieron mayor incidencia de insuficiencia cardíaca congestiva en pacientes diabéticos a pesar de un tamaño de infarto más pequeño. 11 Dos décadas más tarde, Aguilar y cols. describieron que, en pacientes diabéticos comparados con pacientes no diabéticos de características basales similares, es decir, tamaño de infarto y función sistólica similar, los diabéticos presentaron mayor tasa de eventos cardiovasculares, incluyendo insuficiencia cardíaca. 12 Prasad y cols. por su parte, describieron que a pesar de tasas similares de flujo TIMI 3 después de una angioplastia primaria por síndrome coronario agudo, los pacientes diabéticos tenían más probabilidades de presentar una perfusión miocárdica anormal que los no diabéticos. 13 Finalmente, en 2020, Van der Bijl y cols. describieron mayor prevalencia de diabetes en pacientes con remodelado adverso y asociación independiente entre diabetes y hospitalizaciones por insuficiencia cardíaca en pacientes con síndrome coronario agudo. 14
Esto sugiere la existencia de factores adicionales que contribuirían a la disfunción miocárdica y explicaría la mayor frecuencia de remodelado en esta población (entre otros activación de la cascada inflamatoria, estrés oxidativo, obstrucción microvascular, disfunción diastólica). 15
La modalidad diagnóstica no invasiva más utilizada en la actualidad para detectar remodelado, evaluar su gravedad y los factores asociados, es la resonancia magnética cardíaca (RMC). En comparación con la ecocardiografía, la RMC presenta una mejor resolución, mayor reproducibilidad e independencia de las ventanas acústicas. También puede proporcionar información sobre la presencia y extensión de fibrosis miocárdica a través de secuencias con realce tardío de gadolinio (RTG). La extensión del RTG se relaciona inversamente con el remodelado adverso. 16 En este contexto, Monmeneu et al informaron que una menor prevalencia de diabetes estaba relacionada con un mayor porcentaje de miocardio salvado en pacientes con IAM con elevación del segmento ST revascularizados mediante angioplastia. 17 En una revisión que incluyó 10 estudios aleatorizados, Stone y cols. observaron una relación creciente y graduada entre el tamaño del infarto, tomado como cada aumento del 5 %, mortalidad y hospitalización por insuficiencia cardíaca. En este estudio, en menos del 30 % de los pacientes se midió el tamaño del infarto por gated -SPECT, siendo la RMC el método más utilizado para medir la carga necrótica. 18 Si bien la gated SPECT no es el método más utilizado en la práctica habitual para valoración de remodelado, nuestro trabajo apoya la hipótesis de que puede utilizarse para dicho propósito. Hay escasa información en la literatura de estudios que analicen el remodelado ventricular post infarto utilizando esta modalidad de imágenes. Nuestro grupo ha publicado recientemente que la gated SPECT podría utilizarse en la evaluación no invasiva de los principales determinantes de la descarga sistólica, apoyando la posibilidad de expandir las utilidades de esta práctica en la valoración de pacientes con disfunción ventricular. 19
Teniendo en cuenta que es la prueba no invasiva más indicada para descartar isquemia como valoración pronostica en pacientes con antecedentes coronarios, fortalecer la experiencia de su uso en la valoración de pacientes con disfunción ventricular, podría simplificar la evaluación de individuos con miocardiopatía isquémico-necrótica. Por otra parte, la cuantificación de necrosis basada en el score visual semicuantitativo se obtiene fácilmente por este método, no requiere de un software adicional, se realiza en forma rutinaria en la práctica asistencial, y ha demostrado valor pronóstico. 20
Limitaciones
Como limitaciones del presente estudio mencionamos el enfoque retrospectivo y observacional y el carácter unicéntrico del mismo, así como también la posible influencia de otros factores no considerados en el remodelado ventricular. No se evaluó un estándar de referencia para la determinación de remodelado adverso, por lo que no es posible hablar de precisión del SPECT para valoración de remodelado con nuestro diseño, y no se realizó seguimiento clínico para determinación de impacto en el pronóstico.
CONCLUSIONES
La gated-SPECT, la prueba de estrés no invasiva más utilizada en la evaluación diaria de la cardiopatía isquémica, podría utilizarse en la valoración del remodelado adverso y sus factores asociados. Dicha valoración surge de la combinación de variables que no requieren un software adicional y se usan en la práctica diaria. Esto brinda una ventana de oportunidad para identificar a pacientes que podrían beneficiarse de la prescripción de tratamientos que en la actualidad se indican en estadios más avanzados. Estudios prospectivos con mayor número de pacientes y estudios aleatorizados de utilidad en donde se evalúen desenlaces clínicos relevantes deberían llevarse a cabo para verificar estas hipótesis.











 text in
text in 



