INTRODUCCIÓN
La cardiopatía isquémica es la principal causa de muerte en los países de ingresos altos y medianos altos, entre los que se encuentra la Argentina. 1 Esta entidad engloba a varios cuadros clínico-patológicos, el más importante el infarto de miocardio (IM). 2),(3 Este cuadro tiene lugar cuando la perfusión sanguínea es insuficiente para mantener la viabilidad de un sector del miocardio, lo que causa su muerte, con la consiguiente pérdida de masa contráctil. 4),(5 De manera adicional, cuando la dimensión del infarto supera un determinado umbral se produce una serie de cambios estructurales en la pared y en las cavidades ventriculares conocida como remodelado ventricular post IM. 6),(7),(8),(9 La evolución de este proceso provoca dilatación ventricular, deterioro hemodinámico, insuficiencia cardíaca y disminución de la sobrevida en forma lenta y progresiva, durante meses y hasta años. 9),(10),(11),(12 Esta evolución desfavorable ocurre en aproximadamente un tercio de los pacientes, y resulta fundamental desarrollar y emplear medidas terapéuticas que puedan prevenirla o mitigarla.
Durante el remodelado cardíaco post IM y en la insuficiencia cardíaca existe un aumento del estrés oxidativo miocárdico debido a una mayor producción de radicales libres derivados del oxígeno (ROS). 13 El estrés oxidativo se puede definir como el desequilibrio entre oxidantes y antioxidantes a favor de los primeros. En corazones con IM este desequilibrio redox perjudica la viabilidad de los miocitos cardíacos y favorece la hipertrofia con evolución hacia un fenotipo descompensado. 14 El glutatión (GSH) es un agente primordial en el sistema antioxidante del organismo y en el metabolismo redox, siendo una de las principales defensas antioxidantes. 15 Un proveedor de cisteína es la N-acetilcisteína (NAC), un precursor del aminoácido, que se puede suministrar por vía oral o intravenosa a fin de aumentar los niveles de cisteína cuando se necesita elevar las concentraciones de GSH para favorecer procesos de detoxificación. Estudios clínicos iniciales han demostrado la eficacia de la terapéutica con NAC en el tratamiento de la cardiopatía isquémica, con efectos secundarios leves. 16),(17 Un proveedor de cisteína es la N-acetilcisteína (NAC), un precursor del aminoácido, que se puede suministrar por vía oral o intravenosa a fin de aumentar los niveles de cisteína cuando se necesita elevar las concentraciones de GSH para favorecer procesos de detoxificación. Estudios clínicos iniciales han demostrado la eficacia de la terapéutica con NAC en el tratamiento de la cardiopatía isquémica, con efectos secundarios leves. 18),(19 Se ha demostrado que la administración de NAC después de un IM es eficaz para reducir la hiperactividad simpática cardíaca, los episodios arrítmicos, y la extensión del infarto en perros y ratas. 20),(21 Recientemente se ha comenzado a evaluar la eficacia de la NAC para controlar el remodelado post IM. En un ensayo clínico de prueba se observó que los pacientes tratados con NAC presentaron menos eventos cardíacos adversos mayores que aquellos tratados con placebo. 22 En otro estudio, el uso de la NAC en pacientes con insuficiencia cardíaca congestiva ha sido promisorio al facilitar los efectos del dinitrato de isosorbide y reducir la tolerancia a la nitroglicerina. 23
Con estas consideraciones en mente, el presente estudio estuvo destinado a mejorar el conocimiento de los mecanismos involucrados en el proceso de remodelado ventricular post IM y evaluar la posible utilización de una terapéutica antioxidante con NAC para mitigar los eventos desfavorables.
MATERIAL Y METODOS
Modelo experimental
Se utilizó un modelo experimental de IM en conejos siguiendo las indicaciones de la “Guía para el cuidado y uso de animales de laboratorio” perteneciente a la Academia Nacional de Ciencias de los Estados Unidos de Norteamérica y actualizada por la American Physiological Society 24 y en conformidad con el Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL) de la Facultad de Medicina de la Universidad de Buenos Aires (Resolución CD 2375/18). Para ello, conejos machos neozelandeses de 2,8 a 3,2 kg libres de enfermedades infectocontagiosas y parasitarias y que no presentaban disritmias patológicas ni alteraciones ecocardiográficas fueron incorporados a este estudio. Se les indujo anestesia con una mezcla de ketamina (45 mg/kg) y xilacina (0,5 mg/kg) administrada por vía intramuscular, se les colocó un tubo endotraqueal y fueron ventilados mecánicamente con aire ambiental utilizando un respirador Harvard (volumen corriente: 25 ml, frecuencia respiratoria: 32-36 ciclos/min). Inmediatamente se colocó un catéter flexible en la vena marginal de una oreja y se infundió solución de dextrosa al 5 %, a 3 ml/min. Utilizando dicha vía venosa se llevó a cabo el mantenimiento de la anestesia mediante dosis adicionales de tiopental sódico, según los requerimientos del acto quirúrgico. Durante el mismo se llevó a cabo monitoreo electrocardiográfico. Se realizó una toracotomía lateral izquierda a través del cuarto espacio intercostal para exponer el corazón y, tras efectuar pericardiectomía, se procedió a pasar un hilo de seda 5-0 por debajo de una rama prominente de la arteria coronaria izquierda. Para inducir IM se ligó la mencionada arteria; la presencia de isquemia se confirmó mediante la observación de palidez regional de la superficie cardíaca. Luego se efectuó el cierre de la toracotomía respetando los distintos planos anatómicos. A continuación, se administró antibioticoterapia (ciprofloxacina en forma profiláctica) y se permitió la recuperación de los animales bajo el efecto de analgesia (tramadol, 4-5 mg/kg), que se prolongó hasta 48 h del posoperatorio. Los animales fueron ubicados en jaulas especialmente acondicionadas durante 28 días, en ambiente calmo y climatizado y alimentados con alimento balanceado comercial y agua ad libitum.
Grupos experimentales
Se definieron los siguientes grupos experimentales:
Grupo 1 (n=10): En este grupo se realizó cirugía mediante la técnica descripta pero no se indujo infarto ya que no fue ligada la arteria coronaria (grupo Control). Se permitió a los animales seguir su evolución natural durante un período de 28 días.
Grupo 2 (n=9): En este grupo se indujo IM mediante la técnica descripta precedentemente. Se permitió a los animales seguir su evolución natural hasta completar el mismo período de tiempo que el grupo 1 (grupo IM).
Grupo 3 (n=8): En este grupo se produjo infarto mediante la técnica descripta precedentemente y durante el periodo de 28 días se suministró, por vía oral, N-acetilcisteína en dosis de 300 mg/kg/día (grupo IM+NAC).
Una vez concluido el tiempo de evolución se realizaron estudios ecocardiográficos, hemodinámicos y morfológicos.
Estudios ecocardiográficos
Al finalizar el período de cada protocolo experimental se realizaron estudios ecocardiográficos bajo sedación leve con midazolam (2 mg/kg). Se utilizó un ecocardiógrafo Esaote MyLab Gamma configurado con sonda microconvexa de 4 a 9 MHz. Se midieron los siguientes parámetros del ventrículo izquierdo (VI): espesor del septum interventricular, diámetros diastólico y sistólico, porcentaje de acortamiento fraccional y fracción de eyección.
Estudios hemodinámicos
Para evaluar el remodelado y la función cardíaca desde un punto de vista hemodinámico, los animales fueron anestesiados y luego se introdujo un catéter (conectado a un transductor de presión y a un equipo de monitoreo hemodinámico Hewlett Packard Modelo 54S) en la arteria carótida derecha, para evaluar la presión arterial. A continuación, se avanzó el catéter y se lo introdujo en el VI para evaluar el comportamiento hemodinámico del VI, con especial referencia a la presión diastólica final (PDF).
Estudios morfológicos
Tras haber obtenido los datos hemodinámicos se procedió a la eutanasia de los animales mediante una dosis letal de pentobarbital sódico y difenilhidantoína sódica (Euthanyle ®) por vía endovenosa. Inmediatamente se extrajo el corazón, se realizó evaluación macroscópica y se disecó y pesó la cicatriz del infarto como método de estimación del tamaño del infarto.
Análisis estadístico
Los datos numéricos obtenidos están expresados como media aritmética y error estándar de la media. Fueron analizados empleando un programa informático de análisis estadístico (GraphPad Prism, GraphPad Software, San Diego, California, USA). Para las pruebas de significación estadística se efectuó análisis de la varianza seguida del test de comparaciones múltiples de Tukey. Se consideró una diferencia significativa cuando el valor de p fue < 0,05.
RESULTADOS
La determinación del tamaño de infarto permitió establecer su ausencia en el grupo Control mientras que el grupo IM y el grupo IM+NAC presentaron infartos de tamaño similar (20,5±0,98 g y 18,50±1,39 g, respectivamente, p=NS) en la pared libre del VI.
El análisis ecocardiográfico reveló que el espesor del septum interventricular, es decir, de una zona remota al infarto fue de 2,93±0,12 mm en el grupo Control, 2,36±0,15 mm en el grupo con IM (p < 0,05 vs control) y 3,00±0,21 mm en el grupo IM+NAC (p < 0,05 vs grupo IM) al final de la diástole. Al final de la sístole los valores fueron 4,68±0,13 mm, 3,84±0,21 mm y 4,71±0,39 mm, respectivamente. De esta forma, la administración de NAC preservó la morfología de la zona no infartada, y evitó el adelgazamiento producido como parte del remodelado post IM (Figura 1). Al considerar los diámetros del VI se observó que en el grupo Control el diámetro diastólico fue de 12,94±0,64 mm mientras que el diámetro sistólico fue de 8,35 ± 0,50 mm. Ambos diámetros se encontraban aumentados en el grupo con IM (20,21 ± 1,14 mm y 14,71 ±0,77 mm respectivamente, p < 0,05 vs. Control), mientras que tales aumentos se vieron atenuados cuando se administró NAC (16,76 ± 1,00 mm y 12,06 ± 0,81 mm respectivamente, p < 0,05 vs. IM) (Figura 2). Así pudo observarse que la administración de NAC disminuyó la dilatación provocada por el infarto. Tomadas en conjunto, la preservación del espesor parietal del septum y la disminución de la dilatación observadas con la administración de NAC indican un efecto protector de la NAC contra el remodelado adverso provocado por el IM.
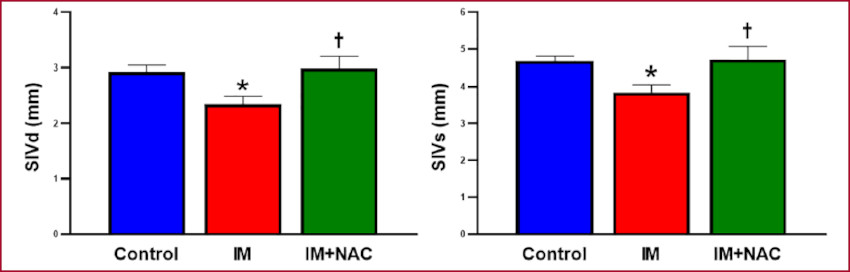
Fig. 1 Espesor del septum interventricular en diástole (SIVd) y en sístole (SIVs). IM: Infarto de miocardio; NAC: N-acetilcisteína. *: p < 0,05 vs. Control. †: p < 0,05 vs. IM.
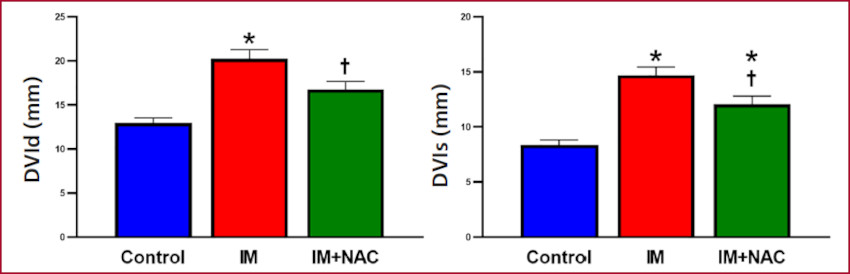
Fig. 2 Diámetros diastólico (DVId) y sistólico (DVIs) del ventrículo izquierdo. M: Infarto de miocardio; NAC: N-acetilcisteína. *: p < 0,05 vs. Control. †: p < 0,05 vs. IM.
Al evaluar el acortamiento fraccional del VI se constató que en el grupo Control fue de 36,54 ± 1,86 %, disminuyó en el grupo IM (22,44 ± 1,47 %, p < 0,05 vs. Control), mientras que en el grupo con IM+NAC tal disminución se vio atenuada (30,05 ± 2,27 %, p < 0,05 vs. IM). Resultados similares se obtuvieron al considerar la fracción de eyección del VI: en el grupo control fue de 68,10 ± 2,43 %, en el grupo IM fue de 47,44 ± 2,81 %, p < 0,05 vs Control, y en el grupo IM+NAC fue de 59,20 ± 2,31 %, p < 0,05 vs. IM. De esta forma, pudo observarse que la administración de NAC preservó la función del VI, en el grupo con infarto de miocardio (Figura 3).
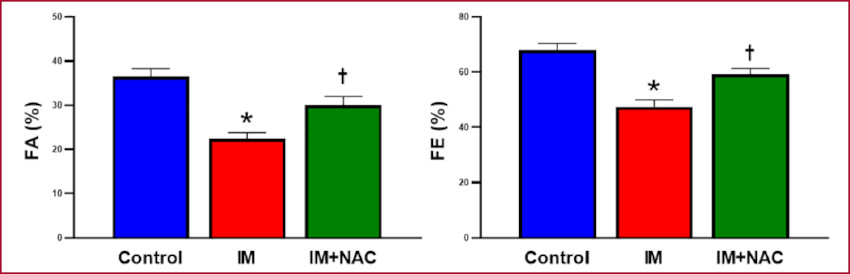
Fig. 3 Porcentaje de acortamiento fraccional (FA) y fracción de eyección (FE) del ventrículo izquierdo. IM: Infarto de miocardio; NAC: N-acetilcisteína. *: p < 0,05 vs. Control. †: p < 0,05 vs. IM.
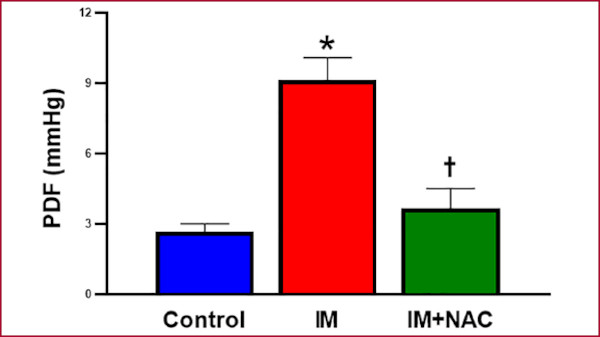
La evaluación del estado hemodinámico a través de la presión arterial no mostró diferencias entre los grupos estudiados (Figura 4). Por el contrario, el estudio del comportamiento hemodinámico del VI permitió observar un claro aumento de la PDF en el grupo con IM (9,13 ± 1,12 mmHg) en comparación con el grupo Control (2,67 ± 0,41 mmHg; p < 0,05) y esto fue mitigado por la N-acetilcisteína (3,67 ± 1,02 mmHg; p < 0,05 vs IM) (Figura 5). Estos resultados sugieren que la administración de NAC luego del IM preserva la función diastólica del VI, con atenuación del deterioro de la misma a causa del infarto.
Fig. 4 Presión arterial sistólica (PAS) y presión arterial diastólica (PAD). IM: Infarto de miocardio; NAC: N-acetilcisteína.
DISCUSIÓN
La presentación de un IM genera una disminución de la contractilidad miocárdica como consecuencia de la pérdida de masa miocárdica funcionante, pero, una vez superado el período agudo, la contractilidad puede continuar disminuyendo debido a fenómenos de remodelado y disfunción ventricular izquierda progresiva. En el presente trabajo utilizamos un modelo experimental de infarto de miocardio de 28 días de evolución en conejos, en que se realizaron estudios ecocardiográficos y hemodinámicos para evaluar el proceso de remodelado ventricular post IM y la posible utilización de una terapéutica antioxidante con NAC para mitigar sus efectos desfavorables. La realización de estos experimentos nos permitió observar un efecto beneficioso de la NAC sobre la morfología de la zona no infartada y sobre la función ventricular.
Se objetivó preservación de la morfología de la zona infartada, y menor remodelado post IM en la zona no infartada, evidenciado por menor hipertrofia excéntrica. Estudios previos han demostrado que el IM desencadena una sobrecarga de volumen en los sectores remanentes, que genera remodelado de los cardiomiocitos con, entre otras modificaciones, formación de nuevos sarcómeros. 25 Los nuevos sarcómeros se ubican en serie con los ya existentes y originan un mayor diámetro longitudinal de los miocitos que, a su vez, trae aparejado un aumento del volumen de la cavidad del VI. Se trata de una peculiar forma de hipertrofia excéntrica ya que ocurre solamente en los sectores remanentes. 26),(27 Aunque la adición de sarcómeros puede considerarse como una respuesta adaptativa para contrarrestar la pérdida de masa contráctil ocasionada por el infarto, genera un agrandamiento concomitante de la cavidad ventricular y, por consiguiente, del volumen ventricular que, al aumentar el estrés parietal y, por lo tanto, el consumo miocárdico de oxígeno, puede resultar perjudicial.
Es habitual que un aumento del volumen ventricular se asocie a una mayor presión intraventricular, pero ello no es necesariamente así, ya que trastornos que impidan el normal llenado del ventrículo sin modificar el volumen de la cavidad también pueden provocar aumento de la presión intraventricular. Por lo tanto, para tener una evaluación más acabada llevamos a cabo el estudio hemodinámico del VI, que nos permitió observar que la presión intraventricular al final de la diástole se encontraba aumentada luego del IM.
La evidencia acumulada indica que la familia de las NADPH oxidasas es la principal fuente de ROS en varias enfermedades cardiovasculares, y que la NAC es capaz de actuar como antioxidante, resultando en una reducción del daño oxidativo 28 El efecto antioxidante de la NAC implica una interacción directa con ROS, 29),(30 o una regulación positiva de la biosíntesis de cisteína y GSH. 31),(32 Se ha informado que este último compuesto se encuentra disminuido en corazones con IM. 32),(33 Recientes estudios experimentales en animales y estudios clínicos han señalado que la existencia de un estrés oxidativo causado por una mayor producción de radicales libres jugaría un rol clave durante el remodelado cardíaco post IM, tanto en etapas tempranas como tardías. 13 Así, la utilización de terapéuticas antioxidantes luego del IM es un campo de investigación en desarrollo, en que la NAC resulta particularmente atractiva. Al respecto, la administración combinada de estreptoquinasa y NAC en pacientes con infarto agudo de miocardio disminuyó el estrés oxidativo y mejoró la función ventricular. 34 La NAC, actuando como antioxidante, también fue capaz de revertir la inflamación y el estrés oxidativo 35 y de preservar la conexina 43 en modelos de IM en ratas 36 Efectos beneficiosos de la NAC sobre la inflamación también fueron observados en pacientes utilizando los valores séricos de factor de crecimiento transformante beta (TGF-β) y de factor de necrosis tumoral alfa (TNF-α) como indicadores.37 La eficacia de la NAC para controlar el remodelado post IM fue evaluada en un ensayo clínico de prueba prospectivo, doble ciego y aleatorizado: se observó que, en comparación con un grupo tratado con placebo, los pacientes tratados con NAC presentaron menos eventos cardíacos adversos mayores (incluyendo el reinfarto) durante un seguimiento de un año. 22
En forma concordante, en nuestro estudio la evaluación de los diámetros ventriculares permitió determinar que la administración de NAC es capaz de disminuir la dilatación ventricular ocasionada por el IM. Al evaluar, en forma complementaria, el comportamiento hemodinámico del ventrículo izquierdo fue posible observar que la administración de NAC también es capaz de atenuar el aumento de la PDF ocasionado por el infarto. Tomados en conjunto, estos resultados sugieren que la administración de NAC luego del infarto preserva la función diastólica del VI, al atenuar el deterioro producido por el remodelado. Coincidentemente, la evaluación ecocardiográfica permitió observar que la administración de NAC también atenúa el deterioro de la fracción de eyección del VI.
Los resultados obtenidos en el presente estudio indican que la administración de NAC modifica favorablemente las etapas iniciales del remodelado post IM, ejerce un efecto protector sobre la zona no infartada, disminuye la dilatación y el aumento de la PDF y atenúa el deterioro de la fracción de eyección. Así, aunque son necesarios estudios que amplíen este conocimiento, nuestros resultados sugieren que la administración de N-acetilcisteína es una terapéutica promisoria para mitigar los efectos desfavorables del remodelado post IM.











 text in
text in