INTRODUCCIÓN
El término inteligencia artificial (IA) fue acuñado en el año 1956 por John McCarthy, quien se aventuró a afirmar que “cada aspecto del aprendizaje o cualquier otra característica de la inteligencia puede, en principio, ser descrito con tanta precisión que se puede hacer que una máquina lo simule”. 1 En esta línea, podemos entender a la IA como una rama de las ciencias de la computación destinada a desarrollar entidades, usualmente programas computacionales, capaces de automatizar algunas actividades relacionadas con el pensamiento humano como la toma de decisiones, la resolución de problemas, el aprendizaje, la formación de conceptos y abstracciones, entre otras. 1,2,3 Se reconoce dentro de la IA, un subcampo conocido como Aprendizaje Automático o Machine Learning (ML), dedicado al desarrollo de algoritmos capaces de reconocer patrones en los datos para resolver determinadas tareas sin ser explícitamente programados para ello. Este tipo de algoritmos se caracterizan por no requerir de la intervención constante de un usuario para resolver tareas en entornos complejos (autonomía) y por mejorar su rendimiento con la experiencia, es decir, a partir de la exposición a los datos (adaptabilidad). 4,5 A su vez, el Aprendizaje Profundo o Deep Learning (DL) es una subdisciplina del ML en la cual existe un bloque de procesamiento que se repite y dispone de manera consecutiva en capas, formando una jerarquía y permitiendo abstraer información compleja a partir de representaciones más simples. 6,7,8 En general, los modelos profundos utilizan Redes Neuronales Artificiales (RNA), modelos computacionales inspirados en la biología del sistema nervioso y en la forma en que el cerebro procesa la información. Están compuestas por unidades funcionales conocidas como neuronas en las que se llevan a cabo una serie de cálculos y operaciones matemáticas, y que se conectan entre sí con el propósito de propagar la información. 7 Las RNA de múltiples capas de profundidad se conocen como Redes Neuronales Profundas (RNP). Su arquitectura básica consiste en una capa de entrada, múltiples capas ocultas intermedias y una capa de salida, tal que la salida de una capa es utilizada como entrada para la capa que le sucede. 8,9,10 El desempeño exhibido por estos métodos en la resolución de tareas complejas en diversos campos de conocimiento impulsó su introducción en el ámbito médico. Fue así que los primeros sistemas de soporte a la decisión clínica utilizados en Medicina, que requerían de la depuración de bases de conocimiento médico y la formulación explícita de reglas robustas, comenzaron a ser desplazados por sistemas guiados por los datos, es decir, por modelos de ML y DL. 10 La implementación de este tipo de soluciones tiene impacto: a) en los profesionales al proveerles una segunda opinión en base a los datos disponibles con el propósito de mejorar el desempeño diagnóstico, b) en el sistema sanitario al permitir la optimización de los procesos y flujos de trabajo, y c) en los pacientes que se verán beneficiados por una mejora en la calidad de la atención. 9 Asimismo, la IA ha sido utilizada en Medicina con múltiples propósitos (diagnósticos, pronósticos, predictivos), para procesar automáticamente múltiples modalidades de datos (clínicos, genéticos, bioseñales, imágenes médicas) generados en diferentes especialidades médicas. 10
La IA en las imágenes cardiovasculares
El uso de IA en Medicina tiene más de medio siglo: ya en 1968 Earl Hunt escribió un artículo de revisión sobre el tema aplicado al campo de la Psicología. 11 El número de artículos publicados desde entonces ha tenido lento incremento hasta hace unos 5 años, en que el aumento fue exponencial, con casi 39 000 artículos sobre el tema publicados solo en 2022, aproximadamente 1 de cada 3 dedicados a imágenes en Medicina.
El campo de las imágenes médicas es particularmente atractivo para el tema, debido al crecimiento exponencial de su número, su complejidad y la limitada disponibilidad de especialistas en la generación e interpretación de dichas imágenes en determinados lugares u horarios. El uso de IA permite reducir los tiempos de adquisición y lectura, adquirir e interpretar las imágenes por personal no entrenado, aumentar la precisión y reducir el riesgo de errores diagnósticos. Por otro lado, aspectos únicos de la IA como la capacidad de detectar cualidades únicas de la imagen más allá de la capacidad del ojo humano, o encontrar patrones de asociación no sospechados en infinidad de variables hacen a esta herramienta un método único para avanzar en nuevos diagnósticos e hipótesis. Si a esto sumamos la capacidad de evaluar en forma conjunta gran cantidad de datos más allá de las imágenes (epidemiológicos, clínicos, laboratorio, genéticos, biométricos) los avances en la ciencia parecen ser impredecibles. 12,13,14
Optimización de tiempos. Adquisición de imágenes por personal “no experto”. Reducción de la variabilidad
La segmentación de las imágenes es una herramienta bien desarrollada en la actualidad. La IA puede reconocer las estructuras y separar estructuras anatómicas en un tiempo mucho menor que el humano entrenado. Una vez realizada la segmentación el software puede realizar mediciones automáticas de diámetros, volúmenes, desplazamientos, flujos y otros parámetros del estudio en cuestión con una precisión similar o superior a la del experto. 15 (Figures 1 and 2).
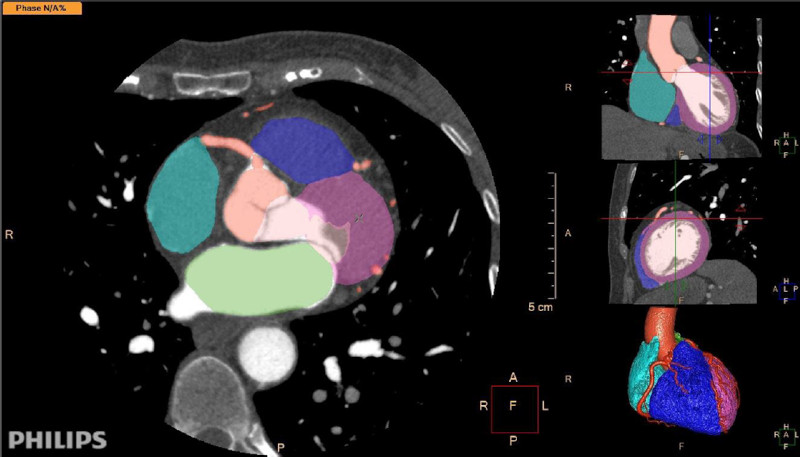
Fig. 1 Segmentación automática de una tomografía cardiovascular con contraste. El software reconoce las cavidades cardíacas, el miocardio, las coronarias y la aorta ascendente, segmenta con diferentes colores cada una de ellas y la imagen puede ser editada y corregida por el profesional. Software: IntelliSpace Portal. Image and Information Management Software. Version 12.1. Philips Medical Systems Nederland B.V. Veenpluis 6, 5684 PC Best, The Netherlands

Fig. 2 A y B. Reconstrucción cardiovascular automática derivada de la figura 1 (A) y con “eliminación” de todas las estructuras para visualizar exclusivamente la aorta y el árbol coronario (B). Software: IntelliSpace Portal. Image and Information Management Software. Version 12.1. Philips Medical Systems Nederland B.V. Veenpluis 6, 5684 PC Best, The Netherlands
Por otro lado, la variabilidad es una de las tantas limitaciones de los métodos diagnósticos. La toma de decisiones basadas en resultados (diámetros, fracción de eyección, áreas) puede ser un desafío para quien interpreta los métodos de imagen. En este sentido, la utilización de IA está demostrando resultados prometedores por su mayor rapidez y fundamentalmente reproducibilidad de las determinaciones.
En ecocardiografía existen programas que pueden evaluar la calidad de la imagen tomada, guiar a un operador inexperto para mejorar la imagen y adquirirla automáticamente cuando detecta que el corte es apropiado para análisis, y posteriormente realizar mediciones automáticas. Un estudio comprobó que 8 enfermeras sin entrenamiento en ecocardiografía pudieron tomar imágenes guiadas por IA de 30 pacientes cada una, con calidad comparable para diagnóstico a la de 5 técnicos en ecocardiografía. 16
Los software pueden reconocer vistas, realizar mediciones de cavidades, masa, volúmenes y deformación miocárdica en forma más rápida y reproducible que el operador experimentado. Con el empleo de un algoritmo adaptativo, Tsang y col. demostraron que con ecocardiografía 3D era factible medir volúmenes ventriculares, auriculares y fracción de eyección con excelente correlación con medición manual por experto y con mediciones por resonancia magnética (RMI), con elevada reproducibilidad (la variabilidad del software sobre la misma imagen es 0, siempre mide igual). Por otro lado, el tiempo medio de medición fue reducido de 144 ± 32 segundos (manual) a 26 ± 2 segundos (software). 17
Un estudio realizado en forma prospectiva, con el entrenamiento de un programa de IA para analizar la función diastólica según guía ASE/EACVI 2016, probó clasificar adecuadamente los patrones de disfunción diastólica con un nivel de acuerdo del 99 %. 18
La estimación de gravedad de una valvulopatía puede ser difícil en algunos escenarios. Con IA se pudo realizar cuantificación automática de insuficiencia mitral con elevada precisión diagnóstica (99,52 % para válvula normal, 99,38 % en reflujo leve, 99,31 % en moderado y 99,59 % para reflujo grave). 19 En pacientes con estenosis aórtica, un programa que utilizaba todos los parámetros ecocardiográficos con excepción del diámetro y velocidad del tracto de salida demostró mejor precisión para diagnosticar estenosis aórtica grave que la ecuación de continuidad, incluso en poblaciones con disfunción ventricular o bajo flujo-bajo gradiente. 20 En RMI cardíaca la planificación y tiempos de adquisición, resolución de artificios de imagen y mediciones automatizadas están progresando rápidamente, logrando reducir los tiempos de estudio y análisis del método. 21 Con IA se logró reducir el tiempo de análisis de 13 minutos (experto) a 20 segundos (IA), logrando una precisión mayor. 22 Los autores estiman que en un estudio que utilice fracción de eyección como punto final, se reduciría un 46 % el tamaño de la muestra mediante el modelo de segmentación por ML.
En tomografía computada (TC) la IA está siendo evaluada para disminuir la dosis de radiación optimizando la adquisición de imágenes, convertir estudios no contrastados en contrastados y viceversa, permitiendo por ejemplo analizar score de calcio en estudios con presencia de contraste. 13
Mejora de los procesos diagnósticos y pronósticos: reducción de errores, diagnósticos oportunistas
La aplicación de IA permite detectar patrones o asociaciones no sospechadas que relacionen una condición o conjunto de condiciones con determinado hallazgo o patología. En ecocardiografía demostró poder diferenciar el corazón de atleta de la miocardiopatía hipertrófica, 23 la pericarditis constrictiva de la miocardiopatía restrictiva, 24 e identificar correctamente pacientes con miocardiopatía hipertrófica, amiloidosis e hipertensión pulmonar. 25
En un estudio multicéntrico con RMI cardiaca se comparó entre médicos expertos, médicos en entrenamiento y ML la exactitud en la medición de parámetros de función ventricular, en especial la fracción de eyección, así como el tiempo para realizar las mediciones. Entre los expertos, los médicos en entrenamiento, y la ML la precisión fue similar con un coeficiente de variación de 6,1 % (IC 95% 5,2 %-7,1 %), p = 0,258; 8,3 % (IC 95% 5,6 %-10,4 %), p = 0,365; 8,8 % (IC 95 % 6,1 %-11,1 %), p = 0,862, respectivamente. Sin embargo, el análisis automatizado por ML fue 186 veces más rápido que la medición hecha por el hombre con un tiempo promedio de 0,07 minutos por la ML vs. 13 minutos promedio para la medición humana. 26
En Medicina Nuclear, el uso de IA demostró superioridad diagnóstica para coronariopatía obstructiva (similar especificidad con mayor sensibilidad) comparado con el déficit de perfusión total utilizado habitualmente, con un tiempo de análisis de 0,5 segundos por paciente. 27 El uso de un algoritmo vectorial demostró ser superior al análisis del monto isquémico, déficit de perfusión total o cambios en la fracción de eyección, con un área ROC superior al análisis de dos operadores expertos independientes. 28 En otro estudio, al combinar variables clínicas con la información de la prueba de stress y de las imágenes de perfusión, el uso de IA fue superior a la información de las imágenes aisladas, la valoración de médico experto y la cuantificación automática para predecir eventos en 2619 pacientes seguidos más de 3 años. 29
La radiómica es otro aspecto importante de la información de las imágenes. A través del análisis de características de la imagen no detectables por el ojo humano, pueden identificarse aspectos propios de los tejidos que orienten a la estirpe de un tumor, características de una lesión (aguda ó crónica), tipo de hipertrofia ventricular o diferencias en el tejido miocárdico en respuesta a factores de riesgo. (30-32)
En estudios de TC sin contraste, Mannil y col. demostraron una sensibilidad de 86 % y especificidad de 81 % para detectar infarto de miocardio con IA, mientras que dos expertos no pudieron detectar ninguno visualmente, jerarquizando la información disponible en los píxeles de imagen no detectable por el ojo humano. 33
En lo que respecta a aspectos pronósticos, un análisis con ML de 25 variables clínicas y 44 tomográficas de la población del estudio CONFIRM (10 030 pacientes) demostró superioridad para predecir mortalidad a 5 años (área ROC 0,79), sobre el score de Framingham (área ROC 0,61) o variables tomográficas convencionales (grado de estenosis, número de segmentos o índice de Duke modificado, áreas ROC 0,64, 0,64 y 0,62, respectivamente). 34 Otro análisis sobre 8844 pacientes de la misma cohorte, demostró superioridad sobre los análisis topográficos convencionales utilizados para predecir infarto o muerte a 3 años (área ROC para ML 0,771, vs. áreas entre 0,685 y 0,701 para los parámetros convencionales). 35
Del mismo modo, utilizando ML en el registro PARADIGM, investigadores demostraron un mayor valor predictivo para rápida progresión de placa ateromatosa coronaria. 36
En pacientes con hipertensión pulmonar de reciente diagnóstico, Dawes y col. pudieron definir un patrón de contracción del ventrículo derecho con RMI 3D, con mejor discriminación para supervivencia comparado con parámetros clínicos, hemodinámicos, funcionales y de imágenes convencionales (área ROC 0,73 vs. 0,60). 37
En lo que respecta a diagnósticos oportunistas (detección de condiciones no buscadas pero evaluables por IA en un método de imagen) hay muchos ejemplos en la literatura. 38 En una simple radiografía de tórax, Pyrros y col. han logrado detectar 5 % de pacientes con diabetes con aceptable precisión diagnóstica (área ROC 0,77). 39 La detección a través de DL de placas cálcicas coronarias en TC de tórax convencional (puntaje >100), ha demostrado tener valor pronóstico para predecir mortalidad a 10 años (HR 1,51; IC 95% 1,28- 1,79); muerte, infarto o accidente cerebrovascular (HR 1,57; IC 95% 1,33-1,84); y muerte, infarto, accidente cerebrovascular y revascularización (HR 1,69; IC 95% 1,45-1,98) comparado con ausencia de calcio. 40 En TC de tórax o abdomen, 41 o en estudios de score de calcio coronario, 42 pueden detectarse parámetros de osteopenia u osteoporosis sin necesidad de radiación ni costos adicionales. Del mismo modo, pueden detectarse placas ateromatosas vasculares, hígado graso, sarcopenia o tejido adiposo visceral, identificando pacientes en riesgo de síndrome metabólico y/o de desarrollo de eventos a largo plazo (muerte, eventos cardiovasculares, fracturas) y cuya detección temprana podría ser costo-efectiva. 43,44 La detección de enfisema ha demostrado ser más rápida y precisa con modelos basados en DL. 45
Aplicabilidad de la IA en el campo de la prevención cardiovascular
Múltiples técnicas basadas en la IA han sido aplicadas en distintos escenarios relacionados con la prevención cardiovascular. Uno de ellos es en el marco del diagnóstico de la hipercolesterolemia familiar (HF). La HF es el trastorno genético más común del metabolismo de los lípidos, y resulta en una exposición a niveles muy altos de colesterol unido a lipoproteínas de baja densidad (C-LDL) a lo largo de la vida que, si no se tratan, aumentan significativamente el riesgo de eventos cardiovasculares. 46 Se puede establecer un diagnóstico clínico de HF (puntajes clínicos) recopilando características clínicas y de laboratorio (C-LDL). Además, el diagnóstico genético de HF puede confirmarse mediante la identificación de variantes patogénicas heterocigotas o bialélicas, principalmente en los genes LDLR, APOB o PCSK9. 47 Sin embargo, las técnicas de IA pueden tener el potencial de mejorar la identificación de los pacientes con HF. En este contexto, varios estudios han demostrado que los modelos basados en IA tienen un excelente valor predictivo para detectar casos genéticamente confirmados de HF (48-51) Inclusive, ese valor predictivo fue mejor que los métodos tradicionales basados en puntajes de riesgo, como los criterios de la Red Holandesa de las Clínicas de Lípidos.
Otro escenario en el cual fue evaluada la IA es en el cálculo del C-LDL. En la práctica habitual, el C-LDL se estima mediante la fórmula de Friedewald. 52 Sin embargo, se sabe que esta ecuación es inexacta en contextos de triglicéridos elevados o ante valores de C-LDL muy bajos. 53 Para mejorar la precisión, se han diseñado otras fórmulas, como la fórmula de Martin-Hopkins o la ecuación de Sampson. 54,55 Varios estudios han evaluado diferentes técnicas de IA en la estimación del C-LDL. 56,57,58,59,60,61 En este caso, los algoritmos para estimar el C-LDL basados en la IA fueron similares o superiores a las ecuaciones convencionales de Friedewald o las más contemporáneas de Martin-Hopkins o Sampson.
Las barreras relacionadas con el uso de las estatinas es otro campo en donde la IA ha sido evaluada. La intolerancia a las estatinas representa un desafío clínico, y su prevalencia es frecuentemente sobreestimada. 62 Es importante destacar que el efecto nocebo podría desempeñar un rol clave en este importante problema de salud pública. 63 Recientemente, un estudio evaluó técnicas basadas en la IA para analizar una enorme cantidad de datos provenientes de las redes sociales públicas, y generar información sobre las percepciones de las personas sobre las estatinas. 64 El análisis reveló un sentimiento predominantemente neutro a negativo (el 30,8 %, el 66,6 % y el 2,6 % tenían un sentimiento negativo, neutro o positivo, respectivamente) en las conversaciones analizadas. Por otro lado, Sarraju y col. desarrollaron un modelo basado en DL para identificar la falta de uso de las estatinas (y los motivos) mediante el uso de registros médicos electrónicos no estructurados de una gran cohorte de pacientes con enfermedad cardiovascular aterosclerótica. 65 Así, el enfoque basado en DL identificó las razones claves a nivel del paciente (efectos secundarios, preferencia) y a nivel médico (prácticas discordantes con las guías) para el no uso de estatinas. De manera similar, otro estudio utilizó un algoritmo basado en DL en pacientes con diabetes. 66 Nuevamente, este enfoque clasificó las razones para la falta de uso de estatinas a partir de una gran cantidad de datos provenientes de registros médicos electrónicos, incluidas las razones de los pacientes (efectos secundarios y dudas sobre el uso de estatinas), las razones del médico (prácticas discordantes con las guías) y las razones del sistema (inercia médica). Es importante remarcar que conocer las barreras relacionadas con el uso de las estatinas que tienen los pacientes y los médicos, podría ayudar a disminuir la inercia médica y mejorar la adherencia al tratamiento.
En el área de la hipertensión arterial, la IA ha sido evaluada en numerosos estudios. Según algunos reportes, los sistemas basados en la IA podrían ayudar a monitorear continuamente la presión arterial utilizando tecnologías portátiles. 67 Por ejemplo, la presión arterial se podría estimar a partir de una señal de fotopletismógrafo obtenida desde un teléfono inteligente o un reloj inteligente usando DL. Además, gracias a los algoritmos basados en ML, es posible realizar el diagnóstico precoz de la hipertensión arterial, 68,69,70 e inclusive, ayudar al diagnóstico de la hipertensión arterial secundaria. 71 Asimismo, los algoritmos de ML predicen con precisión los niveles de presión arterial ambulatoria posteriores al inicio del tratamiento, lo que podría ayudar a los médicos a personalizar el tratamiento antihipertensivo. 72,73
A partir de grandes estudios epidemiológicos se desarrollaron varias funciones o puntajes para predecir el riesgo cardiovascular. Habitualmente, estos puntajes pueden calcularse a partir de un puñado de variables fáciles de obtener en el consultorio. Si bien son herramientas muy útiles en la práctica clínica, tienen limitaciones relacionadas con la calibración y la capacidad de discriminación. 74 En este contexto, un gran número de estudios han incorporado algoritmos basados en la IA/ML para optimizar la predicción del riesgo cardiovascular. Estos estudios, desarrollados en diferentes regiones del mundo, evaluaron múltiples algoritmos con diferentes técnicas de IA, los cuales incluyeron muchas más variables que las utilizadas habitualmente para estratificar el riesgo cardiovascular. 75,76,77,78 En líneas generales, estos modelos, que emplearon datos de miles de pacientes, han demostrado una muy buena capacidad predictiva, y en algunos casos, superior a los puntajes clásicos como el puntaje de Framingham. 75 Asimismo, otro modelo basado en IA que tomó en cuenta la presencia de ateromatosis subclínica (análisis cualitativo de placas ateroscleróticas por TC), tuvo un valor pronóstico considerable para detectar eventos cardiovasculares mayores, y mostró un valor adicional sobre los factores de riesgo clínicos, el puntaje de calcio coronario o los métodos tradicionales para evaluar las imágenes de la TC. 79
Desafíos y limitaciones
La utilidad de la IA en Medicina es indiscutible y su aplicación está creciendo en forma exponencial. Sin embargo, esto no está exento de limitaciones.
En primer lugar, muchos de los programas resuelven algunos aspectos puntuales (como segmentación y/o cuantificación automática), pero no otros relevantes en el análisis de las imágenes. El costo de desarrollo de estos programas es muy elevado, lo que limita su disponibilidad.
Otro aspecto importante es la aplicabilidad. Si bien muchos resultados basados en IA tienen aplicabilidad clínica práctica, otros hallazgos pueden conducir a conclusiones con valor clínico aún limitado, al menos en la etapa actual de la medicina. Esto puede llevar a los profesionales a no tomar en cuenta los resultados, porque se alejan de los hallazgos clínicos habituales de su práctica. Por otro lado, los resultados podrían tener sesgos por la población seleccionada para el desarrollo del programa, y no ser generalizables a otra población de características diferentes, lo cual limita la validez externa del programa.
Del mismo modo, ciertos programas de IA basados en DL crean modelos difíciles o imposibles de interpretar por su complejidad (“black box effect”). El hecho de no poder comprender la construcción intrínseca del modelo utilizado para determinar los resultados, hace complejo aceptar o rechazar los resultados por los profesionales que deben interpretarlos. Esto acarrea inconvenientes clínicos, éticos e incluso legales al momento de evaluar responsabilidad en la toma de decisiones. 80,81
Como ocurrió previamente con algunos programas de análisis, es importante lograr la extrapolación de resultados entre diferentes software, de modo que cualquier estudio de imagen obtenido con un equipo pueda ser analizado con el software de otra marca o uno de análisis genérico.
Por último, y no menos importante, la privacidad de los datos es otro elemento crucial al momento de considerar este tipo de herramientas.
CONCLUSIONES
La IA permite la adquisición de imágenes por personal no experto, y un análisis automatizado de las mismas con un nivel de correlación similar al experto, con mayor velocidad y precisión. A través del análisis de características de la imagen pueden detectarse aspectos no identificables por el ojo humano que orientan a nuevas patologías o pronósticos. La combinación de estas variables con otros datos disponibles permiten una aproximación diagnóstica y pronóstica superior a la imagen aislada tanto para la práctica clínica como en estudios de investigación . En prevención cardiovascular ha permitido un diagnóstico más preciso de HF, cálculo de CLDL, identificar barreras al uso de estatinas, diagnóstico precoz de hipertensión arterial o predicción de eventos clínicos superior a los puntajes tradicionales. Esta nueva tecnología no está libre de sesgos y limitaciones, pero indudablemente se ha incorporado a la práctica cotidiana y posiblemente revolucione la actividad médica, al menos tal y como la conocemos hoy.











 text in
text in 



