Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Boletín de la Sociedad Argentina de Botánica
On-line version ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.57 no.4 Córdoba Dec. 2022
http://dx.doi.org/10.31055/1851.2372.v57.n4.36922
10.31055/1851.2372.v57.n4.36922
Briología
Diversidad taxonómica y funcional de briófitos en diferentes coberturas de un bosque seco tropical, Córdoba (Colombia)
Taxonomic and functional diversity of bryophytes in different covers of a Tropical Dry Forest, Córdoba (Colombia)
Liliana Peñate-Pacheco
Jorge Enrique Gil-Novoa
Merly YenedithCarrillo-Fajardo
1. Universidad de Córdoba, Facultad de Ciencias Básicas. Departamento de Biología, Grupo de Investigación Biodiversidad Unicórdoba, Montería, Colombia.
2. Doutorado em Botánica, Escola Nacional de Botánica Tropical, Instituto de Pesquisas Jardim Botánico do Rio de Janeiro, Brasil.
3. Universidad Pedagógica y Tecnológica de Colombia, Facultad de Ciencias, Escuela de Biología, Grupo de Investigación Sistemática Biológico-SisBio, Av. Central Norte, Tunja, Colombia.
4. Doctorado en Ciencias Biológicas y Ambientales - Universidad Pedagógica y Tecnológica de Colombia, Facultad de Ciencias, Escuela de Biología, Grupo de Investigación Sistemática Biológica-SisBio, Av. Central Norte, Tunja, Colombia.
*lili.penatte@gmail.com
Summary
Background and aims: Microclimatic changes resulting from the alterations in the forest structure affect the diversity of sensitive organisms such as bryophytes, the ecological processes in which they particípate and their responses to new environments. In this work, the bryoflora and the functional groups associated with water regulation were characterized in different covers of a tropical dry forest: gallery forest-BG, silvopastoral system-SSP and high secondary vegetation-VSA.
M&M: There were nine transects of 0.1 ha (three/coverage) and in each one taxonomic, ecological (substrate epiphytic, epilithic, terrestrial and decomposing organic matter) and functional data (width of the caulidio, length and width of the filidio) were recorded, broad leaf base, hyalodermis and imbrication of filidios)
Results; 19 species are recorded, 15 in VSA,14 in BG and 14 in SSP. The richest families are Fissidentaceae (8 spp) and Lejeuneaceae (3 spp). The substrate with the highest incidence is epiphyte-corticola. Six functional groups were identified, differentiated by the traits: filidio length and width, hyalodermis, and filidio imbrication.
Conclusions; The richness and composition of bryophytes did not show significant differences in the evaluated coverages, possibly due to the homogenization of environmental conditions, product of the history of disturbance to which they have been subjected, therefore, it is important to evaluate other parameters (coverage) and compare with coverages vegetables in a better state of conservation. The functional groups are mainly determined by leaf size traits and are more frequent in the forest (BG and VSA).
Key words: Bryoflora, functional traits, microclimate, substrate, water regulation
Resumen
Introducción y objetivos: Los cambios microclimáticos producto de las alteraciones en la estructura forestal inciden sobre la diversidad de organismos sensibles como los briofitos, los procesos ecológicos en los que participan y sus respuestas frente a los nuevos entornos. En este trabajo se caracterizó la brioflora y los grupos funcionales asociados a la regulación hídrica en diferentes coberturas de un bosque seco tropical: bosque de galería-BG, sistema silvopastoril-SSP y vegetación secundaria alta-VSA.
M&M: Se establecieron nueve transectos de 0.1 ha (tres/cobertura) y en cada uno se registraron datos taxonómicos, ecológicos (sustrato epifito-cortícola, epilítico, terrestre y materia orgánica en descomposición), y funcionales (ancho del tallo, largo y ancho del filidio, filidios con bases amplectantes, hialodermis e imbricación de los filidios).
Resultados: Se registraron 19 especies, 15 en VSA, 14 en BG y 14 en SSP. Las familias más ricas son Fissidentaceae (8 spp) y Lejeuneaceae (3 spp). El sustrato con mayor incidencia es el epífito-cortícola. Se identificaron seis grupos funcionales, diferenciados por los rasgos: largo y ancho del filidio, hialodermis e imbricación de filidios.
Conclusiones: La riqueza y composición de briófitos no mostró diferencias significativas en las coberturas evaluadas, posiblemente por la homogenización de las condiciones ambientales, producto del historial de disturbio al que han sido sometidas, por tanto, es importante evaluar otros parámetros (cobertura) y comparar con coberturas vegetales en mejor estado de conservación. Los grupos funcionales están determinados principalmente por los rasgos del tamaño de la hoja y presentan una mayor frecuencia en las coberturas boscosas (BG y VSA).
Palabras claves: Brioflora, microclima, rasgos funcionales, regulación hídrica, sustrato.
Introducción
Los briófitos son un componente importante en la diversidad y funcionalidad de los ecosistemas boscosos (Holz & Gradstein, 2005; Benítez, 2016; Salavarría, 2017). Son organismos altamente sensibles a las alteraciones del hábitat, dado que su fisiología está fuertemente relacionada con la humedad, la radiación solar y la temperatura (Benítez, 2016), por tanto, cambios en las condiciones microclimáticas del hábitat, afectan su distribución, estructura y composición florística (Rovere & Calabrese, 2011).
La morfología de estas plantas, les permite la captura y almacenamiento de importantes cantidades del agua lluvia, y en épocas de menor suministro la van liberando gradualmente de acuerdo con los requerimientos de la comunidad biótica, razón por la cual, se consideran fundamentales en los procesos de regulación hídrica, principalmente en ecosistemas donde el agua es un factor limitante (Aguirre, 2008; Merchán, Herrera & Delgado, 2011); como en los bosques secos tropicales, cuyas precipitaciones no superan los 2000 mm anuales y esto conlleva a que las especies que los constituyen estén adaptados a amplios periodos de sequía; aspecto importante para el equilibrio de las dinámicas ecológicas en dicho ecosistema (Pennington, Lavin & Oliveira, 2009; Pizano & García, 2014; Pizano et al, 2017).
Los análisis de diversidad se pueden abordar desde diferentes dimensiones, tales como, taxonómica, funcional y filogenética (Pavoine & Bonsall, 2011; Swenson, 2011; Moreno et al, 2018; Moreno, 2019). La diversidad taxonómica se define por la riqueza, la cual, es una medida ampliamente aceptada (Antonelli et al, 2018 y Gotelli & Collwell, 2001), e indica, por ejemplo: ¿Cuántos musgos se encuentran en un país, sitio de estudio o árbol? (Magill, 2010). La diversidad funcional, permite entender las relaciones entre los factores abióticos y los procesos ecológicos, a través de los rasgos funcionales entre y dentro de las especies (Antonelli et al, 2018; Mason & de Bello 2013), es fundamental para regular la provisión de los servicios ecosistémicos, como la regulación hídrica (Diaz & Cabido, 1997; Díaz et al, 2007 y Ballesteros & Pérez, 2016); y se expresa a través de grupos funcionales o índices de diversidad funcional (Casanoves et al, 2011).
Existe controversia entre los científicos por la definición y uso de los términos rasgo y rasgo funcional (Violle et al., 2007; Antonelli et al., 2018). Dawson et al. (2021) propusieron que: "Un rasgo es una característica medible (morfológica, fenológica, fisiológica, conductual o cultural) de un organismo individual que se mide en el individuo o en otro nivel relevante de organización". Plantean, usar la expresión "funcional", solo para casos en los que se vaya a evaluar determinada función con relación a un proceso, debido a que todos los rasgos pueden ser funcionales hasta cierto punto, por tanto, es un concepto ambiguo, pero mantener el concepto de valor de rasgo o atributo, que es la condición que expresa el rasgo en su forma cuantitativa o cualitativa (Lavorel et al, 2013; Violle et al, 2007). En el caso de las formas de vida con dificultades para establecer la individualidad, como hongos, corales y musgos, proponen tres métodos: la unidad funcional (ej. medición de rasgos por área), unidad restringida para el organismo (ej. tronco) y organismos clonales que pueden tener un pseudoindividuo definido (ej. ramets).
En Colombia, la mayor parte de los estudios se han realizado en bosques húmedos y montanos, enfocados en temas taxonómicos y sistemáticos, estudiando en menor proporción los bosques secos, el efecto de las alteraciones antrópicas y los procesos ecológicos en los que participan (Sastre de Jesús, 2004; Benítez, 2016), así mismo, se sabe poco sobre algunas regiones del país (Gil-Novoa et al, 2017), como las tierras bajas de los Llanos Orientales, los valles interandinos y el Caribe (García et al., 2016); por ello, el objetivo de esta investigación fue caracterizar la brioflora e identificar grupos funcionales asociados a la regulación hídrica; en diferentes coberturas de un bosque seco tropical, planteando como hipótesis que la diversidad, composición de especies y grupos funcionales podría disminuir en hábitats donde la estructura forestal y el microclima hayan sido fuertemente alterados como consecuencia de la transformación del bosque hacia sistemas silvopastoriles (Benítez, Aragón & Prieto, 2015).
Materiales y Métodos
Área de estudio
El trabajo se realizó en el departamento de Córdoba (Colombia), en la finca Las Palmeras, corregimiento Loma Verde, al suroccidente del municipio de Montería, entre las coordenadas 08°30'37.1''N y 076°06'12.9"W (Fig. 1), a 65 m de altitud. El Norte del departamento, presenta en general una topografía plana y pertenece a la zona de vida de bosque seco tropical, caracterizado por un clima cálido tropical con temperatura media de 28°C, precipitación anual estimada de 1300 mm, con patrón de distribución unimodal que presenta época lluviosa de abril a noviembre y época seca de diciembre a marzo (Rangel & Arellano, 2010). El paisaje predominante en el área de estudio constituye un sistema agropecuario, que favorece el establecimiento de bosques secundarios y en combinación con la vegetación primaria remanente, forman un mosaico de hábitats con diversos tipos de cobertura vegetal. Para este proyecto se seleccionaron tres, basadas en la Leyenda Nacional de Coberturas de la Tierra (IDEAM, 2010): bosque de galería, sistema silvopastoril, y vegetación secundaria alta.
Bosque de galería (BG): formación vegetal, en etapas de sucesión temprana con algunos árboles remanentes, las especies dominantes son, Albizia saman (Jacq.) F. Muell, Guazuma ulmifolia Lam,
Brownea ariza Benth y Tabebuia rosea (Bertol.) DC, con alturas entre 10-15m. En época de lluvias se presentan inundaciones, por lo que la madera en descomposición y las rocas son removidas frecuentemente. En esta cobertura hace más de 25 años no se realizan actividades de tala, pero si hay presencia de ganado vacuno.
Sistema silvopastoril (SSP): pastizales caracterizados por la alta densidad de árboles producto de la vegetación remanente (principalmente de A. saman), regeneración natural y enriquecimiento vegetal; en el estrato arbóreo (15-25m) dominan Maclura tinctoria (L.) D. Don ex Steud. y Hura crepitans L. y, en el estrato herbáceo (1.5 m) representantes de las familias Poaceae, Lamiaceae y Urticaceae.
Vegetación secundaria alta (VSA): formación de bosque secundario en diferentes etapas de sucesión, con poca evidencia de intervención antrópica en los últimos 25 a 30 años. Dominado por especies de las familias Fabaceae, Bignoniaceae, Urticaceae,
Fig. 1. Localización geográfica del área de estudio en la finca Las Palmeras del municipio de Montería en Córdoba-Colombia. A. Colombia (sur América). B. Montería- Córdoba. C. Finca Las palmeras (bosque de galería, sistema silvopastoril y vegetación secundaria alta).
Localización del sitio de estudio
IZZ Culurnbia d Córdoba l~1 Montería * Finca Palmeras ^ Bosque de galería ^ Sistema sUvonastnril ¦ Vegetación secundaria alta
InformadT de referencia
Escala: 1:15000 VHGS04
Ftertte: Gcogle earth retira ríe ¡inageci; oi/oé/2015 Elabora*» por: Lilia irsriePiaie
Simaroubaceae y Malvaceae, con alturas que varían entre 8 y 25 m.
Metodología
Los muéstreos se realizaron entre los meses de mayo y julio de 2019; periodo correspondiente a la época de lluvias y de transición denominado localmente como "veranillo de San Juan". Se realizaron seis salidas de campo con una duración de cuatro días cada una. En cada cobertura vegetal se realizaron mediciones de humedad y luminosidad a través de una estación meteorológica Data Loggin Station, los registros se tomaron, a las 9:00 am durante tres días consecutivos, esto con el fin de establecer diferencias microclimáticas entre las coberturas. El material vegetal fue recolectado bajo permiso marco otorgado por Autoridad Nacional de Licencias Ambientales-ANLA a Universidad de Córdoba en la Resolución N°009147 de 2017.
Diversidad taxonómica: se establecieron nueve transectos de 0.1 ha (100 x 10 m), tres por cada cobertura vegetal evaluada (BG, SSP y VSA). Para caracterizar la brioflora epifita se seleccionaron cuatro forófitos por transecto (36 en total), con una distancia mínima de 20 m, DAP >20 cm, altura superior a los siete metros y corteza rugosa no exfoliable, el muestreo se realizó en la zona 1 del forófito de acuerdo con la clasificación propuesta por Johansson (1974), la cual se subdividió en: raíces aflorantes, estrato 1 (0 cm-50 cm del suelo) y estrato 2 (50,01 cm - 200 cm); esto con el fin de determinar si los briófitos presentaban patrones de distribución vertical. La caracterización de especies de otros hábitos se realizó mediante búsqueda libre al interior de los transectos y por fuera de ellos, los sustratos seleccionados fueron los que presentaron mayor incidencia de briófitos y se denominaron teniendo en cuenta la clasificación propuesta por Aguirre (2008) en: epifito-cortícola, terrestre, epilítico y materia orgánica en descomposición.
El material fue herborizado siguiendo los protocolos tradicionales, es decir, secado mediante exposición al sol y almacenados en bolsas de papel rotuladas por cobertura, número de forófito, zona y número de registro. La identificación de los ejemplares se realizó a través de claves taxonómicas como: Gradstein (1994), Churchill & Linares (1995), Uribe & Aguirre (1997) y Gradstein & Uribe (2011), entre otras. También se consultaron las bases de datos en línea del Missouri Botanical Garden (http://www.tropicos.org/) y el Catálogo de Plantas y Líquenes de Colombia (http://catalogoplantasdecolombia. unal.edu.co). Los especímenes recolectados en esta investigación fueron depositados en el Herbario de la Universidad de Córdoba-HUC (números de catálogo HUC 8306-8476), y constituyen la primera colección de briófitos para este herbario del Caribe colombiano.
Diversidad funcional: Los rasgos asociados a la regulación hídrica se seleccionaron con base en publicaciones de referencia como: Proctor (2000), Frahm (2003), Montenegro et al., (2005) y Glime (2017) y como criterio prioritario de selección se estableció que el rasgo se presentara tanto en musgos como en hepáticas (Tabla 1). Para la correcta identificación de los rasgos y sus atributos en el trabajo de laboratorio, se tuvieron en cuenta para el caso de los musgos las descripciones e ilustraciones de Calzadilla & Churchill (2014) y para las hepáticas a Glime (2017)
La medición de los rasgos se realizó en cinco ramets por colonia, y para cada especie el número máximo de colonias fueron cinco, los rasgos cuantitativos largo y ancho de filidios y ancho del tallo, se midieron con la ayuda del software Image J ver. 1.52 (Schneider et al., 2012) y los cualitativos hialodermis, base amplectante, e imbricación de los filidios, se describieron como ausentes o presentes mediante observación directa a través de estereoscopio y microscopio. En cuanto a la imbricación, no se tuvo en cuenta la orientación dorsal (súcuba) o ventral (íncuba), teniendo como referencia los planteamientos de Basile & Basile (1987) y Glime (2017), quienes concluyeron que la conducción del agua es igual o hace poca diferencia en ambas orientaciones.
Análisis de datos
Diversidad taxonómica: Se estimó la completitud del muestreo tomando como abundancia el número de registros por especie en cada cobertura, a través de curvas de interpolación/extrapolación basadas en la cobertura de la muestra (la proporción que representan los individuos de cada especie en la unidad de muestreo, con respecto al número total de individuos), la cual permite realizar una comparación estadística rigurosa de la riqueza de especies no solo para submuestras enrarecidas, sino también para valores de riqueza extrapolados basados en muestras de tamaños diferentes (Chao & Jost, 2012). El análisis se hizo con el paquete iNEXT online (Ma & Hsieh, 2016). Para estimar la diversidad verdadera se elaboraron curvas de interpolación y extrapolación, basadas en los tres primeros números de Hill: riqueza efectiva (0D), exponente de la diversidad de Shannon ('D) y el inverso del índice de Simpson (2D) Chao et al., (2014), utilizando el paquete estadístico iNEXT (Hsieh et al., 2016). La diversidad P se calculó mediante el índice de similaridad de Jaccard en el programa Infostat (Di Rienzo et al., 2009).
Tabla 1. Listado de los rasgos seleccionados, atributos y participación en el proceso de regulación hídrica.
| Rasgo | Definición | Atributo | Papel ecológico |
| Largo y ancho del filidio | Medidas de área foliar | Medida en cm de la longitud y ancho del filidio | El tamaño de los filidios determina las cantidades de agua retenida e influye en el tamaño de los espacios capilares, por tanto, entre más grande sea la superficie de la hoja mayor será el volumen de agua absorbido y retenido (Glime, 2017). |
| Ancho del caulidio (tallo) | Medida transversal del tallo | Medida en cm del ancho del tallo | El caulidio o tallo está conformado por células hialinas, especialmente en la epidermis por lo que su tamaño se relaciona directamente con la capacidad de retención de agua (Calzadilla, 2014) |
| Hialodermis | Epidermis caulinar con células diferenciadas, hialinas, grandes, alargadas de pared engrosada o delgada, con muy pocos cloroplastos o ausentes (Calzadilla, 2014 y Glime, 2017) | Presencia o ausencia | Almacenamiento de agua en células especializadas (hialinas) (Glime, 2017) |
| Imbricación | Filidios muy próximos y | Presencia o | Formación de cámaras y canales |
| de los filidios | sobrepuestos desde la base hasta el ápice con los márgenes de las hojas arregladas como las tejas de un tejado (Calzadilla, 2014). | ausencia | capilares interconectados que mejoran la conducción ectohídrica (Glime, 2017) |
| Base | Base de los filidios que rodea y | Presencia o | Forman espacios capilares entre la base del |
| amplectante del filidio | abraza al tallo, con frecuencia se compone de hialocistos. (Churchill & Linares, 1995) | ausencia | filidio y el caulidio, por lo tanto, ayudan en la retención de agua (Churchill & Linares, 1995) |
Diversidad funcional, se definieron los grupos funcionales a través de un análisis de conglomerados, agrupando las especies de briófitos según su similitud, mediante el método de agrupamiento de Ward y la distancia de Gower para datos cualitativos y cuantitativos. Las diferencias entre los grupos funcionales (GFs) se determinaron mediante un análisis de varianza multivariado (MANOVA); la prueba estadística de Wilks y la prueba de vectores medios de Hotelling (a=0.05). Para corroborar los resultados del MANOVA, se realizó un análisis discriminante que describe las relaciones entre dos o más grupos y permite establecer la relación entre rasgos cuantitativos y GFs, a fin de determinar cuáles son los que tienen más peso discriminante en la diferenciación de los grupos. Además, se realizó un análisis de tablas de contingencia con el estadístico Chi2 para comprobar si existen asociaciones entre los rasgos cualitativos y los GFs; posteriormente se graficaron las relaciones a través de un biplot obtenido mediante un análisis de correspondencia múltiple. Por último, se realizó un gráfico de frecuencias para determinar cómo varía la frecuencia relativa de los grupos funcionales en las coberturas. Todos los análisis y gráficos fueron realizados en el programa Infostat (Di Rienzo et al, 2009).
Resultados
La completitud del muestreo fue de 88%, 92% y 94% para el BG, SSP y VSA respectivamente (Fig. 2). En total, se registran 19 especies, agrupadas en 11 géneros y 8 familias (Tabla 2), el 79% son musgos y el 21% hepáticas. Fissidentaceae (8 spp) es la familia con mayor riqueza, seguida de Lejeuneaceae (3) y Calymperaceae (2). Los géneros mejor representados son Fissidens y Lejeunea con ocho y dos especies respectivamente. Todos los briófitos identificados en este estudio se registran por primera vez para el departamento de Córdoba y dos son nuevos registros para la costa Caribe colombiana: Bryum renauldii Roll. y Acrolejeunea emergens (Mitt.) Steph.
La riqueza de briófitos (q0) para VSA es de 15, mientras que para BG y SSP es de 14 en cada una, estos resultados indican que la riqueza en las tres coberturas es similar, lo cual se evidencia en la figura 3a por la superposición de los intervalos de confianza. El índice q1 muestra que BG (10.64) y SSP (10.65) presentan mayor número de especies con abundancias similares, por lo que son 1.30 veces más diversos que VSA (8.18) (Fig. 3b), las especies con mayor número de ocurrencias en BG y SSP son Calymperes palisotii (10) y Fissidens submarginatus (11). El índice de Simpson (q2) arroja que VSA presenta mayor dominancia (5.22) con respecto a BG (8.48) y SSP (8.68) (Fig. 3c), debido a que se encuentran menos especies altamente abundantes, Fissidens aff. curvatus es la especie más dominante con 30 registros.
Diversidad Beta
La composición florística de los briófitos en las coberturas evaluadas es similar. SSP y VSA comparten 13 especies, por lo que presentan los niveles más altos de Similaridad (81.3%), seguido de BG y SSP, con 10 especies en común y una similitud de 55.6%; finalmente, la comparación entre BG y VSA indica una similitud de 52.6% con 10 especies compartidas (Fig. 4).
Distribución por tipo de sustrato
Todas las especies registradas (19 especies) se encontraron en el sustrato epifito-cortícola, la zona del árbol con mayor riqueza e incidencia fue raíces aflorantes con 16 especies y 69 registros, seguido de la parte inferior del tallo (0-50 cm) con 13 y 30, respectivamente. En cuanto a los otros sustratos, materia orgánica en descomposición presentó 11 especies y 23 registros, epilítico 8 y 17, y terrestre 7 y 18, en el orden dado. La distribución de los briófitos en los diferentes sustratos para VSA fue muy equitativa a diferencia de BG y SSP, donde las especies dominaron en el epifito-cortícola (Fig. 5).
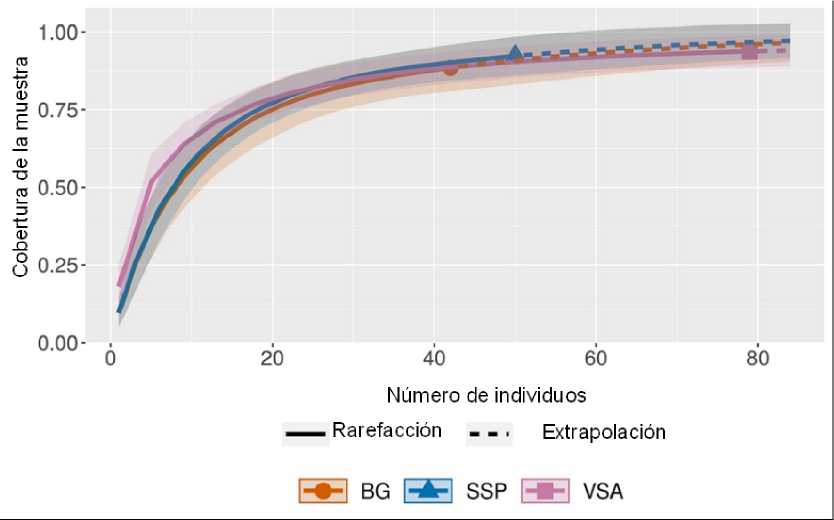
Fig. 2. Completitud del muestreo de briófitos en cada cobertura vegetal. La zona sombreada señala los intervalos de confianza al 95 %. BG= Bosque de Galería, SSP= Sistema Silvopastoril, VSA= Vegetación Secundaria.
Tabla 2. Listado y distribución de las especies de briófitos en las diferentes coberturas y sustratos de estudio. BG= Bosque de Galería, SSP= Sistema Silvopastoril, VSA= Vegetación Secundaria Alta, EC= Epífito-Cortícola, MOD= Materia orgánica en descomposición, EPIL= Epilítico, Ter= Terrestre.
X= presencia, 0= Ausencia.
| FAMILIA | ESPECIE | BG | SSP | VSA | EC | MOD | EPIL | TER |
| Bryaceae | Bryum renauldii Roll. | 0 | x | x | x | 0 | x | 0 |
| Calymperaceae | Octoblepharum albidum Hedw. | x | 0 | 0 | x | 0 | 0 | 0 |
| Calymperaceae | Calymperes palisotii Schwagr. | x | x | x | x | x | 0 | 0 |
| Fissidentaceae | Fissidens angustifolius Sull. | x | x | x | x | x | x | x |
| Fissidentaceae | Fissidens aff. curvatus Hornsch. | x | x | x | x | x | x | x |
| Fissidentaceae | Fissidens dissitifolius Sull. | x | x | x | x | x | 0 | x |
| Fissidentaceae | Fissidens stereei Grout. | x | 0 | 0 | x | 0 | 0 | 0 |
| Fissidentaceae | Fissidens submarginatus Bruch. | x | x | x | x | 0 | 0 | x |
| Fissidentaceae | Fissidens zollingeri Mont. | x | x | x | x | x | 0 | x |
| Fissidentaceae | Fissidens aff. crispus Mont. | 0 | x | x | x | x | x | 0 |
| Fissidentaceae | Fissidens aff. inaequalis Mitt. | 0 | 0 | x | x | 0 | 0 | 0 |
| Pottiaceae | Hyophila involuta (Hook.) A. Jaeger. | x | x | x | x | 0 | x | x |
| Stereophyllaceae | Entodontopsis leucostega (Brid.) W.R. Buck y Ireland. | 0 | x | x | x | x | x | 0 |
| Stereophyllaceae | Eulacophyllum culteliforme (Sullivant) W.R Buck y Ireland. | 0 | x | x | x | 0 | x | 0 |
| Sematophyllaceae | Sematophyllum sp. (Hedw.) Mitt. | x | 0 | 0 | x | 0 | 0 | 0 |
| Lejeuneaceae | Acrolejeunea emergens (Mitt.) Steph. | x | x | 0 | x | x | 0 | 0 |
| Lejeuneaceae | Lejeunea trinitensis Lindenb. | x | x | x | x | x | 0 | x |
| Lejeuneaceae | Lejeunea sp. Lib. | x | x | x | x | x | x | 0 |
| Frullaniaceae | Frullania sp. Raddi. | x | 0 | x | x | x | 0 | 0 |
| N° total de especies | 14 | 14 | 15 | 19 | 11 | 8 | 7 |
Variables Ambientales
Las variables ambientales microclimáticas no difieren significativamente entre las coberturas, sin embargo, se puede observar que SSP presenta los valores más altos de radiación solar (115.6) y los más bajos de humedad relativa (89.1%), por el contrario, BG (32.7- 90.5%) y VSA (25.6- 95.6%) son las coberturas más húmedas y sombreadas.
Grupos Funcionales
Se caracterizaron seis grupos funcionales de briófitos (correlación cofenética= 0.772) (Fig. 6), producto de un conjunto multivariado de seis rasgos funcionales foliares y de tallo, considerados de importancia ecológica por su relación con el proceso de regulación hídrica. Los rasgos que caracterizan a cada grupo, son: GF1: filidios anchos (0,57 cm) e imbricados; GF2: filidios cortos (0.43 cm), tallo angosto (0,07) y presencia de hialodermis; GF3: filidio de tamaño intermedio (1,01cm de largo y 0,33cm de ancho) sin base amplectante; GF4: filidios grandes (1,63cm de largo y 0,57cm de ancho); los últimos dos grupos se diferencian por el tamaño de sus filidios, en el GF5 son más largos (1,13 cm) y anchos (0,27 cm), mientras que en el GF6 son más cortos (0.94 cm) y estrechos (0,25).
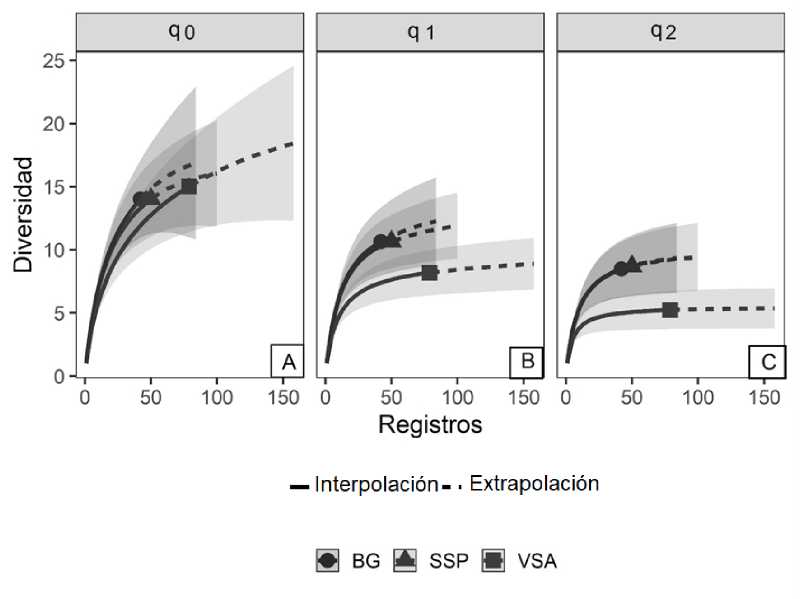
Fig. 3. Diversidad de briófitos en tres coberturas de un bosque seco tropical, A= riqueza de especies (q0), B= número de especies igualmente comunes (q1), C= número de especies dominantes (q2). Las bandas corresponden al intervalo de confianza (95%).
Fig. 4. Similaridad de la composición de briófitos en tres coberturas de un bosque seco tropical en Córdoba-Colombia. VSA= vegetación secundaria alta, SSP= sistema silvopastoril, BG= bosque de galería.
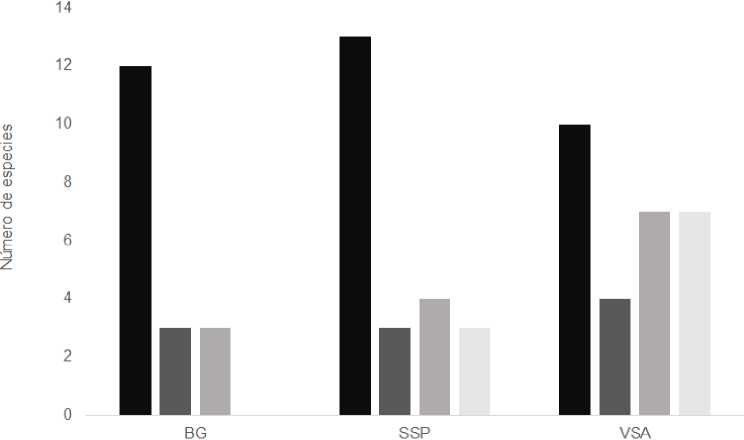
Fig. 5. Distribución de las especies de briófitos por sustratos dentro de cada una de las coberturas vegetales estudiadas.
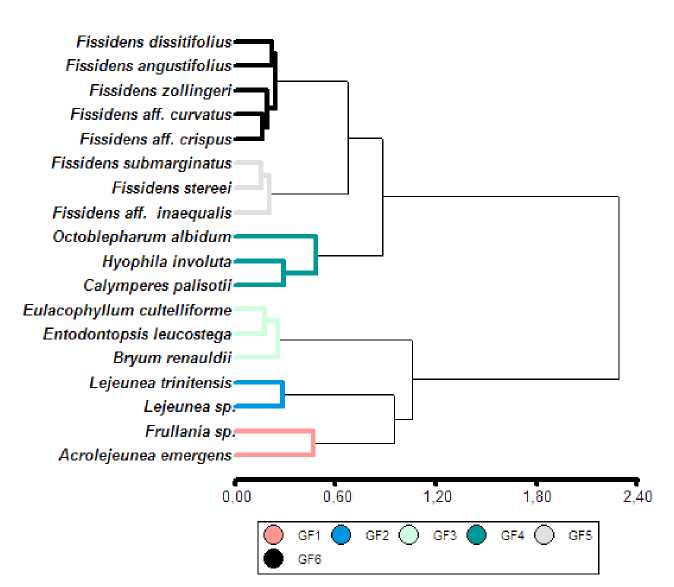
Fig. 6. Grupos funcionales de briófitos asociados a la regulación hídrica, a partir de rasgos foliares (largo y ancho del filidio, imbricación y base amplectante) y de tallo (ancho del tallo y presencia de hialodermis).
Los rasgos cuantitativos permitieron diferenciar significativamente los grupos funcionales (p < 0.0001), (Anexo 1). El rasgo con mayor peso discriminante sobre el eje uno (66.61%) fue ancho del filidio (-1.25), permitiendo separar los grupos funcionales uno y dos (valores altos de AF) de los demás grupos, mientras que largo del filidio (29.56) es el que presenta mayor peso discriminante sobre el eje dos (0.61) separando el GF4 (mayor longitud y ancho del filidio) de los demás (Fig. 7).
Los rasgos cualitativos también permitieron la separación de los grupos funcionales al mostrar asociaciones estadísticamente significativas (p< 0,05) (Anexo 2). Con una inercia del 65.23% el primer eje separa los GFs 1 y 2 de los grupos 3, 4, 5 y 6. Las especies con filidios imbricados se asocian al GF1 y las que presentan hialodermis al GF2. En la parte izquierda del eje se encuentran los GFs 4, 5 y 6 ubicados en el mismo punto al estar asociados a especies con presencia de base amplectante (el rasgo largo del filidio es lo que los diferencia como grupos funcionales) (Fig. 8).
La frecuencia de los grupos funcionales de briófitos varía entre las coberturas. Para el GF1 la frecuencia es mayor en BG y SSP, mientras que los GFs 2 y 3 son más frecuentes en VSA. Los GFs 4 y 5 están mejor representados en bosque de galería y el GF6 presenta la mayor frecuencia en sistema silvopastoril (Fig. 9).
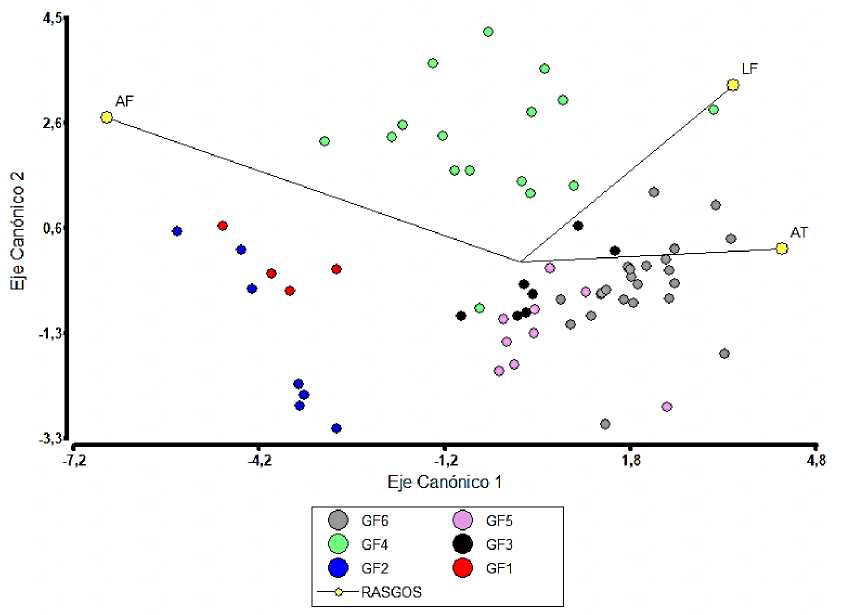
Fig. 7. Asociación de los rasgos cuantitativos con los grupos funcionales. AF= ancho del filidio, LF= largo del filidio, AT= ancho del tallo.
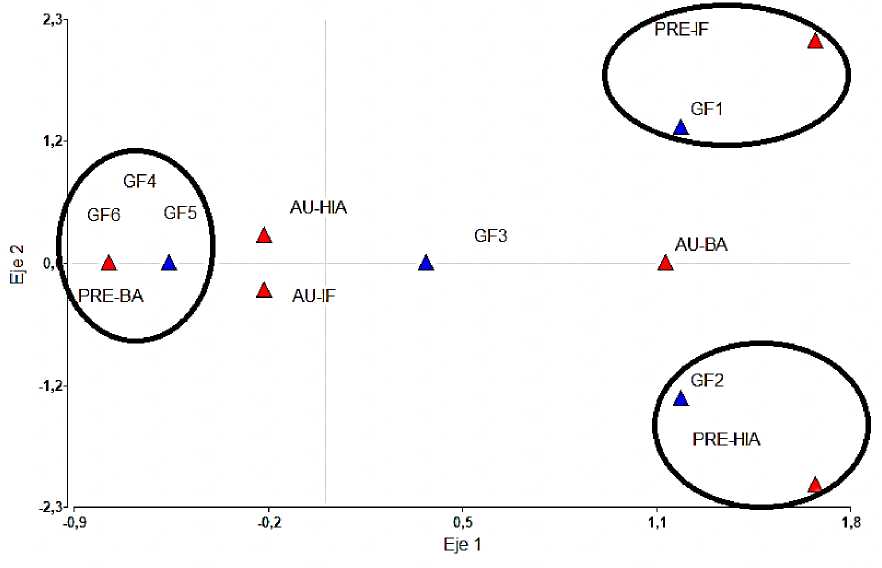
Fig. 8. Asociación de los rasgos cualitativos con los grupos funcionales. PRE= presencia, AU= ausencia, BA=base amplectante, HIA= hialodermis, IF= imbricación de los filidios.
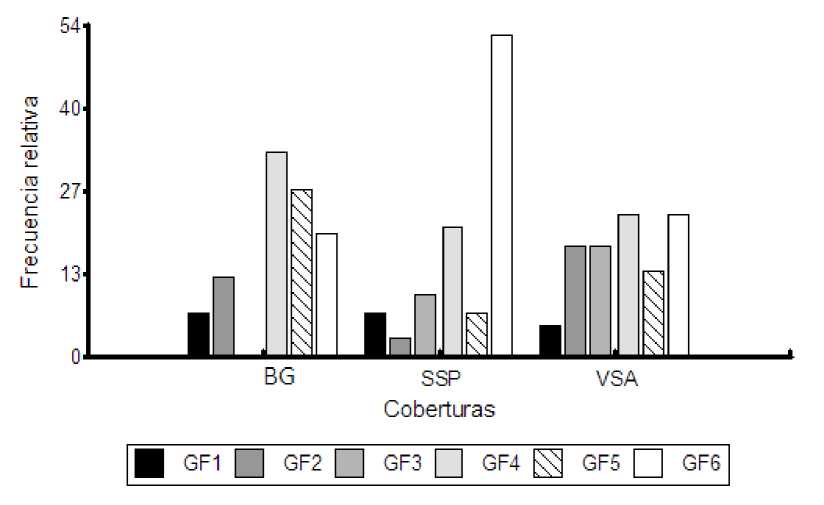
Fig. 9. Frecuencia relativa de cada grupo funcional en las coberturas de estudio. BG: Bosque de Galería, SSP: Sistema Silvopastoril, VSA: Vegetación Secundaria Alta.
Discusión
La diversidad de los briófitos en el bosque seco, generalmente es baja y está compuesta por unas pocas especies tolerantes a la desecación, principalmente musgos (Gradstein et al., 2001), una de las familias más representativas es Fissidentaceae, la cual se caracteriza por presentar hojas dísticas, conformadas por una lámina vaginante, lámina ventral y lámina dorsal, la estructura de la hoja y su inserción en el tallo permite que se formen espacios capilares donde se almacena el agua (García et al., 2016; Santos & Aguirre, 2010; Aguirre & Avendaño, 2008). Las hepáticas también constituyen un alto porcentaje de la brioflora del bosque seco, representadas por algunas especies de la familia Lejeuneaceae (Uribe & Gradstein, 1999), las cuales crecen principalmente como epifitas y en ocasiones son clasificadas como tolerantes a la luz directa, dado que presentan características morfológicas que les permiten resistir las condiciones ambientales que causan la desecación, tales como: presencia de células hialinas en los filidios y en el tallo (hialodermis), anfigastros, sobreposición de los filidios, forma de crecimiento, entre otros (Glime, 2017).
Diversidad taxonómica
Las 19 especies de briófitos identificadas en las tres coberturas (BG, SSP y VSA) del bosque seco tropical de la Finca Las Palmeras en el departamento de Córdoba (Tabla 2), presentan menor riqueza, comparada con otros trabajos realizados en bosques secos de la costa Caribe colombiana, donde se registran 31 especies en bosques de galería y 63 en fragmentos de bosque (García et al., 2016; García & Mercado, 2017), de estas especies solo seis se comparten con los resultados de esta investigación: Fissidens dissitifolius, Fissidens esteerei, Hyophila involuta, Octoblepharum albidum, Eulacophyllum culteliforme y Lejeunea trinitensis; estos resultados, podrían ser producto del historial de transformación al que estuvieron sometidas las coberturas en el área de estudio.
Análisis por cobertura
En términos de riqueza (q0) (Fig. 3A), los briofitos no presentaron diferencias significativas en las coberturas evaluadas, sin embargo, en cuanto al número de especies igualmente comunes (q1) (Fig. 3B), BG y SSP presentaron un mayor número de especies efectivas que VSA, por lo que son comunidades mucho más diversas, esto se asocia a la marcada dominancia (q2) (Fig. 3C) de Fissidens aff. curvatus (30 registros) y L. flava (10 registros) en VSA, que generan una comunidad menos uniforme. Aunque VSA presenta condiciones más favorables para el establecimiento de los briofitos que BG y SSP, como mayor grado de humedad, sombra, disponibilidad de sustrato y densidad arbórea, los resultados sugieren que estas diferencias (florísticas y ambientales) no reflejan un gradiente ecológico "verdadero" en términos de riqueza (Werner & Gradstein, 2009), lo cual puede relacionarse con la homogenización de las condiciones ambientales producto de la transformación de las coberturas y por ende el reemplazo de especies sensibles por aquellas que están adaptadas a condiciones climáticas de mayor luz y temperatura (epífitos de sol) (Guerra et al., 2020).
Bosque de galería: Los bosques ribereños y otros tipos de vegetación de agua dulce son considerados como uno de los hábitats más ricos en briófitos en los trópicos temporalmente secos, principalmente cuando presentan poca afectación por acciones antrópicas (Pocs, 2012; García et al., 2016), sin embargo, y dado el historial de intervención del BG evaluado, la diversidad de especies en esta cobertura no fue la más alta, esto se puede asociar con la baja disponibilidad de sustratos permanentes para la colonización y la discontinuidad en la estructura forestal, producto de la regeneración después de la tala y los árboles remanentes (Dauphin, Grayum & Michael, 2005).
Sistema silvopastoril: En términos de diversidad los pastizales son pobres en briófitos (Gradstein et al, 2001; Werner& Gradstein, 2005); sin embargo, en el área de estudio se presenta un número de especies similar a los registrados en BG y VSA, esto se puede atribuir a la migración de propágulos producto de la dispersión por el viento, desde las coberturas boscosas a zonas aledañas o la presencia de árboles aislados de mayor edad, que por sus grandes dimensiones y características morfológicas crean condiciones microclimáticas favorables para el establecimiento y desarrollo de un gran número de especies de briófitos (Wolf, 2003), en este sentido, cumplen un papel importante en la conservación de la biodiversidad en áreas donde los bosques han sido altamente transformados.
Distribución por sustrato
La corteza de los árboles fue el sustrato donde se registró mayor ocurrencia (113) y número de especies (19) de briófitos, principalmente en las raíces aflorantes y la base del árbol (0-50m) (Fig. 5), dado que representan las regiones del forófito más húmedas y sombreados para las epífitas (Pocs, 1982; Gradstein & Culmsee, 2010). Estos resultados concuerdan con lo encontrado por Dauphin (1999), donde indica que la mayoría de los bosques tropicales están dominados por especies cortícolas y según Santos & Aguirre (2010), la colonización de este sustrato es una adaptación hacia la utilización del agua como recurso sobrante en las plantas hospederas.
En VSA la distribución de las especies en los sustratos fue más equitativa que en BG y SSP (Fig. 5), lo que sugiere que las condiciones que allí se presentan son favorables y permiten una mayor oferta de microhábitats y recursos para los briófitos. SSP presentó el mayor número de especies epifitas (13), de los cuales el 77.7% de los registros se encontró sobre las raíces aflorantes, esto podría relacionarse con la presencia de árboles de sucesión tardía principalmente de la especie Albizia saman, los cuales han tenido mayor tiempo de exposición y área para ser colonizados (Gradstein & Culmsee, 2010; Guerra et al., 2020), y además presentan raíces emergentes de gran tamaño, donde se generan condiciones de mayor humedad y sombra. Por su parte en BG y VSA al estar en proceso de regeneración debido a las alteraciones antrópicas a las que fueron sometidas años atrás, gran parte de los hospederos aún son jóvenes por lo que podrían albergan una menor riqueza de briófitos cortícolas (Gradstein & Sporn, 2010).
Grupos funcionales
El GF1 está conformado por las especies Acrolejeunea emergens y Frullania sp. (hepáticas), las cuales se caracterizan por presentar filidios orbiculares, con los valores más altos para ancho del filidio (0,57 cm), esto les confiere mayor superficie del filidio y por ende les permite interceptar y absorber mayores volúmenes de agua. Además, la imbricación de los filidios forma una serie de cámaras interconectadas y canales capilares que permiten la conducción externa del agua (Montenegro et al., 2005)
El GF2, constituido por especies del género Lejeunea, presenta filidios cortos (0.43 cm), tallos angostos (0,07 cm) y hialodermis, es decir, células grandes, hialinas y con alta capacidad para almacenar agua, debido a que han perdido su contenido celular para realizar esta función (Calzadilla & Churchill, 2014).
Otras características funcionales en el proceso de regulación hídrica, son las que caracterizan al GF3 constituido por Eulacophyllum culteliforme, Entodontopsis leucostega y Bryum renauldii, musgos con filidios oblongo-lanceolados (1,01cm de largo y 0,33cm de ancho), cóncavos y a diferencia de los otros grupos conformados por musgos, estos no presenta base amplectante, sin embargo, el tamaño y forma de las hojas permite que se creen espacios capilares útiles para el almacenamiento de agua (Glime, 2017).
Calymperes palisotii, Hyophila involuta y Octoblepharum albidum representan al GF4, caracterizado por contar con mayor área foliar al presentar los valores más altos para ancho (0.57 cm) y largo del filidio (1,63 cm), permitiéndoles así interceptar y almacenar grandes cantidades de agua (Werner & Gradstein, 2009). La medida del ancho del filidio, es compartida con el GF1, sin embargo, el largo es inferior (0.61 cm), lo que implica menor área foliar; otro aspecto que diferencia a estos grupos es la ausencia de filidios imbricados en el GF4. Otras características observadas en las especies de este grupo, que no fueron evaluadas en esta investigación dado que no cumplían los criterios de priorización (rasgos presentes en musgos y hepáticas), pero que juegan un papel importante en la regulación hídrica son: el enrollamiento de las hojas que presenta H. involuta y C. palisotii como estrategia para evitar la pérdida de agua, las células hialinas en la base del filidio de C. palisotii y O. albidum que actúan como reservorios de agua, y las células especializadas (hialocistos) de las hojas de O. albidum, que participan en el almacenamiento y conducción del agua a través de los poros ubicados en sus paredes internas (Frahm et al, 2003).
Los dos últimos grupos están conformados por especies del género Fissidens y se diferencian por el tamaño de sus filidios, en el GF5 son más largos (1,13 cm) y anchos (0,27 cm), mientras que en el GF6 son más cortos (0.94 cm) y estrechos (0,25), lo que le confiere menos área para interceptar y almacenar agua. En general, el mayor aporte de estas especies a la regulación hídrica radica en sus láminas vaginantes, las cuales se doblan sobre sí mismas abrazando el tallo y formando bolsas que retienen la humedad (Aguirre, 2008).
El GF6 cuenta con la riqueza específica más alta dentro de los grupos funcionales resultantes, por tanto, es el que presenta mayor redundancia funcional, es decir, que el número de especies que lo conforman contribuyen de manera similar a una función del ecosistema (Laliberté et al, 2010; Ricota et al, 2016), en este caso, la regulación hídrica. Esto mejora la resiliencia funcional de la comunidad, debido a la diversidad de respuesta que pueden tener las especies funcionalmente similares ante las perturbaciones (Díaz et al, 2005; Laliberté et al, 2010; Pillar et al, 2013) y favorece la estabilidad del ecosistema, a esta conclusión llegaron Bigg et al. (2020) al evaluar a través de un meta análisis la evidencia empírica para respaldar el planteado vínculo entre la redundancia funcional y la estabilidad ecológica, sin embargo, mencionan la necesidad de aumentar las investigaciones que analicen el efecto, aspecto no considerado para este trabajo.
Otro aspecto a considerar en cuanto a la distribución de los grupos funcionales, es la heterogeneidad del hábitat, que junto con un mayor grado de humedad y sombra pueden influenciar la frecuencia con la que las especies que los conforman se desarrollan en los diferentes hábitats (García y Mercado, 2017); lo anterior se ve reflejado en una mayor frecuencia de los GFs en las coberturas boscosas BG y VSA.
El GF1 presenta la menor frecuencia en las tres coberturas, mientras que el GF3 fue ausente en BG, lo cual podría indicar, una mayor sensibilidad de estas especies ante fenómenos de alteración provocados por tala selectiva y ganadería. El GF6 presenta mayor frecuencia en SSP, lo que podría obedecer a una mayor capacidad de adaptación a condiciones que exigen alta eficiencia hídrica expresada en rasgos que contribuyan a tolerar o evadir la época seca (Fig. 9).
En conclusión, la riqueza y composición de briófitos no mostró diferencias significativas en las coberturas evaluadas, posiblemente por la homogenización de las condiciones ambientales, producto del historial de disturbio al que han sido sometidas, sin embargo, es importante evaluar otros parámetros (cobertura) y comparar con coberturas vegetales en mejor estado de conservación a fin de poder entender cómo influyen esos impactos sobre las especies y cuáles parámetros pueden incidir en la estructura de las comunidades de briofitos en el bosque seco. Los resultados obtenidos contrastan con la predicción planteada, respecto a que en las coberturas con alta luminosidad y baja humedad (SSP), la diversidad de briófitos sería menor, dado la poca disponibilidad de sustratos. Los grupos funcionales están determinados principalmente por los rasgos del tamaño de la hoja, lo que representa una mayor o menor superficie foliar para la intercepción y absorción del agua, además muestran mayor frecuencia en las coberturas boscosas (BG y VSA) y se encuentran distribuidos de una manera más uniforme, posiblemente por contar con condiciones de mayor humedad y sombra.
Contribución de los Autores
LPP, MYCF y JEGN: formularon los objetivos de la investigación, diseñaron el muestreo, redactaron, revisaron y editaron el manuscrito. LPP Y JEGN: determinaron el material colectado. LPP: colecto el material de campo y analizó los datos del estudio.
Agradecimientos
A la Universidad de Córdoba (Colombia) por haber financiado esta investigación, en el marco del proyecto "Diversidad funcional en fragmentos de bosque seco tropical del departamento de Córdoba: Bases para la conservación y manejo de un ecosistema amenazado" del Grupo de Investigación BIODIVERSIDAD UNICÓRDOBA. A la profesora Ángela Ortega, investigadora principal del proyecto marco por su gestión administrativa y los aportes en la formulación de la propuesta de investigación. Los profesores Juan Carlos Linares Arias y María Eugenia Morales Puentes, por los aportes realizados a la propuesta y evaluación del proyecto. A los Biólogos Angie Almanza, Luis Llanos y Duván Bassa por su participación en el trabajo de campo.
Bibliografía
AGUIRRE, J. & K. AVENDAÑO. 2008. Musgos de la región Caribe. En: RANGEL, O (ed.). Colombia diversidad biótica VI: riqueza y diversidad de los musgos y liqúenes en Colombia, pp. 55-59. Bogotá-Colombia: Instituto de Ciencias Naturales.
AGUIRRE, J. 2008. Diversidad y riqueza de musgos y líquenes en Colombia: generalidades y metodología. En: RANGEL, O (ed.), Colombia diversidad biótica VI: riqueza y diversidad de los musgos y liqúenes en Colombia, pp. 1-17. Bogotá-Colombia: Instituto de Ciencias Naturales.
ANTONELLI, A., ARIZA, M., ALABERT, J., ANDERMANN, T., AZEVEDO, J., BACON, C., ... y EDWARDS, S. V. 2018. Conceptual and empirical advances in Neotropical biodiversity research. PeerJ 6: e5644. https://doi.org/10.7717/ peerj.5644
BALLESTEROS, J. & J, PÉREZ. 2016. Diversidad funcional: un aspecto clave en la provisión de servicios ecosistémicos. Rev colombiana Cienc Anim. 8: 94-111. https://doi.org/10.24188/recia.v8.n1.2016.232
BENITEZ, A. 2016. Efectos de la alteración antrópica en bosques tropicales sobre la diversidad de organismos epífitos (líquenes y briófitos). Tesis doctoral. Universidad Rey Juan Carlos, Ecuador. BENÍTEZ, A., G. ARAGÓN & M. PRIETO. 2015. Large trees and dense canopies: Key factors for maintaining high epiphytic diversity on trunk bases (bryophytes and lichens) in tropical montane forests. Forestry 88: 521-527. https://doi.org/10.1093/forestry/cpv022
BIGGS, C. R., YEAGER, L. A., BOLSER, D. G., BONSELL, C., DICHIERA, A. M., HOU, Z., ... & ERISMA, B. E. 2020. Does functional redundancy affect ecological stability and resilience? A review and meta-analysis. Ecosphere 11: e03184. https://doi.org/10.1002/ecs2.3184
CASANOVES, F., PLA, L., & DI RIENZO, J. A. 2011. Valoración y análisis de la diversidad funcional y su relación con los servicios ecosistémicos. Serie Técnica. Informe Técnico (CATIE).
CHAO,A., & JOST, L.2012. Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology 93: 25332547. https://doi.org/10.1890/11-1952.!
CHAO, A., N. GOTELLI., T. HSIEH., E. SANDER., K. MA., R. COLWEL & A. ELLISON. 2014. Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs. 84: 45-67. https://doi.org/10.1890/13-0133.1
DAUPHIN, G. 1999. Bryophytes of Cocos Island, Costa Rica: diversity, biogeography and ecology. Rev Biol Trop. 47: 309-328.
DAUPHIN, L., G. GRAYUM & H. MICHAEL. 2005. Bryophytes of the Santa Elena Peninsula and Islas Murciélago, Guanacaste, Costa Rica, with special attention to neotropical dry forest hábitats. Lankesteriana 5: 53-61. https://doi.org/10.15517/lank.v5i1.21158
DAWSON, S. K., CARMONA, C. P, GONZÁLEZ-SUÁREZ, M., JONSSON, M., CHICHORRO, F., MALLEN-COOPER, M & DUTHIE, A. B. 2021. The traits of "trait ecologists": An analysis of the use of trait and functional trait terminology. Ecology and Evolution 11:16434-16445. https://doi.org/10.1002/ece3.8321
DI RIENZO, J., F. CASANOVE., M. BALZARINI., L. GONZALEZ., M. TABLADA & C. W. ROBLEDO. 2011. InfoStat versión 2011. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. http:// www.infostat.com.ar
DÍAZ, S. & M. CABIDO. 1997. Plant functional types and ecosystem function in relation to global change. J. Veg Sci. 8: 463-474. https://doi.org/10.1111/j.1654-1103.1997.tb00842.x
DÍAZ, S., D. TILMAN., J. FARGIONE., F. CHAPIN III., R. DIRZO., T. KITZBERGER., B. GEMMILL., et al. 2005. Biodiversity regulation of ecosystem services. En: HASSAN, R., SCHOLES, R. Y ASH, N (Eds.), Ecosystems and human well-being: Current state and trends. pp. 297-329. Island Press, Washington D.C.
DÍAZ, S., LAVOREL, S., DE BELLO, F., QUÉTIER, F., GRIGULIS, K., & ROBSON, T. M. 2007. Incorporating plant functional diversity effects in ecosystem service assessments. Proceedings of the National Academy of Sciences 104: 20684-20689. https://doi.org/10.1073/pnas.0704716104
FRAHM, J., T. PÓCS., B. O'SHEA., T. KOPONEN., S. PIIPO., J. ENROTH., ... & Y. FANG. 2003. Manual of briology tropical. Briology tropical.
GARCÍA, S. & J. MERCADO. 2017. Diversidad de briófitos en fragmentos de bosque seco tropical, Montes de María, Sucre, Colombia. Revista Mexicana de Biodiversidad 88: 824-831. https://doi.org/10.1016/j.rmb.2017.10.035.
GARCÍA, S., H. BASILIO., F. HERAZO., J. MERCADO & M. MORALES. 2016. Diversidad de briófitos en los Montes de María, Colosó (Sucre-Colombia). Colombia Forestal 19: 41-52. http://dx.doi. org/10.14483/udistrital.jour.colomb.for.2016.1.a03.
GIL-NOVOA, J.E., CUTA-ALARCÓN, L.E. & MORALES-PUENTES, M.E. 2017. Riqueza y distribución de musgos en un bosque subandino en Bolívar-Santander, Colombia. Revista Biología Tropical 65: 1397-1406. https://doi.org/10.15517/rbt.v65i4.25570 GLIME, J. 2017. Water Relations: Conducting Structures. In: GLIME, J (ed.). Bryophyte ecology, pp. 1134. Michigan Technological University and the International Association of Bryologists.
GOTELLI, N. J. & COLWELL, R. K. 2001. Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecology letters 4: 379-391. https://doi.org/10.1046/j.1461-0248.2001.00230.x GRADSTEIN, R., S. CHURCHILL & N. SALAZAR. 2001. Guide to the bryophytes of Tropical America. The New York Botanical Garden. New York GRADSTEIN, S. R. & CULMSEE, H. 2010. Bryophyte diversity on tree trunks in montane forests of Central Sulawesi, Indonesia. Tropical Bryology 31: 95-105. https://doi.org/10.11646/bde.31.1.16 GRADSTEIN, R & G. SPORN. 2010. Land-use change and epiphytic bryophyte diversity in the Tropics. NovaHedwigia, Beiheft. 138: 311-323.
GUERRA, G., ARROCHA, C., RODRÍGUEZ, G., DÉLEG, J. & BENÍTEZ, Á. (2020). Briófitos en los troncos de árboles como indicadores de la alteración en bosques montanos de Panamá. Revista de Biología Tropical 68: 492-502. http://dx.doi.org/10.15517/rbt.v68i2.38965 HOLZ, I & R. GRADSTEIN. 2005. Cryptogamic epiphytes in primary and recovering upper montane oak forests of Costa Rica - species richness, community composition and ecology. Plant Ecology 178: 89-109. https://doi.org/10.1007/s11258-004-2496-5 HSIEH, T., K. MA & A. CHAO. 2016. iNEXT: an R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution (MEE) 7: 1451-1456. https://doi.org/10.1111/2041-210X.12613 INSTITUTO DE HIDROLOGÍA, METEOROLOGÍA Y ESTUDIOS AMBIENTALES (IDEAM). 2010. Leyenda Nacional de Coberturas de la Tierra. Metodología CORINE Land Cover adaptada para Colombia Escala 1:100.000. IDEAM. Bogotá, Colombia.
JOHANSSON, D. 1974. Ecology of vascular epiphytes in West African rain forest. Tesis doctoral. Universidad de Uppsala, Suecia.
LALIBERTÉ, E., WELLS, J. A., DECLERCK, F., METCALFE, D. J., CATTERALL, C. P., QUEIROZ, C. & MAYFILD, M. M. 2010. Land-use intensification reduces functional redundancy and response diversity in plant communities. Ecology Letters 13: 76-86. https://onlinelibrary.wiley.com/ doi/abs/10.1111/j.1461-0248.2009.01403.x LAVOREL, S., STORKEY, J., BARDGETT, R. D., DE BELLO, F., BERG, M. P., LE ROUX, X., ... & HARRINGTON, R. (2013). A novel framework for linking functional diversity of plants with other trophic levels for the quantification of ecosystem services. Journal of Vegetation Science 24: 942-948. https://doi.org/10.1111/jvs.12083 MA, K. H & T. C. HSIEH T. C. 2016. INEXT (Interpolación y EXTrapolación) en línea. Programa y guía del usuario. Disponible en: http://chao.stat. nthu.edu.tw/wordpress/software_download/. MAGILL, R. E. 2010. Moss diversity: new look at old numbers. Phytotaxa 9: 167-174. https://doi.org/10.11646/phytotaxa.9.1.9 MASON, N. W. & DE BELLO, F. 2013. Functional diversity: a tool for answering challenging ecological questions. Journal of Vegetation Science 24: 777780. https://doi.org/10.1111/jvs.12097 MERCHÁN, J., J. HERRERA & M. DELGADO. 2011. Retención de agua en musgos de páramo de los municipios de Siachoque, Toca y Pesca (Boyacá). Revista Colombiana de Ciencias Hortícolas 5: 295302. http://dx.doi.org/10.17584/rcch.2011v5i2.1275. MONTENEGRO, L., M. CHAPARRO & A. BARÓN. 2005. Regulación hídrica en cinco musgos del páramo de Chingaza. Estrategias adaptativas de plantas de páramo y del bosque altoandino en la cordillera Oriental de Colombia. Bonilla MA, editor. Universidad Nacional de Colombia, 3-24. MORENO C. E., CALDERÓN-PATRÓN, J. M., MARTÍN-REGALADO, N., MARTÍNEZ-FALCÓN, A. P., ORTEGA-MARTÍNEZ, I. J., RÍOS-DÍAZ, C. L. & ROSAS, F. 2018. Measuring species diversity in the tropics: a review of methodological approaches and framework for future studies. Biotropica 50: 929-941. https://doi.org/10.1111/btp.12607 MORENO, C. E. 2019. La Biodiversidad en un mundo cambiante: Fundamentos teóricos y metodológicos para su estudio. Universidad Autónoma del Estado de Hidalgo México.
PAVOINE, S. & M. B. BONSALL. 2011. Measuring biodiversity to explain community assembly: a unified approach. Biological Reviews 86: 792812. https://doi.Org/10.llll/j.1469-185X.2010.00171.x
PENNINGTON, T., M. LAVIN & F. OLIVEIRA. 2009. Woody plant diversity, evolution, and ecology in the tropics: perspectives from seasonally dry tropical forest. Annu Rev Ecol Evol Syst. 40: 437-57. https://doi.org/10.1146/annurev.ecolsys.110308.120327 PILLAR, V. D., C. C. BLANCO, S. C. MÜLLER, E. E. SOSINSKI, F. JONER & DUARTE, L. D. 2013. Functional redundancy and stability in plant communities. Journal of Vegetation Science 24: 963-974. https://onlinelibrary.wiley.com/doi/abs/10.1111/jvs.12047
PIZANO, C & H. GARCÍA (eds.). 2014. El bosque seco tropical en Colombia, pp. 37-44. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, D.C; Colombia. PIZANO, C., GONZÁLEZ, R., HERNÁNDEZ-JARAMILLO, A., & GARCÍA, H. 2017. Agenda de investigación y monitoreo en bosques secos de Colombia (2013-2015): fortaleciendo redes de colaboración para su gestión integral en el territorio. Biodiversidad en la Práctica 2: 87-121. POCS, T. 2012. Tropical forest bryophytes. En SMITH, A (ed.). Bryophyte ecology, pp. 52-99. New York. Springer Science & Business Media.
PROCTOR, M. C. (2000). The bryophyte paradox: tolerance of desiccation, evasion of drought. Plant Ecology 151: 41-49.
RANGEL, O & H. ARELLANO. 2010. Clima del departamento de Córdoba. En: RANGEL, O (ed.). Colombia diversidad biótica IX: Ciénagas de Córdoba: Biodiversidad-Ecología y manejo ambiental, pp 1-13. Instituto de Ciencias Naturales. Bogotá.
RICOTTA, C., DE BELLO, F., MORETTI, M., CACCIANIGA, M., CERABOLINI, B. E., & Pavoine, S. 2016. Measuring the functional redundancy of biological communities: a quantitative guide. Methods in Ecology and Evolution 7: 13861395. https://doi.org/10.1111/2041-210X.12604
ROVERE, A & G. CALABRESE. 2011. Diversidad de musgos en ambientes degradados sujetos a restauración en el Parque Nacional Lago Puelo (Chubut, Argentina). Rev Chil. Hist. Nat. 84: 571-580. http://dx.doi.org/10.4067/S0716-078X2011000400009 SALAVARRÍA L. E. B. 2017. Diversidad de líquenes y briófitos epífitos en bosques Amazónicos de la provincia de Orellana, con diferentes tipos de manejo. Tesis de pregrado. Universidad Técnica Particular de Loja.
SANTOS, G & J. AGUIRRE. 2010. Los musgos de la región de las Quinchas (Magdalena medio, Colombia). Caldasia 32: 257-273.
SASTRE DE JESÚS, I. 2004. Ecología de briófitos en América Latina: De presuposiciones florísticas a la práctica ecológica. En: RANGEL, J. O., J. AGUIRRE., M. G. ANDRADE & D. GIRALDO-CAÑAS (eds.). Memorias del VIII Congreso Latinoamericano y II Colombiano de Botánica, pp: 125-133. Instituto de Ciencias Naturales, Universidad Nacional de Colombia. Bogotá, Colombia.
SCHNEIDER, C. A., W. S. RASBAND & K. W. ELICEIRI. 2012. NIH Image to ImageJ: 25 años de análisis de imágenes, Nature Methods 9: 671-675. https://doi. org/10.1038/nmeth.2089.
STEEGE, H & J. CORNELISSEN. 1989. Distribution and ecology of vascular epiphytes in lowland rain forest of Guyana. Biotropica 21: 331-339. https://doi.org/10.2307/2388283
SWENSON, N. G. 2011. The role of evolutionary processes in producing biodiversity patterns, and the interrelationships between taxonomic, functional and phylogenetic biodiversity. Am. J. Bot.98: 472-480. https://doi.org/10.3732/ajb.1000289
URIBE, J & R, GRADSTEIN. 1999. Estado del conocimiento de la flora de hepáticas en Colombia. Rev. Acad. Colomb. Cienc. 23: 315-318.
VIOLLE, C., NAVAS, M. L., VILE, D., KAZAKOY, E., FORTUNEL, C., HUMMEL, I., & GARNIER, E. 2007. Let the concept of trait be functional!. Oikos 116: 882-892. https://doi.org/10.1111/j.0030-1299.2007.15559.x
WERNER, F. A., HOMEIER, J., & GRADSTEIN, S. R. 2005. Diversity of vascular epiphytes on isolated remnant trees in the montane forest belt of southern Ecuador. Ecotropica 11: 21-40.
WERNER, F & R. GRADSTEIN. 2009. Diversity of dry forest epiphytes along a gradient of human disturbance in the tropical Andes. Journal of Vegetation 20: 59-68. https://doi.org/10.3170/2008-8-18466.
WOLF, J. 2003. Diversidad y ecología de comunidades epifiticas en la cordillera Central, Colombia. En: HAMMEN, T & A. SANTOS (eds.). Studies on Tropical Andean Ecosystems, pp. 455. IGAC, ICN, Universitei van Amsterdam. Bogota.














