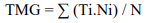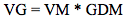1. INTRODUCCIÓN
La Selva Atlántica es una de las regiones del planeta con mayor biodiversidad y riesgo de desaparecer. Ésta es considerada el cuarto “punto caliente de biodiversidad” (hotspot) en cuanto a necesidades de conservación por la excepcional concentración de especies endémicas que presenta y la elevada tasa de desaparición de sus ambientes naturales. En ella existen alrededor de 20.000 especies de plantas vasculares de las cuales 8.000 son endémicas (Myers, 1988). Se estima que sólo queda entre el 7 y el 8 % de su superficie original (Galindo-Leal y Gusmao Câmara, 2003). La superficie de selva remanente en Argentina es de aproximadamente 11.300 km., constituyéndose en el fragmento continuo más grande de Selva Atlántica. Su estado de conservación es variable según los sitios (Holz y Placci, 2003).
Según Viana et al. (1992) los fragmentos forestales tienden a asumir una importancia creciente en la conservación de la diversidad biológica de los bosques. Debido a la acción antropogénica con el uso intensivo del suelo las áreas de conservación representan un papel fundamental en este sentido.
En el Bosque Atlántico podrían citarse como especies de gran importancia económica, y por lo tanto sometidas a una fuerte presión de corte a Myrocarpus frondosus Allemão y Cedrelafissilis Vellozo entre otras. Debido a sus características xilotecnológicas (color, veteado, densidad y facilidad para ser trabajada en aserraje y carpintería), han despertado el interés del sector maderero generando una intensa explotación (Del Castillo et al., 2003). Cedrelafissilis (cedro misionero) si bien es una especie autóctona característica de esta Selva, muy abundante en la provincia de Misiones; se encuentra incluida en el Libro Rojo de la Unión Internacional para la Conservación de la Naturaleza en la categoría de “especie en peligro” (Americas Regional Workshop, 1998), debido a la sobreexplotación de los ejemplares silvestres en su hábitat natural. Se conoce que esta especie posee semillas ortodoxas mientras que de M. frondosus (incienso), existen pocos antecedentes registrados en relación a los problemas de manejo y germinación de las semillas; su comportamiento ante distintas formas de almacenamiento no es bueno, ya que posee semillas recalcitrantes (Salazar et al., 2000) o de comportamiento intermedio, que pierden vigor y viabilidad con el correr del tiempo (Eibl et al., 2009).
La forma más segura de determinar la calidad de una muestra de semillas es a través de ensayos de germinación, los que requieren un ambiente con condiciones controladas, ajustadas para cada especie y un lapso tiempo para la observación de los resultados (Benito-Matías et al., 2004). A pesar de existir la estandarización de estas técnicas por la ISTA (International Seed Testing Association), muchas especies de árboles y arbustos nativos de nuestros bosques no se encuentran bien reflejadas en estas normas, o incluso ni aparecen (Moreno-Álvarez et al., 2001).
Se entiende por viabilidad de un lote de semillas, no durmientes, a su capacidad de germinar y de originar plántulas normales en condiciones ambientales favorables; el vigor de un lote de semillas por su parte, se define como el conjunto de propiedades que determinan el nivel de actividad y capacidad de las semillas durante la germinación y posterior emergencia de las plántulas (Pérez García, y Pita Villamil, 2001); mientras que la capacidad germinativa es el porcentaje de semillas germinadas de una muestra (ISTA, 2003). La evaluación de la viabilidad de semillas permite la sustitución de los ensayos de germinación (Benito-Matías et al., 2004). En este campo se desarrollan técnicas más o menos complejas, como la evaluación mediante el pH, las técnicas basadas en rayos X, que incluso se complementan con la evaluación mediante el test del tetrazolio, o técnicas basadas en la liberación de compuestos por parte de las semillas, como aminoácidos, proteínas, potasio (Custodio y Marcos-Filho, 1997), y otras técnicas que se englobarían bajo un grupo de metodologías que podemos definir como test de electroconductividad (Wang et al., 1994).
El objetivo del presente trabajo es adaptar las distintas metodologías para evaluar la calidad fisiológica de lotes semillas de M. frondosus y C. fissilis.
2. MATERIALES Y MÉTODOS
El área de estudio es la Reserva de Uso Múltiple Guaraní (G) que se localiza en el Depto. Guaraní, provincia de Misiones, Argentina (26º54’-59’S y 54º12’-18’ W). El predio forma parte de la Reserva de Biosfera Yabotí; pertenece a la provincia biogeográfica Paranaense y casi toda su superficie está ocupada por selva primaria con algunas pequeñas áreas de selva secundaria; perteneciente a la Universidad Nacional de Misiones (UNaM) y administrada por la Facultad de Ciencias Forestales (Tressens et al., 2008) es un lugar dedicado a la investigación y que está protegida y custodiada por guardaparques. Los frutos fueron colectados manualmente y conservados en bolsas plásticas y en heladera a 4 °C durante 3 meses aproximadamente; al momento de realizar los distintos ensayos han sido desaladas para favorecer el contacto con las soluciones. Las experiencias, fueron llevadas a cabo en la Cátedra de “Silvicultura” de la Facultad de Ciencias Agrarias-UNNE, Corrientes.
Las semillas de M. frondosus y C. fissilis se recolectaron durante el mes de junio y diciembre de 2012 respectivamente; las muestras analizadas provinieron de una mezcla de árboles seleccionados por su porte, sanidad, accesibilidad y producción de semillas.
2.1. Evaluación de la calidad fisiológica de las semillas de M. frondosus . C. fissilis
2.1.1. Pruebas de vigor
2.1.1 a. Prueba de la conductividad eléctrica individual
Para estimar el vigor, mediante la conductividad eléctrica de los exudados lixiviados por semillas individuales, se establecieron valores de tolerancia denominados valores de corte. Estos valores permiten diferenciar, según la conductividad eléctrica, a aquellas semillas que están en condiciones fisiológicas saludables de las que no lo están. El valor de corte para estimar el Potencial de Germinación fue 240 µS/cm, y para estimar el vigor se fijó un valor de corte de 180 µS/cm. Por encima de este valor, se encuentran representadas todas aquellas semillas que no son capaces de germinar y/o producir plántulas normales (Craviotto, 1998).
El acondicionamiento de las semillas consistió en pesarlas en balanza de precisión (0,0001 g) y posteriormente fueron colocadas para embeber en 30 mL de agua desionizada con una conductividad eléctrica menor a 5 µS/cm (valor de conductividad del agua deionizada recomendado en las Reglas ISTA-2003 para la Prueba de Conductividad Masal para la especie Pisumsativum) por 48 horas, a 25 ºC. Luego de este período de imbibición, se tomaron los valores de la conductividad eléctrica empleándose un conductivímetro. Se realizaron las lecturas de cada una de las semillas y ese valor fue dividido por el respectivo peso de la muestra y los resultados han sido expresados en µS cm -1.g-1de semilla (AOSA, 2014).
2.1.1. b. Prueba Colorimétrica del pH del exudado
Se emplearon 100 semillas para cada especie, distribuidas en gradillas con 100 tubos de ensayo conteniendo 30 mL de agua deionizada a fin de asegurar la correcta inmersión de cada una de las semillas. Luego de sumergir las semillas en los tubos, las gradillas se incubaron en cámara climatizada a 27 ±2 ºC durante 48 h. Finalizado el período de lixiviación de electrolitos desde las semillas hacia el medio de inmersión, se retiraron las gradillas de la cámara y se colocaron en cada tubo 2 gotas (0,03 mg/gota) de la solución indicadora de fenolftaleína al 0,5 % y solución de carbonato de sodio (Na. CO.) al 0,25 % en una relación 1:1 (Peretti, 1994). Inmediatamente después del contacto con las gotas de solución indicadora, se produjo el viraje de color en el agua de inmersión de las semillas en función de la calidad fisiológica de las mismas. Las coloraciones de la solución de inmersión de semillas luego del agregado de la solución indicadora fueron clasificadas como: a) Incolora (semilla no viable); b) rosa pálido (semilla no viable); c) rosa intenso (semilla viable). Posteriormente se cuantificó la cantidad de celdas con color rosa oscuro, expresando dicho resultado como Porcentaje de Exudado Rosa Intenso (Aguirre y Peske, 1988).
2.1.2. Pruebas de viabilidad
2.1.2. a. Prueba Topográfica por Tetrazolio
La evaluación de la viabilidad de las semillas a través de esta prueba se basa en un cambio de coloración de los tejidos vivos en presencia de una solución de la sal de cloruro de 2, 3,5-trifeniltetrazolio. Esta prueba también puede ser utilizada para evaluar el vigor sobre la base de la identificación, localización, y observación de los tejidos de la semilla (Hampton y Tekrony, 1995). Se trabajó con 4 repeticiones de 25 semillas que se acondicionaron realizando una imbibición durante 48 h. Para realizar la tinción, se utilizaron frascos de vidrio de 100 ml con tapa hermética, dónde se colocaron las semillas totalmente sumergidas en la solución de Tetrazolio. Estos frascos se incubaron en estufa a 28 °C y en oscuridad durante 24 h. Una vez concluida la tinción, las semillas se enjuagaron con abundante agua corriente y se realizaron las observaciones sobre cada semilla individualmente. Los resultados se expresaron en % de semillas viables (semillas mayormente teñidas) y semillas no viables (embrión sin tinción).
2.1.2. b. Prueba del índigo carmín
De forma contraria al test de tetrazolio, se produce una coloración de las partes no viables del grano. Se ha reportado como una técnica útil para especies de pináceas y no hay constancias de su utilización en otras especies (Benito-Matias et al., 2004). Se tomaron 4 repeticiones de 25 semillas, y el índigo carmín se preparó añadiendo 0,15 g de índigo carmín en 100 mL de agua. Se sumergieron las semillas 18 h en agua destilada para reblandecer el endospermo. Posteriormente se incubaron en la preparación durante 3 h a temperatura ambiente. Se lavaron y se clasificaron en viables (embriones blancos o con manchas azules nunca localizadas en la radícula), de vitalidad limitada (embriones con dudas), y no viables (embrión completamente teñido).
2.1.2. c. Prueba de Cloruro férrico
Se preparó una solución al 20 % de cloruro férrico (FeCl.), añadiendo cuatro partes de agua a una parte de cloruro férrico por peso; se tomaron 4 repeticiones de 25 semillas y se las colocaron en cajas de Petri, vertiendo suficiente solución para cubrir la totalidad de las semillas. Pasados 5 min se comenzaron a separar las semillas que se colorearon de negro, aunque la mancha sea muy pequeña y se continuó separando las semillas negras hasta pasados un máximo de 15 min de añadida la solución. Se contó el número de semillas que adquirieron coloración negra en cada repetición y se calculó el promedio para todas las repeticiones; ya que generalmente todas las semillas teñidas están muertas o se convierten en plántulas anormales cuando germinan (Aguirre y Peske, 1988).
2.1.3 Pruebas de germinación
2.1.3. a. Prueba de separación del embrión
El objetivo de esta prueba es acelerar la germinación de ciertas semillas que germinan lentamente o muestran latencia en una prueba de germinación. Para semillas con una latencia muy profunda impuesta por las envolturas del embrión, esta prueba ofrece un rápido estimado sobre su viabilidad. La prueba se realizó sobre 100 semillas de cada especie. Se embebieron las semillas para luego extraer fácilmente los embriones en condiciones asépticas. Los embriones se colocaron en cajas de Petri sobre papel de filtro humedecido con agua destilada y se incubaron a 27±2 °C hasta 14 días con al menos 8 h luz por día y se evaluó en forma regular. Los resultados se expresaron en % de embriones germinados (Poulsen, 2000).
2.1.3. b. Pruebas de germinación estándar
Se realizó de acuerdo a las normas ISTA (2003), sobre 4 réplicas de 25 semillas cada una, con arena esterilizada como sustrato, colocadas en cámaras de germinación, con alternancia de temperatura y luz (8 h a 30 °C con luz y 16 h a 20 °C en oscuridad). El conteo de semillas germinadas se realizó diariamente hasta que la germinación se detuvo. Las semillas se consideraron germinadas cuando la radícula alcanzó 2 mm de largo. Se registró:
Porcentaje de germinación (PG) se determinó según Ec.1 teniendo en cuenta las plántulas las plántulas normales, cada 7 días a partir de iniciada la prueba y hasta estabilizarse la germinación. Se calculó mediante la Ecuación 1.
Día de inicio de la germinación (IG) o Energía germinativa (EG), corresponde al tiempo transcurrido desde la siembra de las semillas hasta la germinación del 5 % de las semillas sembradas.
Tiempo medio de germinación máxima (TMG) según lo propuesto por Silva y Nakagawa (1995) según Ecuación 2:
Donde:
Ti es el número de días transcurridos desde el inicio del ensayo, Ni es el número de semillas germinadas en el día y N el número total de semillas germinadas.
Valor de germinación (VG), mediante el método de Czabator (1962) según la Ecuación 3.
Donde: VM corresponde al valor máximo o pico que se presenta entre los valores producto de la división del porcentaje acumulado de germinación y la cantidad de días que se tardó en obtenerse; y GDM es la germinación media diaria, calculada como la razón entre el porcentaje final de germinación (PG) y el número de días transcurridos hasta llegar a ese valor. Dicho índice se expresa sin unidades.
2.1.4. Análisis estadístico
Los datos obtenidos por tratarse de datos porcentuales, se les aplicó primeramente una transformación arcoseno 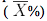 % (Zar, 1996). Posteriormente, en todos los casos se analizaron mediante el análisis de varianza (ANOVA) y una prueba de comparación de medias de Tukey para determinar diferencias entre tratamientos; empleándose el programa Infostat® (Di Rienzo et al., 2009).
% (Zar, 1996). Posteriormente, en todos los casos se analizaron mediante el análisis de varianza (ANOVA) y una prueba de comparación de medias de Tukey para determinar diferencias entre tratamientos; empleándose el programa Infostat® (Di Rienzo et al., 2009).
3. RESULTADOS Y DISCUSIÓN
Pruebas de vigor
Prueba de la conductividad eléctrica individual
El 75±7,91 % de semillas de C. fissilis se encontraron por debajo del valor de corte (Tabla 1) que es el equivalente a porcentaje de semillas viables; mientras que ninguno de los lotes de semillas de M. frondosus logró ubicarse por debajo del este valor; es decir que con este método no se registraron semillas viables.
Tabla 1 Viabilidad de semillas de Cedrela fissilis y Myrocarpus frondosus por diferentes métodos de determinación.Métodos: CE: Conductividad eléctrica; pH: pH del exudado; Tz: Tetrazolio; IC: índigo carmín; FeCl3: Cloruro férrico; embriones: separación de embriones; GE: germinación estandarizada.
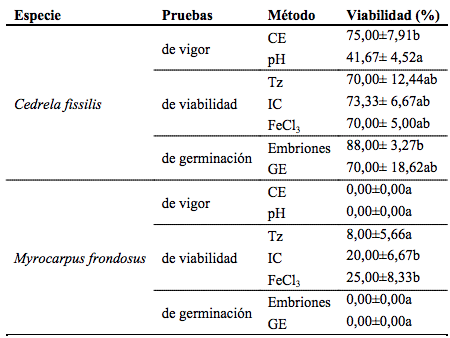
Los valores expresan el promedio de 4 réplicas de 25 semillas ± SD (n= 100). Valores seguidos por la misma letra no presentan diferencias estadísticas significativas entre sí (Tukey 5 %).
Esta prueba considera que semillas con bajo vigor presentan menor velocidad de restaurar la integridad de las membranas celulares y presenta como ventajas la rapidez, objetividad, bajo costo y posee una base teórica consistente, siendo capaz de identificar el deterioro de las semillas en su estado inicial (AOSA, 2014; Hampton y Tekrony, 1995).
Los resultados obtenidos sugieren que la electroconductividad no sería la técnica apropiada para las semillas de M. frondosus, ya que indican una gran pérdida de vigor a menos de un año de almacenamiento, en condiciones óptimas. Bonner (1998) indicó que esta técnica es muy sensible a la variación que existe entre lotes que provienen de diferentes poblaciones y no la recomienda para el análisis de semillas recalcitrantes como las de M. frondosus. Si bien son escasos los antecedentes del uso de esta prueba para otras muchas forestales, Soto Gonzales y Valiengo Valeri (2011) utilizaron esta técnica en semillas de Zeyheriatuberculosa y Marrero et al. (2007) en Rubia fruticosa; demostrando que es adecuada para la selección de lotes de simientes con diferente potencial fisiológico.
Prueba Colorimétrica del pH del exudado
En esta prueba se observó que en C. fissilis el 41,67±4,52 % de las soluciones presentaron una tonalidad rosa demostrando su viabilidad, en cuanto a M. frondosus ninguna de las soluciones presentó coloración (Tabla 1).
Una coloración rosa fuerte corresponderá a semillas con alta capacidad germinativa, que producirán probablemente plántulas normales; una coloración rosa tenue provendrá de semillas que originarán plántulas anormales y si existe ausencia de tinción, simplemente las semillas no tienen capacidad germinativa. Los resultados de esta prueba coinciden con los observados en la prueba de conductividad eléctrica individual aunque demuestra un porcentaje de semillas viables menor para el lote de semillas de C. fissilis.
Pruebas de viabilidad
Prueba Topográfica por Tetrazolio
Los resultados obtenidos arrojaron que en el 70,00±12,44 % de las semillas de C. fissilis (Figura 1.d) hubo tinción, lo que demuestra que se encuentran vivas; mientras que las de M. frondosus, (Figura 2.d) solo registró un 8,00±5,66 % de semillas viables (Tabla 1). Si bien la lectura de la viabilidad del embrión con tetrazolio es rápida, posiblemente la mayor dificultad es encontrar un protocolo adaptado, de forma que las tinciones sean lo suficientemente homogéneas para asegurar una buena interpretación de los resultados. Estos en ocasiones se ven afectados por la cantidad de lípidos, tiempo de tinción, condiciones de temperatura en las que se lleva a cabo la reacción, o incluso experiencia del analizador en dicha especie y en el método (Benito-Matías et al., 2004). Si bien esta prueba ha sido utilizada en numerosas especies forestales como ser Bombacopsisquinata y Tabebuiarosea (Cordero, 1994); Enterolobium cyclocarpum, Gliricidiasepium y Delonixregia (Pivaral Leiva, 1999), Pinuspinea (Benito-Matías, 2004); Schinopsisbalansae (Alzugaray et al., 2005); Acacia melanoxylon (Velásquez, 2006); Aspidosperma quebracho-blanco (Alzugaray et al., 2006); Rubia fruticosa (Marrero et al., 2007); Maytenus vitis-idaea (Bueno et al., 2009) entre otras; para las especies en estudio no existen reportes acerca de su uso. Los resultados obtenidos con esta técnica sobre la viabilidad de semillas, coinciden en líneas generales con las anteriores y representa un avance significativo hacia la elaboración de mapas de tetrazolio para especies de leñosas nativas de Argentina.

Figura 1 Pruebas de viabilidad en semillas de Cedrela fissilis: a) Cloruro férrico, b) separación del embrión, c) del índigo carmín y d) Tetrazolio.
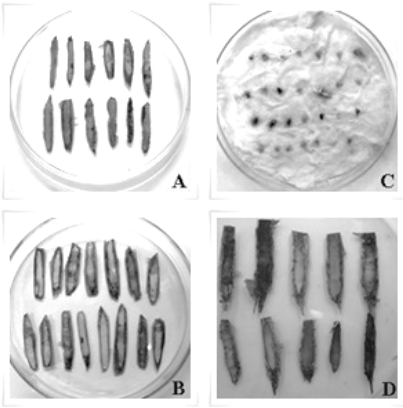
Figura 2 Pruebas de viabilidad en semillas de Myrocarpus frondosus: a) Cloruro férrico, b) separación del embrión, c) del índigo carmín y d) Tetrazolio.
Prueba del índigo carmín
En los ensayos realizados se observó que el 73,33±6,67 % de las semillas de C. fissilis (Figura 1-C) permanecían viables ya que no mostraron tinción; mientras que en M. frondosus (Figura 2-C) sólo el 20,00±6,67 % de las mismas estaban viables (Tabla 1). La tinción de las zonas muertas define claramente cómo se encuentra la semilla, y a pesar de que también pueden aparecer indefiniciones éstas ofrecen menos dudas en la interpretación (Moreno Álvarez et al., 2001).
Prueba de Cloruro férrico
En C. fissilis (Figura 1.a) el 70,00±5,00 % de las semillas no evidenciaron daño mientras que M. frondosus (Figura 2.a) que solo el 25,00±8,33 % de semillas no mostraron reacción al reactivo (Tabla 1). Esta prueba estima la integridad del lote de semillas, que puede estar vinculada a aspectos relacionados a la cosecha y pos cosecha. Se trata de un método práctico que permite hacer una estimación rápida del porcentaje de anormalidades que se puede esperar al cultivar posteriormente un determinado lote de semillas, se puede realizar en el sitio y permite ajustar la cosecha en beneficio de reducir el daño al resto del lote (Aguirre y Pesque, 1988). Los daños mecánicos también pueden ser evaluados y cuantificados mediante técnicas de laboratorio que utilizan principios activos específicos para revelar su presencia en el exterior e interior de la semilla (Craviotto et al., 2003).
Pruebas de germinación
Prueba de separación del embrión
El 88,00 ± 3,266 % de los embriones de C. fissilis (Figura 1.b) germinaron en esta prueba, mientras que en M. frondosus (Figura 2.b no germinó ningún embrión (0 %) (Tabla 1). Recordando que el objetivo de esta prueba es acelerar la germinación de ciertas semillas que germinan lentamente o muestran latencia en una prueba de germinación (CATIE, 2000); estos resultados sugieren ausencia de latencia en C. fissilisy dado los resultados de las otras técnicas probadas en M. frondosus, tampoco podría atribuirse a una latencia, en ésta última especie.
Los embriones no viables se tornan suaves, de color pardo y se pudren en un plazo de dos a diez días, como en el caso de M. frondosus. Los embriones viables permanecen macizos y muestran alguna indicación de viabilidad, dependiendo de la especie.
El ensayo de escisión del embrión se asemeja a los ensayos de germinación en que se basa en la germinación real de la semilla para medir su calidad. Para que el ensayo se realice satisfactoriamente es necesario que el operario posea un nivel considerable de aptitud y experiencia, y además, las Reglas de la ISTA lo limitan únicamente a unas cuantas especies (Willan, 1991).
Prueba de germinación estándar
Las semillas de C. fissilis demostraron un PG (Poder germinativo) del 70,00±18,62 %; si bien Salazar et al. (2000) informan acerca de 86-97 % de PG para semillas frescas, el porcentaje obtenido en el ensayo es aceptable teniendo en cuenta que lleva aproximadamente un año almacenado. El TMG (Tiempo medio de germinación máxima) de 11,31±1,55 días se encuentra dentro del rango descripto para la especie por Salazar et al. (2000). En este ensayo transcurrieron 6,75 ± 0,5 días para IG (Día de inicio de la germinación), y presentaron un valor pico de germinación VG (Czabator, 1962) de 1,71 ± 0,33 como una variable que refleja la velocidad de germinación y (Tabla 2).
Tabla 2. Plántulas normales (PG %), Tiempo medio de Germinación (TMG), Valor de Germinación (VG) y Día de Inicio de la Germinación (IG) de semillas de Cedrela fissilis.
Tabla 2 Plántulas normales (PG %), Tiempo medio de Germinación (TMG), Valor de Germinación (VG) y Día de Inicio de la Germinación (IG) de semillas de Cedrela fissilis.

Los valores expresan el promedio de 4 réplicas de 25 semillas ± SD (n= 100)
El valor pico de germinación VG (Czabator, 1962) es la variable de laboratorio más cercana a lo que realmente ocurrirá en la siembra, por lo cual se lo considera como un indicador de las semillas que darán origen a nuevas plantas (Buamscha et al., 2012).
Para M. frondosus donde no se logró registrar ningún dato de germinación; en congruencia con los resultados obtenidos en las pruebas de vigor y viabilidad. Existen datos de que sus semillas son recalcitrantes a intermedias (Salazar et al., 2000; Eibl et al., 2009) y que germinan entre los 7 a 10 días de la siembra demostrando un 74 % de PG y que pierden su viabilidad antes de los 60 días si son almacenadas en condiciones subóptimas (Eibl et al., 2009). Las semillas de esta especie ensayadas en el presente trabajo fueron almacenadas en condiciones óptimas, y los resultados reafirman la pérdida de viabilidad comunicada por Eibl et al. (2009).
Los resultados de las pruebas de vigor, viabilidad y germinación realizadas en este trabajo han sido útiles para relacionar el PG con la viabilidad de las semillas determinadas con la aplicación de las pruebas rápidas de tinción. El manejo de la relación viabilidad, germinación y vigor, es determinante para precisar si las semillas analizadas requieren o no de tratamientos previos a la siembra y de ser necesario, la intensidad con que se deben realizar (Buamscha et al., 2012).
4. CONCLUSIONES
En este trabajo se demostraron la utilidad de técnicas rápidas, objetivas, sencillas, económicas, reproducibles e interpretativas. Son necesarios precisar detalles en los protocolos de ejecución, para especies en particular. Se determinó que las pruebas de conductividad eléctrica individual y separación de los embriones resultaron ser las mejores para evaluar a C. fissilis, especie de comportamiento ortodoxo debido a que tolera la desecación para su almacenamiento sin mostrar pérdida de viabilidad, mientras que Índigo Carmín y Cloruro férrico lo fueron para M. frondosus, especie de comportamiento intermedio. Se corroboró la pérdida de viabilidad de ésta última especie, dentro del año desde la cosecha, aún en condiciones óptimas de almacenamiento.
AGRADECIMIENTOS
La ejecución de este trabajo fue posible gracias al apoyo de los siguientes proyectos PICTO-2011-0213 (ANPCyT-UNNE), PI A005/12 (SGCyT-UNNE) y PI A001/14 (SGCyT-UNNE).