INTRODUCCIÓN
La enfermedad tiroidea autoinmune (ETA) es un trastorno autoinmune complejo y poligénico, órgano- específico que lleva a la sobreproducción de hormonas tiroideas (hipertiroidismo) o bien causa destrucción glandular y disminución de la producción hormonal1-4(hipotiroidismo). Es el trastorno tiroideo más frecuente en áreas geográficas no deficientes en yodo y la más común de las enfermedades autoinmunes5,6. Comprende a un grupo de entidades clínicas bien definidas o síndromes, como la tiroiditis de Hashimoto (TH) y la enfermedad de Graves-Basedow (EGB) y otras variaciones de estos síndromes como el hipotiroidismo autoinmune atrófico, tiroiditis silente y la tiroiditis posparto5,7-11, todos ellas unidas entre sí por mecanismos inmunológicos estrechamente relacionados y transición de un cuadro clínico al otro dentro del mismo individuo a lo largo del tiempo; los fenotipos probablemente difieren debido al tipo específico de respuesta inmunológica que se produce7-11.Una de las características invariables de la ETA es la producción de anticuerpos hacia los principales autoantígenos de la tiroides, específicamente, los anticuerpos anti-peroxidasa tiroidea (TPOAb);anticuerpos anti-tiroglobulina (TgAb) y los antireceptor de tirotrofina (TRAb)9.
La enfermedad celíaca (EC) es una enfermedad crónica, inmunomediada, sistémica, provocada por la exposición a las proteínas del gluten del trigo, centeno, cebada y avena de los alimentos, que afectan la mucosa del intestino delgado en individuos genéticamente predispuestos. Se caracteriza por una combinación variable de síntomas y signos, la presencia de anticuerpos específicos, un HLA tipo DQ2/DQ8 específico y enteropatía12-17.
El diagnóstico de EC se realiza mediante la combinación de los hallazgos clínicos, serológicos e histopatológicos12. Los marcadores séricos son de gran utilidad como indicadores de EC, si bien la biopsia intestinal sigue siendo el patrón oro para establecer el diagnóstico12,13,15,18. Los anticuerpos anti-transglutaminasa tisular humana de tipo IgA (atTG-IgA) se han mostrado como los marcadores más útiles y hoy en día existe acuerdo generalizado en utilizarlos para el cribado de Ec12,13,16.ei tratamiento más efectivo es una dieta libre de gluten estricta de por vida1.
La prevalencia de EC realizada por cribado serológico en población general es del orden del 1% entre las naciones occidentales y aquellas orientales que incorporan alimentos a base de trigo en sus dietas;mientras que suele ser menor en regiones orientales con bajo consumo de gluten y es más alta en los niños Saharawi en el Sahara Occidental alNorte de África, donde se encontró una incidencia de EC de 5,6%4,12,13,19,20.
La EC puede afectar a cualquier grupo etario13 y determinar diversas formas clínicas de presentación ya sea clasica, no clásicao asintomática, estos últimos casos suelen descubrirse por hallazgos endoscópicos o por rastreo en la población general y en grupos de riesgo donde se encuentran los familiares de primer grado de pacientes celíacos y los sujetos con enfermedades autoinmunes asociadas como ETA, diabetes mellitus tipo I, hepatitis autoinmune, síndrome de Sjogren, nefropatía por depósitos IgA, miocardiopatías y enfermedades genéticas como síndrome de Down o de Turner.
Según el modelo propuesto por Richard Logan en 199113la epidemiología de la EC tiene las características de un iceberg donde los casos diagnosticados se encuentran por encima de la línea del agua y los casos no diagnosticados en la porción sumergida. La estrategia más aceptada para investigar los casos no diagnosticados de EC es el cribado en grupos de riesgo reconocidos, mediante un proceso de búsqueda sistemática de la enfermedad12. Es por ello que el objetivo de este trabajo fue determinar la frecuencia de enfermedad celíaca y describir su relación con las formas clínicas de enfermedad tiroidea autoinmune en individuos mayores de quince años que consultaron en un hospital público de referencia provincial durante los años 2015-2017.
MATERIAL Y MÉTODOS
Se realizó un estudio descriptivo de corte transversal. La muestra se conformó por292 individuos mayores de quince años con diagnóstico de ETA previamente confirmado, que consultaron de modo consecutivo al Laboratorio de Alta Complejidad Misiones (LACMI) del Parque de la Salud Misiones Dr. Ramón Madariaga de la ciudad de Posadas, Misiones y firmaron el consentimiento informado aprobado por el comité de ética del Parque de la Salud Misiones en el periodo comprendido entre junio de 2015 y noviembre de 2017.
Para conocer el estado de la función tiroidea de los individuos con ETA, a cada consultante se le determinó en muestra de suero con ayuno de 8 horas,tirotrofina u hormona estimulante de tiroides (TSH), triyodotironina total (T3), tiroxina total (T4), tiroxina libre (T4l) y anticuerpos tiroideos (TPOAb y TgAb) por método Quimioluminiscencia en equipo Inmulite 2000-Siemens. La misma muestra se utilizó para la búsqueda de anticuerpos específicos de EC mediante el dosaje de anticuerpos atTG-IgA por método de enzimoinmunoensayo (ELISA, kit-ORGENTEC) que se cuantificó con lector de placas Stat Fax 303 (Awareness) más dosaje de IgA total por método Inmunoturbidimétrico en equipo DimensionRxL-Siemens.
Aquellos individuos que presentaron valores de atTG-IgA mayor al valor de corte de 10 U/ml(serología positiva)e IgA dentro de los límites de referencia fueron invitados a realizar biopsia endoscópica de intestino delgado, que se efectuaron por un médico gastroenterólogo con gastroscopio Olympus 180 y bajo anestesia general. Las muestras de biopsias se analizaron por un médico anatomopatólogo y los hallazgos histológicos se clasificaron según los criterios de Marsh modificados por Oberhuber21-23 (Marsh 0, 1, 2, 3a, 3b y 3c). La EC se diagnosticó en aquellos que presentaron serología positiva y biopsia con hallazgos histológicos tipo Marsh 2 y 312-14.
Se excluyeron todos aquellos pacientes que se negaron a realizar la biopsia endoscópica de intestino delgado, los que presentaron algunas de las contraindicaciones de este procedimiento y los que no consumían gluten al momento de la biopsia.
El diagnóstico de ETA de los participantes del estudio fue realizado por la presencia de TPOAb positivo (> 10 UI/ml) y/o TgAb positivo (> 15 UI/ml) y características clínicas evaluadas por médico endocrinólogo.Las formas clínicas de ETA se clasificaron como TH y EGB. TH se definió por la presencia de anticuerpos tiroideos (TgAb y/o TPOAb), estado eutiroideo, hipotiroidismo manifiesto o subclínico y clínica compatible24(bocio difuso y firme).EGB se definió por clínica compatible25,26(bocio, exoftalmos y mixedema pretibial) y la presencia de hipertiroidismo bioquímico y/o anticuerpos tiroideos (TgAb y TPOAb). El dosaje de TRAb no se determinó por dificultades metodológicas.
El estado de la función tiroidea se clasificó como eutiroideos: pacientes con TSH y hormonas periféricas dentro de valores de referenciadescriptos por fabricante (TSH: 0,35-4,94 uUI/ml;T3: 70-170 ng/dl; T4:4,5-12,5 ug/dl; T4l: 0,8-1,9 ng/dl); hipotiroidismo subclínico: pacientes con TSH entre 4,94 y 10,00uUI/ml asociada a hormonas periféricasdentro de los valores de referencia27; hipotiroidismo clínico o manifiesto: pacientes con TSH 4,94 uUI/ml asociada a T3, T4 y/o T4l bajas27(menores al límite inferior de referencia); hipertiroidismo subclínico: pacientes con TSH < 0,01 uUI/ml asociada a hormonas periféricas dentro de los valores de referencia28; hipertiroidismo clínico o manifiesto: pacientes con TSH 0,01 uUI/ml y T3, T4 y/o T4l elevadas28 (mayores al límite inferior de referencia).
El análisis estadístico se llevó a cabo mediante el uso de un programa estadístico de libre acceso. Los datos continuos con distribución normal se presentaroncomo media ± desvío estándar, los no paramétricos como mediana y percentiles (p25 y p75), los datos categóricos con frecuencia y porcentaje. La comparación entre grupos se realizó para los datos continuosmediante eltest de t de Student o Wilcoxon a dos colas, según corresponday para los datos categóricos tabulaciones cruzadas mediante prueba de chi-cuadrado (2), cuando los valores esperados fueran menores a cinco se utilizó la prueba exacta de Fisher.Se consideró un p-valor menor a 0,05 como estadísticamente significativo.
RESULTADOS
La edad promedio de los 292 individuos con ETA estudiados fue 45 ± 13 años, la mayoría fueron mujeres (89%). Se encontraron 241 (82%) sujetos con diagnóstico de TH y 51 (18%) con EGB.Las tablas I y II muestran los valores medios de hormonas y anticuerpos tiroideos en los individuos con TH y EGB respectivamente, según el estado de la función tiroidea.Entre las TH, 135 (56%) sujetos se encontraban eutiroideos al momento del estudio, 51 (21%) hipotiroideos subclínicos y 55 (23%) hipotiroideos manifiestos. Entre las EGB, 11 (22%) se hallaban eutiroideos, 39 (76%) hipertiroideos manifiestos y 1 (2%) hipotiroideo; no se encontró ningún paciente con hipertiroidismo subclínico.
Los TPOAb presentaron positividad en el 91% (n: 265) de los ETA, 90% (n: 217) de las TH y 94% (n: 48) de las EGB con mediana de 399,0 UI/ml (133,0-1000,0 UI/ml); los TgAb fueron positivos en 52% (n: 151) de los ETA, 52% (n: 125) de los TH y 43% (n:22) de los EGB y su mediana fue 253,0 UI/ml (81,3-754,0 UI/ml). Ambos anticuerpos fueron positivos en el 42% (n: 100) de las TH y en el 43%(n: 22) de las EGB.
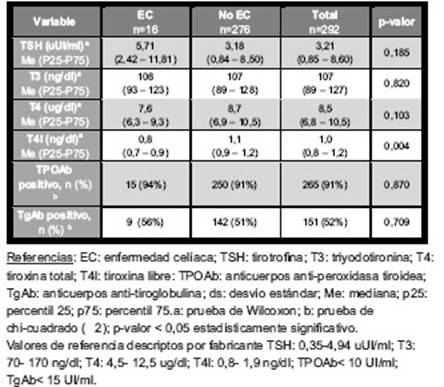
Se hallaron 18 pacientes con serología positiva para EC, encontrándose histopatología compatible con EC en 16 de ellos. Ninguno de ellos presentó déficit selectivo de IgA total. La frecuencia de EC hallada en la población con ETA fue 5,47% (IC 95%: 3,16- 8,74%).
Todos los individuos diagnosticados con EC fueron de sexo femenino, con edades medias de 42 ± 10 años, 15 (94%) eran TH, de los cuales 7 (47%) tenían función tiroidea normal, 5 (33%) con hipotiroidismo subclínico y 3 (20%) hipotiroidismo manifiesto. Se encontró un solo individuo con EGB y EC (6%), el mismo se encontraba hipertiroideo manifiesto. Se hallaron 13 (81%) celíacos con valores de atTG-IgA > 100 U/ml y lesiones de la mucosa digestiva del tipo Marsh 3. Además, 9 (56%) de ellos tenían atrofias vellositarias totales correspondiente a la clasificación Marsh 3c.
Se realizó una comparación de valores de hormonas tiroideas y anticuerpos tiroideos positivos entre los ETA con diagnóstico de EC y no celíacos; los resultados se muestran en la tabla III. Se encontró que los valores de T4l son significativamente menores entre los ETA celíacos comparados con los no celíacos (p=0,004).
Con el objetivo de analizar si existe relación entre las formas clínicas de presentación de ETA y EC, se comparó la proporción de celíacos que se presentaron en los individuos con TH y EGB, no existiendo relación entre ellas (p= 0,224).
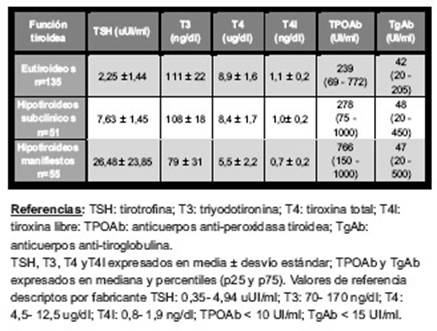
Tabla I Valores medios de hormonas y anticuerpos tiroideos en los individuos con tiroiditis de Hashimoto clasificados según el estado de la función tiroidea(n=241).
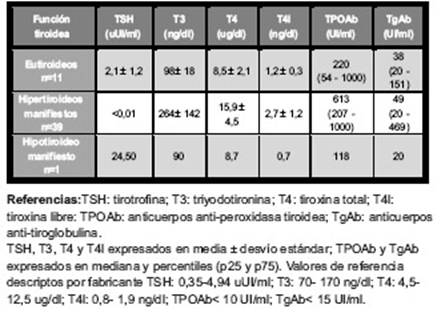
Tabla II Valores medios de hormonas y anticuerpos tiroideos en los individuos con enfermedad de Graves-Basedowclasificados según el estado de la función tiroidea (n=51).
DISCUSIÓN
La ETA y EC son enfermedades autoinmunes que ocurren en individuos genéticamente predispuestos12-17, la primera es órgano específica y la segunda sistémica con un disparador externo conocido, el gluten de la dieta. Ambas expresaron predominio del sexo femenino(89% en ETA y 100% en EC), estos hallazgos son habituales en la literatura que abarca patologías de naturaleza autoinmune .
La ETA incluye varias formas clínicas de presentación o síndromes5,7-10, donde laTH y la EGB son las más comunes. En los individuos estudiados, la mayoría fueron TH (82%) y solo el 18% fueron EGB. Esta relación entre formas clínicas también fue descrito por Cuoco y col.34, quien estudió a 92 pacientes con ETA, hallando que el 75% de ellos eran TH y el 25% EGB.
En una revisión sobre tiroiditis crónica autoinmune hecha por Collin y col.35, refieren que entre 50- 75% de los sujetos con anticuerpos tiroideos positivos son eutiroideos, 25- 50% tienen hipotiroidismo subclínico y 5- 10% tienen hipotiroidismo manifiesto. Yanes Quesada y col.36encuentra en población cubana con TH, 58% de eutiroideos, 24% hipotiroidismo subclínico y 17% de hipotiroidismo clínico. Nuestros resultados coinciden con dichos autores en el porcentaje hallado de función tiroidea normal, pero la cantidad de sujetos con hipotiroidismo clínico es mayor que aquellos con estado subclínico. Teniendo en cuenta que los ETA incluidos tenían diagnóstico previo del mismo, estas discrepancias halladas en nuestro estudio, podrían representar una evolución de la enfermedad hacia estados más avanzados de disfunción tiroidea.
En los individuos con EGB, la gran mayoría se encontraban hipertiroideos (76%); esto coincide con lo aportado por la bibliografía26,37, indicando que esta patología se expresa mayoritariamente como hiperfunción y puede evolucionar a hipotiroidismo.
Los TPOAb fueron positivos en aproximadamente el 90% de los ETA, sean TH o EGB; los TgAb presentaron positividad en la mitad de los ETA, tanto TH como EGB y solo el 42% de las TH y el 43% de las EGB tuvieron ambos anticuerpos positivos. La bibliografía nos indica que los TPOAb resultan positivos en 85 a 100% de los casos de ETA, mientras que los TgAb se evidencian en el 56 a 100% y aunque los anticuerpos tiroideos están siempre presentes en la ETA10, no siempre ambos anticuerpos son positivos. El porcentaje disímil tiene que ver con la patogenia de la enfermedad autoinmune; diferencias en el microambiente local concluyen en una respuesta inapropiada a autoantígenos tiroideos y una expresión fenotípica distinta8.
En el presente estudio, se buscó EC en un grupo de riesgo como la ETA.La frecuencia encontrada (5,48%) confirma, al igual que lo demostrado por numerosos autores en todo el mundo3,9,29,3843, que la EC se presenta en este grupo con mayor prevalencia que en la población general (1%)4,12,13,18,4449. En una revisión hecha por Kumar en 200140 en población estadounidense, la prevalencia global de EC se estima en 2-4,8% en ETA. Cifras similares se han publicado en Italia en 2001, donde Volta y col.29 informan que la prevalencia de EC es del 3,2% en 220 pacientes con ETA en comparación con 0,4% en los controles. En un metanálisis de varios autores hecha por Chng y col. en 200738 se informa una prevalencia de EC del orden de 2- 5% en los trastornos autoinmunes de la tiroides. Mainardi y col. en 20 0241 encontraron una frecuencia menor (2%), al igual que Ventura y col.30en Brasil, quienes hallaron una prevalencia de 1,8%. Sharma y col.48 en 220 individuos de la India encontraron una frecuencia mayor de 8,6% en 2016. Collin y col.49 en 1994 estudiaron a 83 pacientes con ETA, encontrando presencia de anticuerpos antigliadina y antiendomisio positivos en cinco pacientes, con una prevalencia de 4,8% en comparación con 0,4% en el grupo control. El mismo autor en 20024 hace una revisión de asociaciones entre ETA y EC, encontrando en varios estudios de tamizaje serológico una prevalencia de EC de 2-4% y recomiendan que los endocrinólogos deben considerar la EC en diferentes condiciones autoinmunes donde la prevalencia de la enfermedad es claramente más alta que en la población general.
Respecto al estado de la función tiroidea de los celíacos
prevaleció el eutiroidismo, seguido del hipotiroidismo subclínico y menor número de individuos con hipotirodismo clínico. Marsiglia10 manifiesta que en la historia natural de la ETA se presentan varios estadios clínicos, caracterizados siempre por positividad de anticuerpos tiroideos, presencia o no de bocio y distintos estados de función tiroidea, siendo frecuente de encontrar eutiroidismo.
Los valores de T4l fueron menores entre los ETA celíacos de reciente diagnóstico comparados con los no celíacos, los cuales recibían reemplazo hormonal de la función tiroidea. Uno de los fundamentos que se propone para este hallazgo es que en aquellos pacientes hipotiroideos tratados con levotiroxina la absorción puede verse afectada por la presencia de EC31,48, afectando los niveles séricos de tiroxina o su fracción libre, T4l. Aunque este hecho no ha sido evaluado en este estudio; el daño de la mucosa, la presencia de alimentos no digeridos y el aumento de agua neto en el lumen intestinal en los enfermos celíacos predisponen a esta situación. La recuperación parcial de la estructura de la mucosa después de una dieta libre de gluten puede ser suficiente para mejorar la absorción de T4, reducir las dosis terapéuticas y mejorar el hipotiroidismo31,48,50,51. La frecuencia de EC en pacientes con TH es mayor que en los EGB (3,4% - 6,4% frente al 0%- 3,8%) en la bibliografía revisada49,52, lo que coincide con lo hallado en nuestro estudio (6,22% frente a 1,96%). La mayoría de los celíacos tenían TH (94%) y no se encontró relación entre las formas clínicas de ETA y EC. Mehrdad y col.33 en pacientes iraníes reportaron que todos los pacientes celíacos detectados padecían TH, sin relación estadística significativa entre las enfermedades. Texeira y col.31 en pacientes del sur de Brasil, no encontraron diferencia entre grupos cuando comparo los celíacos con EGB y TH. Sin embargo, en el estudio hecho por Hadithi y col.53 en holandeses, se encontró relación entre TH y EC.
Los pacientes con dos o más enfermedades autoinmunes, como EC y ETA, suelen presentar síntomas inespecíficos e incluso ser totalmente asintomáticos, lo que amplía el espectro de diagnósticos diferenciales33,52.En el presente estudio se observó que la EC puede estar presente con títulos altos de anticuerpos (75% con atTG-IgA >100 U/ml) y hallazgos histológicos con alto compromiso de la mucosa (81% con Marsh 3) revelando que esta enfermedad sigue siendo una afección esquiva en su diagnóstico y presentación clínica53.
Los afectados por enfermedades autoinmunes pasan años con un diagnóstico incorrecto; Bai y col.13refieren que cuando un paciente presenta alguna otra enfermedad autoinmune además de EC, esta última entidad es frecuentemente silente y lo habitual es que la otra enfermedad autoinmune sea diagnosticada primero. En los adultos, la EC es diagnosticada en promedio más de 10 años después de que el paciente presenta sus primeros síntomas13,44.El diagnóstico tardío, o la ausencia del mismo, se encuentran relacionados con la continuidad de la enfermedad y sus complicaciones a largo plazo12,31,47.
En la EC, existe un tratamiento dietético efectivo que puede proporcionar beneficios en la salud general19,33,38,48,52,53 y además, ser beneficiosa en el tratamiento de la enfermedad endocrinológica subyacente4,54.Debido a que el pronóstico de la enfermedad correctamente diagnosticada y tratada es excelente, un retraso en el diagnóstico genera una alta repercusión individual y social, creando además un alto costo sanitario25. Este estudio mostró mayor frecuencia de EC en la ETA que en la población general y permitió la detección de enfermos celíacos en grupos de alto riesgo quienes no habían sido pesquisados con anterioridad.
Declaración de conflicto de intereses
Los autores del artículo declaran no poseer conflicto de intereses, no existen conflictos financieros o personales que hayan influenciado inapropiadamente la investigación.
Agradecimientos:
El presente trabajo de investigación fue realizado con el apoyo del programa de becas “Ramón Carrillo-Arturo Oñativia”, categoría individual, otorgada por el Ministerio de Salud de la Nación, a través de la Comisión Nacional Salud Investiga.
Los autores de la investigación agradecen a los colaboradores de esta investigación: los servicios de endocrinología, gastroenterología y anatomía patológica del Hospital Escuela de Agudos Dr. Ramón Madariaga, el sector de endocrinología del LACMI, los técnicos del laboratorio de referencia provincial de enfermedad celíaca en Laboratorio del Hospital Provincial de Pediatría, Dr. Fernando Barreyro y a los individuos participantes del estudio, quienes con su participación gratuita y voluntaria hicieron posible este estudio.