Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Ciencia y Tecnología
On-line version ISSN 1851-7587
Rev. cienc. tecnol. no.24 Posadas Dec. 2015
INGENIERÍA, TECNOLOGÍA E INFORMÁTICA
Producción de Hidrógeno por Reformado en Fase Gas de Glicerol: Desactivación - Regeneración de un Catalizador Níquel-Alúmina
Hydrogen Production by Glycerol Steam Reforming: Deactivation-Regeneration of a Nickel-Alumina Catalyst
Esteban A. Sanchez1,*, Raúl A. Comelli1
1 Instituto de Investigaciones en Catálisis y Petroquímica - INCAPE (FIQ-UNL, CONICET), Santiago del Estero 2654, S3000AOJ, Santa Fe, Argentina.
* E-mail: esanchez@fiq.unl.edu.ar
Resumen
La energía del hidrógeno atrae considerable atención por su eficiencia y beneficios ambientales. El glicerol, subproducto del biodiesel, adquirió interés debido a su mayor producción relacionada a la creciente demanda de biocombustibles y por provenir de materias primas renovables, pudiendo emplearse como sustrato bio-renovable para producir hidrógeno. Catalizadores de Ni resultaron activos y selectivos para producir hidrógeno, representando el depósito carbonoso formado un importante problema. La desactivación de un catalizador Ni/g-Al2O3 con 5,2% p/p de metal fue evaluada durante el reformado en fase gas de glicerol a 700 °C y 0,1 MPa, en ciclos de 12 h de reacción y etapas intermedias de regeneración. El principal compuesto generado fue H2, seguido por CO y CH4. En cada ciclo, la fracción de H2 disminuyó a mayor tiempo de operación, mientras CO y CH4 aumentaron. La naturaleza del depósito carbonoso generado fue principalmente grafítica y afectó la actividad de los sitios metálicos.
Palabras clave: Hidrógeno; Glicerol; Reformado Catalítico; Desactivación; Regeneración.
Abstract
Hydrogen energy attracts considerable attention because of its efficiency and environmental benefits. Glycerol, a biodiesel by-product, acquired great interest due to its increased production associated with the major biofuels demand and because it comes from renewable raw materials, it can be used as bio-renewable substrate to obtain hydrogen. Nickel catalysts are active and selective to produce hydrogen, representing the carbonaceous deposit formed an important problem. Deactivation of a Ni/g-Al2O3 catalyst with 5.2 wt.% metal was evaluated during glycerol steam reforming at 700ºC and 0,1 MPa, with 12 h reaction cycles and intermediate regeneration stages. The main product generated was H2, followed by CO and CH4. In each cycle, H2 fraction decreased with time-on-stream, while both CO and CH4 increased. The nature of generated carbonaceous deposit was mainly graphitic and affected the activity of metallic sites.
Keywords: Hydrogen; Glycerol; Catalytic Reforming; Deactivation; Regeneration.
Introducción
Las energías limpias se han convertido en una de las principales áreas de investigación de la catálisis en todo el mundo. La energía del H2, el elemento más simple y abundante, ha atraído considerable atención debido a las ventajas relacionadas con la eficiencia energética y cuidado medioambiental, y su demanda se encuentra en aumento por los avances en la industria de celdas de combustibles. Esto implicó encontrar fuentes renovables de materias primas para producirlo, pues casi 95% proviene de combustibles fósiles no renovables. Las economías de los países industrializados dependen en gran medida de los combustibles fósiles, los cuales presentan inestabilidad respecto al continuo suministro y precio, y difícilmente permitirán lograr un modelo de desarrollo económico y ambiental sostenible. En consecuencia, varios países han iniciado y desarrollado numerosos estudios y proyectos tecnológicos relacionados a fuentes de materias primas alternativas, priorizando la biomasa por su abundancia y sostenibilidad, para generar bioenergía y bioproductos [1-3].
Los biocompuestos, producidos a partir de fuentes renovables, han adquirido un papel creciente como combustibles para transporte. El biodiesel, mezcla de ésteres metílicos de ácidos grasos, es obtenido a partir de aceites vegetales por transesterificación con metanol [4]. Esta reacción produce como subproducto glicerol, aproximadamente 10% en peso, que es utilizado en la industria química, farmacéutica, alimenticia y cosmética [5]. La transformación del glicerol es de gran interés debido a su mayor producción asociada a la creciente demanda de biocombustibles y por provenir de materias primas renovables, lo que permitirá un desarrollo ambiental sostenible. Por lo tanto, se prevé considerar su utilidad como sustrato renovable para producir H2, combustible renovable de próxima generación [6].
Actualmente, la vía más utilizada para generar H2 es el reformado catalítico de hidrocarburos [7]. El estudio de la conversión del glicerol a H2 por vía catalítica tomó gran impulso en los últimos años por la necesidad de obtener fuentes renovables que sean empleadas como combustibles a partir de compuestos provenientes de la biomasa [6, 8]. El reformado en fase gas presentó interés por sus características operativas y una mayor eficiencia de reacción. La evaluación del comportamiento catalítico de varios materiales en esta reacción mostró para Ni/Al2O3 el mejor desempeño, con 65% del máximo rendimiento teórico de H2 [9]. La modificación de Ni/Al2O3 con Ce, Mg, Zr y La mostró que estos promotores favorecen la selectividad a H2 [10]. Catalizadores mono y bimetálicos de Ni y Pt sobre Al2O3 mejoraron el comportamiento al modificar el soporte con La2O3, alcanzando Ni/Al2O3 modificada la mayor selectividad a H2 [11]. Un soporte mixto Al2O3(92%)-SiO2(8%) se utilizó para evaluar conversión y selectividad entre 600 y 900 ºC [12].
Los procesos de desactivación durante el reformado de glicerol en fase gas sobre Pt/g-Al2O3 y Al2O3 modificada con Ce y Zr, demostraron que los materiales ácidos favorecen reacciones laterales indeseables como deshidratación, deshidrogenación, hidrogenólisis y condensación, generando depósitos carbonosos y una rápida desactivación del catalizador; mientras que los materiales con propiedades ácidas atenuadas o características neutras alcanzaron gran actividad hacia productos gaseosos, alta selectividad a H2 y adecuada estabilidad en el tiempo [13]. Usando Rh o Ni sobre Al2O3, MgO o CeO2, el depósito carbonoso se formó a partir de olefinas generadas por descomposición térmica del glicerol, y temperaturas superiores a 650 ºC favorecieron la generación de carbón encapsulado, lo que disminuyó la estabilidad del catalizador [14]. Con Ni/Al2O3 y Ni/Al2O3 modificada con ZrO2 y CeO2, Ni-Ce presentó mayor estabilidad, y su carácter básico inhibió las reacciones de formación de depósitos carbonosos que desactivan el material [15]. Estos promotores mejoraron la dispersión metálica, la estabilidad térmica y la disponibilidad de O2, facilitando la gasificación del depósito carbonoso [16- 18]. Los catalizadores de Ni fueron activos y selectivos para producir H2, aunque la desactivación representó un problema por formación de productos intermedios desde glicerol, generando depósito carbonoso [14].
El objetivo del trabajo fue estudiar la reacción de reformado en fase gas del glicerol, empleando un catalizador con Ni impregnado sobre Al2O3, analizando su desactivación como consecuencia del depósito carbonoso formado y evaluando posteriores etapas de regeneración para intentar recuperar la actividad catalítica. Catalizador y soporte fueron caracterizados por espectrometría de emisión óptica por plasma de acoplamiento inductivo, reducción a temperatura programada (RTP), difracción de rayos X (DRX) y espectroscopía infrarroja con Transformada de Fourier (FTIR). El depósito carbonoso formado sobre el material durante la reacción se analizó por oxidación a temperatura programada (OTP).
Materiales y Métodos
Catalizador
El material preparado fue una muestra de níquel impregnado sobre alúmina. Se empleó un soporte comercial de g-Al2O3 (CK-300, Akzo Nobel), con superficie específica 199 m2 g-1 y volumen de poros 0,51 cm3 g-1. La impregnación se realizó siguiendo la técnica de humedad incipiente, utilizando nitrato de níquel hexahidratado (Merck) como precursor. Se preparó una solución con concentración adecuada para obtener una carga de Ni de 5,1% p/p. La muestra impregnada fue secada a 110 ºC durante toda la noche en estufa (flujo estanco), enfriándose luego hasta temperatura ambiente en desecador. Finalmente, el pretratamiento del material consistió en una calcinación en corriente de aire (50 mL min-1) a 500 ºC por 3 h, enfriamiento hasta 30 ºC con pasaje de N2 (40 mL min-1) y reducción en corriente de H2 (100 mL min-1) a 500 ºC por 3 h. La muestra se identificó como Ni/Al2O3.
Caracterización
La carga metálica se determinó por espectrometría de emisión óptica por plasma de acoplamiento inductivo (equipo Perkin Elmer Optima 2100 DV). Previo a las mediciones, el catalizador reducido fue molido hasta obtener un polvo fino y colocado en estufa a 110 ºC durante 2 h para permitir su acondicionamiento. Luego, se realizó una digestión con una mezcla de ácidos clorhídrico y nítrico en relación 3:1 en un digestor rotativo y posteriormente se llevó la muestra a volumen final para su inyección en el equipo. La reducibilidad de especies Ni se estudió por RTP (equipo Ohkura TP2002S). La muestra (60 mg) fue pretratada in-situ (masa luego del pretratamiento 50 mg), calcinando 3 h en corriente de aire a 500 ºC y enfriando a temperatura ambiente en corriente de N2; luego se aumentó de 35 a 900 ºC, con una rampa de calentamiento de 10 ºC min-1, en corriente de 1,8% v/v de H2 en Ar, midiendo la señal continuamente con un detector de conductividad térmica (DCT). Para la caracterización por FTIR (espectrómetro Shimadzu IR Prestige-21), los materiales fueron reducidos empleando idéntico tratamiento y masa, luego
diluidos al 2% p/p en KBr (Merck), y molidos a punto talco. Posteriormente, se preparó un disco fino que se colocó en una celda con ventanas de CaF2, la cual operó bajo vacío; el espectro se registró entre 4000 y 1000 cm-1. La estructura cristalina se determinó por DRX (difractómetro de rayos X Shimadzu XD-C1). Las muestras reducidas, empleando idéntico tratamiento y masa, fueron molidas a punto talco y colocadas en un portamuestra de vidrio. Para la detección fue utilizada la radiación Kα de Cu, con velocidad de barrido 1º min-1, voltaje 30 kV y corriente 40 mA, evaluando el ángulo de difracción en modo continuo para 2θ entre 10 y 90º.
Evaluación Catalítica
El comportamiento catalítico durante el reformado en fase gas del glicerol se evaluó en un reactor de lecho fijo y flujo continuo descendente, calefaccionado con un horno eléctrico que dispone de un controlador-programador de temperatura (Eurotherm), teniendo el sistema un vaporizador previo y un condensador posterior al reactor. Una muestra reducida de catalizador (500 mg) fue colocada sobre el soporte poroso del reactor. Se alimentó, en forma simultánea al vaporizador, una corriente He como gas carrier a través de un controlador de flujo másico (Aalborg) y una solución acuosa de glicerol al 70% p/v mediante bomba de jeringa (Cole Parmer 74900). Las condiciones de operación fueron 700 ºC, 0,1 MPa, flujo de alimentación de solución acuosa de glicerol (FAG) 0,17 ml min-1, velocidad espacial másica horaria (VEMH) 5 h-1, y relación molar agua:glicerol (RMAG) 3:1. El tiempo total de reacción fue 48 horas, con cuatro ciclos de 12 horas cada uno, y etapas intermedias de regeneración. El enfriamiento del sistema luego de la reacción se realizó con pasaje de N2 (40 mL min-1).
El seguimiento de la reacción se realizó por cromatografía de gases (cromatógrafo Varian Star CX-3400). La corriente de gases y productos no condensados eluyente del sistema de reacción se analizó en línea usando dos válvulas de muestreo. La primera permitió inyectar una muestra gaseosa a una columna de acero inoxidable rellena con Molecular Sieve 13X 80/100 Mesh (CRS), alimentada con He como gas carrier y operada isotérmicamente a 30 ºC, analizando con un DCT los gases H2, CO y CH4. La segunda válvula permitió inyectar otra muestra gaseosa a una columna Megabore GS-Alúmina (J&W), alimentada con N2 como gas carrier y operada con el programa: 5 min a 100 ºC, 10 ºC min-1 hasta 185 ºC, manteniendo la temperatura durante 15 min, analizando con un detector de ionización de llama (DIL) al CH4 y compuestos gaseosos livianos. La fracción condensada durante la reacción (colectada cada hora) se analizó inyectando la muestra en una columna Megabore DB-20 (J&W), con el programa: 4 min a 35 ºC, 15°C min-1 hasta 180 ºC, manteniendo la temperatura durante 5 min, calentamiento a 25°C min-1 hasta 200 ºC, manteniendo esta temperatura durante 20 min, e identificando los compuestos mediante otro DIL. Un patrón certificado de gases con concentración conocida de H2, CO, CO2 y CH4 fue empleado para calcular la composición de la corriente de productos gaseosos y no condensables, mientras que el método de estándar interno, utilizando 1-butanol, se empleó para calcular la concentración de glicerol en la fracción condensada. El desempeño catalítico fue cuantificado sobre la fracción líquida condensada a cada hora de operación, calculando la conversión de glicerol como la relación entre moles de glicerol consumidas (diferencia entre moles alimentadas y eluyentes) y moles de glicerol alimentadas al sistema; la conversión se evaluó a cada hora y como promedio de las determinadas a cada hora de operación.
Regeneración
Luego de cada ciclo de reacción de 12 h, se realizó una etapa de regeneración en el mismo sistema de reacción. Se alimentó una corriente de 50% v/v de aire en He (120 mL min-1) y se llevó el lecho catalítico de 30 a 760 ºC, con una rampa de calentamiento de 4°C min-1, manteniendo la temperatura por 16 h. El enfriamiento del sistema luego de la regeneración (al igual que posterior a la reacción) se realizó hasta 30 ºC con pasaje de N2 (40 mL min-1). La corriente de gases eluyente del sistema se analizó en línea utilizando el sistema de válvula de muestreo, columna de acero inoxidable (CRS) y DCT descriptos previamente. La cantidad de O2 consumida en la combustión del depósito carbonoso formado sobre el catalizador se obtuvo por diferencia entre la cantidad de O2 en la corriente alimentada y la cantidad de O2 en la corriente de salida del sistema, siendo cuantificadas con un patrón certificado de gases (Indura).
OTP
El depósito carbonoso formado durante la reacción fue caracterizado por OTP. Se utilizaron dos reactores tubulares de cuarzo en serie: el primero, con 10 mg de catalizador con depósito carbonoso, se alimentó con una corriente de 6% v/v de O2 en He (40 mL min-1) y se llevó de 30 a 760 ºC con una rampa de calentamiento de 12 ºC min-1, manteniendo la temperatura por 25 min. El segundo reactor, con 500 mg de Ni/Raney (Merck), fue operado en forma isotérmica a 400 ºC y alimentado con la corriente del primer reactor, adicionando una corriente de H2 (22 mL min-1), la cual permitió convertir los óxidos de carbono, producto de la combustión del depósito carbonoso, en metano. La señal fue continuamente medida utilizando un DIL. El depósito carbonoso formado durante la reacción se cuantificó realizando un balance de átomos de carbono, considerando que cada mol de carbono eliminado generó un mol de CH4, por lo que la integración del área bajo la curva de la cantidad de CH4 detectada y cuantificada mediante un patrón certificado de gases (H2, CO, CO2 y CH4), permitió obtener la cantidad de carbón en el depósito formado.
Resultados y Discusión
La carga de Ni en el material preparado, determinada por análisis elemental, fue 5,2% p/p, valor levemente superior al teórico (5,1% p/p) y con una diferencia relativa porcentual menor al 2%, lo que permitió considerar como aceptables los cálculos teóricos realizados.
Los perfiles de RTP correspondientes al soporte g-Al2O3 y al catalizador calcinados son presentados en la Figura 1. El perfil de g-Al2O3 no presentó consumo de H2 por la ausencia de sitios reducibles. Para el catalizador con Ni, la deconvolución del perfil permitió identificar tres picos de reducción. El primero correspondió al menor consumo de H2, entre 150 y 450 ºC, luego el mayor pico de reducción, entre 350 y 750 ºC (con máximo centrado en 580 ºC), y el tercer pico a mayor temperatura, entre 650 y 850 ºC. Resultados previos indicaron que preferentemente existen tres especies Ni sobre Al2O3: NiO libre o superficial (temperatura de reducción menor a 400 ºC), NiO unido a Al2O3 (temperatura de reducción entre 400 y 690 ºC), y NiO incorporado a la estructura Al2O3, formando las especies NiAl2O4 y NiAlxOy (temperatura de reducción mayor a 700 ºC) [19]. Ni/Al2O3 calcinado entre 300 y 600 ºC presentó el principal pico de reducción entre 475 y 660 ºC [12]. Empleando 4,1% p/p de Ni sobre Al2O3, al calcinar a 400 ºC se reportó baja presencia de NiAl2O4 debido a una pobre difusión de iones Ni hacia la red de g-Al2O3, mientras que al calcinar a 700 ºC el pico de reducción a mayor temperatura aumentó debido al incremento en la difusión de los iones Ni en el soporte formando la especie NiAl2O4 [20]. El perfil obtenido para el catalizador preparado mostró que la principal especie presente fue NiO, mientras que NiAl2O4 se encontró en mediana proporción, posiblemente debido a la temperatura de calcinación utilizada. La elevada temperatura necesaria para lograr la completa reducción de las especies Ni, indicó que las mismas son difíciles de reducir.

Figura 1: Perfiles RTP de Ni/Al2O3 y g-Al2O3 calcinados en aire a 500 ºC durante 3 h.
La Figura 2 exhibe los espectros FTIR para el soporte calcinado y el catalizador reducido. En la región de alta frecuencia (4000-3000 cm-1) se observó una banda intensa centrada a 3500 cm-1, cuya intensidad disminuyó para el material con Ni, y varias bandas débiles entre 3700 y 3900 cm-1. La banda a 3500 cm-1 se asignó a la interacción entre grupos OH y/o H2O quimisorbida con OH libres de la Al2O3 mediante enlaces puente H [21]; las bandas a 3700- 3900 cm-1 correspondieron a frecuencias de estiramiento de grupos OH, con cinco posibles configuraciones estructurales [22]. La disminución de intensidad en la banda principal se relacionó al efecto de especies óxido metálico superficiales sobre el grado de hidratación del soporte [23]. A baja frecuencia (2000-1000 cm-1) se observó una banda a 1630 cm-1, cuya intensidad no varía, y otra a 1440 cm-1; bandas a 1620 y 1470 cm-1 fueron asignadas a Al2O3 [24]. La identificación a menos de 1700 cm-1 se dificultó por la gran variedad de especies formadas entre iones Ni y la fase del soporte [21]. El material de Ni impregnado sobre alúmina presentó diferentes estructuras formadas entre los grupos OH y el soporte, y especies metálicas que disminuyeron el grado de hidratación superficial.
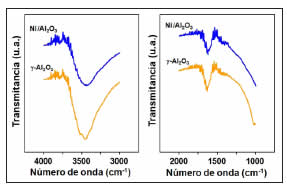
Figura 2: Espectros FTIR de Ni/Al2O3 reducido y g-Al2O3 calcinado en aire a 500 ºC durante 3 h.
La Figura 3 presenta la caracterización por DRX para el soporte calcinado y el catalizador reducido. Los perfiles muestran un pico ancho de mediana intensidad a 38º, y picos a 46º y 68º más definidos y de mayor intensidad. Resultados previos mostraron patrones similares, siendo predominante la fase correspondiente a g-Al2O3 [20]. Para Ni/Al2O3, el pico a 38° también pudo corresponder a la formación de la estructura tipo espinela de aluminato de níquel (NiAl2O4), que también presentó picos a 46º y 68° aunque de menor intensidad [20]. Una estructura pseudo-espinela con parámetros de red similar a los de NiAl2O4 fue reportada para g-Al2O3, mientras que un material con 6,8% p/p de Ni sobre Al2O3 mostró débilmente la especie NiO [25]. Al calcinar Ni/Al2O3 a 600º C, el patrón DRX presentó picos intensos a 37º y 44,8º (NiAl2O4), siendo el pico a 43,2º (NiO) de menor proporción [26]. Catalizadores calcinados a 300 ºC mostraron picos a 43º y 65º (cristales de NiO) sólo con cargas superiores a 7,3% p/p de Ni; cargas menores únicamente presentaron el perfil correspondiente a g-Al2O3 [27]. Nuestros resultados concuerdan con lo reportado, siendo similares los perfiles entre catalizador y soporte; la temperatura de calcinación utilizada y la carga (5,2% p/p de Ni) posiblemente dificultan la detección de especies NiAl2O4 y NiO.
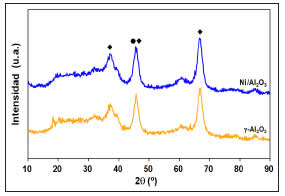
Figura 3: Perfiles DRX de Ni/Al2O3 reducido y g-Al2O3 calcinado con aire a 500 ºC por 3 h. (♦) NiAl2O4 y g-Al2O3. (●) NiO.
La Figura 4 muestra la fracción de H2 (%) en la corriente de gases a la salida del sistema de evaluación catalítica, durante los 4 ciclos de reacción realizados. Durante el primer ciclo, la fracción de H2 aumentó suavemente durante las primeras 5-6 h, hasta 78,1%, y luego disminuyó con el tiempo hasta aproximadamente 51,5% a 12 h de reacción. Este comportamiento se asoció a que el catalizador necesita un tiempo hasta alcanzar su mayor actividad, y luego comienza a disminuir debido al ensuciamiento y al bloqueo de parte de los sitios activos del material como consecuencia de la formación de depósito carbonoso. Al inicio del segundo ciclo de reacción, la fracción de H2 fue mayor que al inicio del primer ciclo, pero la fracción disminuyó marcada y continuamente. El ciclo 3 indicó que la segunda regeneración no fue tan efectiva como la primera, pues aunque la fracción inicial de H2 fue parecida a la del primer ciclo, el comportamiento con el tiempo de reacción fue similar al segundo ciclo. En el último ciclo, la tercera regeneración permitió recuperar la actividad inicial, pero en la segunda mitad del ciclo de reacción, la fracción de H2 disminuyó drásticamente hasta 34%.

Figura 4: Fracción de H2 (%) en reformado de glicerol (Ni/Al2O3: 700 ºC; 0,1 MPa; FAG 0,17 ml min-1; VEMH 5 h-1; RMAG 3:1, ciclos de 12 h).
La Figura 5 presenta la fracción de CO (%) en la corriente de gases a la salida del sistema de evaluación catalítica durante los 4 ciclos de reacción. En el primer ciclo, la fracción de CO disminuyó levemente hasta 5-6 h y luego aumentó marcadamente hasta 38,9% a 12 h. Los ciclos 2 y 3 fueron cualitativamente similares, creciendo con el tiempo; durante las primeras 6 horas la fracción de CO fue menor para el ciclo 2 y luego levemente superior. El ciclo 4 fue similar al ciclo 3 en las primeras 4 h, aumentó las siguientes 2 horas hasta 58,1% y luego se mantuvo sostenido hasta las 12 h.

Figura 5: Fracción de CO (%) en reformado de glicerol (Ni/Al2O3: 700 ºC; 0,1 MPa; FAG 0,17 ml min-1; VEMH 5 h-1; RMAG 3:1, ciclos de 12 h).
La Figura 6 presenta la fracción de CH4 (%) en la corriente de gases a la salida del sistema de evaluación catalítica durante los 4 ciclos de reacción. El comportamiento en los 4 ciclos fue cualitativamente similar al de la fracción de CO. Durante el primer ciclo, la fracción de CH4 disminuyó levemente durante las primeras 5 h y luego aumentó hasta 9,3% a 12 horas. Este comportamiento, similar al del CO, se relacionó con la disminución de la fracción de H2 debido a menor disponibilidad de sitios por formación de depósito carbonoso y a reacciones que generan CH4, consumiendo H2. Al inicio del segundo ciclo, la cantidad de CH4 fue menor (2,4%), con incremento continuo en el tiempo, alcanzando 8,5% a 12 h. Los ciclos 3 y 4 presentaron comportamiento cualitativo similar al ciclo 2, con aumento de la fracción CH4.
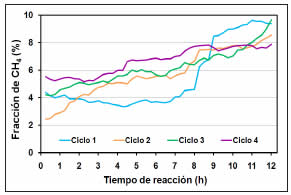
Figura 6: Fracción de CH4 (%) en reformado de glicerol (Ni/Al2O3: 700 ºC; 0,1 MPa; FAG 0,17 ml min-1; VEMH 5 h-1; RMAG 3:1, ciclos de 12 h).
Las Figuras 4, 5 y 6 muestran que en el reformado con vapor de glicerol sobre Ni/Al2O3, el principal producto generado fue H2, seguido por CO y en menor proporción CH4. Este comportamiento se asoció a la elevada temperatura de reacción (700 ºC) que favorece la conversión de CO2, CH4 y parte del depósito carbonoso a H2, CO y H2O [28]. La elevada temperatura de reacción favoreció también la descomposición de glicerol, generando H2, CO, CO2, olefinas y CH4 [14]. Entre varios catalizadores, Ni/Al2O3 resultó ser más activo a 800 ºC, con pérdida de actividad en las primeras 2 h de reacción y desactivación casi completa luego de 6 h, siendo la descomposición térmica de glicerol la reacción que produjo H2 [14].
La Tabla 1 muestra los valores de conversión de glicerol a 1, 6 y 12 h y promedio (X1h, X6h, X12h y XT, respectivamente) obtenidos para el reformado en fase gas sobre Ni/Al2O3 durante los sucesivos ciclos de reacción. La conversión se mantuvo estable y en 100% durante el primer ciclo, disminuyendo hasta 69,7, 62,8 y 51,6% al final de los ciclos 2, 3 y 4 (X12h), respectivamente. La conversión al inicio del ciclo 2 fue 99% (X1h), prácticamente la del ciclo 1, mientras que las regeneraciones 2 y 3 sólo permitieron recuperar parcialmente la actividad inicial del ciclo anterior, mostrando una tendencia decreciente (96,4 y 89,1% para X1h, respectivamente). En los ciclos 2, 3 y 4 se evidenció una pérdida de actividad al aumentar el tiempo de operación así como al realizar las sucesivas regeneraciones.
Tabla 1: Conversiones de glicerol a 1 h (X1h), 6 h (X6h), 12 h (X12h) y promedio (XT) en reformado en fase gas sobre Ni/Al2O3 durante ciclos de reacción sucesivos con regeneraciones intermedias.

La Figura 7 presenta los perfiles de OTP para Ni/Al2O3 al final de los ciclos 1, 2 y 4 de reacción. La oxidación del depósito carbonoso formado sobre el catalizador durante la reacción comenzó a 400 ºC, creciendo en forma suave hasta 600 ºC, presentando luego un pico bien definido e intenso, con máximo centrado aproximadamente a 720 ºC y finalizando a los 65 min (valor isotérmico en 760 ºC). Durante el reformado en fase gas del glicerol se formó una importante cantidad de depósito carbonoso, siendo posible que una proporción considerable del mismo se haya adsorbido sobre el soporte. La elevada temperatura requerida para la remoción parcial de los depósitos carbonosos sugirió que su naturaleza fue principalmente de tipo grafítico (especies adsorbidas sobre el soporte), con menor presencia del tipo amorfo, que sería removido a menor temperatura (especies adsorbidas cerca de las partículas metálicas) [29-31]. Las concentraciones de carbón, cuantificadas a partir de las curvas de OTP, alcanzaron 14,8; 27,4 y 25,7 mg C g cat-1 h-1 en los ciclos 1, 2 y 4 de reacción, respectivamente.
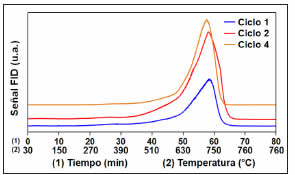
Figura 7: Perfiles de OTP para Ni/Al2O3 al final de los ciclos 1, 2 y 4. (Alimentación: 6% v/v de O2 en He, 40 mL min-1, velocidad calentamiento 12 °C min-1).
La Figura 8 muestra los perfiles de consumo de O2 durante las regeneraciones realizadas luego de los ciclos 1, 2 y 3 de reacción. En cada regeneración el consumo de O2 aumentó de manera marcada a partir de 270 ºC, alcanzando su consumo máximo a 670 ºC, siendo la temperatura final de regeneración 760 ºC. Esta elevada temperatura indicó que el depósito carbonoso formado durante los ciclos de reacción fue difícil de eliminar. El mayor consumo de O2 se tuvo en la primera regeneración y el menor en la segunda. Durante las regeneraciones 1 y 3, el consumo total de O2 fue 7,5 y 7,0 moles, respectivamente, muy superiores al de la regeneración 2 (4,0 moles); esto indicaría que el depósito carbonoso formado durante el ciclo 2 fue menor. La regeneración se continuó hasta 16 h (datos no mostrados), manteniendo el lecho en 760 ºC y observando un pequeño consumo de O2 al final de la etapa. Esto se interpretó considerando que una pequeña proporción de depósito carbonoso fuertemente adsorbida al catalizador no fue completamente eliminada en la regeneración, aún luego de mantener el sistema a 760 ºC hasta un tiempo total de 16 h. Éste depósito no eliminado durante la regeneración facilitaría la formación de mayor depósito carbonoso en la siguiente etapa de reacción, el cual fue encontrado fuertemente adsorbido al soporte y principalmente afectando la actividad de los sitios metálicos [32].
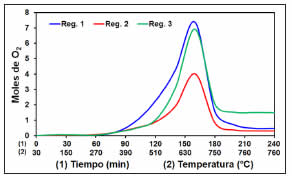
Figura 8: Perfiles de consumo O2 para Ni/Al2O3 en sucesivas regeneraciones. (Alimentación: 50% v/v de aire en He, 120 mL min-1, velocidad calentamiento 4 °C min-1).
Conclusiones
Un catalizador con 5,2% p/p de Ni soportado sobre g-Al2O3 se preparó siguiendo la técnica de impregnación por humedad incipiente. Las especies Ni impregnadas en g-Al2O3 fueron difíciles de reducir, presentando una adecuada interacción metal-soporte y disminuyendo el grado de hidratación superficial del soporte. La desactivación del catalizador en el reformado en fase gas del glicerol se evaluó a 700 ºC, 0,1 MPa, FAG 0,17 ml min-1, VEMH 5 h-1 y RMAG 3:1, en ciclos de 12 h de reacción y etapas intermedias de regeneración. El principal compuesto generado al inicio de cada ciclo de reacción fue H2, seguido por CO y en menor proporción CH4, comportamiento asociado a la elevada temperatura de reacción que favoreció la conversión de CO2 y CH4 a H2, CO y H2O. En cada ciclo de reacción, a mayor tiempo de operación disminuyó la fracción de H2, aumentando las de CO y CH4. Una importante cantidad de depósito carbonoso se formó sobre el catalizador durante los ciclos de reacción, requiriendo elevada temperatura para su eliminación. La recuperación de la actividad catalítica fue posible, aún cuando una pequeña proporción de depósito carbonoso quedó fuertemente adsorbida al soporte.
Agradecimientos
Los autores agradecen la asistencia económica de CONICET y U.N.L. (CAI+D).
1. Werpy, T. y Petersen G. Top Value Added Chemicals from Biomass: Vol. I-Results of Screening for Potential Candidates from Sugars and Synthesis Gas, U.S. Department of Energy, Washington D.C., U.S.A. 2004. [ Links ]
2. Archambault, É. Towards a Canadian R&D Strategy for Bioproducts and Bioprocesses, National Research Council, Montreal, Canada. 2004. [ Links ]
3. Oertel, D. Industrial conversion of biomass, TAB report 114, Office of Technology Assessment at the German Parliament, Berlin, Germany. 2007. [ Links ]
4. Vicente, G.; Martínez, M. y Aracil, J. Integrated biodiesel production: a comparison of homogeneous catalysts systems, Bioresour. Technol. 92: p. 297-305. 2004. [ Links ]
5. Leffinwell, G. y Lesser, M., Glycerin: its Industrial and Commercial Applications, Editor. Chemical Publishing Co., Brooklyn, p. 1-259. 1945. [ Links ]
6. Pachauri, N. y He, B. Value-added Utilization of Crude Glycerol from Biodiesel Production: A Survey of Current Research Activities, ASABE Annual International Meeting, Portland, U.S.A. 2006. [ Links ]
7. Climate Action Network Europe (CAN-Europe) Hydrogen production, Climate Technology Sheet 9: p. 1-10. 2003. [ Links ]
8. Adhikari, S.; Fernando, S.D. y Haryanto A. Hydrogen production from glycerol: An update, Energy Conv. Manag. 50: p. 2600-2604. 2009. [ Links ]
9. Douette, A.M.D.; Turn, S.Q.; Wang, W. y Keffer, V.I. Experimental investigation of hydrogen production from glycerin reforming, Energy & Fuels 21: p. 3499-3504. 2007. [ Links ]
10. Iriondo, A.; Barrio, V.L.; Cambra, J.F.; Arias, P.L.; Güemez, M.B.; Navarro, R.M.; Sánchez-Sánchez, M.C. y Fierro, J.L.G. Hydrogen production from glycerol over nickel catalysts supported on Al2O3 modified by Mg, Zr, Ce or La, Top. Catal. 49: p. 46-58. 2008. [ Links ]
11. Iriondo, A.; Barrio, V.L.; Cambra, J.F.; Arias, P.L.; Güemez, M.B.; Navarro, R.M.; Sánchez-Sánchez, M.C. y Fierro, J.L.G. Influence of La2O3 modified support and Ni and Pt active phases on glycerol steam reforming to produce hydrogen, Catal. Comm. 10: p. 1275-1278. 2009. [ Links ]
12. Adhikari, S.; Fernando, S.D. y Haryanto, A. Production of hydrogen by steam reforming of glycerin over alumina-supported metal catalysts, Catal. Today 129: p. 355- 364. 2007. [ Links ]
13. Pompeo, F.; Santori, G. y Nichio, N. Hydrogen and/or syngas from steam reforming of glycerol. Study of platinum catalysts, Int. J. Hydrog. Energy 35: p. 8912-8920. 2010. [ Links ]
14. Chiodo, V.; Freni, S.; Galvagno, A.; Mondello, N. y Frusteri, F. Catalytic features of Rh and Ni supported catalysts in the steam reforming of glycerol to produce hydrogen, Appl. Catal. A 381: p. 1-7. 2010. [ Links ]
15. Buffoni, I.; Pompeo, F.; Santori, G. y Nichio, N. Nickel catalysts applied in steam reforming of glycerol for hydrogen production, Catal. Commun. 10: p. 1656-1660. 2009. [ Links ]
16. Liberatori, J.W.C.; Ribeiro, R.U.; Zanchet, D.; Noronha, F.B. y Bueno, J.M.C. Steam reforming of ethanol on supported nickel catalysts, Appl. Catal. A 327: p. 197-204. 2007. [ Links ]
17. Dong, F.; Suda, A.; Tanabe, T.; Nagai, Y.; Sobukawa, H.; Shinjoh, H.; Sugiura, M.; Descorme, C. y Duprez, D. Characterization of the dynamic oxygen migration over Pt/CeO2-ZrO2 catalysts by 18º/16º isotopic exchange reaction, Catal. Today 90: p. 223-229. 2004. [ Links ]
18. Dutta, G.; Waghmare, U.V.; Baidya, T.; Hegde, M.S. Priolkar, K.R. y Sarode, P. Reducibility of Ce1-xZrxO2: origin of enhanced oxygen storage capacity, Catal. Lett. 108: p. [ Links ]
19. Rynkowski, J.; Paryjczak, T. y Lenik, M. On the nature of oxidic nickel phases in NiO/g-Al2O3 catalysts, App. Catal. A 106: p. 73-82. 1993. [ Links ]
20. Zhu, X.; Huo, P.; Zhang, Y.; Cheng, D. y Liu, C. Structure and reactivity of plasma treated Ni/Al2O3 catalyst for CO2 reforming of methane, App. Catal. B 81: p. 132-140. 2008. [ Links ]
21. Stoilova, D.; Koleva, V. y Cheshkova, K. Infrared spectroscopic study of NO and NH3 adsorption on alumina-supported nickel oxide catalysts, Z. Phys. Chemie 216: p. 737-747. 2002. [ Links ]
22. Knözinger, H. y Ratnasamy, P. Catalytic aluminas: surface models and characterization of surface sites, Catal. Rev.-Sci. Eng. 17: p. 31-70. 1978. [ Links ]
23. Kapteijn, F.; Singoredjo, L.; Andreini, A.; Moulijn, J.; Van Driel, M.; Ramis, G. y Busca, G. Alumina-supported manganese oxide catalysts II: surface characterization and adsorption of ammonia and nitric oxide, J. Catal. 150: p. 105-116. 1994. [ Links ]
24. Turek, A.; Wachs, I. y DeCanio, E. Acidic properties of alumina-supported metal oxide catalysts: an infrared spectroscopy study, J. Phys. Chem. A 96: p. 5000-5007. 1992. [ Links ]
25. Lo Jacono, M.; Schiavello, M. y Cimino A. Structural, magnetic, and optical properties of nickel oxide supported on h- and g- aluminas, J. Phys. Chem. A 75: p. 1044- 1050. 1971. [ Links ]
26. Auroux, A.; Monaci, R.; Rombi, E.; Solinas, V.; Sorrento, A. y Santacesaria, E. Acid sites investigation of simple and mixed oxides by TPD and microcalorimetric techniques, Thermochim. Acta 379: p. 227-231. 2001. [ Links ]
27. Mattos, A.R.J.M.; Probst, S.H.; Afonso, J.C. y Schmal, M. Hydrogenation of 2-ethyl-hexen-2-al on Ni/Al2O3 catalysts, JBCS 15: p. 760-766. 2004. [ Links ]
28. Dou, B.; Dupont, V.; Rickett, G.; Blakeman, N.; Williams, P.; Chen, H.; Ding, Y. y Ghadiri, M. Hydrogen production by sorption-enhanced steam reforming of glycerol, Bioresour. Technol. 100: p. 3540-3547. 2009. [ Links ]
29. Rynkowski, J.; Paryjczak, T. y Lenik, M. Characterization of alumina supported nickel-ruthenium systems, App. Catal. A 126: p. 257-271. 1995. [ Links ]
30. Silverwood, P.; Hamilton, N.; Staniforth, J.; Laycock, C.; Parker, S.; Ormerod, R. y Lennon, D. Persistent species formed during the carbon dioxide reforming of methane over a nickel-alumina catalyst, Catal. Today 155: p. 319-325. 2010. [ Links ]
31. Araque, M.; Martínez, T.; Vargas, J. y Roger, A. Hydrogen production by glycerol steam reforming over CeZrCo fluorite type oxides, Catal. Today 176: p. 352-356. 2011. [ Links ]
32. De Lima, S.; Silva, A.; Graham, U.; Jacobs, G.; Davis, B.; Mattos, L. y Noronha, F. Ethanol decomposition and steam reforming of ethanol over CeZrO2 and Pt/CeZrO2 catalyst: Reaction mechanism and deactivation, Appl. Catal. A-Gen. 352: 95-113. 2009. [ Links ]
Recibido: 20/02/2013
Aprobado: 10/08/2015














