Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Asociación Argentina de Ortopedia y Traumatología
On-line version ISSN 1852-7434
Rev. Asoc. Argent. Ortop. Traumatol. vol.78 no.2 Ciudad Autónoma de Buenos Aires June 2013
INVESTIGACIÓN
Osteointegración del aloinjerto crioconservado asociado a plasma enriquecido en plaquetas, en defectos óseos infectados
Estudio experimental
Pablo Alexis Bruno, Damián Gabriel Bustos, Jorge Flores, Ignacio Fernández Savoy, Natalia Gutiérrez, Luis Sebastián Rucheli, Alberto Javier Jabif y Christian Antonio Allende
Instituto Allende de Cirugía Reconstructiva de los Miembros Departamento de Cirugía Experimental - Universidad Católica de Córdoba
Recibido el 8-12-2012. Aceptado luego de la evaluación el 14-4-2013.
Correspondencia: Dr. PABLO BRUNO brunopablo25@hotmail.com
Resumen
Introducción: El objetivo de este trabajo experimental es determinar si el agregado de plasma rico en plaquetas influye en la osteointegración del aloinjerto crioconservado con antibióticos, en fracturas infectadas, con pérdida ósea, en huesos largos de conejos.
Materiales y métodos: Se evaluaron cuatro grupos de 7 conejos cada uno, a los cuales se les generó una fractura infectada del fémur derecho. En los cuatro grupos, se colocó aloinjerto molido con antibiótico local, en el grupo II y en el grupo IV, se agregó también plasma rico en plaquetas. Se sacrificó a los grupos I y II, a los 30 días, y a los grupos III y IV, a los 90 días. Se realizó una evaluación histológica y tomográfica.
Resultados: Nueve conejos murieron en el período de estudio. No hubo diferencias estadísticamente significativas entre los grupos evaluados. En el grupo IV, con plasma rico en plaquetas, se observó neoformación ósea en tres de las cuatro muestras; se advirtieron sectores de acoplamiento entre el tejido receptor y el injertado, con consolidación en las imágenes tomográficas.
Conclusiones: En este trabajo, hubo correlación entre los resultados histológicos y tomográficos. Pese a que no se hallaron diferencias estadísticamente significativas, el agregado de plasma rico en plaquetas, además de estimular la generación de nuevos tejidos, disminuyó la reabsorción del tejido injertado al análisis anatomopatológico, y mostró mayor neoformación ósea y consolidación en el grupo IV (75%) tratado con plasma rico en plaquetas que en el grupo III (25%) al que no se asoció plasma rico en plaquetas al aloinjerto óseo.
Palabras clave: Fracturas infectadas; Aloinjerto óseo; Plasma rico en plaquetas.
Osseointegration of cryopreserved allograft associated with platelet-rich plasma, in infected bone defects. Experimental study
Abstract
Blackground: The objective of this experimental work was to determine whether the addition of platelet-rich plasma influences the osseointegraton of cryopreserved allograft with antibiotics in infected fractures with bone loss, in long bones of rabbits.
Methods: Four groups of 7 rabbits with generated infected fracture of the right femur. Milled allograft with local antibiotic was placed in the four groups; groups II and IV also received platelet-rich plasma. Rabbits in groups I and II were sacrificed at 30 days, and those of groups III and IV at 90 days. Histological and CT evaluation was performed.
Results: Nine rabbits died during the study period. There were no statistically significant differences between groups. In group IV with platelet-rich plasma, bone formation was observed in three of the four samples, with noticeable areas of coupling between the receiver and the grafted tissue with consolidation in CT.
Conclusions: In our study, there was no correlation between the histological and tomographic findings. Although we found no statistically significant differences, the addition of platelet-rich plasma stimulated the generation of new tissue, and also decreased reabsorption of the grafted tissue according to the pathologic analysis. Besides increased bone formation and consolidation was detected in group IV (75%) treated with platelet-rich plasma, compared to group III (25%) without platelet-rich plasma bone allograft.
Key words: Infected fractures; Allograft bone; Platelet-rich plasma.
Introducción
El tratamiento de fracturas complicadas con infección y pérdidas óseas constituye uno de los mayores desafíos a los que puede enfrentarse un cirujano traumatólogo. Ante estas lesiones, es posible utilizar diferentes técnicas de reconstrucción, todas tienen como objetivo final curar la infección, restaurar la anatomía y obtener la consolidación. Tanto el método de estabilización, como los injertos, sustitutos u osteoinductores que se utilicen en cada reconstrucción, deben ser aquellos que generen la mayor posibilidad de éxito, con el mínimo riesgo y la menor morbilidad para el paciente. Será el cirujano, basado en las características de la lesión por tratar y la biología de los tejidos óseos y blandos periféricos, quien deberá decidir cuál es la mejor opción terapéutica para cada paciente en particular.
Los factores de crecimiento son grupos de moléculas proteicas que no solo estimulan el crecimiento, sino que también poseen otras acciones importantes, como mantener la vida celular, iniciar la mitogénesis y estimular la migración de las células. Un grupo de estos factores, las citoquinas glucoproteicas, se unen a los receptores celulares y estimulan la proliferación celular y, de este modo, favorecen la fase de cicatrización de las heridas.1 Uno de los factores sobre el que hoy en día más se está trabajando es el factor de crecimiento plaquetario, una glucoproteína de bajo peso molecular producida por plaquetas, macrófagos y otras células inflamatorias, que sirve como un componente mitógeno de células mesenquimales responsables de la cicatrización de las heridas. Pero, además, el factor de crecimiento plaquetario consigue regenerar la matriz ósea, con lo que acelera la aparición de hueso en zonas en las que este es defectuoso.2
El objetivo de este trabajo experimental es determinar si el agregado de plasma rico en plaquetas influye en la osteointegración del aloinjerto crioconservado con antibióticos, en fracturas infectadas con pérdida ósea, en huesos largos de conejos.
Materiales y métodos
Se utilizaron 28 conejos neozelandeses, con un peso promedio de 1500 g y de sexo indeterminado. Se trabajó sobre el fémur derecho en todos los casos. Los conejos fueron divididos en cuatro grupos de siete animales cada uno (Tabla 1). A todos los conejos, se les practicó un abordaje lateral longitudinal al eje del fémur para luego reproducir una fractura expuesta mediodiafisaria. Después se inyectaron 10 mm de una jeringa de tuberculina de un inóculo de 0,5 en la escala de McFarland de Staphylococcus aureus cepa ATCC 25923, cultivado durante siete días en medio de cultivo agar sangre y caldo cerebro-corazón, en el foco de fractura; posteriormente, se procedió a cerrar la herida y se esperó siete días hasta obtener signos clínicos de infección. A los siete días de la cirugía inicial, se extrajo el hueso infectado utilizando el mismo abordaje y se envió material a bacteriología para corroborar la infección mediante cultivos, y así se dejó un defecto óseo de la misma magnitud en todos los conejos. Se realizó, entonces, una limpieza quirúrgica, a fin de efectuar el tratamiento previsto para cada grupo asignado aleatoriamente. En el grupo I, se colocó aloinjerto óseo crioconservado más antibiótico local (vancomicina en polvo) y, en el grupo II, se colocó aloinjerto óseo crioconservado más antibiótico local (vancomicina en polvo) más plasma rico en plaquetas. Los conejos de los grupos I y II fueron sacrificados a los 30 días de la primera cirugía. En los grupos III y IV, se efectuaron los mismos tratamientos que en los grupos I y II, respectivamente, solo que los conejos fueron sacrificados a los 90 días de la primera cirugía.
Tabla 1. Grupos de conejos
| Grupo | Tratamiento | |
| I | Aloinjerto óseo con antibiótico + antibiótico sistèmico | Sacrificados a los 3D días |
| II | Aloinjerto óseo con antibiótico + antibiótico sistèmico + plasma rico en plaquetas | |
| III | Aloinjerto óseo con antibiótico + antibiótico sistèmico | Sacrificados a los 9D días |
| IV | Aloinjerto óseo con antibiótico + antibiótico sistèmico + plasma rico en plaquetas |
Los conejos fueron evaluados en el preoperatorio para descartar enfermedades o malformaciones; habitaron en jaulas individuales y fueron alimentados con comida balanceada para conejos (150-200 g/día aproximadamente) y con agua ad líbitum. El procedimiento quirúrgico se llevó a cabo en el laboratorio de cirugía experimental de la Universidad Católica de Córdoba. La anestesia fue inducida con ketamina intramuscular (1 mg/kg de peso) y diazepam intramuscular (3-5 mg/kg peso). La asepsia de la piel se realizó con yodopovidona. Antes de la cirugía, se mantuvo a los animales en ayuno de alimentos y de hidratación por 8 y 2 horas, respectivamente. Se utilizó aloinjerto de hueso, obtenido de la ablación de dos conejos de la misma raza, que fue almacenado en un banco de injertos a -40°C durante 14 días. En el momento de utilizarlo, se lo molió y mezcló con 2 g de vancomicina en polvo para luego dividir esta mezcla en siete partes iguales y usarla en cada conejo de cada grupo. Se administró a todos los grupos cefalomicina 1 mg/kg/día, por vía intramuscular, durante 7 días como antibio-ticoterapia sistémica posoperatoria. Se permitió el movimiento de los conejos dentro de las jaulas, sin restricciones de carga de peso en el miembro fracturado, ni empleo de inmovilización externa después de la intervención.
Los animales fueron sacrificados a los 30 días (grupos I y II) o 90 días (grupos III y IV), con una inyección intracardíaca de potasio más adrenalina para realizar evaluación histológica de la zona injertada; en los grupos I y II, se realizó una tomografía del fémur a los 30 días y, en los grupos III y IV, a los 60 y 90 días, a fin de valorar la incorporación del aloinjerto y la consolidación de la fractura.
Para la preparación y colocación del plasma rico en plaquetas, se extrajeron, de manera estéril, muestras de sangre de cada conejo con una jeringa con el agregado de anticoagulante (citrato de sodio); la toma se realizó suavemente para no generar hemólisis, lo que causaría la variación en el sedimento final. Luego, esta muestra fue colocada en un tubo de ensayo para ser centrifugada. La sangre fue separada con una fuerza centrífuga de 1800 rpm durante 10 minutos, luego de lo cual se obtuvieron cinco niveles en el tubo. Se descartaron las muestras que contenían líquido turbio generado por hemólisis; se extrajeron suavemente los tres niveles superiores del tubo de ensayo en tres pipetas distintas, y la tercera muestra se utilizó para el estudio. Una vez obtenida la muestra de plasma para utilizar, se la activó mediante cloruro de calcio al 10%, minutos antes de colocarla en el foco de fractura.3 Finalmente, se colocaron 3 cc de plasma rico en plaquetas activado en el foco de fractura a los tres días del aloinjerto óseo en los grupos II y IV. Este procedimiento se realizó a través de la herida quirúrgica y sin retirar los puntos de sutura, bajo estrictas normas de asepsia, con una jeringa hipoalergénica de 5 cc y aguja 40x8- 21Gx 1%.
Para la evaluación histológica los cortes de los especímenes se obtuvieron seccionando en el punto medio del defecto (foco de fractura) y, luego, se los incluyó en parafina. Se efectuaron múltiples cortes de 6 mm de espesor con micrótomo y se los tiñó con hematoxilina eosina para microscopia de luz convencional. Se realizó la evaluación cualitativa y cuantitativa de las muestras, en las cuales se determinó la angiogénesis y la proliferación fibroblástica, la hemorragia del foco, el infiltrado leucocitario, la actividad osteoclástica, el acoplamiento óseo y la formación de callo óseo; todas estas variables fueron expresadas en cruces según la actividad (+++: intensa, ++: moderada, +: leve, -: ausente).
La tomografía se efectuó con un tomógrafo Siemens SOMA-TOM Sensation multislice de 64 canales, con cortes axiales y sagitales de 2 mm de espesor. Se consideró que la fractura había consolidado cuando se observó continuidad entre los cabos óseos a través del foco. La reabsorción del tejido injertado fue expresada en cruces, según la cantidad de hueso remanente en las imágenes tomográficas: 3 cruces indicaban las muestras que no sufrieron disminución de la imagen; 0 cruces, reabsorción completa del aloinjerto; 1 y 2 cruces, mayor o menor reabsorción parcial del aloinjerto, respectivamente.
En el análisis estadístico, se utilizó el programa Medcal CV 10 para el procesamiento de los datos. La comparación entre grupos se realizó con el test de ji2. Se consideró estadísticamente significativo un valor p <0,05.
Resultados
Del total de conejos al comenzar el estudio, nueve murieron. La mortalidad por grupo fue la siguiente: 2 (grupo I), 1 (grupo II), 3 (grupo III) y 3 (grupo IV); es importante remarcar que la alta mortalidad en los últimos dos grupos puede ser causa de sesgo en los resultados. En el análisis histológico de los grupos I y II (cinco muestras con injerto óseo molido sin plasma rico en plaquetas y seis muestras con plasma rico en plaquetas), el tejido óseo evidenció importantes fenómenos de hemorragia y depósito de fibrina en el foco de fractura; además, se identificó tejido de granulación con proliferación fibro-blástica y angiogénesis. A los 30 días del injerto óseo, no se observaron signos de consolidación en las muestras de los grupos I y II; sin embargo, en una muestra de cada grupo, se encontró neoformación de tejido óseo circundante al foco por osificación endocondral (callo óseo); el tejido óseo injertado se observaba en pequeños fragmentos, se reconoció la colonización de lagunas por osteocitos y se identificó actividad osteoclástica manifiesta en ambos grupos. Se advirtió adelgazamiento de estructuras trabeculares en ambos grupos, a predominio del tejido injertado sin plasma rico en plaquetas (Fig. 1). El tejido óseo injertado fue acoplado con nuevas áreas de hueso al sitio receptor en ambos grupos de conejos; no obstante, en las muestras con plasma rico en plaquetas, el fenómeno de acoplamiento entre el tejido receptor y el injertado fue evidentemente más claro en el análisis microscópico como se detalla en la Tabla 2 (Fig. 2).
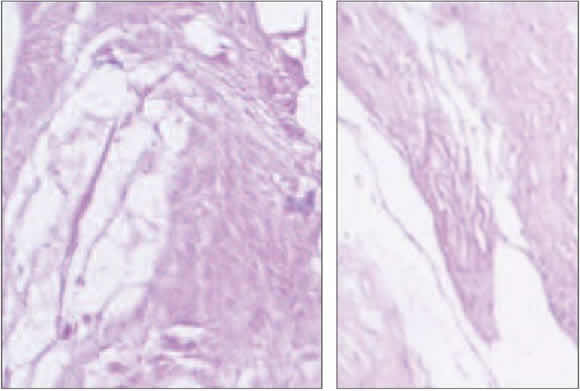
Figura 1. A. Tejido óseo injertado sin agregado de plasma rico en plaquetas; se observa disminución del espesor de sus trabéculas con respecto a la imagen B, en la que se visualiza el injerto autólogo de hueso con el agregado de plasma rico en plaquetas.

Figura 2. Imágenes que muestran el fenómeno de acoplamiento entre el tejido receptor y el injertado, que es notablemente superior en una muestra con plasma rico en plaquetas (B).
En la evaluación histológica de los grupos III y IV (cuatro muestras sin plasma rico en plaquetas y cuatro con plasma rico en plaquetas), se observaron trabéculas óseas neoformadas con marcada actividad osteoclástica focal en 2 de 4 muestras del grupo III; se hallaron tejido fibroso intertrabecular y acúmulos de leucocitos, neutrófilos y fibrina; edema intertrabecular y material basófilo amorfo de naturaleza cálcica; y se evidenció osificación endocondral (callo óseo) solo en una de las muestras de este grupo. En el grupo IV con plasma rico en plaquetas, se observó neoformación ósea en tres de las cuatro muestras, y se advirtieron sectores de acoplamiento entre el tejido receptor y el injertado en una proporción similar a la formación de callo óseo; al igual que en el grupo III, se hallaron depósitos de fibrina y regiones con importante cantidad de leucocitos neutrófilos y, también, similar actividad osteoclástica y edema intertrabecular a los del grupo III (Tabla 2).
Tabla 2. Resultados histológicos
| Conejo Nro. | Angiogénesis | Hemorragia | Infiltrado GB | Actividad osteoclástica | Acoplamiento | Callo óseo |
| 1 | + | +++ | - | +++ | + | - |
| 2 | ++ | +++ | - | +++ | ++ | - |
| 3 | ++ | +++ | - | ++ | ++ | - |
| 4 | + | +++ | - | +++ | + | + |
| 5 | + | +++ | - | ++ | + | - |
| 6 | ++ | +++ | - | ++ | ++ | - |
| 7 | + | +++ | - | ++ | +++ | - |
| 8 | ++ | +++ | - | ++ | ++ | - |
| 9 | ++ | +++ | - | + | +++ | - |
| 10 | ++ | +++ | - | + | ++ | - |
| 11 | ++ | +++ | - | ++ | ++ | + |
| 12 | + | ++ | + | + | - | - |
| 13 | + | + | ++ | + | + | ++ |
| 14 | + | + | + | - | - | - |
| 15 | + | + | ++ | + | - | - |
| 16 | + | + | ++ | ++ | ++ | ++ |
| 17 | + | ++ | ++ | + | ++ | ++ |
| 18 | + | ++ | +++ | ++ | - | - |
| 19 | + | + | ++ | + | ++ | ++ |
Los resultados de las tomografías mostraron que, en los grupos I y II, no se observó diferencia significativa plasma rico en plaquetas.
Al analizar los resultados, no hubo diferencia estadísticamente significativa en la consolidación entre los grupos III y IV a los 60 días (p = 0,292) ni a los 90 días (p = 0,263). Del mismo modo, no se encontraron diferencias significativas en la reabsorción del aloinjerto óseo entre los grupos III y IV a los 60 días (p = 0,292) y a los 90 días (p = 0,263), a pesar de que, en el grupo con plasma, la reabsorción fue menor que en el grupo sin plasma (Tabla 3).
Tabla 3. Resultados tomográficos: reabsorción del injerto y consolidación de la fractura
| Conejo Nro. | Reabsorción del injerto óseo | Consolidación de la fractura |
| 1 | +++ | NO |
| 2 | +++ | NO |
| 3 | +++ | NO |
| 4 | +++ | SÍ |
| 5 | +++ | NO |
| 6 | +++ | NO |
| 7 | +++ | NO |
| 8 | +++ | NO |
| 9 | ++ | NO |
| 10 | +++ | NO |
| 11 | +++ | SÍ |
| 60 días 90 días | 60 días 90 días | |
| 12 | + | NO NO |
| 13 | ++ ++ | NO SÍ |
| 14 | + | NO NO |
| 15 | ++ + | NO NO |
| 16 | ++ + | SÍ SÍ |
| 17 | +++ ++ | SÍ SÍ |
| 18 | ++ ++ | NO NO |
| 19 | ++ + | NO SÍ |
Discusión
El autoinjerto sigue siendo de elección en la mayoría de las reconstrucciones postraumáticas de huesos largos. Hay abundante experiencia con el uso de aloinjertos óseos en cirugía de columna,4,5 en cirugías de revisión protésica6 y en reconstrucciones tumorales;7 pero, en la reconstrucción postraumática de huesos largos, hay escasos reportes publicados. La adición de antibióticos,8 fijadores de calcio (bifosfonatos)9 y otros osteoinductores (proteínas morfogenéticas, plasma rico en plaquetas, etc.) al injerto óseo, a los sustitutos óseos o a otros elementos utilizados como conductores (polimetilmetacrilato) puede darle a estos últimos función de sistemas de transporte o estructura de soporte.10,11
En nuestro trabajo, el agregado del plasma rico en plaquetas, además de estimular la generación de nuevos tejidos, disminuyó la reabsorción del tejido injertado, según el análisis anatomopatológico; y logró mayor neoformación ósea y consolidación en el grupo IV (75%), tratado con plasma rico en plaquetas que en el grupo III (25%) sin plasma rico en plaquetas, en el aloinjerto óseo.
Las principales limitaciones de este estudio fueron el tamaño de los grupos estudiados (debido a la alta tasa de mortalidad) que puede sesgar nuestros resultados, y no haber inmovilizado los miembros en el posoperatorio.
En 1965, Marshall R. Urist identificó una proteína capaz de inducir la formación de hueso, que fue llamada proteína ósea morfogenética o BMP, abriendo el camino para una serie de investigaciones que arrojaron como resultado un mejor entendimiento del proceso de la reparación ósea y de los múltiples factores que intervienen en él.12
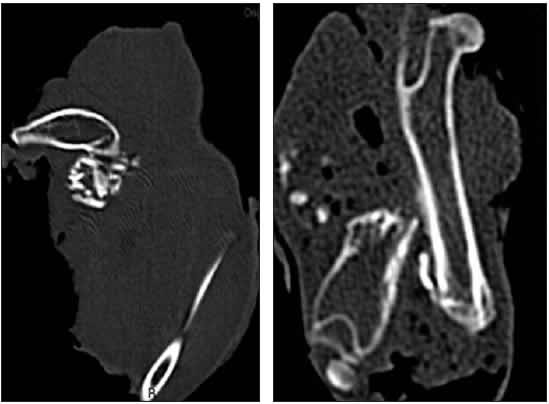
Figura 3. Tomografía computarizada del fémur del ejemplar 12 a los 60 y 90 días. No hay consolidación de la fractura; conservación parcial del injerto de hueso.
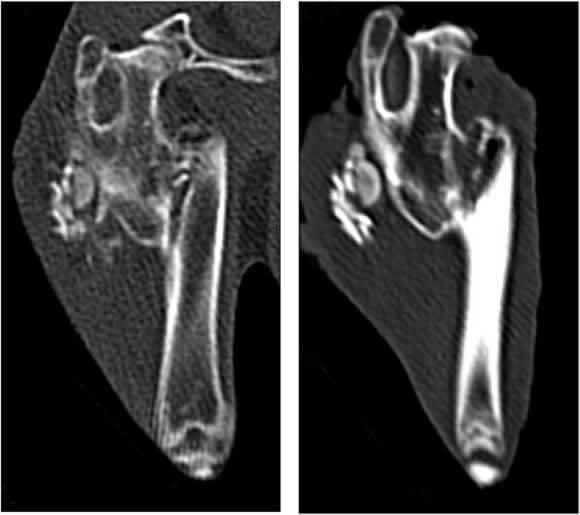
Figura 4. Tomografía computarizada del fémur del ejemplar 17 a los 60 y 90 días. Consolidación de la fractura y conservación del injerto de hueso.
En 1989, Gibble y Niss describen que el plasma concentrado de plaquetas combinado con fibrina y calcio es capaz de formar rápidamente un gel viscoso, que mejora la incorporación de tejidos e implantes en cirugía maxilofacial. Esto abrió la puerta para investigar la presencia de factores de crecimiento que se encuentran, en su gran mayoría, en las plaquetas del organismo.13 El plasma rico en plaquetas puede no ser un complemento apropiado para la matriz ósea desmineralizada en algunas aplicaciones clínicas, ya que disminuiría la formación de hueso.14 Harris y cols. evaluaron el efecto del plasma rico en plaquetas en tejidos sanos de conejos, y llegaron a la conclusión de que este tratamiento estimula el infiltrado celular inflamatorio a partir de linfocitos y monocitos en todos los tejidos en que se realizó la práctica; esto daría comienzo a una cascada de eventos fisiológicos para generación de nuevos tejidos.15
La cirugía traumatológica requiere el uso regular de injertos óseos para contribuir al tratamiento o la curación de las lesiones esqueléticas; el injerto autólogo de cresta ilíaca continúa siendo el patrón de referencia para dichos procedimientos. La morbilidad relacionada con la obtención del injerto, así como su poca disponibilidad (no suele ser suficiente para rellenar defectos segmentarios o de tamaño importante), han promovido la búsqueda de otras alternativas.4 Entre las ventajas del injerto autólogo encontramos la completa histocompatibilidad sin posibilidad de transmitir enfermedades, mayor osteointegración y menor tiempo de fusión; mientras que sus principales desventajas son la cantidad limitada de tejido óseo, el dolor, el riesgo de hematomas, daño neurovascular y fracturas pelvianas.16 El aloinjerto óseo fresco congelado representa una opción de reconstrucción en defectos óseos en los que el autoinjerto no es suficiente o su uso no es posible, ya que evita la morbilidad del sitio donante, es abundante y se lo puede utilizar retirándolo de los depósitos, disminuye la estadía hospitalaria y el tiempo de cirugía; pero el uso de estos aloinjertos no está exento de complicaciones, puede asociarse a problemas, como transmisión de infecciones y enfermedades, y tiene una menor y más lenta incorporación que el autoinjerto.5,17,18 Las fracturas expuestas se asocian a mayor riesgo de infección y complicaciones en la curación.19 Una adecuada concentración de antibiótico en hueso cuando se lo administra por vía sistémica requiere de altas dosis por un prolongado período de tiempo, lo que incrementa el riesgo de toxicidad y el costo del tratamiento.10,20 El injerto óseo esponjoso representa un sistema efectivo de entrega local de antibióticos para prevenir y combatir infecciones.10 Chan y cols. comprobaron que el uso de injerto óseo impregnado con antibiótico no parece provocar ningún efecto adverso en la incorporación del injerto y, además, ayuda a curar la infección.21 Bagliardelli y cols. demostraron experimentalmente en conejos que, cuando se decide hacer la reconstrucción en fracturas infectadas, en un tiempo quirúrgico, la asociación de antibiótico al aloinjerto de hueso ayuda a prevenir la infección.8
Conclusiones
En fracturas infectadas y con pérdida del stock óseo, primero, se debe realizar un desbridamiento quirúrgico amplio con escisión de los tejidos necróticos, avasculares e infectados.
Cuando hay una pérdida de stock óseo significativa en estas lesiones, y el uso de autoinjerto óseo no es posible o suficiente para rellenar el defecto, el empleo de aloinjerto crioconservado molido con el agregado de antibióticos y plasma rico en plaquetas ayuda a curar la infección y a incrementar la tasa de consolidación.
En nuestro trabajo, encontramos una correlación entre los resultados histológicos y tomográficos, tanto respecto a la actividad osteoclástica y la disminución del injerto observado, respectivamente, como así también respecto a la formación de callo y los signos de consolidación entre los dos métodos de evaluación; a pesar de que no hallamos diferencias estadísticamente significativas.
1. Metha S, Watson JT. Plateletrich concentrate: basic science and current clinical applications. J Orthop Trauma 2008;22:433-8. [ Links ]
2. Rio M, Gotter Campo G, Barrera Oro A, Sanatini Araujo E, Cabrini R. Reparación tendinosa con la utilización de plasma rico en plaquetas. Estudio experimental en conejos. Rev Asoc Argent Ortop Traumatol 2007;72(3):270-5. [ Links ]
3. Larrabe L. Plasma rico en plaquetas en cirugía de ortopedia y traumatología. Rev Argent Artroscopia 2007;14(2):145-51.
4. De Long WG Jr, Einhorn TA, Koval K, McKee M, Smith W, Sanders R. et al. Bone grafts and bone graft substitutes in orthopaedic trauma surgery. A critical analysis. J Bone Joint Surg Am 2007;89(3):649-58. [ Links ]
5. Aurori BF, Weierman RJ, Lowell HA, Nadel CI, Parsons JR. Pseudoarthrosis after spinal fusion for scoliosis: A comparison of autogenic and allogenic bone graft. Clin Orthop 1985;99:153-8.
6. Winkler H. Rationale for one stage exchange of infected hip replacement using uncemented implants and antibiotics impregnated bone graft. Int J Med Sci 2009;6(5):247-52. [ Links ]
7. López Millán L, Aponte Tinao L, Farfalli G, Ayersa MA, Muscolo L. Reconstrucción de defectos segmentarios del fémur con aloinjerto óseo intercalar. Rev Asoc Argent Ortop Traumatol 2011;76(4):309-15.
8. Bagliardelli J, Díaz Gallardo P, Flores J, Bustos D, Bruno P, Allende C. Valor de la utilización de espaciadores de cemento y aloinjerto con antibiótico para reconstruir defectos óseos infectados. Estudio experimental en conejos. Rev Asoc Argent Ortop Traumatol 2011;76(2):133-40.
9. Kesteris U, Aspenberg P. Rinsing morcellised bone grafts with bisphosphonate solution prevents their resorption. J Bone Joint Surg Br 2006;88:993-6. [ Links ]
10. Allende C, Mangupli M, Bagliardelli J, Diaz P, Allende BT. Infected nonunions of long bones of the upper extremity: staged reconstruction using polimethylmethacrylate and bone graft impregnated with antibiotics. Chir Organi Mov 2009;93(3):137-42.
11. Cid Casteulani A. Enriquecimiento de injerto autólogo con concentrado de factores de crecimiento. Rev Asoc Argent Ortop Traumatol 2007;72(4):373-81. [ Links ]
12. Radice FD, Yánez RD, Gutiérrez VB, Pinedo MB, Rosales J, Coda S. Uso de concentrado autólogo rico en factores de crecimiento en la reconstrucción del LCA. Rev Argent Artroscopia 2007;15(1):31-40.
13. Alsousou J, Thompson M, Hulley P, Noble A, Willett K. The biology of plateledrich plasma and its applications in trauma and orthopaedic surgery. J Bone Joint Surg Br 2009;91:987-95. [ Links ]
14. Ranly D, Lohmann CH, Andreacchio D, Boyan BD, Schwartz Z. Platelet-rich plasma inhibits demineralized bone matrix-induced bone formation in nude mice. J Bone Joint Surg Am 2007;89:139-47. [ Links ]
15. Harris NL, Huffer WE, Von Stade E, Larson AI, Phinney S, Purnell ML. The effect of platelet-rich plasma on normal soft tissues in the rabbit. J Bone Joint Surg Am 2012;94:786-93.
16. Sasso RC, LeHuec JC, Shaffrey C. Iliac crest bone graft donor site pain after anterior lumbar interbody fusion: a prospective patient satisfaction outcome assessment. J Spinal Disord Tech 2005;18(Suppl.):S77-81. [ Links ]
17. Fernyhough JC. Lumbar spine fusion: Comparing crushed, freeze-dried cortical allograft with autograft. Meeting International Society for Study of the Lumbar Spine. Marseille, France, 1993.
18. Herron LD, Newman MH. The failure of ethylene oxide gas-sterilized freeze-dried bone graft for thoracic and lumbar spinal fusion. Spine 1989;14(5):496-500. [ Links ]
19. Zalavras CG, Marcus RE, Levin LS, Patzakis MJ. Management of open fractures and subsequent complications. J Bone Joint Surg 2007;89:884-95.
20. Hanssen A. Local antibiotic delivery vehicles in the treatment of musculoskeletal infection. Clin Orthop Relat Res 2005;437:91-6. [ Links ]
21. Chan YS, Ueng SW, Wang CJ, Lee SS, Chen CY, Shin CH. Antibiotic-impregnated autogenic cancellous bone grafting is an effective and safe method for the management of small infected tibial defects: a comparison study. J Trauma 2000;48(2):246-55. [ Links ]














