Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista agronómica del noroeste argentino
Print version ISSN 0080-2069On-line version ISSN 2314-369X
Rev. agron. noroeste arg. vol.36 no.2 San Miguel de Tucumán Dec. 2016
ARTÍCULO CIENTÍFICO
Efectos de la inoculación con bacterias solubilizadoras de fosfato en tabaco (Nicotiana tabacum L.) y pimiento (Capsicum annuum L.) en condiciones controladas
Effects of inoculation with phosphate solubilizing bacteria on tobacco (Nicotiana tabacum L.) and pepper (Capsicum annuum L.) under controlled conditions
N.I. Buono; E.L.Ulla*
Cátedra Microbiología Agrícola, Facultad de Agronomía y Zootecnia, Universidad Nacional de Tucumán. Avda. Kirchner 1900, (4000), San Miguel de Tucumán, Tucumán, Argentina. E-mail: elsaulla@hotmail.com
Resumen
Las rizobacterias promotoras de crecimiento vegetal (PGPR) benefician el desarrollo de las plantas a través de mecanismos como la producción de fitohormonas, el antagonismo contra fitopatógenos por producción de sideróforos y la solubilización de fosfato mineral. Las bacterias solubilizadoras de fosfato constituyen un grupo importante de PGPR, son capaces de adaptarse y colonizar la rizósfera y de favorecer su desarrollo por medio de la solubilización de compuestos como fosfato tricálcico y rocas fosfóricas. La biotecnología permitió el uso de microorganismos como alternativas en la producción de cultivos de importancia económica. El objetivo de este trabajo fue estudiar el efecto de la inoculación con bacterias solubilizadoras de fosfato en tabaco y pimiento en condiciones controladas. Se emplearon bacterias caracterizadas como Bacillus amyloliquefaciens, Pseudomonas fluorescens y Pseudomonas sp. Se determinó la eficiencia de solubilización de fosfato tricálcico en medio sólido y líquido. Se comprobó la solubilización de otros fosfatos y producción de sideróforos. Se inocularon plantines de tabaco y pimiento y posteriormente se los incubó en cámara de cultivo durante 45 días. Se midió el peso seco, la cantidad de fósforo de la parte aérea y la longitud de las raíces. Los tratamientos con P. fluorescens, Pseudomonas sp. y B. amyloliquefaciens promovieron el crecimeinto de la parte aérea en pimiento, mientras que en tabaco esto se logró en el tratamiento con B. amyloliquefaciens. El tratamiento con P. fluorescens estimuló el crecimiento radicular e incrementó el contenido de fósforo foliar en ambos cultivos. Los resultados sugieren que estas bacterias podrían emplearse como alternativa biotecnológica en la producción de tabaco y pimiento.
Palabras clave: Bacillus; Pseudomonas; Solubilización de fosfato; Promoción de crecimiento.
Abstract
The promoting growth plant rhizobacteria (PGPR) benefits the development of plants throughout the production of phytohormones, antagonism against plant pathogens by siderophores production and mineral phosphate solubilization. Phosphate solubilizing bacteria form a very important group of PGPR that are able to adapt, colonize and exist in the rhizosphere and encourage their growth by means of the inorganic phosphate solubilization of different compounds. The development of biotechnology has allowed the use of microorganisms as a valid alternative in the production process of economically important crops. The aim of this work was to study the effect of phosphate solubilizing bacteria inoculation in tobacco and pepper under controlled conditions. Three bacteria characterized as Bacillus amyloliquefaciens, Pseudomonas fluorescens and Pseudomonas sp. were used. The solubilization efficiency was calculated in solid and liquid media. Also other phosphate solubilization and siderophores production were determined. Tobacco and pepper plants were inoculated and placed in a growth chamber with controlled temperature and photoperiod during 45 days. Dry weight and phosphorus in leaves and root length was measured. The treatment with P. fluorescens, Pseudomonas sp. and B. amyloliquefaciens promoted plant growth in pepper while in tobacco this occurred in the treatment with B. amyloliquefaciens. The treatment with P. fluorescens promoted root growth and increased phosphorus content in the leaves in both crops. Results suggest that these bacteria have the potential to be used as a biotechnological alternative in the production of tobacco and pepper.
Keywords: Bacillus; Pseudomonas; Phosphate solubilization; Plant growth.
Recibido 03/08/16; Aceptado 18/11/16.
Los autores declaran no tener conflicto de intereses.
Introducción
En la rizósfera, zona de suelo influenciada por el sistema radicular, los microorganismos interactúan en forma simultánea y/o independiente, en sinergia y/o antagonismo con resultados benéficos y/o perjudiciales para las plantas (Manoharachary y Singh, 2006). Las rizobacterias promotoras de crecimiento (PGPR) benefician el crecimiento y desarrollo de las plantas a través de mecanismos que comprenden la producción de fitohormonas como el ácido indol acético, ácido giberélico, citoquininas y etileno (Glick, 1995); la fijación biológica de nitrógeno (Boddey y Döbereiner, 1995); el antagonismo contra microorganismos fitopatógenos por producción de sideróforos (Scher y Baker, 1982) y la solubilización de fosfato mineral y otros nutrientes (De Freitas et al., 1997). Los microorganismos solubilizadores de fosfato constituyen un grupo importante de PGPR, pues están involucrados en un amplio rango de procesos que afectan la transformación del fósforo, siendo componentes integrales del ciclo edáfico de este nutriente (Fankem et al., 2006).
Las bacterias solubilizadoras de fosfatos (BSF) pueden ser de vida libre en el suelo o establecer relaciones simbióticas con algunas plantas, son capaces de adaptarse, colonizar y persistir en la rizósfera y favorecer su desarrollo por medio de la solubilización de fosfato inorgánico de diferentes compuestos como son el fosfato tricálcico y rocas fosfóricas (Patiño, 2010). La mayoría pueden solubilizar complejos de fosfato de calcio y sólo algunas pueden solubilizar fosfato de aluminio o hierro (Guang-Can et al., 2008). Dentro de las BSF se encuentran los géneros Achromobacter, Aerobacter, Agrobacterium, Azotobacter, Azospirillum, Bacillus, Pseudomonas, Burkholderia y Rhizobium, entre otros (Paredes y Espinosa, 2010; Aguado-Santacruz, 2012).
Numerosos investigadores han demostrado el potencial biotecnológico de la aplicación de microorganismos solubilizadores de fosfatos sobre la promoción de crecimiento. Pandey et al. (2006) en maíz en invernadero; Banerjee et al. (2010) en arroz; Villegas et al. (2010) en Prosopis chilensis y Alvarado et al. (2011) en tomate.
Sánchez López et al. (2014) trabajaron con Lactuca sativa y encontraron que las plantas inoculadas con Pseudomonas fluorescens y Pseudomonas sp. presentaron mayor biomasa en su parte aérea respecto al testigo que recibió un fertilizante químico. Oliviera et al. (2008) aislaron, seleccionaron y evaluaron la actividad solubilizadora de microorganismos en la rizósfera de maíz de suelos brasileros e identificaron los géneros Bacillus y Burkholderia sp., como mejores bacterias; asimismo, encontraron un nuevo género de actinomicete solubilizador de fosfato, Kitasatospora y, Aspergillus terreus como mejor hongo solubilizador.
En Argentina, estudios realizados en La Pampa en rizósfera de alfalfa, obtuvieron nueve aislamientos de bacterias solubilizadoras de fósforo que fueron caracterizados fenotípica y metabólicamente, comprobándose su efecto promotor de crecimiento (Grassano et al., 2003). Sobero y Rojo et al. (2011) demostraron que la cepa de Bacillus subtilis P6C1 es capaz de promover el crecimiento de plantines de frutilla. En Tucumán, se aislaron y caracterizaron bacterias solubilizadoras de fosfatos de la rizósfera de diferentes cultivos y suelos (Brandán de Weht et al., 2013; Rodríguez et al., 2014) y se demostró su incidencia en la promoción de crecimiento en batata y en maíz (Peralta et al., 2014; García et al., 2015).
Los antecedentes demuestran que el desarrollo de la biotecnología ha permitido el uso de microorganismos como alternativa válida en el proceso de producción de cultivos de importancia económica por lo que resulta interesante analizar diferentes cultivos. Entre ellos, se encuentran el tabaco y el pimiento. Estos cultivos son promotores del desarrollo socio económico debido a la demanda de mano de obra que generan.
En Argentina se cultivan 90.000 ha de tabaco (Nicotiana tabacum L.) y se producen más de 150 millones de kilos en las provincias de Jujuy, Salta, Tucumán, Chaco, Catamarca, Misiones y Corrientes. El sistema de manejo utilizado durante décadas incluye una alta tasa de uso de agroquímicos, monocultivo y la labranza convencional. Esto causó el deterioro físico y la pérdida de fertilidad química de los suelos, lo cual se tradujo en una disminución en producción y calidad (Balari, 2005). Una alternativa ecológica para aumentar la disponibilidad de nutrientes en el suelo la constituyen los microorganismos y en los últimos años se ha prestado especial atención a la investigación para su potencial uso como biofertilizantes. Pérez Brandán et al. (2005) estudiaron el efecto de un producto comercial mixto y de uno simple a base de microorganismos solubilizadores de fosfato en un sistema de plantación directa y concluyeron que el inóculo simple fue el más eficiente en los parámetros de crecimiento analizados. González et al. (2010) demostraron que con la inoculación con Azotobacter chroococcum y la co-inoculación de éste con Bacillus megatherium var. phosphaticum se mejoraron la longitud y el diámetro del tallo, la relación masa fresca/masa seca, el área foliar y la clorofila de plántulas de tabaco. Pernasetti y Di Barbaro (2012) demostraron que el efecto de la inoculación con Azospirillum puede dar como resultado un cambio significativo en varios parámetros de crecimiento, los cuales pueden afectar o no los rendimientos.
Por su parte, el pimiento (Capsicum annuum L.) tiene una gran demanda en el mercado internacional y su éxito radica en que es un cultivo con tres destinos de consumo: en fresco, para pimentón y para conserva. Entre las condiciones que se requieren para elevar la producción y el rendimiento de este cultivo se encuentra el uso de plántulas vigorosas y con un alto porcentaje de germinación (Molina y Pacheco, 2011), lo que podría conseguirse inoculando semillas con rizobacterias que promueven el crecimiento y desarrollo de las plántulas (Vessey, 2003). Di Barbaro et al. (2005) informan que la inoculación con rizobacterias en semillas podría beneficiar a la planta desde la germinación hasta su desarrollo posterior. Han et al. (2006) demostraron que la aplicación de Bacillus megaterium var. phosphaticum junto con roca fosfórica produjo incrementos en parámetros de crecimiento y rendimiento en cultivos de ají y pepino, tanto en invernadero como en campo. Carletti et al. (2011) demostraron que la inoculación con Azospirillum brasilense empleando una mezcla de varias cepas produjo un aumento significativo del peso fresco de la raíz y el peso total de la planta. Datta et al. (2011) aislaron 15 bacterias y evaluaron el efecto de su inoculación en plántulas, demostrando que Bacillus sp. y Streptomyces sp. incrementaron altura y peso de la planta, número y peso de frutos y número de semillas por fruto. Shigueru-Okumura et al. (2013) sostienen que la aplicación de inoculantes líquidos directamente en las semillas promueve cambios bioquímicos, fisiológicos y morfológicos en la célula vegetal e incrementa el potencial de crecimiento de las plantas. Morales Guzmán (2013) inoculó plantines con un formulado comercial de Bacillus sp., concluyendo que con la aplicación de estas bacterias se obtienen beneficios en producción, rendimiento y calidad.
Considerando que los microorganismos solubilizadores de fosfatos mejoran la nutrición y el desarrollo vegetal, se propuso como objetivo general estudiar el efecto de la inoculación con bacterias solubilizadoras de fosfato en plantines de tabaco y pimiento en condiciones controladas. Como objetivos específicos se plantearon: (1) determinar la eficiencia de solubilización y cuantificar la solubilización de fosfato tricálcico de las bacterias utilizadas; (2) comprobar la solubilización de otros fosfatos y la capacidad para producir sideróforos; (3) evaluar la capacidad para estimular el crecimiento vegetal en condiciones controladas.
Materiales y métodos
Se trabajó con dos aislamientos que fueron caracterizados como Bacillus amyloliquefaciens y Pseudomonas sp. (García et al., 2015) y un producto comercial de Pseudomonas fluorescens. Con el propósito de encontrar la fase exponencial de crecimiento para la producción de un inóculo óptimo, se realizaron las curvas de crecimiento y se ajustaron las DO (densidad óptica) a 590 nm, 0,9 para B. amyloliquefaciens; 0,8 para Pseudomonas sp. y 0,6 para P. fluorescens, que corresponden a un número entre 107 y 108 UFC/ml (UFC = unidades formadoras de colonias).
Eficiencia y cuantificación de la solubilización de fosfato tricálcico
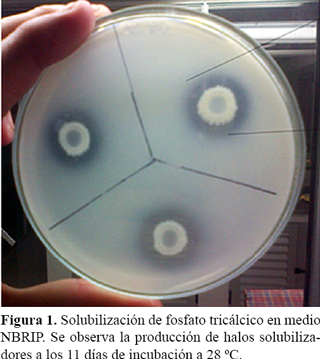
La eficiencia de solubilización (ES) de fosfato tricálcico se determinó según el protocolo desarrollado por El-Komy (2005). Se sembraron 5 µl de cada suspensión bacteriana, por triplicado, en medio de cultivo NBRIP (Nautiyal, 1999). Se incubaron a 28 ºC durante 11 días hasta la aparición de halos transparentes alrededor de la zona de crecimiento indicando la solubilización del fosfato. Se midió el diámetro de cada colonia y de cada halo, en tres direcciones; se promediaron los valores y se determinó la eficiencia de solubilización, utilizando la fórmula ES = diámetro del halo/diámetro de la colonia x 100. Para cuantificar la solubilización, se tomaron 10 ml de cada suspensión y se inocularon erlenmeyers con 100 ml de medio NBRIP líquido. Se incubaron por 8 días a 28 °C con agitación. Se tomaron muestras a los 1, 3, 6 y 8 días, se filtraron y en el filtrado se determinó el fósforo soluble por el método del azul fosfomolibdato (Murphy y Riley, 1962).
Solubilización de otros fosfatos
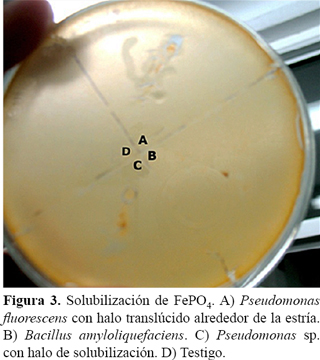
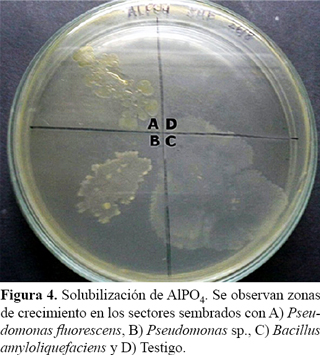
Para verificar la solubilización de fosfato de aluminio se utilizó un medio base con 10 g de manitol, 2 g de extracto de levadura, 6 g de fosfato bipotásico y 18 g de agar por litro, con el agregado de 5,34 g de cloruro de aluminio (esterilizado por separado), para formar el precipitado de fosfato de aluminio. Para comprobar la solubilización de fosfato de hierro se utilizó el mismo medio base más el agregado de 5,34 g de cloruro de hierro (esterilizado por separado), para formar el precipitado de fosfato de hierro (Dos Santos Hara y de Oliveira, 2005). Para cada determinación se sembraron los medios con un volumen de suspensión bacteriana como se describió previamente.
Capacidad para producir sideróforos
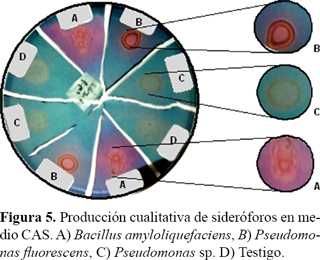
Se utilizó la técnica universal del Cromo Azurol Sulfonato (CAS) en medio sólido (Schwyn y Neilands, 1987). Las bacterias se cultivaron en medio líquido libre de hierro, se centrifugaron, se lavaron tres veces con agua destilada estéril y se sembraron 10 µl en las cajas que contenían el medio de cultivo sólido con la solución CAS. Se incubaron a 28 ºC.
Determinación de la promoción del crecimiento vegetal en condiciones controladas
Tabaco. Se utilizaron plantines de tabaco tipo Virginia de 60 días, que fueron inoculados por inmersión de raíces en las suspensiones bacterianas durante 30 minutos. Las bacterias se hicieron crecer en medio TSC (Tripteína soja caldo), con agitación. Se centrifugaron, se lavaron con agua destilada estéril y se resuspendieron en agua destilada estéril hasta obtener las DO correspondientes a 108 UFC/ml. Los plantines inoculados se colocaron en macetas con una mezcla 2:1 de suelo y arena, se llevaron a cámara de cría a 28 ºC con un fotoperiodo de 14 h de luz durante 45 días.
Se empleó un diseño experimental completamente aleatorizado que contó con 4 tratamientos y 5 repeticiones por tratamiento. Los tratamientos analizados fueron: T1: inoculado con Bacillus amyloliquefaciens; T2: inoculado con Pseudomonas fluorescens; T3: inoculado con Pseudomonas sp. y T4: Testigo inoculado con agua destilada estéril.
Pimiento. Se utilizaron plantines Trompa de Elefante de 30 días que se trasplantaron a macetas con una mezcla de suelo y arena 2:1. Los inóculos se prepararon de igual forma que para tabaco y la inoculación se realizó colocando un volumen determinado (5 ml y 10 ml) de suspensión bacteriana sobre la base del tallo. Las macetas se llevaron a cámara de cría durante 45 días a 28 °C y con fotoperiodo de 14 hs de luz.
Se empleó un diseño experimental completamente aleatorizado que contó con 5 tratamientos y 5 repeticiones por tratamiento. Los tratamientos analizados fueron: T1: 5 ml de Bacillus amyloliquefaciens; T2: 10 ml de Bacillus amyloliquefaciens;T3: 5 ml de Pseudomonas fluorescens;T4: 10 ml de Pseudomonas fluorescens y T5: testigo con agua destilada estéril.
Variables analizadas
En ambos cultivos, tabaco y pimiento, las variables analizadas fueron: peso seco de la parte aérea por secado en estufa a 60 ºC hasta peso constante; porcentaje de fósforo foliar, realizado en un laboratorio privado, a partir de una muestra compuesta con la totalidad de las hojas para cada tratamiento y longitud de las raíces por el método de intersección de líneas de Newman (1965).
Análisis de los datos
Los resultados se analizaron mediante un análisis de la varianza seguido de la prueba LSD de Fisher para detectar diferencias entre medias para los distintos tratamientos. Se trabajó con un nivel de significación del 5 % y se utilizó el paquete estadístico Infostat (Di Rienzo et al., 2013).
Resultados y discusión
Eficiencia y cuantificación de la solubilización de fosfato tricálcico
En los tres casos se logró la solubilización de las bacterias (Figura 1) y P. fluorescens presentó la mayor eficiencia de solubilización (Tabla 1). Estos resultados concuerdan con los encontrados por El Komy (2005) quien obtuvo valores similares de ES, 350 para P. fluorescens y 185 para Bacillus megaterium.
Los resultados de la cuantificación de fosfato tricálcico en medio NBRIP líquido mostró que P. fluorescens solubilizó mayor cantidad de fosfatos comparado con las demás bacterias en todos los tiempos analizados (Figura 2), presentando un máximo de solubilización de 405,3 mg/l a los seis días de incubación.
Bacillus amyloliquefaciens y Pseudomonas sp. presentaron un máximo de 166,3 y de 85,2 mg/l respectivamente a los ocho días de incubación, momento en que P. fluorescens comienza a decrecer probablemente por una disminución del pH y la desaparición del fosfato. Hussain et al. (2013) obtuvieron resultados de 523 y 733 mg/l para 2 cepas de Pseudomonas y 611 mg/l para Bacillus sp. Por el contrario, Sánchez López (2012) obtuvo 133 mg/l para Pseudomonas y Bacillus utilizando un medio de cultivo suplementado con roca fosfórica. Esta diferencia podría deberse a que la roca fosfórica es más difícil de solubilizar.
Solubilización de fosfatos de hierro y aluminio
Pseudomonas fluorescens y Pseudomonas sp. presentaron zona de crecimiento y halo de solubilización de hierro mientras que B. amyloliquefaciens no fue capaz de crecer en el medio evaluado (Figura 3).
En el medio con fosfato de aluminio las tres especies bacterianas mostraron zona de crecimiento sin formación de halo (Figura 4). Bashan et al. (2012) sostienen que para que una bacteria sea considerada como solubilizadora de fosfatos, además de fosfato tricálcico, debe solubilizar fosfato de hierro y/o de aluminio. Con este resultado, se podría inferir que solamente las dos Pseudomonas son solubilizadoras de fosfatos. Sin embargo debe prestarse atención a la presencia de crecimiento por parte de las bacterias en el medio suplementado con fosfato de aluminio; ello indicaría que fue asimilado por los microorganismos.
Producción de sideróforos
La producción de sideróforos evaluada con la técnica universal del Cromo Azurol Sulfonato, se aprecia en la Figura 5.
Pseudomonas fluorescens y B. amyloliquefaciens muestran esa capacidad, no así Pseudomonas sp. Cuando el complejo CAS-Fe se disocia se genera un cambio en la coloración del medio de cultivo de azul a naranja o púrpura dependiendo el tipo de sideróforos. Estos resultados concuerdan con los obtenidos por Parani y Saha (2012) y Mamta et al. (2012) que demostraron la capacidad de producción de sideróforos, por especies del género Pseudomonas. Wani et al. (2007) reportaron que cepas de Bacillus sp. aisladas de suelos de cultivos de mostaza y tomate, también produjeron sideróforos.
Promoción del crecimiento
Tabaco. Los valores de peso seco de la parte aérea, fósforo foliar y longitud de raíz, así como los resultados de los análisis de la varianza, se muestran en la Tabla 2. Para peso seco de la parte aérea, el tratamiento 1 (B. amyloliquefaciens) mostró diferencias significativas respecto del testigo, indicando un efecto positivo de la práctica de la inoculación. Estos resultados se corresponden con los obtenidos por González et al. (2010) en tabaco inoculado con Azotobacter chroococcum y Bacillus megatherium var. Phosphaticum. Por otro lado, tanto Supanjani et al., (2006) como Han et al. (2006), encontraron que la aplicación de Bacillus megaterium var. phosphaticum junto con roca fosfórica produjo incrementos en parámetros de crecimiento y rendimiento en cultivos de ají y pepino en condiciones de invernadero y campo. El aumento de masa seca mediado por bacterias, es comúnmente reportado como una respuesta a la inoculación en numerosos cultivos (Sánchez López et al., 2014). En cuanto a la concentración de fósforo en el follaje, todos los tratamientos generaron valores considerados normales para el cultivo. Los resultados muestran un aumento en el porcentaje de fósforo en el tratamiento con P. fluorescens, debido probablemente a la mayor superficie de exploración radicular que presentan las plantas inoculadas con esta bacteria. Estos resultados concuerdan con los obtenidos por Sánchez López et al. (2014) que demostraron que el contenido de fósforo foliar en lechuga aumenta al ser inoculadas con P. fluorescens. Con relación a la longitud de raíces, las plantas inoculadas con P. fluorescens presentaron raíces más largas que el testigo. Resultados semejantes fueron encontrados por Rives et al. (2010) quienes demostraron el aumento de la longitud de raíces en arroz inoculado con dos cepas de P. putida. Por otra parte, Villegas et al.(2010) señalaron el incremento de la longitud radicular de Prosopis chilensis inoculado con Azospirillum halopraeferens y B. amyloliquefaciens en condiciones de salinidad.
Pimiento. El peso seco de todos los tratamientos inoculados (Tabla 3), mostraron diferencias significativas con respecto al control. Estos resultados concuerdan con los de Di Barbaro et al. (2005); Shigueru-Okumura et al. (2013) y Morales Guzmán (2013). En ese sentido, Díaz Vargas et al. (2001), inocularon lechuga con 5 ml de suspensión de 30 cepas bacterianas y obtuvieron resultados promisorios en área foliar, peso fresco y seco. Por su parte, Kang et al. (2007) y Datta et al. (2011) observaron incrementos en el peso de plantas de pimiento inoculadas con bacterias promotoras del crecimiento vegetal y López Bucio et al. (2006) inocularon plantas de Phaseolus vulgaris y Arabidopsis thalian con B. megaterium y demostraron el aumento significativo de peso fresco y seco de las plantas. La concentración de fósforo en el follaje (Tabla 3), presentó valores adecuados en todos los tratamientos, que de acuerdo a Casas Castro y Casas Barba (1999), oscilan entre 0,3 % y 0,8 %. El mejor resultado lo presenta P. fluorescens (5 ml) con 0,75 % frente a 0,67 % del control sin inocular. El efecto de la inoculación sobre la longitud de raíces se muestra en la Tabla 3. En el presente ensayo, solo T3 (P. fluorescens 5 ml) muestra diferencias significativas con el control sin inocular, resultado que concuerda con Manikandan et al. (2010) quienes demostraron que la inoculación con P. fluorescens en tomate, produjo incrementos en: longitud de raíz, parte aérea, altura de planta y rendimiento en condiciones de invernáculo y campo. En otros cultivos como trigo, también se han registrado aumentos en la longitud y peso seco, tanto en raíz como en parte aérea (Minaxi, 2010). En diversos estudios se ha encontrado que las bacterias del género Pseudomonas presentan la propiedad de inducir la iniciación radicular e incrementar la formación de raíces y pelos radiculares. Por otra parte, Kang et al. (2007) demostraron el aumento de biomasa de raíz en pimiento inoculados con Pseudomonas rhodesiae y Pantoea ananatis.
Conclusiones
Las tres bacterias estudiadas tuvieron efectos benéficos en los cultivos de tabaco y pimiento. Pseudomonas fluorescens, Pseudomonas sp. y B. amyloliquefaciens incrementaron el peso seco en pimiento, mientras que en tabaco esto se logró con B. amyloliquefaciens. A su vez, P. fluorescens estimuló la longitud radicular y el contenido de fósforo foliar en ambos cultivos. Los resultados aportados aquí, sugieren que estas bacterias poseen potencial para emplearse como alternativa biotecnológica en la producción de tabaco y pimiento.
Agradecimientos
Este trabajo fue financiado por el Programa PIUNT 26 A 526. Se agradece a Finca La Caravana, provincia de Jujuy por la provisión de los plantines de tabaco y a Hortícola del NOA, provincia de Tucumán por la provisión de plantines de pimiento.
Referencias bibliográficas
1. Aguado-Santacruz G.A. (2012). Uso de microorganismos como biofertilizantes. En: Introducción al uso y manejo de los biofertilizantes en la agricultura. Aguado-Santacruz G.A. (Ed.). INIFAP/SAGARPA. México. Pp. 35-78. [ Links ]
2. Alvarado P., Brutti L., Rojas T., Martín A. (2011). Producción industrial de plantines de tomate en sustratos inoculados con rizobacterias promotoras de crecimiento. XXXIV Congreso Argentino de Horticultura. 27-30 de septiembre. Buenos Aires, Argentina. P. 456. [ Links ]
3. Balari M.H. (2005). Tabaco Virginia aspectos eco fisiológicos y de la nutrición en condiciones de cultivo. 1ra ed. Alejandro Granzani S.A. San Salvador de Jujuy, Jujuy, Argentina. [ Links ]
4. Banerjee S., Palit R., Sengupta C., Standing D. (2010). Stress induced phosphate solubilization by Arthrobacter sp. and Bacillus sp. isolated from tomato rhizosphere. Australian Journal of Crop Science 4 (6): 378-383. [ Links ]
5. Bashan Y., Kamnev A.A., de-Bashan L.E. (2012). Tricalcium phosphate is inappropriate as a universal selection factor for isolating and testing phosphate solubilizing bacteria that enhance plant growth: a proposal for an alternative procedure. Biology and Fertility Soils 49: 465-479. [ Links ]
6. Boddey R., Döbereiner J. (1995). Nitrogen fixation associated with grasses and cereals: Recent progress and perspectives for the future. Fertilizer Research 42: 241-250. [ Links ]
7. Brandán de Weht C.I., Amigo J.A., Ulla E.L. (2013). Interrelaciones microbianas en la rizósfera de plantas cultivadas de interés económico en el Noroeste Argentino. En Microbiología Agrícola: Un aporte de la investigación en Argentina. 2da. ed. Albanesi, A. Magna Publicaciones, Tucumán, Argentina. Pp. 215-236. [ Links ]
8. Carletti S., Vita F., Garbi M., Mezquiriz N., Rodríguez Cáceres E. (2011). Respuesta de especies hortícolas a la inoculación con Azospirillum brasilense. XXV Reunión Latinoamericana de Rizobiología. I Congreso Nacional de Microorganismos Promotores de Crecimiento Vegetal. 4-6 de septiembre, Piriápolis, Uruguay. Pp. 47-48. [ Links ]
9. Casas Castro A., Casas Barba E. (1999). Análisis de Suelo-Agua-Planta y su aplicación en la nutrición de cultivos hortícolas en la zona peninsular. Caja Rural de Almería, España. [ Links ]
10. Datta M., Palit R., Sengupta C., Kumar Pandit M., Banerjee S. (2011). Plant growth promoting rhizobacteria enhance growth and yield of chilli (Capsicum annuum L.) under field conditions. Australian Journal of Crop Science 5 (5): 531-536. [ Links ]
11. De Freitas J., Banerjee M., Germida J. (1997). Phosphate solubilizing rhizobacteria enhance the growth and yield but not phosphorus uptake of canola (Brasica napus L.). Biological Fertilizer Soils 24: 358-363. [ Links ]
12. Di Barbaro G., Pernasetti S., Stegmayer A. (2005). Evaluación del efecto de Azospirillum brasilense en la germinación y emergencia del pimiento pimentonero (Capsicum annum L. var. trompa de elefante). Revista del Centro de Investigaciones en Zonas Áridas y Semiáridas de la Facultad de Ciencias Agrarias, Universidad Nacional de Catamarca 6 (1-2): 74-85. [ Links ]
13. Díaz Vargas P., Ferreira R., Almaraz G. (2001). Inoculation of plant growth-promoting bacteria in lettuce. Terra 19: 327-335. [ Links ]
14. Di Rienzo J.A., Casanoves F., Balzarini M.G., González L., Tablada M., Robledo C.W. (2013). InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
15. Dos Santos Hara F.A., de Oliveira L.A. (2005). Características fisiológicas e ecológicas de isolados de rizóbios oriundos de solos ácidos de Iranduba, Amazonas. Pesquisa Agropecuária Brasileira 40 (7): 667-672. [ Links ]
16. El-Komy H.M.A. (2005). Co-inmobilization of Azospirillum lipoferum and Bacillus megaterium for successful phosphorus and nitrogen nutrition of wheat plants. Food Tecnology Biotechnology 43:19-27. [ Links ]
17. Fankem H., Nwaga D., Deubel A., Dieng L., Merbach W., Etoa F.X. (2006). Occurrence and functioning of phosphate solubilizing microorganisms from oil palm tree (Elaeis guineensis) rhizosphere in Cameroon. African Journal of Biotechnology 5: 2450-2460. [ Links ]
18. García R.A., Lovaisa N.C., Ulla E.L. (2015). Aislamiento y caracterización de bacterias solubilizadoras de fosfatos del Noroeste Argentino y su efecto en la promoción de crecimiento en maíz (Zea mays L.). Revista Agronómica del Noroeste Argentino 35 (1): 19-28. [ Links ]
19. Glick B.R. (1995). The enhancement of plant growth by free- living bacteria.Canadian Journal of Microbiology 41: 109-117. [ Links ]
20. González Y.L., Martínez Viera R., Hernández Martínez J.M., Hernández Y.C. (2010). Efecto de la aplicación combinada de Azotobacter chroococcum y Bacillus megatherium var phosphaticum sobre las características morfológicas de plántulas de tabaco.Cuba Tabaco 11 (2): 10-16. [ Links ]
21. Grassano A., Ronchi A.L., García P., López M.L. (2003). Acción de bacterias solubilizadoras de fósforo sobre la simbiosis rizobio-leguminosa. IV Reunión Nacional Científico Técnica de Biología de Suelos y IV Encuentro sobre Fijación Biológica de Nitrógeno. 2-4 de julio, Las Termas de Río Hondo, Santiago del Estero, Argentina. [ Links ]
22. Guang-Can T., Shu-tun T., Miao-Ying C., Guang-hui T. (2008). Phosphate solubilizing and mineralizing abilities of bacteria isolated from soils. Pedosphere 18 (4): 515-523. [ Links ]
23. Han H. S., Supanjani S., Lee K. (2006). Effect of co-inoculation with phosphate and potassium solubilizing bacteria on mineral uptake and growth of pepper and cucumber. Plant Soil Environment 52 (3): 130-136. [ Links ]
24. Hussain I.M., Asghar N.H., Akhtar M.J., Arshad M. (2013). Impact of phosphate solubilizing bacteria on growth and yield of maize. Soil Science Society of Pakistan32 (1): 71-78. [ Links ]
25. Kang S.H., Hyun-Soo C., Hoon C., Choong-min R., Jihyun F.K., Seung-hwan P. (2007). Two bacterial entophytes eliciting both plant growth promotion and plant defense on pepper (Capsicum annuum L.). Journal of Microbiology and Biotechnology17 (1): 96-103. [ Links ]
26. López-Bucio J., Campos-Cuevas J.C., Hernández-Calderón E., Velásquez-Becerra C., Farías-Rodríguez R., Macías-Rodríguez L.I., Valencia-Cantero E. (2006).Bacillus megaterium rhizobacteria promote growth and alter root-system architecture through an auxin- and Eehylene-independent signaling mechanism in Arabidopsis thaliana. The American Phytopathological Society 20 (2): 207-217. [ Links ]
27. Mamta G., Shashi K., Arvind G., Bikram S., Rupinder T. (2012). Isolation and identification of phosphate solubilizing bacteria able to enhance the growth and aloin-A biosynthesis of Aloe barbadensis Miller. Microbiological Research 167: 358-363. [ Links ]
28. Manikandan R.D., Saravanakumar L., Rajendran T., Raguchander R., Samiyappan R. (2010). Standarization of liquid formulation of Pseudomonas fluorescens Pf1 for its efficacy against Fusarium wil of tomato. Biological Control 54: 83-89. [ Links ]
29. Manoharachary C., Singh J. (2006). Microbial activity in the Rhizosphere. Gopal Mukerji, K., Manoharachary, C., Singh, J. (Eds). Springer,Alemania. P.349. [ Links ]
30. Minaxi J.S. (2010). Efficacy of rizobacterial strains encapsulated in nontoxic biodegradable gel matrices to promote growth and yeld of weat plants. Applied Soil Ecology 48: 301-308. [ Links ]
31. Molina N.A., Pacheco R. (2011). Producción de pimiento con distintas alternativas de manejo y localización geográfica en la provincia de Corrientes. Publicación EEA Bella Vista. Serie Técnica Nº 44. [ Links ]
32. Morales Guzmán J. (2013). Evaluación de la producción y calidad de pimiento (Capsicum annuum L.) cv ´Cannon' obtenido mediante biofertilización. En:
http://www.remeri.org.mx/portal/REMERI.jsp?id=oai:ri.uaq.mx:123456789/1102, consulta: marzo 2015.
33. Murphy J., Riley H.P. (1962). A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta 27: 31-36. [ Links ]
34. Nautiyal, C.S. (1999). An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEM Microbiology Letters 170: 265-270. [ Links ]
35. Newman E.I. (1965). A method of estimating the total length of roots in a sample. Journal of Applied Ecology 2: 139-145. [ Links ]
36. Oliviera C., Alves V., Marriel I., Gómez E., Scotti M., Carneiro M., Guimaraes M., Schaffert R., Sa N. (2008). Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil Biology and Biochemistry 41: 1782-1787. [ Links ]
37. Pandey A., Trivedi P., Kumar B., Palni L. (2006). Characterization of a phosphate solubilizing and antagonistic strain of Pseudomonas putida (BO) isolated from a sub-Alpine location in the Indian Central Himalaya. Current Microbiology 53: 102-107. [ Links ]
38. Parani K., Saha B. (2012). Prospects of using phosphate solubilizing Pseudomonas as biofertilizer. European Journal of Biological Sciences 4 (2): 40-44. [ Links ]
39. Paredes M., Espinosa D. (2010). Ácidos orgánicos producidos por rizobacterias que solubilizan fosfatos: una revisión crítica. Terra Latinoamericana 28 (1): 61-70. [ Links ]
40. Patiño C. (2010). Solubilización de fosfatos por poblaciones bacterianas aisladas de un suelo del Valle del Cauca. Estudio de biodiversidad y eficiencia. Tesis Doctoral en Ciencias Agropecuarias - Manejo de Suelos y Aguas. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia sede Palmira, Colombia. [ Links ]
41. Peralta J.M., Ulla E.L., Zamudio N.M., Boroni R.H. (2014). Rizobacterias solubilizadoras de fosfatos inoculadas en dos cvs. de batata (Ipomoea batatas L.) Revista Agronómica del Noroeste Argentino34 (2): 169-171. [ Links ]
42. Pérez Brandán C., Altamirano F., Torres N., Arzeno J.L. (2005). Evaluación de inóculos para tabaco. V Reunión Nacional Científico Técnica de Biología del Suelo y V Encuentro sobre Fijación Biológica del Nitrógeno. 6-8 de julio. San Salvador de Jujuy. Argentina. P. 69. [ Links ]
43 .Pernasetti S., Di Barbaro G. (2012). Rizobacterias promotoras de crecimiento vegetal como biofertilizantes. Biología en Agronomía 2 (2): 5. [ Links ]
44. Rives N., García Y., Vega M., Díaz E., Arteaga Yanelis I., Hernández A. (2010). Efecto de dos cepas de pseudomonas putida en algunos parámetros del crecimiento de tres variedades comerciales de arroz (Oryza Sativa L.). XVII Congreso Científico del INCA. 22-26 noviembre, San José de las Lajas, Cuba. Pp. 22-26. [ Links ]
45. Rodríguez P.I., Peralta J.M., Buono N., Sandoval E., Ulla E.L. (2014). Aislamiento y caracterización de bacterias solubilizadoras de fosfatos de rizósfera de yacón (Smallanthus sonchifolius).Revista Agronómica del Noroeste Argentino34 (2): 50-51. [ Links ]
46. Sánchez López D.B., García Hoyos A.M., Romero Perdomo F.A., Bonilla Buitrago R.R. (2014). Efecto de rizobacterias promotoras de crecimiento vegetal solubilizadoras de fosfato en Lactuca sativa cultivar White Boston. Revista Colombiana de Biotecnología 16 (2): 122-128. [ Links ]
47. Sánchez López D.B. (2012). Efecto de la inoculación con bacterias promotoras de crecimiento vegetal sobre el cultivo de tomate bajo condiciones de invernadero. Revista Mexicana de Ciencias Agrícolas 3 (7): 1401-1415. [ Links ]
48. Scher F., Baker R. (1982). Effect of Pseudomonas putida and a synthetic iron chelator on induction of soil suppressiveness to Fusarium wilt pathogens. Phytopathology 72: 1570-1573. [ Links ]
49. Schwyn B., Neilands J. (1987). Universal Chemical assay for the detection and determination of siferophores. Analytical Biochemistry 160: 47-56. [ Links ]
50. Shigueru-Okumura R., De Cinque-Mariano D., Dallacort R., Nogueira-De Albuquerque A., Da Silva-Lobato A.K., Silva-Guedes E.M., De Oliveira-Neto C.F., Oliveira-Da Conceicao H.E., Ruffei-Alves G.A. (2013). Azospirillum: a new and efficient alternative to biological nitrogen fixation in grasses. Journal of Food Agriculture and Environment 11: 142-1146. [ Links ]
51. Sobero y Rojo M.P., Pozzo I., Rodríguez P., Lattanzio G., Carletti S. (2011). Evaluación de la capacidad promotora de crecimiento de cepas de rizobacterias aplicadas a plantines de frutilla en ensayos en maceta. Horticultura Argentina 30 (73): 78. [ Links ]
52. Supanjani H.S., Jung J.S., Lee K.D. (2006). Rock phosphate potassium and rock-solbullising bacteria as alternative sustainable fertilizers. Agronomy for Sustainable Development 26 (4): 233-240. [ Links ]
53. Vessey J.K. (2003). Plant growth promoting rhizobacteria as fertilizers. Plant and Soil 255: 571-586. [ Links ]
54. Villegas J.A., Rueda E.O., Murillo B., Puente M.E., Grimaldo O., Avilés S.M., Ponce J.F. (2010). Efecto de la inoculación de Azospirillum halopraeferens y Bacillus amyloliquefaciens en la germinación de Prosopis chilensis. Tropical and Subtropical Agroecosystems 12: 19-32. [ Links ]
55. Wani P., Khan M., Zaidi A. (2007). Chromium reduction, plant growth-promoting potentials and metal solubilization by Bacillus sp. isolated from alluvial soil. Current Microbiology 54: 237-243. [ Links ]