Desde oriente al resto del mundo
La historia ubica el origen de los cítricos hace 20 millones de años (Figura 1), mucho antes de la aparición de los seres humanos (Medina, 2015). Desde entonces hasta la actualidad han sufrido numerosas modifica- ciones, ya que los cítricos que hoy conocemos distan mucho de sus ancestros. En la antigüedad los mismos no formaban parte de la dieta de la humanidad debido a su extrema acidez, pero sí se utilizaban las flores y los aceites esenciales de los frutos. El hombre comenzó a seleccionarlos y a domesticarlos para incorporarlos como alimento recién desde hace 6.000 a 10.000 años. La cita más antigua que menciona a los cítricos con esa finalidad es el libro chino de Yu Gong, escrito hace 4000 años.
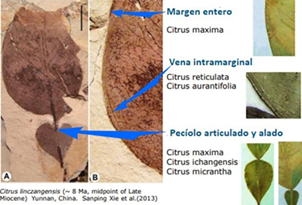
(Extraído de Xie et al. 2013)
Figura 1 El cítrico fósil más antiguo. Citrus linczangensis sp. n., una nueva especie fue descripta en base a restos fósiles encontrados en la ciudad de Lincang, provincia de Yunnan, China. Los estudios determinaron que los restos encontrados serían del Mioceno, último periodo de la era Cenozoica, el cual se inició hace 23 millones de años y terminó hace 5 millones de años. El espécimen fósil encontrado compartiría características anatómicas comunes con especies del género Citrus actuales como por ejemplo la morfología de las hojas compuestas unifolioladas, un pecíolo articulado y de alas anchas, y los bordes de las hojas completos con nervaduras intramarginales basales
Existen varias hipótesis con respecto al centro de origen de los cítricos, coincidiendo todas ellas en que se corresponde con las regiones tropicales y subtropicales del Sureste Asiático y del Archipiélago Malayo. Sin embargo hay controversias a la hora de definir el centro de origen con una mayor precisión. Así, por ejemplo, Tanaka (1954) propuso que el centro de origen primario sería el noroeste de India y Burma, mientras que China sería un centro de distribución secundario, contrario a la propuesta de Calabrese (1992) quien señaló a China como centro principal. Tampoco se conoce con exactitud la forma en la que se distribuyeron al resto del mundo. Una hipótesis de su recorrido es que desde Asia fueron llevados al norte de África y al sudeste de Europa. Desde allí arribaron a América con las expediciones de Cristóbal Colón. Luego fueron introducidos y distribuidos por los misioneros católicos, inicialmente en el Caribe y Brasil, y luego al resto del continente (Gmitter y Hu, 1990).
Los cítricos se cultivan en casi todas las regiones tropicales y subtropicales del mundo dentro de la franja com- prendida entre los 40° de latitud N y S. Con una producción mundial que supera los 100 millones de toneladas por año, se constituyen como el principal cultivo frutal. A pesar de que se cultivan en más de 130 países, cerca del 70 % de la producción se concentra solo en cinco (China, Brasil, Estados Unidos, India y México) lo que pone en evidencia claros contrastes en la escala productiva. Argentina ocupa el octavo lugar a nivel mundial, con una producción total aproximada de 3,2 millones de t en una superficie de 135.500 hectáreas, siendo la actividad citrícola una de las más importantes dentro de la fruticultura a nivel nacional (Federcitrus, 2018).
Una familia compleja
Los cítricos pertenecen a la familia de las Rutáceas y subfamilia Aurantioideas, y bajo esta denominación se incluyen a los géneros Citrus, Poncirus y Fortunella. El género Citrus es el más importante de los tres, y den- tro del mismo se distinguen el subgénero Papeda y Eucitrus, al que pertenecen los genotipos cultivados para consumo (Swingle y Reece, 1967). Dentro del género Citrus se incluyen numerosas especies cuya clasifica- ción taxonómica no está del todo esclarecida. En base a diferentes estudios, se consideran sólo cuatro especies puras o básicas: C. reticulata (mandarina), C. maxima (pomelo), C. medica (cidro) y C. micrantha (micranta),entre las cuales existe una alta compatibilidad sexual que ha permitido el cruzamiento espontáneo entre ellas, contribuyendo a un alto nivel de hibridación, a la complejidad del grupo, y a una difícil clasificación taxonó- mica (Figura 2) (Curk et al., 2016). A pesar de esta elevada diversidad, sólo algunas especies se utilizan como variedades comerciales; evidencia de ello es el hecho que la naranja dulce representa cerca del 70% de la producción mundial de cítricos. La mayoría de los genotipos comerciales que se conocen en la actualidad (por ejemplo, C. sinensis, C. paradisi y C. limon) no constituyen especies biológicamente definidas ya que muchos cultivares dentro de cada grupo se originaron a partir de mutaciones somáticas. Las mismas se fueron seleccio- nando a lo largo de miles de años y estabilizándose por propagación clonal mediante semillas apomícticas, un fenómeno muy frecuente en muchos genotipos cítricos (Gmitter, 1995). Así, por ejemplo, la historia registra descubrimientos casuales como el de la mandarina clementina (Citrus Clementina Hort. Ex Tan.), una hibridación natural descubierta por el francés Clement Rodier a comienzos del siglo XX. Posteriormente, en 1953, a partir de una mutación espontánea ocurrida en un árbol de C. clementina en el pueblo de Nules (Castellón), surgieron las clemenules, una de las variedades de mandarina más consumidas en España (Cubillo, 2013). La diversificación de la naranja dulce también es consecuencia de la ocurrencia de mutaciones de brotes somáti- cos (Aubert, 2001). Breto et al. (2001) propusieron que este fenómeno, que es muy frecuente en los cítricos, podría ser debido a los elementos transponibles.
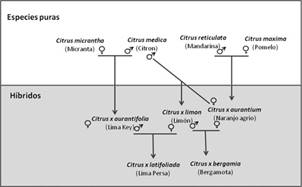
Adaptación de Curk et al., 2016.
Figura 2 Relaciones filogenéticas de los principales genotipos cítricos actuales. El uso de marcadores moleculares y la secuenciación del genoma han contribuido a identificar las especies cítricas originales “puras” del género Citrus: C. medica (citron), C. maxima (pomelo), C. reticulata (mandarina) y Citrus micrantha (micranta), de los cuales derivan los cítricos cultivados. El esquema muestra los híbridos cítricos que derivan de cruzamientos simples entre dos genotipos originales. Existen otros genotipos que derivan de procesos más complejos que incluyen más de dos parentales y retrocruzamientos, como en el caso de las mandarinas actuales y la naranja dulce (C. sinensis), las que derivaron de múltiples cruzamientos e introgresiones de C. máxima.
Además de las mutaciones y cruzamientos espontáneos ocurridos en la naturaleza, otros genotipos son el re- sultado de cruzamientos dirigidos, los cuales según datan los registros escritos, se iniciaron en China hace más de 4.000 años, donde decidieron mejorar a los cítricos ya que eran extremadamente ácidos, pequeños y llenos de semillas. Comenzaron a combinar genotipos hasta obtener frutos más dulces y menos ácidos, similares a los actuales. Así, por ejemplo, el cruzamiento de una mandarina (C. reticulata) y un pomelo ancestral (C. maxima) dio lugar a un fruto comestible, un híbrido con baja acidez que se volvió a cruzar varias veces. Recientemente se identificó un locus (localización específica de una secuencia de ADN dentro de un cromosoma) que estaría involucrado en la disminución de la acidez, ubicado en el cromosoma 8 (0,3-2,2 Mb) de todas las variedades de las mandarinas y naranjas dulces actuales de baja acidez, el cual habría sido introgresado del pomelo (Wu et al., 2018).
El origen, evolución, genealogía y domesticación de los cítricos, siempre ha sido motivo de estudio y aún exis- ten muchos interrogantes. Recientemente, un equipo de investigadores pertenecientes al Centro de Genómica del Instituto Valenciano de Investigaciones Agrarias (IVIA) (España), junto al “Department of Energy Joint Genome Institute” (DOE JGI) (EE.UU.), obtuvieron resultados que desafían los actuales principios taxonó- micos y filogenéticos, apuntando hacia una reformulación del género Citrus (Wu et al., 2018). Dichos inves- tigadores realizaron un estudio comparativo del genoma de 58 genotipos representantes de todos los grupos de cítricos, y determinaron que los genotipos actuales descienden de diez especies naturales procedentes de un área cercana al Himalaya, delimitada por el este de la India, el norte de Myanmar y el oeste de Yunnan. El estudio sugiere que estos genotipos ancestrales sufrieron un evento de especiación durante el Mioceno tardío, hace unos 8 millones de años, lo que coincidió con un cambio climático que transformó las condiciones del monzón húmedo a un clima más seco, a lo que se sumó un complejo proceso de “domesticación” por parte del ser humano, dando origen a la diversidad de los genotipos cítricos actuales.
Si bien la evolución de los cítricos ha sido continua a lo largo de miles de años por intervención de la natura- leza y del hombre, la investigación y el mejoramiento sistemático se inició con las Leyes de Gregor Mendel (Austria, 1822-1868) y Charles Darwin (Reino Unido, 1809-1882), las cuales sentaron las bases del mejo- ramiento genético como una disciplina científica, con fundamentos sólidos, enfocados en técnicas clásicas de botánica y citogenética. A partir de allí se han generado algunos resultados exitosos, aunque en general fueron muy lentos (Talón y Gmitter, 2008; Wood y Corley, 2008). Los grandes avances en genética, biología molecular y biotecnología de las últimas décadas han impartido otra dinámica al mejoramiento de los cítricos, acelerando los procesos de mejoramiento y permitiendo superar limitaciones asociadas a la propia biología del grupo, que no podrían haberse logrado sólo con las técnicas convencionales.
Objetivos de mejoramiento
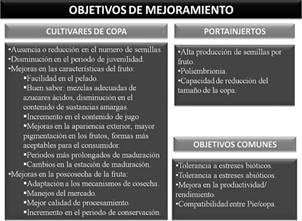
Una planta cítrica destinada a la producción comercial está constituida por dos partes genéticamente diferen- tes, la “copa o variedad” y el “pie o portainjerto”, conjunto que se denomina “combinación cítrica”. El portain- jerto aporta el sistema radicular a la variedad de la copa elegida, siendo el responsable de la absorción de agua y elementos nutritivos; pero además puede tener influencia en diferentes características de una variedad, como por ejemplo, en el vigor y tamaño de la planta, tolerancia al frío, adaptación a ciertas condiciones de suelo (tales como salinidad o acidez), tolerancia a enfermedades o plagas, productividad y calidad interna y externa de la fruta, etc. (Agustí, 2003). Si bien no existe el portainjerto ideal para una situación particular, la elección del mismo se hace teniendo en cuenta la mayoría de los factores limitantes del cultivo en una determinada zona y al objetivo específico de la producción (fruta fresca o industria). Es por ello que los programas de me- joramiento de cítricos estarán focalizados a la mejora del pie o la variedad de copa, o de ambos, dependiendo de las necesidades de cada región. En la Figura 3 se mencionan algunos de los objetivos más comúnmente perseguidos en el mejoramiento de los cítricos.
Tecnologías de mejoramiento genético utilizadas en cítricos
La evolución del mejoramiento de los cítricos responde a la conjunción de las características propias del cultivo y a la evolución de las tecnologías de mejoramiento genético vegetal. Las técnicas de mejoramiento utilizadas en cítricos se pueden dividir en dos grupos: convencionales y biotecnológicas.
Técnicas convencionales
Las técnicas conocidas como convencionales o tradicionales de mejoramiento, se basan en los recursos gené- ticos que se encuentran en el grupo a mejorar, e incluyen la selección de genotipos superiores o modificación de genomas mediante hibridación sexual o mutaciones (naturales o inducidas).
La hibridación sexual entre individuos diploides combinados con la selección artificial, ha sido utilizada tra- dicionalmente en los programas de mejora de cítricos y aún se continúan utilizando; sin embargo, el número de genotipos de interés obtenidos ha sido limitado (Gmitter y Hu, 1990), sumado a que es un proceso costoso y lento, que puede llevar entre 20 y 30 años. Este resultado es atribuible, en parte, a factores que son comunes a las especies leñosas y a características específicas relacionadas con la biología reproductiva de las especies del género Citrus y de los géneros relacionados, tales como: el elevado nivel de heterocigosis que presentan la mayoría de las especies (Herrero et al., 1996), lo que produce una gran segregación de caracteres en la des- cendencia; esterilidad del polen y frecuentes casos de inter y autoincompatibilidad sexual (Cameron y Frost, 1968). Adicionalmente, la alta frecuencia de partenocarpia, donde la fecundación de los óvulos no ocurre y las semillas no se desarrollan debido a que las mismas quedan reducidas a pequeños rudimentos seminales (Spiegel-Roy y Goldschmidt, 1996); el largo periodo de juvenilidad (entre 5 y 21 años) (Spiegel-Roy y Goldschmidt, 1996), por lo que la evaluación de los híbridos resultantes requiere muchos años y es muy costosa (Wood y Corley, 2008); y la apomixis parcial que produce semillas con embriones nucelares idénticos a la planta madre, sin que exista fecundación, limitando el desarrollo del embrión zigótico y dificultando la recuperación de la progenie sexual (Spiegel-Roy y Goldschmidt, 1996). Por último, el gran tamaño de los árboles dificulta la disponibilidad de una progenie numerosa, y hace necesario disponer de grandes espacios (Spiegel-Roy y Goldschmidt, 1996). A pesar de estas limitaciones, a lo largo de la historia se obtuvieron cultivares de copa y portainjerto de gran importancia comercial mediante esta técnica, como los tangelos (mandarina X híbridos de pomelo) Minneola, Orlando, Pearl, Sampson; los tangores (mandarina X híbridos de naranja dulce) Mur- cott, Temple, King y algunos portainjertos como citrumelo Swingle (pomelo X híbrido de naranjo trifoliados) (Wood y Corley, 2008) y citrumelo 79AC y 75AB (Cleopatra X Citrumelo Swingle) (Stein y Foguet, 2015). En el género Citrus y géneros relacionados, el número de cromosomas gaméticos es n=9, y los individuos diploides son los más habituales, sin embargo, se producen de forma espontánea variantes euploides, espe- cialmente triploides (2n=3x=27) y tetraploides (2n=4x=36). En general los genotipos poliploides presentan características morfológicas de interés comercial como por ejemplo, frutos sin semillas u órganos de mayor tamaño. En la meiosis de las plantas triploides se producen gametos con distintas dotaciones cromosómicas que reducen la viabilidad de los mismos y los frutos no tienen semillas (Esen et al., 1978). Los genotipos tri- ploides se pueden obtener por hibridación entre una madre tetraploide y el padre diploide, aunque este tipo de cruce produce sólo unos pocos híbridos y muchos embriones nucelares, debido al alto nivel poliembriónico de la madre tetraploide. Desde la década de 1970 se sabía que también se pueden obtener de la cruza de genotipos diploides cigótigos como madre y los genotipos tetraploides como padres (2x X 4x), sin embargo, estas estra- tegias no pudieron aplicarse en programas de mejora hasta que se desarrollaron técnicas biotecnológicas como el rescate y cultivo de embriones in vitro, análisis del nivel de ploidía mediante citometría de flujo y obtención de nuevos parentales tetraploides (Aleza et al., 2010).
Por otro lado, una gran parte de genotipos de copa o portainjertos que se utilizan al presente se originaron por la aparición espontánea de plantas sobresalientes o de mutaciones espontáneas en el campo, un proceso que se denomina selección clonal. Este es un evento relativamente frecuente en los cítricos, lo que indica una cierta inestabilidad genética de los mismos. La selección de estas mutaciones es el método más antiguo y ha permitido la obtención de los cultivares más ampliamente empleados en las principales zonas productoras del mundo (Gmitter et al., 1992). Las especies en las que se ha logrado el mayor número de variedades clonales son las naranjas del grupo Navel y mandarinas del grupo de los Clementinos y Satsumas (Bono et al., 1996). Sin embargo, la identificación de este tipo de material exige una gran capacidad de observación de los mejo- radores y requiere una evaluación crítica del comportamiento de los árboles, de la calidad de la fruta, de los beneficios económicos y de “marketing”, lo que implica mucho tiempo y dinero, dificultando su utilización. La generación de mutaciones también se puede inducir en forma artificial, mediante la cual se modifican al azar uno o pocos caracteres de un genotipo, sin cambiar de forma significativa su fondo genético. Los rayos gamma han sido el agente mutagénico más utilizado en cítricos y han permitido la obtención de distintas varie- dades de frutos sin semillas y de gran aceptación comercial, como la mandarina “Mor” o la variedad Nusselin, entre otras (Roose y Williams, 2007; Navarro, 2011). Otros rasgos inducidos por mutagénesis incluyen el tamaño de la planta, el tiempo de floración, la maduración y coloración de la fruta, la autocompatibilidad y la resistencia a patógenos (Predieri, 2001). Sin embargo, esta técnica conlleva la desventaja que las mutaciones son al azar y hay que evaluar muchos individuos, durante muchos años, hasta lograr la estabilización de la mutación, ya que en muchos casos ocurre reversión al genotipo original (Navarro, 2011).
Técnicas biotecnológicas
En las últimas décadas, el mejoramiento de los cítricos ha tomado otro impulso con el surgimiento de nuevas técnicas biotecnológicas que han permitido sortear muchos de los problemas asociados con la biología repro- ductiva de estos cultivos, incrementando la eficiencia y disminuyendo los tiempos de obtención de genotipos mejorados.
El desarrollo de métodos que permiten la manipulación del ADN, junto a las posibilidades que ofrece el culti- vo de tejidos in vitro, han creado grandes expectativas para la mejora de plantas leñosas. La manipulación de la ploidía, el aprovechamiento de la variación somaclonal, el rescate de embriones, la fusión de protoplastos o la transformación genética, suponen grandes avances en la mejora de los cítricos (Mohan et al., 1997).
A continuación, se detallan las herramientas biotecnológicas más utilizadas para la mejora genética en cítricos: Manipulación de la ploidía: la biotecnología ha facilitado la obtención de genotipos cítricos poliploides (Gmitter et al., 1992) mediante por ejemplo el cultivo de tejidos in vitro en un medio adicionado con antimitóticos como colchicina (Soost y Cameron, 1969). Otras estrategias utilizadas son el cultivo de endospermo (Wang y Chang, 1978) y el rescate de embriones triploides a partir de semillas abortadas de frutos originados de hibri- daciones sexuales (2x X 4x) (Aleza et al., 2010). La creación de nuevos parentales tetraploides resulta de mu- cho interés, ya que ha permitido la obtención de nuevas combinaciones de híbridos triploides que no se podían obtener décadas atrás. Por ejemplo, mediante citometría de flujo se pueden identificar plántulas tetraploides originadas por la duplicación espontánea del número de cromosomas (embrionía adventicia) que se producen en las células de la nucela de genotipos apomícticos (poliembriónicos). En las semillas de los genotipos no apomícticos (monoembriónicos) que contienen únicamente un embrión de origen sexual, no se produce la duplicación espontánea del número de cromosomas por lo que es necesario la utilización de otras tecnologías, como por ejemplo el tratamiento de los ápices con antimitóticos, los cuales se injertan por micropropagación y posteriormente se seleccionan los tetraploides mediante citometría de flujo (Aleza et al., 2010).
Variación somaclonal: consiste en la variación genética o epigenética heredable que aparece en las células vegetales sometidas a cultivo in vitro (Díaz et al., 2004). Este proceso puede incluir cambios en el ADN tanto a nivel nuclear como citoplasmático (Larkin y Scowcroft, 1981). Los cambios producidos por la variación somaclonal en general son indeseables o suceden sin manifestarse en cambios morfológicos evidentes. Sin embargo, la aparición ocasional de caracteres no encontrados en las poblaciones naturales y que representan una ventaja desde el punto de vista agronómico, permiten utilizar este fenómeno en programas de mejora genética (Dewald y Moore, 1987). Esta técnica es muy utilizada para generar clones mejorados como por ejemplo en Citrus sinensis, especialmente para la obtención de los cultivares Hamlin y Valencia, dos de los genotipos de naranja más cultivados en Florida, EE.UU. (Grosser et al., 2007a).
Selección asistida por marcadores moleculares: es un método de mejora que se basa en la identificación de re- giones del ADN asociadas a un locus que codifica para una determinada característica de interés agronómico. La identificación de estos marcadores permite realizar una selección temprana de la progenie a fin de abordar la mejora de una forma más rápida, eficaz y dirigida. Las isoenzimas, RFLP (siglas en inglés de “Restric- tion Fragment Length Polymorphism”), RAPD (siglas en inglés de “Random Amplification of Polymorphic DNA”), AFLP (siglas en inglés de “Amplified Fragment Length Polymorphism”) o los Microsatélites-SSR (siglas en inglés de “Simple Sequence Repeat”), son algunas de las técnicas más empleadas. En cítricos se han desarrollado en los últimos años un elevado número de marcadores microsatélites que actualmente permiten la elaboración de mapas genéticos más precisos (Fang et al., 2018). Sin embargo, aún resulta escaso el número de marcadores asociados a caracteres de interés. Se conocen algunos marcadores asociados a genes de resis- tencia al virus de tristeza de los cítricos identificados en el genoma de Poncirus trifoliata (Fang et al., 1998). También se han identificados marcadores relacionados con genes que controlan la cantidad de ácido cítrico en los frutos (Fang et al., 1998), la embrionía nucelar (Smith et al., 2019), la tolerancia a nemátodos (Ling et al., 2000) y la tolerancia a salinidad (Tozlu et al., 1999). Algunas características genéticas de los cítricos, como el bajo número de cromosomas y el reducido tamaño de su genoma [C = 0,62] (Guerra, 1984), así como el elevado nivel de polimorfismo y la posibilidad de generar híbridos fértiles intraespecíficos e intergenéricos, favorecen la construcción de mapas genéticos de ligamiento. Hasta la fecha se han publicado numerosos mapas genéticos de cítricos correspondientes a especies de interés para la citricultura, ya sea por su aplicación como portainjerto (C. aurantium, C. volkameriana, P. trifoliata), o por la producción de fruta para consumo en fresco (C. sinensis, C. clementina). Disponer de mapas genéticos para las diferentes especies del género Citrus permite la comparación de sus genomas, abriendo nuevas líneas de investigación en el campo de la genómica comparativa, la mejora genética asistida por marcadores moleculares, o el desarrollo de estrategias de clonación posicional, entre otras (Chen et al., 2008).
Hibridación somática mediante fusión de protoplastos: esta alternativa de mejoramiento genético se ha uti- lizado en cítricos para sortear los problemas de la incompatibilidad sexual, esterilidad del polen y la poliem- brionía. La técnica se basa en el aislamiento y posterior unión de dos protoplastos de células no sexuales provenientes de dos parentales, para formar una única célula híbrida, denominada heterocarionte (célula que contiene núcleos genéticamente diferentes), a partir de la cual se puede regenerar una planta completa con téc- nicas de cultivo in vitro (Figura 4). Los híbridos resultantes contienen la combinación de los genomas nuclear, cloroplástico y mitocondrial de ambos parentales, y pueden expresar los caracteres de ambos; sin embargo, muchas veces hay una expresión parcial o combinada de los dos genomas (Grosser y Gmitter, 1990). De esta manera, se han generado híbridos somáticos alotetraploides interespecíficos e intergenéricos de cultivares de copa o portainjertos que pueden utilizarse en programas de mejoramiento (Grosser et al., 1996). Por ejemplo, se han generado híbridos somáticos resistentes a nemátodos utilizando suspensiones de cultivos de mandari- na y pomelo (Grosser et al., 2007b); plantas tolerantes a la cancrosis y a la clorosis variegada de los cítricos (CVC) mediante la utilización de protoplastos de hojas de la variedad Hamlin de naranja con la mandarina montenegrina (Pavan et al., 2007).

Figura 4 Etapas de la fusión de protoplastos. A. Callos embriogénicos de citrus. B. Protoplastos fusionados. C. Microcolonias derivadas de protoplastos fusionados. D. Brotes regenerados a partir de los embriones somáticos obtenidos a partir de productos de la fusión de protoplastos.
Transformación genética: en general se entiende por transformación genética de plantas a la transferencia de genes foráneos al interior del genoma vegetal. La transgénesis, reportada en la década de 1980, es una de la he- rramientas más versátiles y poderosas, ya que permite introducir características nuevas a un cultivo “elite” sin modificar la integridad o fondo genético del mismo (Peña, 2000). Por otro lado, la transgénesis no sólo puede ser útil para la mejora genética de las plantas, sino también para investigar los mecanismos que controlan su desarrollo y sus respuestas a factores bióticos y abióticos.
La transformación de cítricos se ha efectuado a partir de varios tipos de explantos como epicótilo (Moore et al., 1992), segmentos de tallo nodal e internodal (Kaneyoshi et al., 1994), células embriogénicas (Yao et al., 1996), callos (Hidaka et al., 1990) y protoplastos (Fleming et al., 2000). Sin embargo, se ha reportado que el explanto que mejor responde es el epicótilo (Moore et al., 1992) y, por lo tanto, es el más utilizado en experi- mentos de transformación de cítricos en la actualidad.
Entre las técnicas de transformación que se han utilizado en cítricos se incluyen la absorción químicamente asistida de ADN foráneo en protoplastos (Fleming et al., 2000) y el bombardeo de callos o segmentos de epi- cótilo con partículas recubiertas de ADN (Yao et al., 1996). El primer trabajo publicado sobre transformación directa de cítricos fue en 1989, en el que se describió la obtención de dos líneas de callos transgénicas a partir del tratamiento con polietilenglicol (PEG) de protoplastos de C. sinensis cv. Trovita (Kobayashi y Uchimiya, 1989). En 1990 se consiguió la regeneración de plantas transgénicas de limón Rugoso (C. Jambhiri Lush.) utilizando la misma técnica de transformación, pero combinada con un proceso embriogénico de regenera- ción (Vardi et al., 1990). Sin embargo, el método de transformación en el cual interviene el sistema biológico basado en el plásmido Ti (del inglés “Tumor inducing”) de Agrobacterium tumefaciens (At) ha demostrado ser el más exitoso en cítricos (Bond y Roose, 1998; Domínguez et al., 2000). Este sistema se basa en la ca- pacidad de la bacteria para transferir e integrar información genética en el genoma de la planta. Si bien este método es el más utilizado, existen determinados factores a tener en cuenta para su éxito, ya que la eficiencia de transformación puede variar entre un 0 y 45 %. Este parámetro dependerá de diversos factores como es el genotipo cítrico, ya que algunos son considerados recalcitrantes, es decir, con nula o baja respuesta a la regeneración in vitro y/o transformación (Costa et al., 2002), la concentración del inóculo de At y condiciones de co-cultivo (Bond y Roose, 1998; Dominguez et al., 2000). Además, se debe tener en cuenta que una vez que se ha integrado el ADN foráneo en el genoma de la planta, la célula transformada debe ser capaz de regenerar una planta completa (Figura 5), y el transgen debe ser expresado en forma estable durante un largo periodo de tiempo para poder validar la tecnología de transformación.
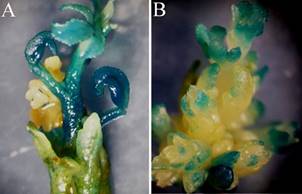
Figura 5 Regeneración de brotes transgénicos de citrange troyer. Para la detección de brotes regenerados a partir de células transformadas, se utilizan “genes reporteros” que se incorporan en la construcción génica acompañando al gen de interés, como el gen gus que codifica para la Beta-glucuronidasa. Las células trans- formadas se tiñen de azul debido al producto que se forma por acción de la enzima en contacto con el cro- mógeno X-Gluc. En A se observa un brote azul completamente transformado, y en B brotes quiméricos, es decir que poseen células transformadas y no trasformadas.
Los avances en transgénesis en cítricos logrados hasta el presente, permitieron la obtención de genotipos me- jorados mediante la introducción de diferentes genes capaces de conferir características de interés agronómico en una gran diversidad de genotipos cítricos. En la Figura 6 se destacan los logros de mayor relevancia.
Edición de genoma: la técnica más reciente en mejoramiento genético es la edición del genoma mediante la tecnología conocida como CRISPR/Cas9, la cual permite “editar” o “corregir” el genoma de cualquier célu- la. CRISPR es la abreviatura en inglés de “Clustered Regularly Interpaced Short Palindromic Repeats”. El sistema CRISPR-Cas9 deriva del mecanismo de defensa empleado por algunas bacterias para eliminar virus. Dicho sistema consta de un complejo formado por una proteína Cas unida al ARN producido a partir de las secuencias CRISPR. Cuando se hace uso biotecnológico de este mecanismo se utilizan ARNs conocidos como ARNs guías, complementarios a la región del ADN que se quiere modificar. Dichos ARNs se asocian con la enzima Cas9, e hibridan con la secuencia complementaria del genoma, dirigiendo a la endonucleasa Cas9 a cortar el ADN en una región específica. En la segunda etapa se activan al menos dos mecanismos naturales de reparación del ADN. En el mecanismo más comúnmente denominado “Non-homologous end joining” (NHEJ) se generan en la secuencia específica del ADN donde se unió el ARN guía, los denominados indels mediante la inserción o deleción de algunas pocas bases. Esto conlleva a la pérdida de la función original del ADN cortado. Un segundo mecanismo dependiente de recombinación de secuencias homólogas, permite la incorporación de una secuencia concreta (de interés) exactamente en el sitio original de corte (Belhaj et al., 2015).
Con la tecnología CRISPR/Cas9 se inauguró una nueva era de la ingeniería genética en la que se podrá regular la expresión génica, etiquetar sitios específicos del genoma en células vivas, identificar y modificar funciones de genes y corregir genes defectuosos o incluso introducir modificaciones epigenéticas en cualquier célula de una manera fácil, rápida, barata y altamente precisa.
Actualmente ya se han obtenido genotipos cítricos “editados”. Así, por ejemplo, Jia et al., (2017a) modifi- caron el gen CsLOB1 responsable de la susceptibilidad a la cancrosis o su secuencia promotora (Jia et al., 2016) en pomelo Duncan, obteniéndose líneas editadas con tolerancia a cancrosis en sus etapas iniciales de crecimiento. La edición del mismo gen en Citrus sinensis también arrojó resultados promisorios (Peng et al., 2017). Además, la edición del factor de transcripción CsWRKY22 en C. sinensis llevó a una disminución de la susceptibilidad en plantas infectadas con Xanthomonas citri (Wang et al., 2019). Aunque la edición de geno- ma en cítricos está es sus etapas iniciales, posee ciertas limitaciones asociadas por ejemplo a la poliploidia ya que se ha demostrado que la eficiencia de edición de genes es generalmente menor en esta condición. Por otro lado, alelos múltiples deberían editarse simultáneamente (Peng et al., 2017; Zhang et al., 2019). Por lo tanto, es necesario mayor experimentación y conocimiento para obtener mayores beneficios de esta tecnología.
Huanglongbing (HLB), el gran desafío para los mejoradores del nuevo siglo
El Huanglongbing o HLB, nombre derivado del chino mandarín que significa “dragón amarillo”, es considera- da la mayor crisis fitosanitaria que ha tenido la citricultura a lo largo de su historia (Bové, 2006). Esta enferme- dad es producida por tres especies de bacterias gram-negativas restringidas al floema: Candidatus Liberibacter asiaticus (CLas) (Bové, 2006) y Candidatus Liberibacter americanus (CLam) (Texeira et al., 2005) que son transmitidas por el psílido vector Diaphorina citri (Hall et al., 2013); y Candidatus Liberibacter africanus (CLaf) (Jagoueix et al.,1994) que es transmitida por el insecto Trioza eritreae (McClean y Oberholzer, 1965). Además, estas bacterias pueden transmitirse también por injerto (Bové, 2006).
El HLB es una enfermedad emergente, que fue descripta por primera vez en 1919 en el sudeste de China (Reinking, 1919) y luego de un largo confinamiento en esa región, pudo superar océanos y miles de kilómetros de tierra firme y llegar al continente americano donde se reportó su aparición por primera vez en Brasil en el 2004, y en menos de una década se extendió al resto del continente afectando hoy a más de 40 países (Bové, 2006; Gottwald y Graham, 2014). Actualmente también se define como una enfermedad cuarentenaria, ya que hay zonas productoras en donde aún no ha sido detectada, así como en ciertos países de Europa. El control del HLB es sólo preventivo y está basado en el control del insecto vector y en la erradicación de las fuentes de inóculo. Esto último se debe a que todavía no se conoce ninguna fuente de germoplasma resistente a la enfer- medad (da Graça et al., 2016). Los mecanismos de dispersión y supervivencia de este microorganismo son tan eficaces que le han permitido producir graves perjuicios a la totalidad de las especies comerciales de cítricos cultivadas en el mundo. En países como Brasil y en EE.UU. los daños han sido muy grandes, por ejemplo, en Florida en 10 años la producción ha disminuido a más de la mitad (Neupane et al., 2016). En Argentina en el año 2012 se detectaron árboles infectados aislados en Misiones, los cuales fueron erradicados. Posteriormente en 2017, se registraron casos positivos en el arbolado urbano de las provincias de Formosa, Chaco y Santiago del Estero (www.clarin.com/rural/agricultura/senasa_0_ByE-PYYQW.html), y en el año 2018 se detectaron en lotes productivos del departamento Federación (provincia de Entre Ríos), el cual es clave en la producción de cítricos de esa provincia (http://acnoa.com.ar/situacion-actual-del-hlb-en-argentina/).
La situación de la industria frente a la enfermedad es muy crítica, especialmente debido a la falta de resistencia y la inexistencia de un tratamiento convencional efectivo, por lo que las mayores expectativas para controlar la enfermedad, están puestas en la biotecnología. Actualmente un elevado porcentaje de las actividades y presupuestos de las diferentes instituciones de investigación y programas de mejoramiento de los principales países citrícolas del mundo, están destinados a combatir la enfermedad. Se han evaluado diferentes estrategias, pero una de las principales es la búsqueda y/o generación de germoplasma resistente. Aunque se han detectado varios genotipos con cierta tolerancia a la enfermedad (Albrecht y Bowman, 2011; Miles et al., 2017), hasta el momento no existe un genotipo comercial que sea resistente (da Graça et al., 2016). Para identificar genes que podrían estar involucrados en la tolerancia al HLB y que puedan ser utilizados en estrategias de mejora, se han realizado numerosos estudios de expresión génica en plantas cítricas infectadas con HLB (Kim et al., 2009; Aritua et al., 2013; Zhong et al., 2015), así como también estudios comparativos entre genotipos susceptibles y aquellos con cierta tolerancia a la enfermedad (Wang et al., 2016).
La transgénesis se ha utilizado para la obtención de plantas resistentes al HLB y una de las estrategias más evaluadas fue la introducción de genes que codifican para péptidos antimicrobianos. Así por ejemplo, Zou et al. (2017) transformaron plantas de C. sinensis con el gen cecropin B bajo el control de un promotor de expresión específico de floema, donde la bacteria se multiplica, obteniéndose plantas menos susceptibles a la enfermedad. Resultados similares obtuvieron Hao et al. (2016), quienes transformaron con un gen sintético que codifica para una tionina modificada, y por Felipe et al. (2013) y Rocha et al. (2019), con el gen de la attacina A (attA), un péptido antimicrobiano de Drosophila melanogaster. Otra aproximación utilizada fue la transformación con genes que codifican para componentes del mecanismo de defensa de la planta, de tal forma que la sobreexpresión constitutiva o inducible, produzca el incremento de la resistencia sistémica. Tal es el caso del gen NPR1 (del inglés, “Non-expressor of Pathogenesis Related 1”). Existen varios reportes de plantas cítricas transgénicas con NPR1 que han mostrado menor susceptibilidad al HLB (Dutt et al., 2015; Robertson et al., 2018).
Finalmente, ya se ha incursionado en la edición de genoma o tecnología CRISPR/Cas9 (Jia et al., 2017 a, b) pero aún no se han reportado resultados contundentes, fundamentalmente debido a que para esta tecnología es necesario conocer con anterioridad el gen que se desea “editar”, y en el caso de HLB aún queda mucho por “descubrir” acerca de los mecanismos que intervienen en la virulencia de la bacteria responsable.
Los cítricos transgénicos y la percepción pública
Los avances en la tecnología de mejoramiento han permitido alcanzar objetivos que en algunos casos resul- taban inimaginables. La transgénesis, en particular, ha permitido intercambiar genes entre organismos de diferentes reinos, además en forma relativamente sencilla y rápida. Hoy existen innumerables evidencias que muestran los beneficios de los organismos genéticamente modificados (OGM) en diferentes aspectos: econó- micos, sociales, ambientales, etc. Sin embargo, existe una percepción negativa sobre los OGM por parte de la sociedad en general. Las razones a este rechazo son múltiples, como ser factores psicológicos inherentes al ser humano, la acción de influenciadores, las tendencias en la sociedad moderna, siendo muchas de ellas infundadas y el resultado de conceptos erróneos (Durán, 2004).
En muchos cultivos, la percepción pública ha sido una de las razones que ha frenado en alguna medida la velocidad de mejoramiento. En el caso específico del HLB por ejemplo, en donde las soluciones tardan en llegar y la biotecnología parece ser la única esperanza, los científicos necesitan saber si los productores adoptarán estas tecnologías y si los consumidores las consumirán. Un estudio reciente, llevado a cabo por la Universidad de Michigan y financiado por el Departamento de Agricultura de EE.UU., proporciona algunas respuestas (Ruth et al., 2018). En base a encuestas realizadas a consumidores de EE.UU., los investigadores encontraron que aproximadamente el 50 % se mostraron a favor de los transgénicos, mientras que el 14 % tenía percepcio- nes negativas de los mismos. En general, las opiniones negativas surgen desde el desconocimiento del tema, las cuales dan sustento a lo que se conoce como “teoría del espiral del silencio” (Noelle-Neumann, 1974), una hipótesis sobre la formación de la opinión pública que afirma en parte que “las personas que expresan sus opiniones en público alientan a expresarse a aquellos con opiniones similares, mientras que silencian a quienes sostienen puntos de vista opuestos”. En otro estudio realizado por Fernbach et al. (2019), determina- ron que un 90 % de los encuestados (población adulta de EE.UU., Francia y Alemania), se mostró con cierta disconformidad ante el uso de los OGM. El resultado más sobresaliente de este estudio reveló que “cuanto más firme es la posición de las personas en contra de los alimentos modificados genéticamente, menor es su cono- cimiento real”, lo que se conoce como “psicología del extremismo”, conclusiones que fueron compartidas por el Dr. M. Sánchez de ChileBio en un estudio realizado sobre consumidores de ese país (https://www.chilebio. cl/2019/02/22/los-transgenicos-pueden-salvar-a-los-citricos-de-florida-lo-aceptaran-los-consumidores/). Este comportamiento también fue extensivo hacia otros temas científicos, por lo que los investigadores coinciden en que “es responsabilidad de los científicos participar de estos temas para evitar que personas que no tienen antecedentes científicos llenen el vacío” (Fernbach et al., 2019; Taylor et al., 2019).
Protección de la propiedad de los genotipos cítricos mejorados: situación en Argentina
Al obtener un nuevo genotipo por alguna estrategia de mejoramiento, existe una legislación que le confiere al obtentor de una variedad vegetal “un título/derecho de propiedad”, como reconocimiento a su actividad fitomejoradora. El marco legal en la República Argentina está regulado por la Ley de Semillas y Creaciones Fitogenéticas N° 20.247, la cual fue reglamentada en el año 1991 por el Decreto N° 2183/91, y la Ley N°
24.376 que establece la adhesión de Argentina al Convenio Internacional para la Protección de las Obtencio- nes Vegetales-UPOV (Unión Internacional para la Protección de las Obtenciones Vegetales). Desde el año 1994, la República Argentina es integrante de la UPOV, la cual depende del OMPI (Organización Mundial de la Propiedad Intelectual). La Ley N° 20.247 protege la propiedad de obtentor de una variedad, pero para poder comercializarla, se debe registrar la variedad en el Registro Nacional de la Propiedad de Cultivares (RNCP) y en el Registro Nacional de Cultivares (RNC) (Labarta, 2004).
El derecho de obtentor tiene tres excepciones: la de consumo, la de uso propio del agricultor en su propia ex- plotación, y la del fitomejorador que, según establece el Artículo 43 de la Ley N° 20.247, lo habilita a utilizar libremente una variedad protegida para crear y comercializar una nueva variedad (Artículo 43: “La propiedad de una variedad no impide su utilización como fuente de variación o como aporte de características deseables en trabajos de mejoramiento vegetal. Para tales fines no será necesario el conocimiento ni la autorización del obtentor”). Esta última también se contempla en la legislación de la Comunidad Europea (Reglamento CE 2100/94), a excepción del caso de que la nueva variedad sea esencialmente “derivada de la variedad original”, en donde sí se necesita la autorización del obtentor de esta última para la comercialización. Se considera que una variedad es “derivada” de la original cuando se diferencia solamente en el carácter introducido. Por lo tanto, si bien una sola variación del fenotipo alcanza para otorgar el título de propiedad de la variedad vegetal, habrá una necesidad de retribuir al obtentor inicial por la investigación y desarrollo de la variedad vegetal inicial (Art. 14, inc. 5, b, del Convenio Internacional para la Protección de las Obtenciones Vegetales). En este sentido, y teniendo en cuenta las modificaciones asociadas a la tecnología de mejoramiento utilizada, este sería el caso de las variedades generadas por transgénesis, edición de genoma y mutagénesis; no así en el caso de los procedimientos que involucran una hibridación (sexual o somática), en donde el nuevo genotipo difiere sustancialmente de los originales (Navarro, 2011). Estas consideraciones son importantes a la hora de elegir los genotipos iniciales en un programa de mejoramiento, en especial cuando los fines son de comercialización. En un futuro muy cercano habrá que definir el marco regulatorio para la próxima generación de vegetales modificados por edición de genomas para los cuales aún no existen definiciones precisas sobre como consi- derarlos. Por ejemplo, las agencias reguladoras europeas consideran que los productos editados deberían tra- tarse como los OGM, mientras que la USDA (siglas en inglés de “United States Department of Agriculture”), considera que los cultivos editados pueden considerarse como productos de mutagénesis biológica, como la mutagénesis química y de radiación utilizada en el fitomejoramiento convencional (Fritsche et al., 2018). Por lo tanto, este tema deberá analizarse cuidadosamente para proceder en forma correcta.
Programas de mejoramiento genético de cítricos en el mundo
Las actividades de mejoramiento genético de una manera sistemática mediante la hibridación dirigida y la selección clonal datan de fines de 1800 con el trabajo de los pioneros Swingle y Webber en Florida, EE.UU. (Traub y Robinson, 1937; Cooper et al., 1962). Luego esta actividad se extendió entre los principales países productores como Japón (1909), y un poco más tarde, entre 1920 y 1930, a otros países como España, Italia e Israel (Traub y Robinson, 1937), a medida que paralelamente se comenzaron a organizar programas de mejo- ramiento, principalmente por iniciativas de los gobiernos. En las últimas tres décadas hubo una proliferación de nuevos programas de mejoramiento en todo el mundo, destacándose una mayor inversión de fondos priva- dos en programas públicos de mejoramiento, así como un número creciente de programas privados. Después de más de un siglo, muchos programas de mejoramiento todavía utilizan enfoques clásicos como la evaluación fenotípica de un gran número de descendientes y la selección clonal (Caruso et al., 2020), a pesar de las falen- cias que conllevan las observaciones empíricas, especialmente cuando se trata de características fuertemente influenciadas por el ambiente.
Actualmente, casi todos los países productores poseen programas de mejoramiento con distintos grados de complejidad, integrando en mayor o menor medida los enfoques clásicos, la biología molecular, la genética, la genómica, metabolómica, etc.
El programa de mejoramiento más antiguo le corresponde a Estados Unidos, el cual se inició en el año 1893 en Florida por iniciativa de la USDA (Cooper et al., 1962), y que aún sigue vigente. Luego, en 1907 en la Universidad de California se creó el “Citrus Experiment Station” en Riverside, y posteriormente en la Uni- versidad de Florida se creó el “Citrus Research and Education Center” (CREC; https://crec.ifas.ufl.edu), el cual inició su programa de mejoramiento de cítricos en la década de 1920. El CREC, actualmente posee uno de los programas de mejoramiento más grandes. El enfoque más importante del programa es la resistencia a enfermedades (virosis, nemátodos y HLB), y la calidad de la fruta, especialmente en naranjas de ombligo, mandarinas y pomelos.
En China, primer productor mundial, el mejoramiento de los cítricos enmarcado dentro de un programa comenzó en la década de 1960, aunque luego sufrió una disminución en sus actividades en las décadas de 1980 y 1990. El programa de mejoramiento de China fue posteriormente activado, y en el año 2003 el gobierno realizó una fuerte inversión en la creación del Centro de Mejoramiento de Cítricos en la Universidad Agrícola de Huazhong y un Centro de Mejora de Cítricos en el Instituto de Investigación de Cítricos de la actual Uni- versidad del Suroeste, una de las más antiguas instituciones de educación superior en China. Dentro de los principales objetivos de mejoramiento se incluyen la extensión de las temporadas de cosecha, la obtención de variedades sin semillas, y la calidad de la fruta tanto en color como en sabor, principalmente de mandarina, naranja y pomelo. El programa de mejoramiento de China utiliza técnicas convencionales, en especial la se- lección de mutantes, en fuerte combinación con numerosas herramientas biotecnológicas tanto para mejora- miento como para investigación en genética (Deng, 2008).
En España, el inicio de las actividades formales de mejoramiento genético, se iniciaron como consecuencia de la fuerte incidencia del virus de la tristeza de los cítricos que ocasionó importantes pérdidas económicas en la década de los 60 (Navarro y Ballester, 1976). La comunidad valenciana lidera la producción de naranjas (59 %) y mandarinas (73,3 %), mientras que la Comunidad de Murcia la de limones (55 %). En el año 1975 se creó el Programa de Mejora Sanitaria de Cítricos, el cual involucra tres programas coordinados: Sanea- miento, Cuarentena y Certificación. Los objetivos del programa eran obtener y proveer plantas sanas a través de un sistema de certificación y el mantenimiento en un banco de germoplasma de cítricos. Cada programa es responsabilidad de una institución pública diferente: el Programa de Saneamiento se desarrolla en el Instituto Valenciano de Investigaciones Agrarias (IVIA) en donde también se encuentra el Banco de Germoplasma de Cítricos (BGCI); el Programa de Cuarentena se desarrolla en la Unidad de Sanidad Vegetal del Ministerio de Agricultura y Recursos Marinos (MARM); y el de Certificación se lleva a cabo de forma compartida entre la Oficina Española de Variedades Vegetales (OEVV) del MARM y los servicios competentes de las Comu- nidades Autónomas. En Murcia, el Grupo de Citricultura del IMIDA (Instituto Murciano de Investigación y Desarrollo Agrario y Alimentario) viene desarrollando un “Programa de Mejora Genética del Limonero”, con el objetivo de obtener clones tardíos de la variedad “Fino” mediante cruzamientos.
Cabe aclarar la importancia que tiene la conservación de germoplasma, especialmente en un cultivo como los cítricos cuya producción se basa en unas pocas variedades seleccionadas de alto rendimiento, y en donde existe una riquísima fuente de germoplasma “no utilizado”, y que muchos genotipos son abandonados y se pierden. Actualmente, el BGCI del IVIA consta de 694 genotipos y tres colecciones: la de campo, la de inver- nadero y una colección de callos embriogénicos crioconservados (Ancillo y Medina, 2017).
En Brasil, las instituciones que llevan a cabo el mejoramiento de cítricos son varias, tales como el Centro de Citricultura Sylvio Moreira- Instituto Agronômico de Campinas (CCSM-IAC); Escola Superior de Agricultu- ra Luiz de Queiroz da Universidade de São Paulo (ESALQ-USP), Centro de Energía Nuclear na Agricultura, Universidade de São Paulo (CENA-USP), Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA), e Ins- tituto Agronômico do Paraná (IAPAR), Instituto Agronómico, en Cordeirópolis (São Pablo), y en EMBRAPA, en Cruz das Almas (BA). La introducción de germoplasma exótico está estrictamente regulado por EMBRAPA (EMBRAPA, 2016) o por el Instituto Agronómico de Campinas (Dudienas et al., 2017). El programa de mejoramiento genético de EMBRAPA data desde 1970 (EMBRAPA, 2015) e involucra la evaluación de germoplasma y la evaluación agronómica de nuevos híbridos para portainjertos. La colección de germoplasma se inició en la década de los treinta y cuenta con más de 1.700 accesiones que representan todas las especies y variedades de cítricos. Se considera la colección de genotipos cítricos más grande del mundo (Carvalho et al., 2019).
En India, el mejoramiento del cultivo en forma organizada comenzó con la creación del Consejo de Investiga- ción Agrícola (ICAR) en el año 1929. Antes de eso el trabajo estaba en manos de productores locales que se- leccionaban genotipos destacados, o se introducía germoplasma exótico. Desde 1929 hasta 1997, con la ayuda del ICAR, se crearon varias estaciones de experimentación agrícola en diferentes zonas del país, destinadas a atender problemáticas locales. En India existe una red interactiva de institutos de investigación de la que también forman parte numerosas universidades, no sólo dedicados al mejoramiento de cítricos, sino también de otra gran cantidad de frutas, hortalizas y flores. Este país es un centro de diversidad genética muy impor- tante de numerosos cultivos. Esta base genética local, junto a la introducción de material genético exótico, ha permitido la generación de numerosos nuevos cultivares de diferentes cultivos comerciales que se producen en ese país. El “Centro Nacional de Investigaciones en Citrus” localizado en Nagpur en el estado de Maharas- htra, famoso por las mandarinas “orange” (Citrus reticulata), fue creado en 1985 para mantener una riquísima colección de germoplasma de India (Hasan y Suresh, 2008).
Italia comenzó las actividades de mejoramiento en la década de 1940. En 1978 comenzaron un importante programa para la generación de triploides. Actualmente hay una fuerte interacción del “Consejo de Investigación Agrícola” (CREA) y el sector privado de productores que acelera la evaluación del germoplasma y la llegada al sector productivo. En el CREA se realiza la generación y evaluación de germoplasma, mutaciones, sanea- miento e introducción de material exótico, mientras que en el sector privado se realizan las evaluaciones en campo, análisis económico y llegada a la producción comercial. A diferencia de lo que ocurre en otros países, en Italia el mejoramiento de los cítricos está fuertemente financiado por fondos privados (Caruso et al., 2016). En Japón, el “Instituto Nacional de Ciencia de la Fruta” inició un fuerte Programa de Mejoramiento de Cítri- cos en el año 1909 (Nesumi y Matsumoto, 2003), fundamentalmente en base a las actividades de selección de mutaciones espontáneas, como ocurrió en el resto de los países en esa época (Nishiura, 1964). La hibridación se fue incorporando lentamente, lográndose varios genotipos comerciales como el tangor “Kiyomi”, un híbri- do de mandarina “Miyagawa-wase” y naranja “Trovita”, el primer cultivar de tangor que se lanzó en Japón, con excelente calidad alimenticia, sabor, alto contenido de jugo y semillas monoembrionarias (Nishiura et al., 1983). Desde la segunda mitad de la década de 1990, se lanzaron nuevos cultivares enriquecidos en compo- nentes funcionales, incluidos los carotenoides como la β-criptoxantina y/o polimetoxiflavonoides, como la variedad de naranja “Kankitsu Chukanbohon Nou 6 gou”. La mandarina satsuma se adapta al clima japonés y se ha cultivado extensivamente durante más de 100 años en Japón, la cual tiene un lugar privilegiado en los programas de mejora, y cuyos principales objetivos son la calidad de la fruta, la producción estable y resisten- cia al estrés biótico (Omura y Shimada, 2016).
En Argentina existen dos instituciones que llevan a cabo el mejoramiento de los cítricos. El Instituto Nacional de Tecnología Agropecuaria (INTA) y la Estación Experimental Agroindustrial Obispo Colombres (EEAOC). El INTA, mediante el Programa Nacional de Frutales, investiga en mejoramiento genético y trabaja con los productores para asegurar calidad y eficiencia. En la provincia de Tucumán, noroeste del país, en la Estación Experimental de Famaillá, desde 1970 se trabaja en la obtención de variedades mejoradas, como así también en la sanidad en cultivo y poscosecha (INTA informa, 2016a). Cuenta con una colección de germoplasma pro- pio y exótico, introducido desde diferentes partes del mundo. Por otro lado, en el noreste del país destacado por la producción de dulces (naranjas, mandarinas y pomelos), el INTA Concordia en la provincia de Entre Ríos, trabaja en el desarrollo integral de la cadena productiva, desde la producción de germoplasma, semillas y yemas de plantas madres saneadas, como así también en el desarrollo de técnicas de manejo, sanidad, comer- cialización, etc. (INTA informa, 2016b). Esta institución cuenta con el “Programa de Mejoramiento Genético y Sanitario de Cítricos” desde 1984, y el “Centro Único de Introducción y Saneamiento (CUIS)”, el cual con- tiene el Banco de Germoplasma y de variedades comerciales saneadas y en aislamiento que cuenta con más de 220 genotipos cítricos comerciales con identidad genética y sanidad controlada. También se realiza la intro- ducción, injerto por micropropagación, diagnóstico y mantenimiento en condiciones de seguridad de varieda- des cítricas, que luego son certificadas por el Instituto Nacional de Semillas (INASE) y el Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA) y multiplicadas en viveros (INTA informa, 2016a). Esa unidad del INTA mantiene una colección de casi 1.000 variedades cítricas en campo y tiene ensayos con tecnologías innovadoras como plantaciones en alta densidad, fertirrigación y técnicas de manejo para disminuir el uso de plaguicidas (INTA informa, 2016a). Los laboratorios de Protección Vegetal y Biotecnología (Registro RNCFS 5983/AI) y el CUIS de INTA Concordia, son responsables de la introducción y mantenimiento de variedades en proceso de saneamiento, variedades saneadas (original y réplica) y de los análisis de enfermedades acorde a lo dispuesto por la Resolución 149/98 de la Secretaría de Agricultura, Ganadería, Pesca y Alimentación, denominada “Normas para la producción, comercialización e introducción de plantas cítricas de vivero y sus partes”. El CUIS provee varetas yemeras para formar los lotes de preincremento en el Centro Proveedor de Material Certificado “El Alambrado”, el cual provee de material de incremento y comercial a viveristas para producir plantas cítricas certificadas, de acuerdo a lo requerido por el Programa Nacional de Certificación de Cítricos (Plata Tamayo et al., 2015).
La EEAOC en la provincia de Tucumán, es otra de las instituciones que trabajan en el mejoramiento de los cí- tricos. La EEAOC, ente autárquico del Ministerio de Desarrollo Productivo del Gobierno de Tucumán, inició un Programa de Mejoramiento Genético de Portainjertos en el año 1960, el cual se encuentra vigente (http:// www.eeaoc.org.ar/proyectos/133/Programa-Citrus.html). El objetivo del programa es desarrollar genotipos de portainjertos específicos para la industria limonera local, con resistencia o tolerancia a enfermedades, adapta- ción a las condiciones ecológicas, y que favorezcan una calidad de fruta que responda a las exigencias del mercado nacional e internacional. En el período comprendido entre 1960 y 1995 se realizaron 128 cruzamientos, empleando 99 progenitores femeninos y 40 masculinos, y 1859 híbridos fueron evaluados en campo. Como resultado de estos trabajos, en el año 2006 se inscribieron en el INASE y se liberaron al cultivo comercial tres portainjertos: Citrandarin 61 AA 3, Citrumelo 75 AB, 79 AC (Cleopatra x Citrumelo Swingle), 81 G 220 y 81 G 513, estos últimos, producto de un cruzamiento de Volkameriano x Cleopatra (Stein y Foguet, 2015). En las primeras décadas del siglo XX, la EEAOC introdujo numerosas especies y variedades cítricas que fueron las bases de su colección de germoplasma cítrico ubicado en el predio experimental en la sede central y que cuenta con aproximadamente 700 genotipos. Al igual que INTA, la EEAOC también cuenta con un Centro de Saneamiento habilitado por el INASE desde octubre del año 2004, el cual realiza el saneamiento, diagnóstico de virosis y provisión de semillas y yemas certificadas a los productores locales (Figueroa et al., 2019).
Consideraciones finales
La evolución que han tenido los cítricos a lo largo de su historia es sorprendente. El mejoramiento de este cultivo, como de las especies leñosas en particular, exige un esfuerzo y riesgos extras, considerando que los resultados de innovaciones no son de visibilidad inmediata. Gracias a las nuevas tecnologías, esta espera e incertidumbres han disminuido, aunque también han surgido otros nuevos obstáculos por sortear. Entre ellos se pueden mencionar los asociados al ya inminente cambio climático que genera un panorama desconocido e incierto en cuanto al escenario en el que se deberá desarrollar el cultivo, así como también la percepción pública, el marco regulatorio y, muchas veces los precios bajos y costos elevados que han puesto en crisis a la industria a nivel mundial. Es por ello la importancia de la implementación de tecnologías que permitan incrementar la eficiencia productiva del cultivo y que aseguren su continuidad, no sólo por el valor nutricional e industrial del producto, sino también por la importancia social, ya que la citricultura moviliza una gran can- tidad de actividades paralelas que son el sustento de muchas economías regionales y nacionales.