Services on Demand
Journal
Article
Indicators
-
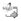 Cited by SciELO
Cited by SciELO
Related links
-
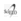 Similars in
SciELO
Similars in
SciELO
Share
Lilloa
Print version ISSN 0075-9481On-line version ISSN 2346-9641
Lilloa vol.55 no.2 San Miguel de Tucumán Dec. 2018
http://dx.doi.org/10.30550/2018.55.2/5
Lilloa 55 (2): 47-66, 7 de diciembre de 2018
Artículo original https://doi.org/10.30550/2018.55.2/5Análisis micromorfológico de Senecio subserie Polyphylli (Senecioneae, Asteraceae)
Micromorphological analysis of Senecio subseries Polyphylli (Senecioneae, Asteraceae)
Hernández Marcelo P.1,2* ; Daniel A. Giuliano1 ; Susana E. Freire3
1rea de Botánica, Depar tamento de Ciencias Biológicas, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, Avda. 60 entre 116 y 118, (1900) La Plata, Argentina.
2LAMCE (Laboratorio de Morfología Comparada de Espermatófitas), rea de Botánica, Departamento de Ciencias Biológicas, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, Avda. 60 entre 116 y 118, (1900) La Plata, Argentina
3Instituto de Botánica Dar winion, Casilla de Correo 22, Labardén 200, (B1642HYD) San Isidro, Buenos Aires, Argentina.
* Autor corresponsal: mphciencia@yahoo.com
Resumen
Se presenta un estudio micromorfológico de las especies de la subserie Polyphylli del género Senecio. Se analizaron caracteres vegetativos (tricomas foliares) y reproductivos (tricomas de los filarios y aquenios; vena media de los dientes de la corola tubulosa; collares, bases y apéndices conectivales de las anteras; polen; ramas del estilo, aquenios). Se presenta una clave basada en microcaracteres para diferenciar a las especies de la subserie.
Palabras clave: Anteras; Compositae; corolas; polen; ramas del estilo; tricomas; Sudamérica.
Abstract
A micromorphological study of the species of Senecio subseries Polyphylli is presented. Vegetative (leaf trichomes) and reproductive characters (phyllary and achene trichomes; middle vein of the tubulose corolla teeth; anther collars, anther bases, and connectival appendages; pollen; style branches; achenes) are analyzed. A key based on microcharacters for the identification of the species is presented.
Keywords: Anthers; Compositae; corollas; pollen; style branches; trichomes; South America.
Original recibido el 10 de julio de 2018,
aceptado el 08 de noviembre 2018.
INTRODUCCIN
El género Senecio L. en su circunscripción tradicional comprendía aproximadamente 3000 especies prácticamente cosmopolitas, constituyendo una de las unidades sistemáticas más grandes dentro de las Angiospermas en general y de las Asteraceae en particular (Cabrera, 1949). Esta concepción amplia del género se basó en estudios sistemáticos de importancia del siglo XIX, basados en caracteres macromorfológicos, entre los que pueden mencionarse los de De Candolle (1838), Bentham (1873) y Hoffmann (1894). Más recientemente, algunos autores (Cuatrecasas, 1960; Nordenstam, 1978a, 1978b), sobre la base de microcaracteres, tales como la disposición de los tricomas en el ápice de las ramas estilares, el tipo de collar de los filamentos estaminales, los engrosamientos de las células del endotecio de las anteras y las áreas estigmáticas de las ramas del estilo, propusieron la elevación de grupos de especies o secciones previamente esta- blecidas a la categoría de género. El género Senecio s.str. quedó, de acuerdo con estos autores, restringido a cerca de 1500 especies de distribución cosmopolita, y definido por los siguientes caracteres: filamentos de los estambres con collares dilatados en la base («balusteriformes»), ramas del estilo truncadas en el ápice donde llevan una coronita de pelos colectores, y áreas estigmáticas discontinuas. Así entonces una gran cantidad de nuevos géneros fueron segregados de Sene- cio y otros fueron rehabilitados (Robinson y Brettell, 1973a, 1973b, 1973c, 1973d, 1974; Robinson, 1978; Nordenstam, 1976, 1978a, 1978b, 2006; 2007; Jeffrey, Halliday, Wil- mot-Dear, Jones, 1978; Jeffrey, 1980; Pelser, Nordenstam, Kadereit, Watson, 2007, 2009). Más recientemente, sobre la base de estudios moleculares, Pelser et al. (2007) y Nordenstam et al. (2009) han redefinido la circunscripción del género Senecio a cerca de 1000 especies.
MATERIALES Y MÁTODOS
1. Material estudiado
Se revisaron ca. 360 ejemplares de her- bario de Senecio subser. Polyphylli correspondientes a las siguientes instituciones: BAA, BAB, CONC, CORD, CTES, GH, K, LP, LPAG, MCMS, NY, P, SGO, SI (Thiers, 2018). También se estudiaron materiales frescos de Senecio farinifer colectados por uno de los autores (M.P.H.) en la provincia de San Juan en febrero de 2016. En el apéndice 1 se citan las especies estudiadas acompa±adas por el material examinado.
2. Metodología
Tricomas y papilas.â Para el estudio y análisis detallado de los tricomas y papilas de hojas, filarios y aquenios, se utilizó material de herbario. El material seleccionado se hidrató en una solución de agua destiladadetergente, en estufa a 40 oC, durante 24 hs. y se fijó y conservó en una solución FAA (constituida por formaldehido al 40%-100 ml, alcohol etílico 96o-500 ml, ácido acético 50 ml, agua destilada 350 ml). El material se diafanizó utilizando el método de Dizeo de Strittmatter (1973). Los cortes transversales de hojas, filarios y aquenios se realizaron a mano alzada, se decoloraron con hipoclorito de sodio 5 % durante 5-20 min. y se ti±eron con safranina 80% y, se montaron en gelatina-glicerina o en glicerina-agua destilada 1:1 (Zarlavsky, 2014). Para evidenciar el mucílago de los pelos gemelos de los aquenios, se utilizó una técnica histoquímica basada en la tinción con azul brillante de cresilo 1 % (Zarlasvky, 2014). Para el análisis morfológico de los tricomas se utilizó la terminología propuesta por Ramayya (1962).
Corolas, anteras y estilos.â Para el estudio de los microcaracteres florales, se utilizaron 5-10 flores maduras marginales y 5-10 flores del centro del capítulo por espécimen. Según su estado de conservación, el material seleccionado se hidrató utilizando una solución de agua destilada-detergente, en estufa a 40 oC, durante 24 hs o, hirviéndolo en agua caliente y detergente. Parte del material se fijó y conservó en una solución FAA; el resto, se diseccionó separando corolas, anteras y estilos, posteriormente clarificados a temperatura ambiente en hipoclorito de sodio 5% durante 5-10 min. Finalmente, el material diseccionado se ti±ó con safranina 80 % y se montó en gelatina-glicerina.
Las observaciones de tricomas, papilas y microcaracteres florales, se realizaron con lupa binocular Willd M8, microscopio óptico Gemalux equipado con cámara Moticam 1000 y software MoticImages Plus 2.0 y, microscopio óptico CETI equipado con cámara clara. También se realizaron observaciones con Microscopía Electrónica de Barrido (MEB) en muestras seleccionadas de estilos. Para la preparación de las muestras se siguió el protocolo que se detalla a continuación:
Polen.â Se utilizaron flores tubulosas del centro inmaduras (5-20 flores por espécimen) y los granos de polen fueron tratados por acetólisis. La acetólisis se desarrolló siguiendo el protocolo presentado por Erdtman (1960) con algunas modificaciones. Los granos de polen seleccionados se montaron en gelatina-glicerina; las observaciones se hicieron con un microscopio óptico Nikon equipado con cámara clara y cámara fotográfica Nikon Coolpix S10. Asimismo, muestras acetolizadas fueron tratadas con hexametildisilazano (HMDS) siguiendo el protocolo presentado por Brown (1993) y montados en una cinta doble faz; las muestras fueron recubiertas por pulverización catódica con oro / paladio (Mini catódica SC 7620) y se observaron con MEB (PHILIPS XL30). Para el análisis morfométrico de los granos de polen se utilizó la terminología propuesta por Erdtman (1969).
Para el estudio de las estructuras men- cionadas anteriormente, se confeccionaron y analizaron cerca de 370 preparados (MO).
RESULTADOS Y DISCUSIN
Tricomas
Las especies de la subserie Polyphylli presentan tricomas eglandulares y glandulares en tallos, hojas y filarios.
Los tricomas eglandulares son pluricelu- lares, uniseriados y simples, y están presentes en la mayoría de las especies estudiadas; solo están ausentes en S. famatinensis, S. niederleinii, S. otaeguianus, S. pseudalmeidae y S. segethii. En su mayoría están constituidos
por un cuerpo formado por 2-18 células y una célula apical flagelada larga. En algunas especies (i.e. S. eightsii, S. farinifer, S. pseudaspericaulis y S. punae) estos tricomas se presentan densamente dispuestos y anastomosados adquiriendo un aspecto lanuginoso (Fig. 1 C). En S. nublensis, el flagelo se une al cuerpo por 1-2 células de paredes engrosadas (Fig. 1 A). En solo unas pocas especies (i.e. S. portulacoides, S. retanensis y S. triodon), estos tricomas presentan un cuerpo constituido por 7-18 células, aparentemente sin flagelo apical (Fig. 1 B).
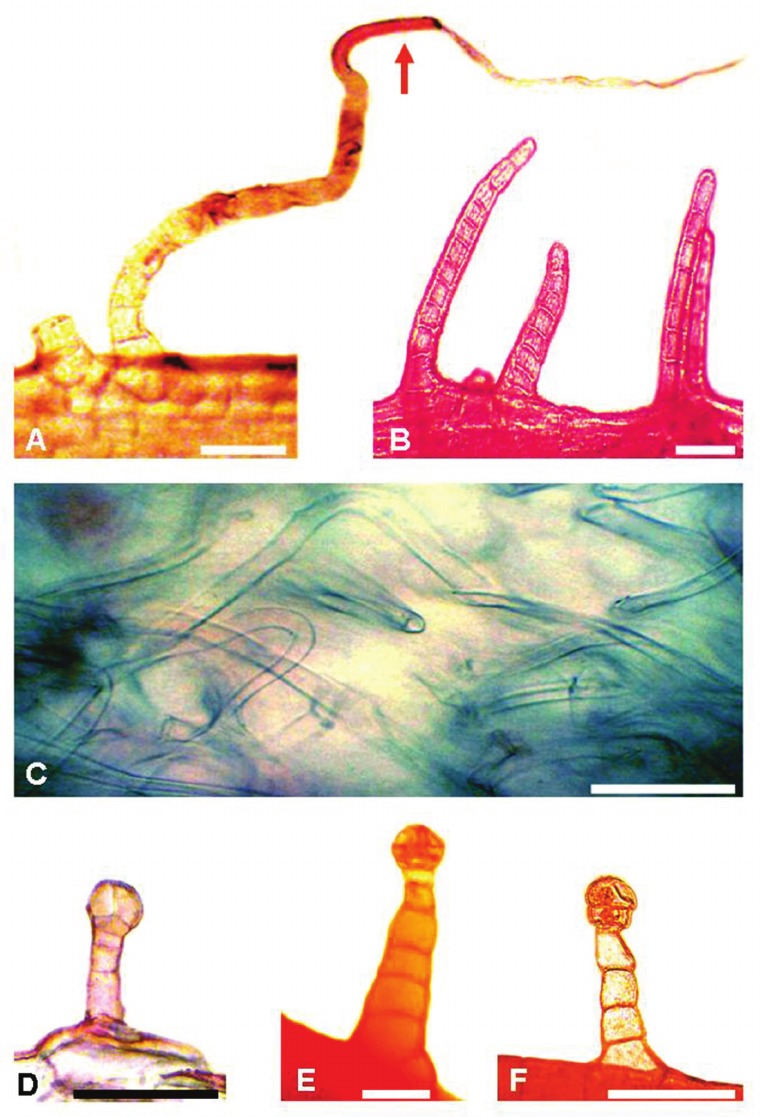
Fig. 1. Tricomas foliares (Fotografías al MO). Tricomas eglandulares: A) S. nublensis. B) S. portulacoides. C) S. eightsii. Tricomas glandulares: D) S. aspericaulis. E) S. retanensis. F) S. subpubescens. Barra de escala: 100 μm.
Los tricomas glandulares presentan un cuerpo uniseriado, constituido por 2-9 células y una cabeza formada por 1-8 células (Fig. 1 D, E, F; Fig. 2 B, C). Estos tricomas se hallan presentes en las siguientes especies: S. achalensis, S. aspericaulis, S. chrysanthemum, S. farinifer, S. nublensis, S. otaeguianus, S. portulacoides, S. potosianus, S. retanensis, S. steparius, S. subpubescens y S. triodon. En el dorso de los filarios de S. polyphyllus, hay tricomas glandulares con un cuerpo uniseriado, constituido por 4-6 células, sin cabeza diferenciada, donde el contenido celular puede estar en la célula apical o en todo el cuerpo (Fig. 2 D, E).
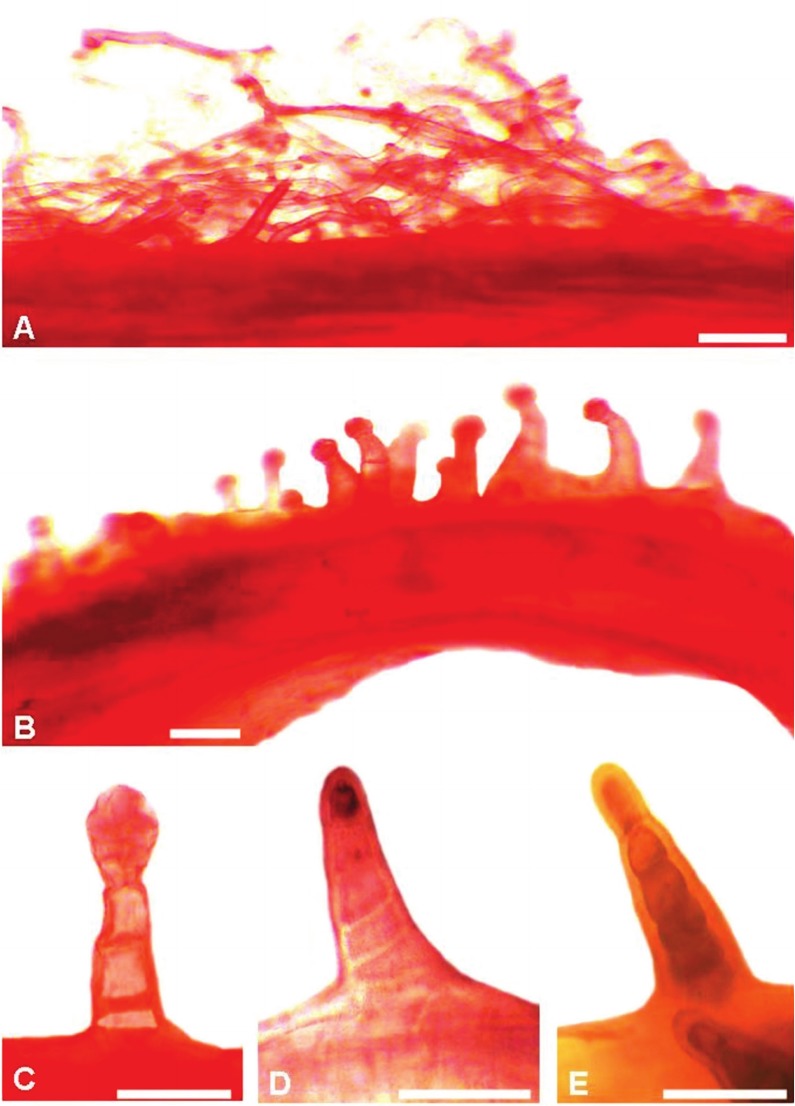
Fig. 2. Tricomas del dorso del filario (Fotografías al MO). Tricomas eglandulares: A) S. eightsii. Tricomas glandulares: B y C) S. farinifer. D y E) S. polyphyllus. Barra de escala: 100 μm.
Corolas
Todas las especies presentan capítulos con flores marginales con corolas liguladas y flores del centro con corolas tubulosas 5- dentadas. Los dientes pueden presentar o no, una vena media longitudinal (Fig. 3 y 4). Esta vena está presente en las siguientes especies: S. achalensis, S. chrysanthemum, S. famatinensis, S. madariagae (esta última especie presenta una vena muy gruesa; Fig. 4 A), S. niederleinii, S. portulacoides, S. pseudalmeidae, S. punae, S. retanensis, S. segethii, S. steparius, S. subpubescens y S. triodon. Asimismo, en S. farinifer, S. nublensis, S. lilloi y S. otaeguianus, la vena media puede estar o no presente. En todos los casos cada diente presenta dos venas marginales que en ocasiones se unen el ápice (Fig. 3 A, B, C)
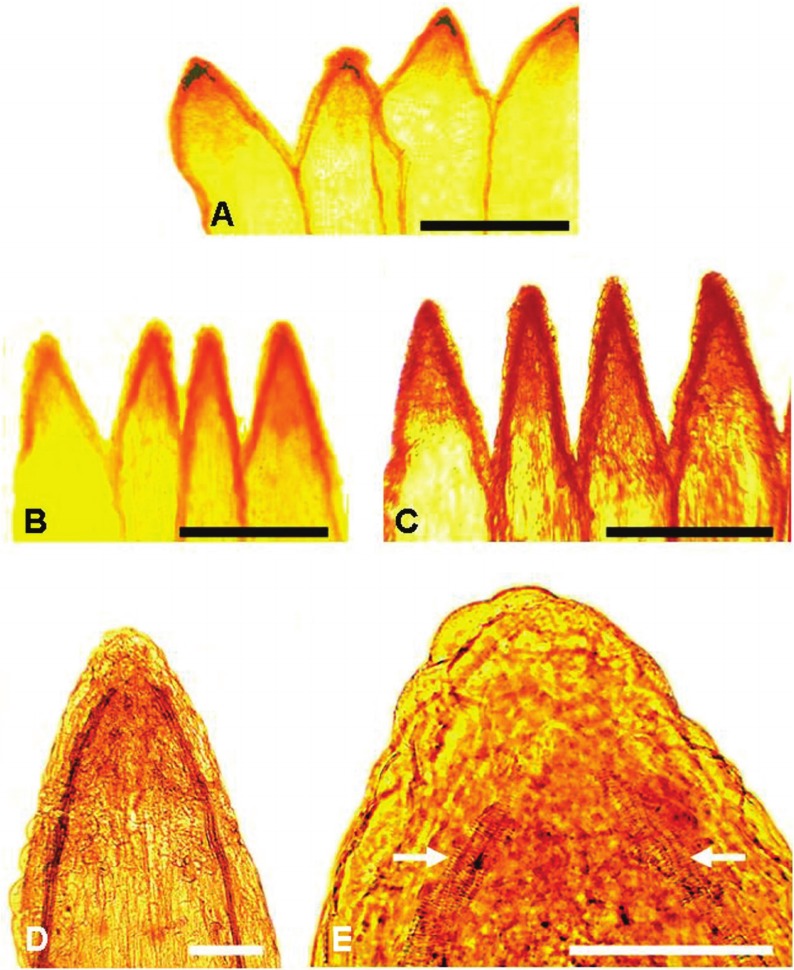
Fig. 3. Dientes de la corola tubulosa sin vena media (Fotografías al MO): A) S. pseudas- pericaulis. B) S. famatinensis. C) S. krapovickasii. D) S. chrysantemum mostrando las venas marginales. E) S. chrysantemum mostrando la vascularización marginal en el ápice del diente. Barra de escala: A y C = 0,5 mm; D y E = 100 μm.
Anteras
Las anteras de las especies del género Se- necio pertenecientes a la subserie Polyphylli presentan las siguientes características morfológicas:
Collares.â Numerosos autores (e.g. Koyama, 1967; Drury, 1973; Nordenstam, 1978c; Robinson y Brettell, 1973d; Jeffrey et al., 1978) han se±alado el valor taxonómico de la forma de los collares de las anteras. En la subserie Polyphylli se hallaron tres tipos morfológicos: 1. Collares cilíndricos (sensu Drury, 1973): diámetro150-200 μm, largo menor a 1000 μm (Fig. 5 A, E); 2. Collares largamente cilíndricos (sensu Hernández, Giuliano, Freire, 2013): diámetro 60-120 μm, largo mayor a 1000 μm (Fig. 5 C); 3. Collares balusteriformes (sensu Drury, 1973): diámetro 100-300 μm, largo menor o igual a 1000 μm (Fig. 5 G, I).
Apéndices conectivales.â Teniendo en cuenta el valor taxonómico de la forma de los apéndices conectivales de las anteras (Jeffrey, 1980), en todos los taxones examinados se hallaron dos tipos morfológicos: 1. Apéndices conectivales oblongos: ancho 190- 440 μm, largo 500-900 μm (Fig. 5 D, F, H); 2. Apéndices conectivales ovados o elípticos: ancho 190-370 μm, largo 370-750 μm (Fig. 5 B, J).
Teniendo en cuenta la morfología de los collares y apéndices conectivales, los taxones estudiados conforman tres grupos y dos subgrupos:
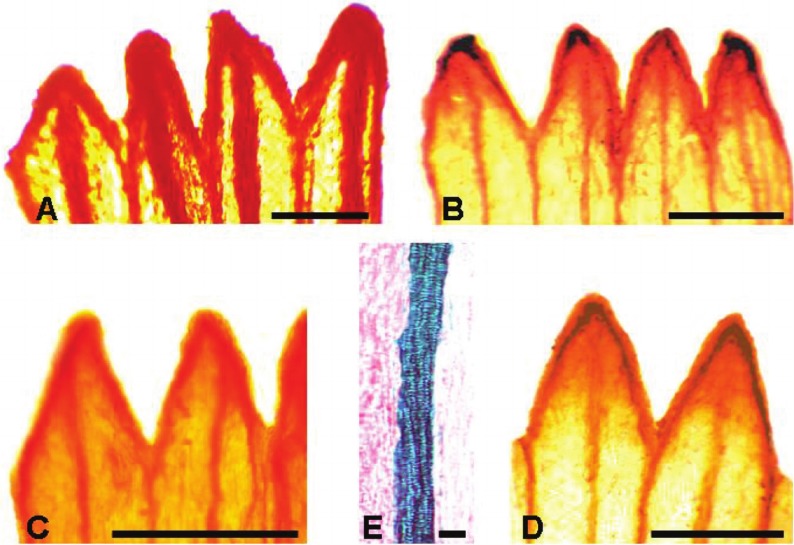
Fig. 4. Dientes de la corola tubulosa con vena media (Fotografías al MO): A) S. madariagae. B) S. niederleinii. C) S. steparius. D) S. farinifer. E) S. chrysantemum: Detalle de la vena media. Barra de escala: A = 1 mm; B y D = 0,5 mm; E = 1 μm.
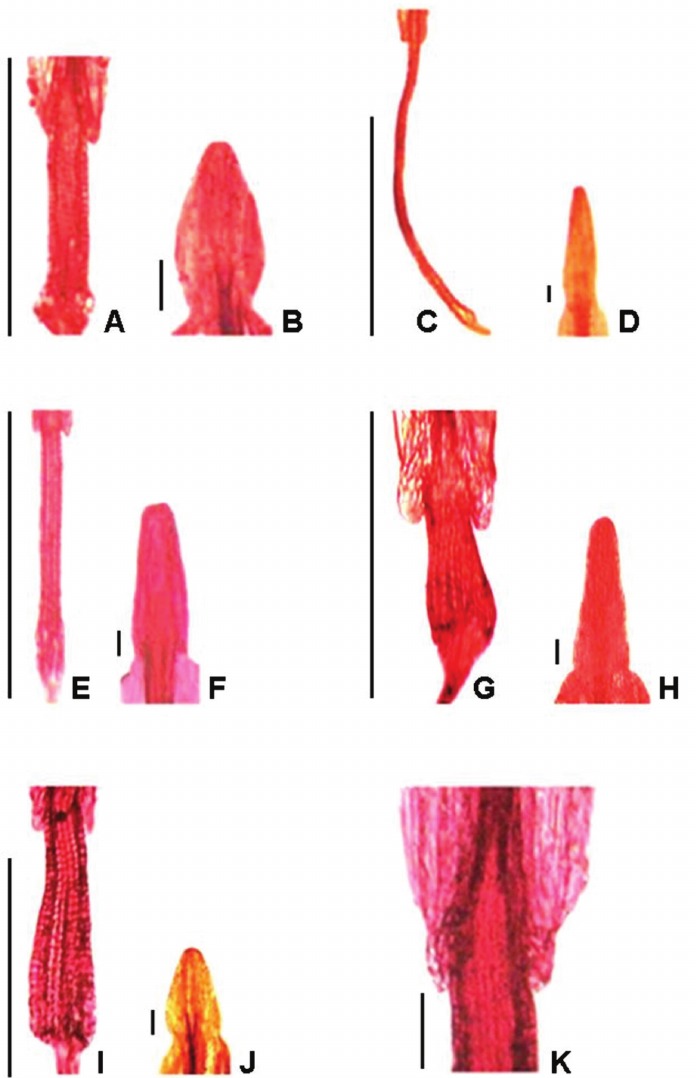
Fig. 5. Collares de las anteras (Fotografías al MO): A) S. subpubescens. C) S. aspericaulis. E) S. pseudaspericaulis. G) S. nublensis. I) S. portulacoides. Apéndices conectivales de las anteras (MO): B) S. subpubescens. D) S aspericaulis. F) S. pseudaspericaulis. H) S. nublensis. J) S. portulacoides. Base de la antera (MO): K) S. nublensis. Barra de escala: A, C, E, G y I = 1 mm; B, D, F, H, J y K = 100 μm.
Base de las anteras.â En Senecio s. str. se han hallado anteras de bases obtusas o redondeadas, auriculadas o sagitadas (Nordenstam, 2007; Pelser et al., 2007; Salomón, Hernández, Giuliano, Freire, 2016). Sin embargo, en la subserie Polyphylli, todos los taxones estudiados presentan anteras con bases auriculadas (Hernández et al., 2013) (Fig. 5 K).
Polen
En la Tabla 1 se presentan los caracteres palinológicos estudiados de cada especie de la subserie Polyphylli.
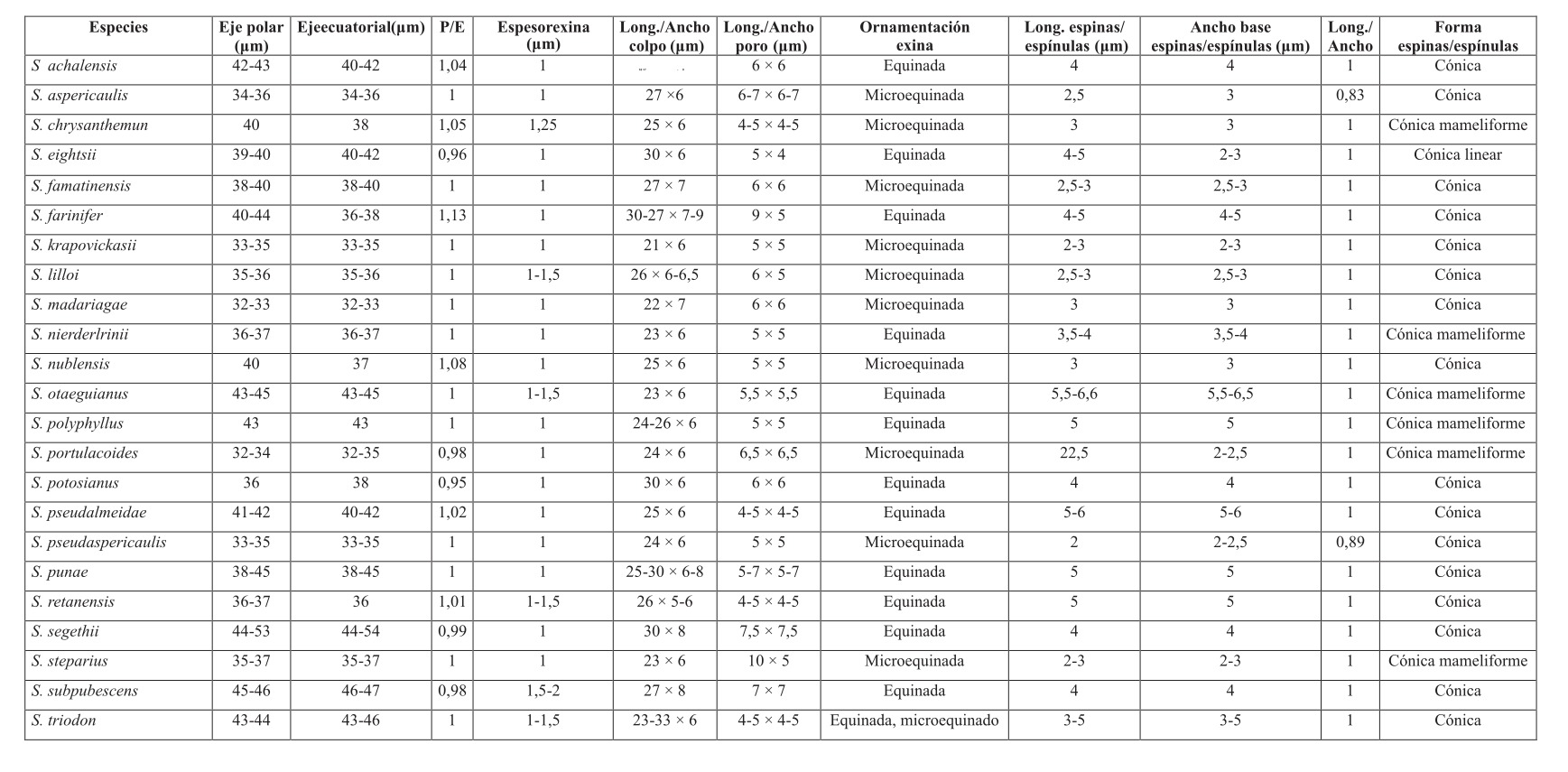
Tabla 1. Caracteres morfológicos del polen en la subserie Polyphylli.
Espesor de la exina.â Los taxones estudiados, presentan un espesor que varía de 1 a 2 μm.
Ornamentación (escultura) de la exina.â La ornamentación es equinada (espinas de 3,5-6,5 μm de largo.) (Fig. 6 C, D; Fig. 7 B) o microequinada (= equinulada; espínulas de 2-3 um long.) (Fig. 6 A, B; Fig. 7 A) o, puede presentarse una combinación de am- bos tipos de ornamentación. La relación largo y ancho basal (l/a) de espinas y espínulas, varía desde 0,83 en S. aspericaulis hasta 1,3 en S. eightsii. La forma general de las espinas es cónica, tal como fue mencionado por Vincent y Getliffe Norris (1989) para especies africanas de Senecio. Sin embargo en los taxones estudiados existe una variación de las espinas y espínulas en longitud, ancho basal y ápice; de esta manera en la subserie Polyphylli se presentan espinas cónicas, cónicas mameliformes (Fig.7 F) y cónicas lineares (Fig. 7E) y, espínulas cónicas (Fig. 7 C) y cónicas mameliformes (Fig. 7 D).
Según el tipo de ornamentación y la forma de las espinas/espínulas, los taxo- nes estudiados forman dos grupos y cinco subgrupos:
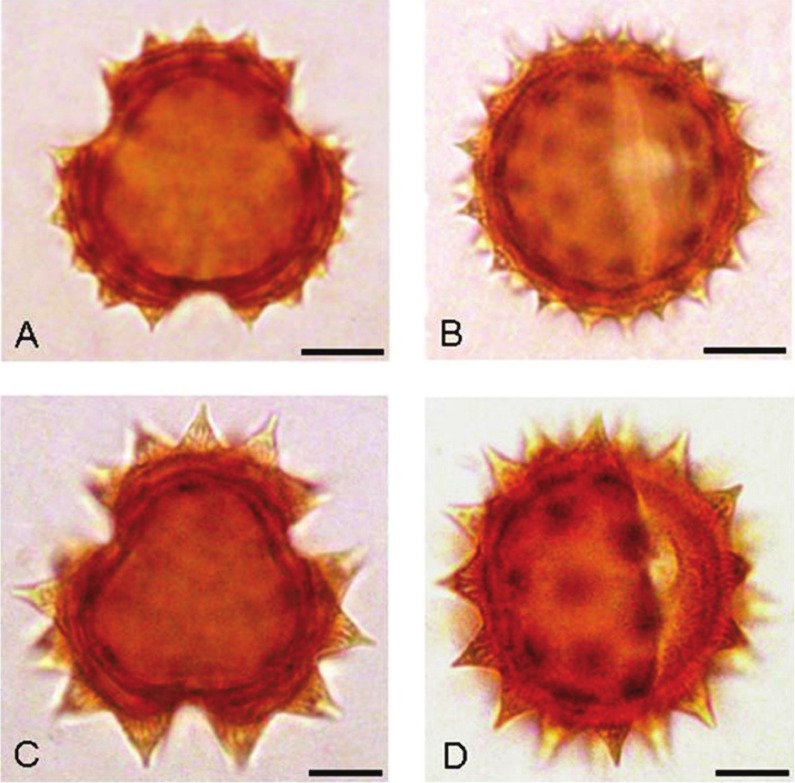
Fig. 6. Granos de Polen (Fotografías al MO). A) Grano microequinado (vista polar). B) Grano microequinado (vista ecuatorial). C) Grano equinado (vista polar). D) Grano equinado (vista ecuatorial). A y B) S. famatinensis.C y D) S. otaeguianus. Barra de escala: 10 μm.
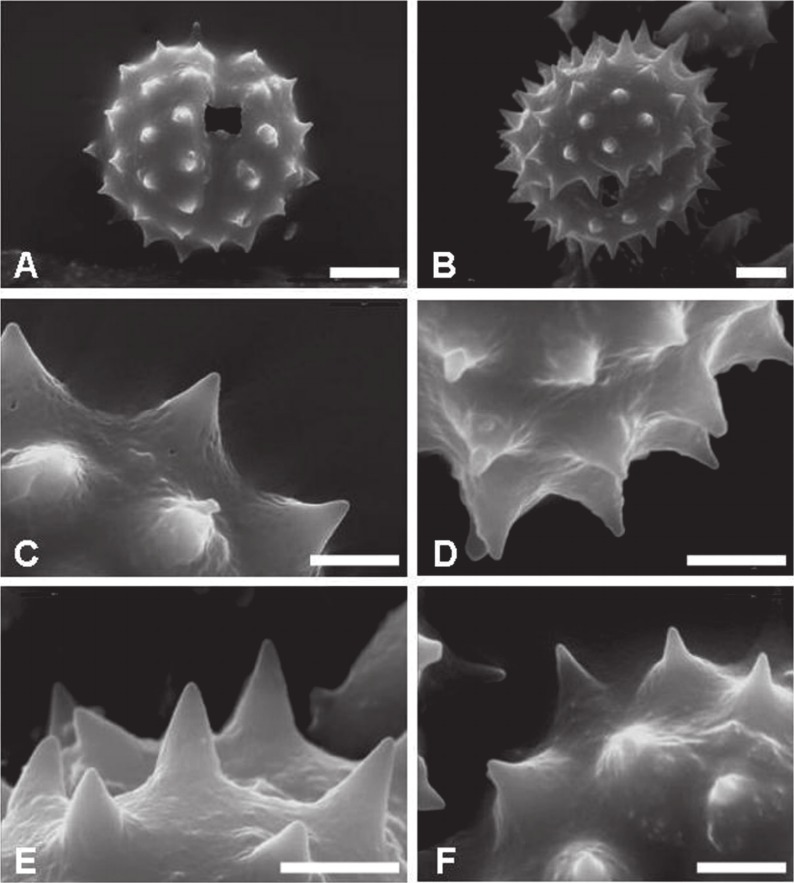
Fig. 7. Granos de Polen (Fotografías al MEB). A) Grano microequinado (vista ecuatorial). B) Grano equinado (vista ecuatorial). C) Espínula cónica. D) Espínula mameliforme. E) Espina cónica linear. F) Espina cónica mameliforme. A y F) S. portulacoides. B y E) S. eightsii. C) S. aspericaulis. D) S. polyphyllus. Barra de escala: A y B = 10 μm; C y F = 2 μm; D y E = 5 μm. E. Reproducido con autorización de PHYTOTAXA 244 (1): 8 (Fig. 1A). 2016. Copyright Magnolia Press, Auckland, New Zealand.
Ramas del estilo
En todas las especies de la subserie Polyphylli, las ramas del estilo son convexas a subconvexas en el ápice, menudamente papilosas y rodeadas por una corona de pelos. En aquellas especies que fueron estudiadas con MEB (Salomón et al., 2016), la superficie estigmática presenta la configuración tipo «hendida»; en ella, la hendidura media longitudinal a lo largo de las ramas estigmáticas no presentan una diferenciación morfológica notoria entre las células de los bordes de la hendidura y las células que conforman la misma (Fig. 8).
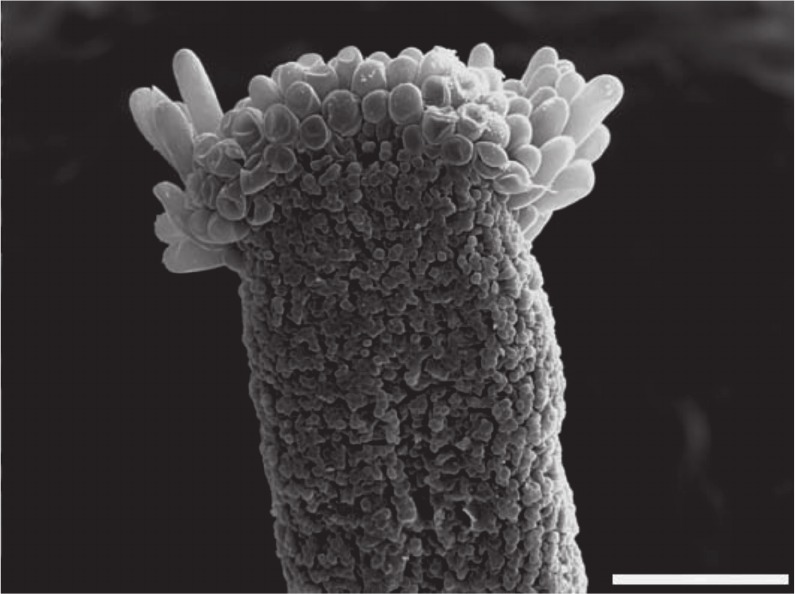
Fig. 8. Ramas de estilo (Fotografía al MEB): Senecio eightsii, configuración estigmática hen- dida, mostrando una rama del estilo con ápice subconvexo rodeado de tricomas cortos. Barra de escala: 100 μm. Reproducido con autorización de PHYTOTAXA 244 (1): 14 (Fig. 4B). 2016. Copyright Magnolia Press, Auckland, New Zealand.
Aquenios
Las especies de la subserie Polyphylli presentan aquenios cilindroides cuya superficie epidérmica puede ser glabra (Fig. 9 A) o pubescente (Fig. 9 C). El primer caso está representado por S. aspericaulis, S. chrysanthemum, S. eigthsii, S. niederleinii, S. portulacoides, S. segethii, S. subpubescens y S. triodon, mientras que en el segundo, se encuentran S. achalensis, S. famatinensis, S. krapovickasii, S. lilloi, S. madariagae, S. nublensis, S. otaeguianus, S. potosianus, S. pseudaspericaulis, S. punae, S. retanensis y S. steparius; en tanto S. pseudalmeidae puede presentar aquenios glabros o pubescentes. En algunas especies la superficie epidérmica puede ser papilosa (S. aspericaulis, S. farinifer, S. nublensis y S. polyphyllus, Fig. 9 B).

Fig. 9. Superficie del aquenio (Fotografías al MO): A) Lisa (S. triodon). B) Papilosa (S. polyphyl- lus). C) Aquenio cilindroide pubescente (S. krapovickasii). D) Contenido interno de mucílagos (S. madariagae). E) Contenido de mucílago expulsado (S. punae). Barra de escala: A, B, D y E = 100 μm; C = 1 mm.
En el caso de aquenios con superficie pubescente, se presentan pelos gemelos de 60 a 250 μm de largo, formados por dos células basales y dos células apicales simétricas. (Fig. 9 D, E; Fig. 10); estos pelos presentan sustancias mucilaginosas en su interior, las cuales son expulsadas a la madurez (Fig. 9: D y E; Fig. 10).
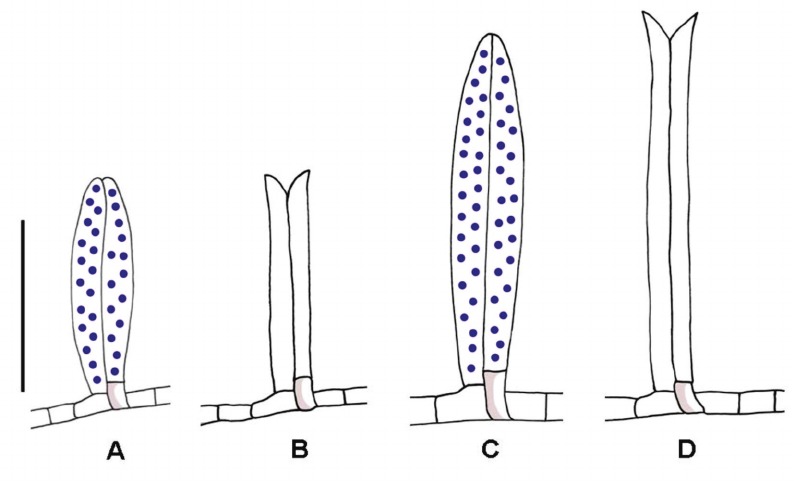
Fig. 10. Pelos gemelos de los aquenios con contenido de mucílago: A) S. potosianus. C) S. nublensis. Pelos gemelos de los aquenios una vez expulsado el contenido de mucílago: B) S. punae. D) S. lilloi. A, B, largo de hasta 150 μm; C, D, largo superior a 150 μm. Barra de escala: 100 μm. El contenido de mucílago se indica mediante puntos azules.
En la figura 11 se presenta una síntesis de los microcaracteres florales en Senecio subser. Polyphylli.
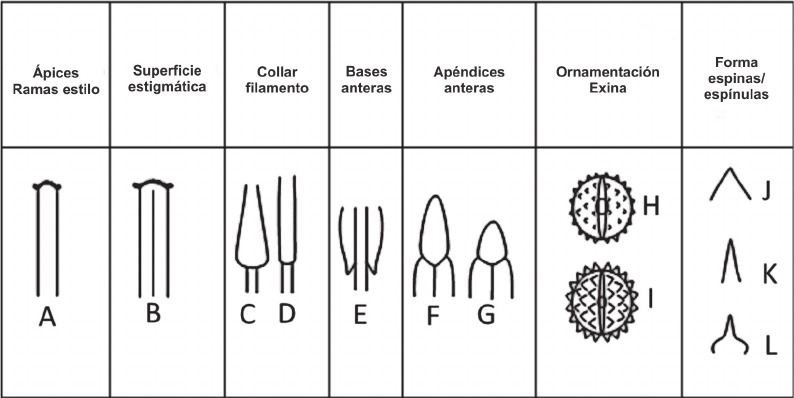
Fig. 11. Microcaracteres florales en Senecio subser. Polyphylli. A) pice convexo o subcon- vexo. B) Configuración tipo "hendidaâ. C) Collar balusteriforme. D) Collar cilíndrico. E) Base auriculada. F) Apéndice conectival oblongo. G) Apéndice conectival ovado o elíptico. H) Orna- mentación microequinada. I) Ornamentación equinada. J) Espina/espínula cónica. K) Espina cónica linear. L) Espina/espínula cónica mameliforme. Modificado con autorización de PHYTOTAXA 244 (1): 21 (Table 4). 2016. Copyright Magnolia Press, Auckland, New Zealand.
CONCLUSIN
Hasta el momento, las especies de Senecio subserie Polyphylli se hallan diferenciadas en claves dicotómicas basadas en macrocaracteres vegetativos y reproductivos; dos de ellas incluyen a las 17 especies argentinas (Cabrera et al., 1999; Freire, Ariza Espinar, Salomón, Hernández, 2014) mientras que la restante incluye a las 12 especies chilenas (Cabrera, 1949). Los datos micromorfológi- cos obtenidos en el estudio, han permitido confeccionar por primera vez una clave para diferenciar la totalidad de las especies de la subserie Polyphylli, la cual se presenta a continuación.
Clave de las especies Senecio subser. Polyphylli por microcaracteres vegetativos y reproductivos
1 Hojas sin tricomas ........................ 2
1' Hojas con tricomas eglandulares y/o tricomas glandulares .................... 5
2 Granos de polen microequinados, espínulas cónicas ......Senecio famatinensis
2' Granos de polen equinados ............ 3
3 Espinas cónicas ........................... 4
3' Espinas cónicas mameliformes ....... 5
4 Aquenios glabros ............. S. segethii
4' Aquenios pilosos con pelos gemelos ............................... S. pseudalmeidae 5 Dientes de la corola tubulosa con vena media. Apéndices conectivales de las anteras oblongos ......... S. niederleinii
5' Dientes de la corola tubulosa general- mente sin vena media. Apéndices conec- tivales de las anteras ovados ............................................ S. otaeguianus
6 Hojas con tricomas eglandulares y glan- dulares ...................................... 7
6' Hojas con tricomas eglandulares o glan- dulares .................................... 17
7 Collares de las anteras cilíndricos ... 8
7' Collares de las anteras balusteriformes ................................................ 9
8 Apéndices conectivales de las anteras oblongos. Granos de polen microequina- dos ........................ S. aspericaulis
8' Apéndices conectivales de las anteras ovados. Granos de polen equinados ................................. S. subpubescens
9 Apéndices conectivales de las anteras oblongos ................................. 10
9' Apéndices conectivales de las anteras ovados .................................... 13
10 Granos de polen microequinados, espínu- las cónicas o cónicas mameliformes ............................................... 11
10' Granos de polen equinados, espinas cónicas .................................... 12
11 Tricomas foliares flageliformes con 1-2 células de paredes engrosadas por debajo del flagelo apical. Espínulas cónicas .................................. S. nublensis
11' Tricomas foliares flageliformes sin células de paredes engrosadas por debajo del fla gel o api c al. Espínulas cónicas mameliformes ............... S. steparius
12 Filarios glabrescentes. Dientes de la corola tubulosa sin vena media ........................................ S. potosianus
12' Filarios glabros. Dientes de la corola tubulosa con vena media ..................................................... S. retanensis
13 Filarios sin tricomas ......... S. triodon
13' Filarios con tricomas eglandulares y/o glandulares .............................. 14
14 Filarios sólo con tricomas glandulares ...................................... S. farinifer
14' Filarios con tricomas eglandulares y glandulares ............................... 15
15 Filarios con tricomas glandulares sin cabeza diferenciada ........ S. polyphyllus
15' Filarios con tricomas glandulares con cabeza pluricelular ..................... 16
16 Granos de polen microequinados, espínulas cónicas mameliformes ........................................... S. portulacoides
16' Granos de polen equinados, espinas cónicas ...................... S. achalensis
17 Hojas con tricomas glandulares .................................. S. chrysanthemum
17' Hojas con tricomas eglandulares flageliformes .................................... 18
18 Collares de las anteras largamente cilíndricos .............. S. pseudaspericaulis
18' Collares de las anteras balusteriformes ............................................... 19
19 Granos de polen equinados .......... 20
19' Granos de polen microequinados ... 21
20 Espinas cónicas. Aquenios pilosos con pelos gemelos .................. S. punae
20' Espinas cónicas lineares. Aquenios glabros .............................. S. eightsii
21 Apéndices conectivales de las anteras oblongos ................. S. krapovickasii
21' Apéndices conectivales de las anteras ovados ..................................... 22
22 Tricomas foliares adaxiales .................................................. S. madariagae
22' Tricomas foliares en ambas caras de lalámina ................................ S. lilloi
AGRADECIMIENTOS
A los curadores de los herbarios BAA, BAB, CONC, CORD, CTES, GH, K, LP, LPAG, MCMS, MO, NY, P, SGO y SI por el suministro del material correspondiente a las especies de Senecio subserie Polyphylli; asimismo, a los revisores anónimos por la lectura crítica del manuscrito.
BIBLIOGRAFÍA
Bentham, G. 1873. Compositae. En: Bentham G., Hooker J. D. Genera Plantarum 2 (1): 163-533. London. [ Links ]
Bremer, K. 1994. Asteraceae: Cladistics & Classification. Timber Press, Portland. [ Links ]
Brown, B.V. 1993. A further chemical alternative to critical point drying for preparing small (or large) files. Fly Times11: 10. [ Links ]
Cabrera, A. L. 1939. Las especies tucumanas del género Senecio. Lilloa 5: 65-120. [ Links ]
Cabrera, A. L. 1949. El género Senecio en Chile. Lilloa 15: 27-501. [ Links ]
Cabrera, A. L. 1957. El género Senecio (Compositae) en Brasil, Paraguay y Uruguay. Archivos do Jardim Bot¢nico do Rio de Janeiro 15: 163-269. [ Links ]
Cabrera, A. L. 1985. El género Senecio (Compositae) en Bolivia. Darwiniana 26: 79-217. [ Links ]
Cuatrecasas, J. 1960. Studies in Andean Compositae, IV. Brittonia 12: 182-195. [ Links ]
De Candolle A. P. 1838. Senecio. En: Prodromus 6: 340-437. Paris. [ Links ]
Dizeo de Strittmatter, C. 1973. Nueva téc- nica de diafanización. Boletín de la Sociedad Argentina de Botánica15 (1): 126-129. [ Links ]
Erdtman, G. 1960. The acetolysis method, a revised description. Svensk Botanisk Tidskrift 54: 561-564. [ Links ]
Erdtman, G. 1966. Pollen morphology and plant taxonomy. Hafner, New York & London. [ Links ]
Freire, S. E., Ariza Espinar L., Salomón L, Hernández M. P. 2014. Senecio. En: Zuloaga F. O., Belgrano M. J., Anton A. M. (Eds.), Flora Argentina vol. 7 (3): 27-220. Estudio Sigma S.R.L., Bs. As. [ Links ]
Hernández, M. P., Giuliano D. A., Freire S. E. 2013. Anteras y ramas estigmáticas en Senecio Subseries Radiati (Asteraceae). XXXIV Jornadas Argentinas de Botánica, La Plata, Buenos Aires, Argentina. Boletín de la Sociedad Argentina de Botánica 48 (suplemento): 115. [ Links ]
Hernández, M. P. 2016. Revisión taxonómica y análisis cladístico de la subserie Radiati (Cabrera) Cabrera & S.E. Freire del género Senecio (Asteraceae). Tesis Doctoral publicada on-line en SEDICI (Universidad Nacional de La Plata). [ Links ]
Jeffrey, C. 1980. Generic and sectional limits in Senecio (Compositae): II. Evaluation of some recent studies. Kew Bulletin 34: 49-58. [ Links ]
Jeffrey, C., Halliday P., Wilmot-Dear M., Jones S. W. 1978. Generic and sectional limits in Senecio (Compositae): I. Progress report. Kew Bulletin 32: 47-67. [ Links ]
Nordenstam, B. 1976. Lamprocephalus B. Nord., a new senecioid genus from South Africa. Botaniska Notiser 128: 323-326. [ Links ]
Nordenstam, B. 1978a. Taxonomic studies in the tribe Senecioneae (Compositae). Opera Botanica 44: 3-83. [ Links ]
Nordenstam, B. 1978b. Senecioneae and Liabeae - systematic review. En: Heywood V. H., Harborne J. B., Turner B. L. (Eds.), The biology and chemistry of the Compositae. Vol. 2: 799-830. Academic Press, New York. [ Links ]
Nordenstam, B. 1978c. Taxonomic studies in the tribe Senecioneae (Compositae). Opera Botanica 44: 1-84. [ Links ]
Nordenstam, B. 2006. Canariothamnus B. Nord., a new genus of the Compositae Senecioneae, endemic to the Canary Islands. Compositae Newsletter 44: 24- 29. [ Links ]
Nordenstam, B. 2007. Senecioneae. En: Ka- dereit, J. W., Jeffrey, C. (Eds.), The Families and Genera of Vascular Plants [Editado por Kubitzki, K.], Flowering Plants, Eudicots, Asterales, Vol. 8: 208-241. Springer, Berlin, Heidelberg, New York.
Nordenstam, B., Pelser P. B., Kadereit J. W., Watson L. E. 2009. Senecioneae. En: Funk, V. A., Susanna, A., Stuessy, T. F., Bayer, R. J. (Eds.), Systematics, Evolution, and Biogeography of Compositae: 503-525. International Association for Plant Taxonomy, Institute of Botany, University of Vienna, Vienna. [ Links ]
Pelser, P. B., Nordenstam B., Kadereit J. W., Watson L. E. 2007. An ITS phylogeny of tribe Senecioneae (Asteraceae) and a new delimitation of Senecio L. Taxon 56: 1077-1104. [ Links ]
Ramayya, N. 1962. Studies on the trichomes of some Compositae I. General structure. Bulletin of the Botanical Survey of india 4: 177-188. [ Links ]
Robinson, H. 1974. Studies in the Senecione- ae (Asteraceae). VI. The genus Arnoglossum. Phytologia 28: 294-295. [ Links ]
Robinson, H. 1978. Studies in the Senecioneae (Asteraceae). IX. A new genus, Dresslerothamnus. Phytologia 40: 493-494. [ Links ]
Robinson, H., Brettell R. D. 1973a. Studies in the Senecioneae (Asteraceae). I. A new genus, Pittocaulon. Phytologia 26: 451-453 [ Links ]
Robinson, H., Brettell R. D.1973b. Studies in the Senecioneae (Asteraceae). II. A new genus, Nelsonianthus. Phytologia 27: 53-54. [ Links ]
Robinson, H., Brettell R. D.1973c. Studies in the Senecioneae (Asteraceae). III. The genus Psacalium. Phytologia 27: 254-264. [ Links ]
Robinson, H., Brettell R. D.1973d. Studies in the Senecioneae (Asteraceae). IV. The genera Mesadenia, Syneilesis, Miracacalia, Koyamacalia, and Sinacalia. Phytolo- gia 27: 265-276. [ Links ]
Robinson, H., Brettell R. D.1974. Studies in the Senecioneae (Asteraceae). V. The genera Psacaliopsis, Barkleyanthus, Telantophora and Roldana. Phytologia 27: 402-439. [ Links ]
Salomón, L., Hernández M. P., Giuliano D. A., Freire S. E. 2016. Floral microcharacters in South American species of Senecio s. str. (Asteraceae) with considerations on the circumscription of this genus. Phytotaxa 244 (1): 1-25. [ Links ]
Salomón, L., Hernández M. P., Giuliano D. A., Freire S. E. 2016. Floral microcharacters in South American species of Senecio s. str. (Asteraceae) with considerations on the circumscription of this genus. Phytotaxa 244 (1): 1-25. [ Links ]
Thiers, B. 2018. Index Herbariorum: A global directory of public herbaria and associ- ated staff. New York Botanical Garden Ìs Virtual Herbarium. Disponible en http:// sweetgum.nybg.org/ih/. [Consulta: Sep- timebre 2018].
Vincent, P. L. D., Getliffe Norris F. M. 1989. An SEM study of the external pollen morphology in Senecio and some related genera in the subtribe Senecioninae (As- teraceae- Senecioneae). South African Journal of Botany 55 (3): 304-309. [ Links ]
Zarlavsky, G. E. 2014. Histología Vegetal. Técnicas simples y complejas. Sociedad Argentina de Botánica. Buenos Aires. [ Links ]
APÁNDICE 1
Senecio achalensis Cabrera: ARGEN- TINA. Prov. Córdoba, Hosseus 389 y 560 (CORD); Hunziker 8558 (CORD).
S. aspericaulis J. Rémy: ARGENTINA. Prov. Mendoza, Boelcke et al. 10357 (BAB). Prov. Neuquén, Boelcke 14070 y 14289 (BAB). Prov. no identificada: Patagonia, Moreno y Fonini 477 (NY). CHILE. Región Metropolitana de Santiago, Belem s.n. (MO). Región Maule, C. Marticorena y Matthei 903 (CONC); Luebert y Teillier 2285 (CONC); Co- rrea y Barros 1706 (LP); Ricardi et al. 962 (CONC, LP); Schlegel 3473 (CONC); Z¶llner 11832 (MO). Región Biobío, Stuessy y Baeza 11097 (CONC); Jaffuel 2815 y 2816 (CONC); Pfister s.n. (CONC); Ricardi 5609 (CONC); Rodriguez 1135 (CONC); Gardner y Knees 6823 (CONC).
S. chrysanthemum Dusén: ARGEN- TINA. Prov. Santa Cruz, C. Ameghino 1301 (LP). Prov. no identificada: Patagonia, Tesslef 6078 (LP).
S. eightsii Hook. & Arn.: ARGENTINA. Prov. Tierra del Fuego, Goodall 6 (LP); U. S. Exploring Expedition s.n. (GH, NY); Dudley et al. 208 (P, SI); Torres 1165 y s.n. (LP); Spegazzini 134 (LP); Nicora et al. 7216 (BAB, CTES, SI); Rodriguez 18 (LP); Rodriguez s.n. (CTES); Dudley 827 (P); Dudley et al. 1502 (BAB); Biganzoli 707 (SI); Dudley et al. 1366 (BAB); Dudley et al. 942 A (MO); Castellanos s.n. (LP); Banks y Solander s.n. (GH).
S. famatinensis Cabrera: ARGENTINA. Prov. La Rioja, Hieronymus y Niederlein s.n. (LP); Burmeister 56 (SI).
S. farinifer Hook. & Arn.: ARGENTINA. Prov. San Juan, Hernández 203, 204, 205 y 206 (LPAG). CHILE. Región Coquimbo, Jiles 4700 (CONC); Worth y Morrison s.n. (GH, SI); Worth y Morrison 16525 (MO); C. Marticorena y Matthei 407 (CONC); Behn 8620 (CONC, LP); Z¶llner 4475 (CONC). Región Valparaíso, Garaventa 1173 (CONC, LP); Aellen s.n. (CONC); Z¶llner 10916 (CONC); Z¶llner 6501 (CTES); Rovito 231 (CONC). Provincia no identificada, Cosson 18 (P). Región Metropolitana de Santiago, Rosas y Acosta 4487 (CONC); Garaventa 629 (GH); Mahu 5642 (BAB, CONC); Montero 317 (GH); Joseph 2801 (CONC); Looser 2065 (CONC, LP, MO); Jafuell 309 y 831 (GH); Schlegel 158 (CONC); Montedoro 317 (MO); Mahu 5643 (LP); Montero 3627 (CONC); Arriaga s.n. (CONC); Z¶illner 5365 (CONC); Schlegel 5873 (CONC); Schlegel 783 y 2527 (CONC); Gunckel 28358 (CONC). Región Libertador Bernardo Oâ Higgins, Garaventa 5420 (CONC). Región Maule, Wolf Maige s.n. (LP); Weisser 358 (CONC). Región Araucanía, C. Marticorena et al. 1401 (CTES).
S. krapovickasii Cabrera: ARGENTINA. Prov. La Rioja, Krapovickas 6324 y 6331 (BAB); Krapovickas 6292 (BAB, LP); Flossdorf 82 (LP).
S. lilloi Cabrera: ARGENTINA. Prov. La Rioja, Ratto et al. 152 (BAA).
S. madariagae Phil.: ARGENTINA. Prov. Salta, Cabrera 7914 (GH). CHILE. Región Tarapacá, Werdermann 1107 (NY). Región de Antofagasta, Navas 2085 (CONC, LP); Ricardi et al. 349 A (BAB, CONC, LP); Bauman 112 (CONC).
S. niederleinii Cabrera: ARGENTINA. Prov. La Rioja, Barboza 3331 (CORD).
S. nublensis Soldano: CHILE. Región del Biobío, Cabrera 19676 (LP); Barros 236 (LP).
S. otaeguianus Phil.: CHILE. Región Valparaíso, Fernández 1311 (CONC); Gunckel 71213 (CONC).
S. polyphyllus Kunze ex DC.: ARGENTINA. Prov. Neuquén, Nicora 7437 (BAA, LP); Nicora 7438 (CTES). CHILE. Región Valparaíso/Metropolitana de Santiago, Barros 3124 (CONC). Región Libertador General Bernardo OâHiggins, Montero s.n. (CONC); Villagrán y Kalin Arroyo s.n. (CONC). Región del Maule, Werdermann 592 (GH); Aravena 33332 (GH); C. Marticorena y Mathei 840 (BAB, CONC, LP); Schlegel 3715 (CONC); C. Marticorena et al. 121 (CONC); Rodríguez et al. 5453 (CONC). Región del Biobio, Cabrera 19679 (LP); Ricardi y C. Marticorena 5170 y 5818 (CONC); Mihoc et al. 4126, 4277, 6338 y 7209 (CONC); Ruthsatz s.n. (CONC); Aravena 33332 (MO); Pennell 12451 y 12456 (GH); Werdermann 1320 (GH); Jaffuel 2718 (CONC); Jaffuel 2718 y 2814 (GH); Cabrera 3630 y 3647 (LP); Hempel 6992 (CONC); Schlegel 5833 (CONC); Pfirster 1029 (CONC); Grandjot 2418 (CONC); Ledezma 664 (CONC). Región Araucanía, Hollermayer 752 (NY); Brown et al. 971 (CONC); Ricardi y C. Marticorena 5098 (CONC); Gunckel 16528 (CONC). Región no identificada: Gay s.n. (GH).
S. portulacoides J. Rémy : CHILE. Región de Coquimbo, Jiles 1561, 1979,2122a, 2317, 2318, 2871, 3365, 3712, 5567 y 5568 (CONC); Jiles 2122 (CONC, LP); Ruthsatz y Schuttang s.n. (CONC); Ruthsatz y Bemer- kungen 6242 (CONC); Z¶llner s.n. (CONC).
S. pseudalmeidae Cabrera: CHILE. Región Antofagasta, Johnston 5152 (GH); Z¶llner 1913 (LP); López s.n. (CONC); Ricardi 2728 (CONC); Barchers s.n. (LP); Montero 2900 (GH); Barros 618 (LP); Ricardi et al. 1086 (CONC); Jiles 5469 y 5472 (CONC); Quesada y Ruiz 236 (CONC), Loyola 94 (CONC).
S. pseudaspericaulis Cabrera: ARGENTINA. Prov. Tierra del Fuego, Pisano 3014 (LP).
S. punae Cabrera: ARGENTINA. Prov. Jujuy, Venturi 9356 (LP, SI); Venturi 10133 (GH, MO); Fabris y Crisci 7436 (MO); Venturi 8779 (GH, LP, MO); West 6324 (GH); Ahumada y Garzón 7181 (CTES); Cabrera 9335 (BAB); Fabris y Zuloaga 7694 (MO); Saravia y Toledo 15176 (CTES); Cabrera 9090 (LP); Castellanos 18 (LP); Cabrera y Hernández 13990 (BAB, LP); Cabrera et al. 15108 (GH); Cabrera et al. 26366 (SI); Zuloaga et al. 10203 (SI). Prov. Salta, Tolaba et al. 4666 (CTES); Cabrera 7914, 8253, 8352, 8668 y 8842(LP); Tolaba 5804 (CTES); Budier 22 (LP); Castellanos s.n. (LP).
S. retanensis Cabrera: ARGENTINA. Prov. Córdoba, A.T. Hunziker 9641 (CORD, CTES); A.T. Hunziker 8686 (CORD); J. H. Hunziker 1389 (CORD).
S. retanensis Cabrera: ARGENTINA. Prov. Córdoba, A.T. Hunziker 9641 (CORD, CTES); A.T. Hunziker 8686 (CORD); J. H. Hunziker 1389 (CORD).
S. segethii Phil.: ARGENTINA. Prov. San Juan, Kiesling et al. 7470 (NY); Johnston 6186 (GH). CHILE. Región Atacama, Arancio et al. 94252 (CONC). Región Coquimbo, Volckmann s.n. (LP).
S. steparius Cabrera: ARGENTINA. Prov. Neuquén, Pérez- Moreau 3329 (BAB); Ruiz Leal 23853 y 24479 (LP).
S. subpubescens Cabrera: ARGENTINA. Prov. Río Negro, Cordini 124 (GH); Cabrera 5873 y 6046 (LP); Boelcke y Correa 5471 (BAB); Sleumer 1583 (LP); R. A. Spegazzini s.n. (LP). Prov. Neuquén, Diem s.n. (LP). CHILE. Región Biobío, Ricardi y C. Marticorena 5815 (CONC); Mihoc et al. 6780 (CONC); Barros s.n (CONC); Garaventa 4687 (CONC). Región Araucanía, Pennell 611 (GH, MO); Montero 4388 y 6442 (CONC); Schlegel 7167 (CONC). Región Los Ríos, Rosas 6369 (CONC). Región Magallanes y de la Antártida Chilena, Dollenz 22 (GH); Arroyo y Squeo s.n. (CONC).
S. triodon Phil.: ARGENTINA. Prov. Neuquén, León y Calderón 915 y 967 (BAA); Boelcke y Correa 6852 (BAB); Diem 1861 (SI); Ragonese 253 (LP); Kahenmann s.n. (LP); de Jones 1785 (LP); Cabrera 19735 y 20561 (LP). Prov. Río Negro, Boelcke y Correa 5918 (BAA, BAB, SI); Cabrera 6061 (GH); Cabrera 5914 (LP); Hosseus 642 (LP); Lourteig y Buchinger 124 (P); Fabris 2197 (LP); Hosseus 314 (CORD, LP). Prov. Chubut; Soriano 4234 (BAB). CHILE. Región Maule, C. Marticorena y Matthei 844 (CTES); Behn 498 (CONC). Región Biobío, Pfister 1027 (CONC). Región Araucanía, Ruthsatz 7629 (LP). Región Araucanía/ Los Rios, Pfister s.n. (CONC). Región de Los Lagos, Werdernann 661 (GH, SI); Pfister s.n. (CONC), Dawson y Schwabe 2775 (BAA, BAB); Sparre y Smi- th 363 (CONC); Pfister s.n. (CONC); Z¶llner 7487 (CONC, MO). Región Aysén del General Carlos Ibá±ez del Campo, Schwabe s.n. (CONC); Pirion 3418 (GH). Región no identificada, Klatt s.n. (GH).














