Introducción
Son muchas las consultas que recibimos los médicos reumatólogos en relación al compromiso ocular de las enfermedades, sobre todo de aquellas inflamatorias (como sarcoidosis, síndrome de Behcet, espondiloartritis, enfermedad asociada a IgG4, vasculitis sistémicas y enfermedad de Vogt-Koyanagi-Harada) o del tejido conectivo. Pero este órgano es una caja de sorpresas y debemos tener en cuenta otras enfermedades que pueden comprometerlo. En los últimos años hemos llamado la atención en algunos artículos sobre enfermedades como ER-IgG4, enfermedad de Erdheim Chester, amiloidosis o mieloma múltiple que comprometen la estructura ocular1-4.
El tracto uveal es el sitio oftálmico más frecuente para la diseminación hematógena de metástasis tumorales de otros sitios, relacionado con el abundante flujo sanguíneo dentro del tejido coroideo. Por lo tanto, la coroides es el tejido ocular más comúnmente afectado por el compromiso metastásico. Otros sitios oftálmicos menos comunes de metástasis hematógenas incluyen la órbita, los párpados, la conjuntiva, la retina y el humor vítreo5.
Shields et al. estudiaron 520 ojos con metástasis uveal y encontraron que el sitio primario más común era el cáncer de mama (68%) en mujeres y el cáncer de pulmón (40%) en hombres6.
La metástasis uveal precedió al diagnóstico de cáncer de pulmón en un 44% de los casos7.
Estudios previos de cáncer de mama demostraron que la metástasis ocular precedió en un 3% al diagnóstico de tumor7-8.
El cáncer de pulmón se ha comunicado que hace metástasis en el ojo de un 0,2% a un 7% de los pacientes en estudios clínicos, y de un 6% a un 7% de los pacientes en estudios histopatológicos post morten5,7. La expectativa media de vida luego de la detección de la metástasis uveal se ha calculado en 12 meses y 7,5 meses en otro estudio7,9.
Tanto la uveítis anterior granulomatosa, la uveítis intermedia bilateral, la panuveitis bilateral o las lesiones granulomatosas a nivel coroideo o del nervio óptico se consideran indicativas de sarcoidosis en presencia de un cuadro radiológico compatible10. Las mismas pueden preceder a los signos sistémicos en un 30% de los casos. Con frecuencia, el curso es agudo o subagudo y desaparece espontáneamente, pero en algunos individuos es crónico y persiste durante años. En estos casos, la incidencia de afectación ocular es más elevada11-13.
Se describen tres casos clínicos con síntomas oftalmológicos (Tabla 1): dos pacientes con metástasis ocular que precedieron al tumor y una con sarcoidosis.
Tabla 1: Resumen de casos clínicos.
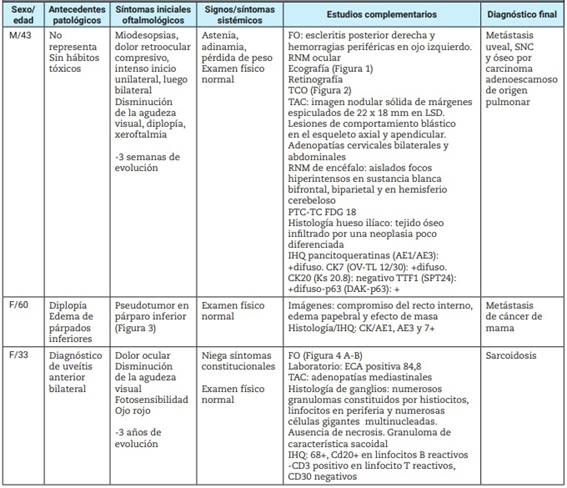
M: masculino; F: femenino; FO: fondo de ojo; RNM: resonancia nuclear magnética; TCO: tomografía de coherencia óptica; TAC: tomografía axial computada; LSD: lóbulo superior derecho; PTC-TC FDG 18: tomografía por emisión de positrones con flúor‐18‐fluorodeoxiglucosa, IHQ: inmunohistoquímica; SNC: sistema nervioso central; AE-CK7: citoqueratinas 7; TTF1: factor de transcripción tiroideo; DAK: calretinina; ECA: enzima convertidora de la angiotensina.
Caso clínico 1
Paciente masculino, de 43 años de edad, sin antecedentes patológicos conocidos ni hábitos toxicológicos, que consulta por miodesopsias de forma unilateral (compromiso ocular izquierdo), progresando en días de forma bilateral con disminución de la agudeza visual, diplopía, xeroftalmia, dolor retro ocular compresivo de intensidad 7/10 que cede con AINEs o paños fríos. Refiere además pérdida de peso que no sabe especificar, astenia y adinamia de 3 semanas de evolución. Evaluado por varios oftalmólogos en múltiples oportunidades, se prescribe tratamiento sintomático sin mejoría. En una interconsulta con otro oftalmólogo, se observa en el fondo del ojo una escleritis posterior derecha y hemorragias periféricas en el ojo izquierdo. Por este motivo se lo deriva al Servicio de Reumatología.
Al interrogatorio o examen físico no presenta datos patológicos. En estudios de laboratorio: fosfatasa alcalina aumentada, FAN (hep-2), anti DNA (crithidia), ENA, ANCA C y P negativo, enzima convertidora de angiotensina (ECA) normal, hemograma, proteinograma por electroforesis y función renal normal, sin proteinuria ni sedimento activo. La resonancia magnética de encéfalo muestra focos aislados hiperintensos en sustancia blanca bifrontal, biparietal y en hemisferio cerebeloso. En la luz del conducto auditivo interno izquierdo, realce con el contraste sin reconocerse alteraciones en el paquete acústico facial; probable origen meníngeo. Engrosamientos uveo esclerales bilaterales de aspecto inflamatorio/infiltrativo en ambos globos oculares. Engrosamiento de la mucosa a nivel fronto etmoidal. Se realiza ecografía de ojo derecho y se encuentra imagen en doble giba (Figura 1), una angiografía digital con fluoresceína muestra hipofluorescencia en tiempo temprano extensa y en fase tardía se aprecia hiperfluorescencia en puntos y una tomografía de coherencia óptica (TCO) que objetiva elevación irregular del epitelio pigmentario empujado por los cambios en el espesor coroideo (Figura 2).

Figura 1: Ecografía de ojo derecho imagen sobreelevada con reflectividad media. Se observa imagen de “doble giba” de forma irregular que evidencia efecto de masa.
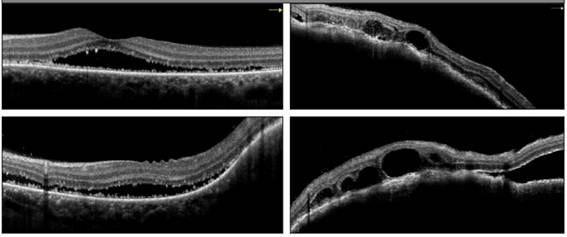
Figura 2: Tomografía de coherencia óptica. Se observa elevación irregular del epitelio pigmentario con cambios en la arquitectura macular con efecto de masa en el espesor coroideo que corresponde al patrón de metástasis coroidea; cavidades quísticas hiporreflecticas con líquido suprayacente, tanto en área macular como en la periferia, que genera una superficie irregular en bultos y baches (lumpy-bumpy surface).
Por tomografía se detecta la presencia en lóbulo pulmonar superior y para hiliar derecho una imagen nodular sólida de márgenes espiculados de 22 x 18 mm, en íntimo contacto con bronquio. Lesiones de comportamiento blástico en el esqueleto axial y apendicular. Adenopatías cervicales bilaterales y abdominales. Finalmente, la tomografía por emisión de positrones con 18-fluordesoxyglucosa (PET-TC 18 FDG) muestra hipercaptación de FDG-18 en nódulo pulmonar, tiroides y en esqueleto axial y apendicular, asociada a adenopatías generalizadas diagnosticándose, por histología e inmunohistoquímica ósea, metástasis correspondiente a un carcinoma adenoescamoso de probable origen pulmonar.
El paciente es derivado a un médico especialista para su tratamiento. Progresa a los meses con empeoramiento de síntomas visuales, aumento en la frecuencia e intensidad de la cefalea, disfagia a sólidos, dificultad en la marcha y paresia en miembros inferiores. Fallece por complicaciones de la patología neoplásica.
Caso clínico 2
Paciente femenina, de 60 años de edad, inicia con diplopía, edema de párpado inferior con pseudotumor (Figura 3) sin otros síntomas sistémicos. Examen físico normal. En la resonancia magnética se observa: compromiso del recto interno, edema palpebral y efecto de masa. Se realiza biopsia de la lesión pseudotumoral con informe histológico que describe una morfología plasmocitoide y patrón disohesivo. Inmunohistoquímica positividad para CK7, negatividad para E-cadherina que orientan hacia origen mamario. Se deriva a la paciente al Servicio de Ginecología donde se confirma el diagnóstico de atipia mamaria.
Caso clínico 3
Paciente femenina, de 33 años de edad, refiere haber comenzado hace 3 años con alteraciones visuales, dolor ocular urente, fotosensibilidad y ojo rojo realizando múltiples consultas a especialistas. Se la deriva con diagnóstico de uveítis anterior bilateral recurrente tratada con esteroides tópicos oculares. Al examen físico no presenta lesiones cutáneas, caída de cabello, úlceras orales, artritis, parotidomegalias, ni aumento de glándulas salivales. Examen respiratorio, cardíaco y digestivo sin particularidades. Se interconsulta con otro oftalmólogo que al examen ocular encuentra uveítis anterior granulomatosa con la presencia de exudados snow balls y coroiditis multifocal bilateral indicativos de sarcoidosis (Figura 4). Las serologías para toxoplasmosis, VDRL, VIH, citomegalovirus resultaron negativas. Dosaje de enzima convertidora de angiotensina positiva 84,8 U/L (valor normal hasta 34 U/L). En tomografía de cabeza y cuello, tórax y abdomen se informan adenopatías mediastinales para traqueal, subaórtica, paraaórtica, subcarinal, paraesofágica y parahiliar, el resto sin particularidades. Se solicita biopsia de ganglio y se detectan numerosos granulomas constituidos por histiocitos, linfocitos en periferia y numerosas células gigantes multinucleadas. Ausencia de necrosis. Granuloma de característica sarcoide. Inmunohistoquímica CD 68 positivo, CD 20 positivo en linfocitos B reactivos, CD3 positivo en linfocito T reactivos. CD 30 negativos. Se comienza con pulsos de esteroides 1 g/kg por 3 días vía endovenoso y luego meprednisona 1 mg/k/día vía oral dosis descendientes, asociado a metotrexato 15 mg/semanal y ácido fólico. La paciente evoluciona favorablemente con mejoría en los controles posteriores oculares sin recurrencias de su uveítis ni presencia de adenopatías.
Discusión
Los primeros dos casos muestran pacientes cuyos síntomas oftalmológicos guiaron finalmente al hallazgo de patologías neoplásicas de sitios alejados como pulmón y mama.
El primer paciente con dolor retro ocular y miodesopsias a causa de metástasis uveal posterior de origen pulmonar. Según las distintas series, el porcentaje de pacientes donde la metástasis uveal precede al diagnóstico de cáncer de pulmón fue de entre un 44% y 72%. También se describe una prevalencia del sexo masculino entre la quinta y sexta década de la vida. Sanket et al. estudiaron a 194 pacientes con 374 tumores uveales por cáncer de pulmón donde el 55% fueron hombres, con una edad media de 62 años. Este predominio en hombres también lo describen Meziani et al. en su serie de 109 pacientes (61% hombres)7,9. Shields et al. encontraron que el sitio primario más común era el cáncer de mama (68%) en mujeres y el cáncer de pulmón (40%) en la población masculina. El sitio más frecuente (88%) de afectación fue la coroides5,7, con características particulares como: color amarillo 98%, configuración en meseta 61%, cúpula 38%, líquido subretiniano 85%, con un diámetro medio de 8 mm y un grosor de 3 mm. El espesor de la pared posterior es un dato relevante en la orientación diagnóstica, como así también la irregularidad de la superficie que se objetiva en la TCO y que Shields et al. describen como imágenes en lumpy-bumpy surface16,17 similar a los hallazgos presentes en nuestro paciente. Estas características, demostradas en la serie de Sanket et al., difieren con la metástasis de cáncer de mama en el mismo sitio anatómico (Tabla 2). A diferencia de nuestro paciente cuyo compromiso fue bilateral, en las series es más frecuente la forma unilateral5,6,7,14. Los síntomas más prevalentes fueron: visión borrosa (73%), dolor (14%), miodesopsias (6%), coincidiendo con otras series6,9,14. El dolor ocular fue el síntoma más común de presentación en contrapartida a los demás cánceres agrupados (14 vs. 7%)6. Es importante categorizar estos síntomas, sobre todo cuando aparecen en pacientes jóvenes y de forma súbita (Tabla 3). En los estudios, la mayoría de los pacientes presentó diagnóstico de carcinoma de células no pequeñas vs. los de células pequeñas (84% vs. 16%). De ellos, el más frecuente fue el adenocarcinoma al igual que en nuestro caso. También se describe un peor pronóstico con alta mortalidad en todas las series (54%) al cabo de un año del diagnóstico de las metástasis uveales7,14.
Tabla 2: Diferencias y similitudes entre metástasis uveal de mama y pulmón.

Elaboración propia. Tabla basada en datos de Saha et al.
Tabla 3: Síntomas visuales: signos de alarma.
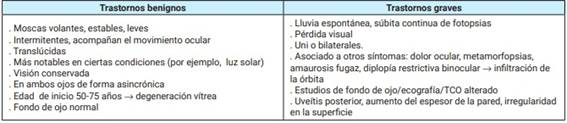
TCO: tomografía de coherencia óptica. Elaboración propia.
Las lesiones metastásicas orbitarias generalmente se presentan en pacientes con diagnóstico establecido de cáncer diseminado y hay un intervalo de tiempo medio de 4,5 a 6,5 años desde el diagnóstico de carcinoma de mama15. Los intervalos más largos desde el diagnóstico de cáncer de mama primario hasta la presentación de metástasis orbitarias son de 25 y 28 años18,19. Si bien es lo habitual, se debe tener en cuenta que estas pueden ser la primera manifestación de un tumor primario hasta en el 25% de los casos, de ahí el interés de su reconocimiento precoz1,18-21. Las formas bilaterales y multifocales ocurren con mayor frecuencia en estas metástasis6,8, aunque también es probable la presentación unilateral con distribución lateral y superior. Dada una preferencia específica del tejido del cáncer de mama por el músculo extraocular y la grasa orbitaria circundante, la diplopía resultante de los déficits de movilidad es un síntoma frecuente15. En nuestras pacientes estos también fueron los síntomas que motivaron la consulta y se halló compromiso de recto interno en la segunda paciente coincidiendo con lo descripto en la literatura1,22. Los exámenes de ultrasonido, tomografía y resonancia nuclear magnética son las modalidades de estudio principales para arribar al diagnóstico, pero la biopsia sigue siendo una herramienta obligatoria. En la resonancia magnética, la enfermedad metastásica suele ser hipointensa en imágenes ponderadas en T1 e hiperintensa en T2. Esta apariencia puede ayudar a diferenciarlo de un pseudotumor orbital, que generalmente es isointenso en T2. Cuando se observan lesiones hiperintensas en T1, debe sospecharse una metástasis muy vascular (por ejemplo, tiroides, renal) o metástasis de melanoma1,23.
En una revisión importante de 420 pacientes con metástasis uveales de todos los sitios primarios, se encontró que 142 (32%) no tenían antecedentes conocidos de cáncer en el momento del diagnóstico ocular. Este trabajo mencionó el cáncer de pulmón como el sitio primario más común (35%), seguido del cáncer de mama (7%), cáncer gastrointestinal (1%), cáncer de próstata (1%) y cáncer primario indeterminado (51%). Estos hallazgos sugieren que la presencia de metástasis uveal en un paciente sin cáncer conocido debe impulsar a una investigación exhaustiva para detectar principalmente el cáncer de pulmón6.
La paciente del caso clínico 3 inició con compromiso ocular con un diagnóstico final de sarcoidosis, dado por una biopsia de ganglio que demostró los típicos granulomas no caseificantes. La afectación ocular de esta entidad se conoce desde principios del siglo XX y desde entonces se hizo cada vez más reconocida1. Las mujeres (56%) tienen mayores probabilidades de desarrollar compromiso ocular en comparación con los hombres (23%). Un estudio de 121 pacientes con sarcoidosis comprobada por biopsia11 muestra dos picos de incidencia: uno entre los 20-30 años y otro entre los 50-60 años. Las prevalencias de afectación ocular en diferentes series oscilan ampliamente entre un 13%24 y un 79%25 de los pacientes con sarcoidosis sistémica3. Este puede ser el síntoma de presentación en aproximadamente un 20-30%26 como ocurrió en la paciente del tercer caso, y en un 20-50% durante el curso de la enfermedad (variable según las series y los exámenes oculares) variando de asintomático a enfermedad grave, progresando a una discapacidad o incluso a la ceguera, siendo frecuentes los síntomas constitucionales2-4. Los signos agudos de uveítis como dolor, fotofobia, lagrimeo o enrojecimiento pueden estar ausentes, por lo cual los pacientes con “uveítis silenciosa” asociada a sarcoidosis pueden desarrollar daño ocular permanente antes que se diagnostique el proceso intraocular y se inicie el tratamiento. En la serie antes mencionada11, 29/121 pacientes presentaron uveítis. De estos 29, 10 fueron diagnosticados por un oftalmólogo en ausencia de molestias oculares en el momento del cribado oftalmológico inicial. En cuanto al compromiso oftalmológico, se reportó uveítis en 30-70% y nódulos conjuntivales en 40%27, siendo una característica frecuente y temprana de la sarcoidosis. Más del 70-80% de los casos de uveítis se manifiestan dentro del año posterior al inicio de la enfermedad sistémica. En pacientes jóvenes es más común la uveítis anterior y puede presentarse como una iridociclitis aguda, que se observa principalmente en el síndrome de Löfgren, o como una uveítis granulomatosa crónica con precipitados queráticos que pueden variar desde el tipo celular hasta el tipo de “grasa de cordero” o mutton fat. En cambio, la uveítis posterior fue la localización más común de la uveítis sarcoide en pacientes de raza blanca (65-83%), específicamente en aquellos de edad con hallazgos al fondo de ojo de periflebitis, exudados perivenosos, que generalmente se indican como “goteo de cera de vela”. Las lesiones coroideas pueden ser multifocales. Las lesiones redondas en sacabocados (las taches de bougies originales), presentes en la paciente descripta ocasionalmente en quien también se diagnosticó uveítis intermedia al observarse agregados celulares en el humor vítreo (snow balls), son características, pero no exclusivas de la sarcoidosis28. Este tipo de uveítis intermedia puede preceder a cambios más graves del segmento posterior y en este caso resulta de utilidad la tinción en la angiografía con verde de indocianina (AVI) que logra demostrar la extensión generalizada de la afectación coroidea convirtiéndose en una herramienta adicional para monitorear la propagación y la actividad de la enfermedad. La presentación como panuveítis a menudo se observa en personas de mediana edad y mayores28. A medida que avanza la enfermedad, la sarcoidosis ocular puede afectar todas las estructuras del ojo, como la úvea, la córnea, la esclerótica, el nervio óptico, la órbita y la vía visual6. Este último método junto con la angiografía fluoreceinica (AFG) son de utilidad en el estudio del segmento posterior dado que, para algunos autores, la participación coroidea ocurre en todos los casos con afectación posterior, pero no todos tendrán alteraciones retinianas29.
Nuestra paciente presentó niveles séricos de ECA elevados. Power et al. hallaron que, en pacientes con uveítis, la sensibilidad de la ECA sérica elevada fue de 73% y la especificidad del 83%. No obstante, los niveles normales de esta enzima no excluyen el diagnóstico de sarcoidosis, especialmente en aquellos con enfermedad ocular aislada. En la forma confinada al ojo, la ECA no siempre aumenta puesto que es escasa la cantidad de tejido granulomatoso en el organismo30.
Algunas asociaciones del compromiso ocular (segmento posterior) se relacionan con trastornos cardíacos (taquicardia ventricular) y afectación del sistema nervioso central (desde enfermedad del nervio óptico, parálisis de los nervios craneales, encefalopatía, y trastornos del hipotálamo y la glándula pituitaria)27,31.
Conclusiones
Se presentaron los casos de tres pacientes con hallazgos oftalmológicos de inicio con dolor ocular, disminución de la agudeza visual y diplopía. Uno de ellos refirió miodesopsias, sin otro compromiso sistémico; dos pacientes con metástasis de órbita que precedieron al diagnóstico de tumor primario de pulmón y de mama en uno y dos meses respectivamente; otra paciente con diagnóstico final de sarcoidosis confirmada posteriormente con biopsia de ganglio con compromiso ocular como manifestación inicial y de 3 años de evolución.
Los síntomas y signos oculares pueden preceder a enfermedades sistémicas. Las características de los síntomas -sobre todo el dolor ocular, la disminución de la agudeza visual o las miodesopsias en pacientes jóvenes y de inicio abrupto- deben aumentar esta sospecha y obliga a profundizar los estudios en estos pacientes. Además, hay que tener en cuenta que en estudios complementarios los hallazgos como engrosamiento de la pared posterior o lumpy-bumpy surface en estudios de imágenes, son característicos de metástasis uveal y deben orientar sobre el origen del tumor primario (origen pulmonar o mamario) teniendo en cuenta el sexo, el espesor de la pared, el compromiso uni o bilateral y la presencia de líquido subretiniano. En cuanto a la sarcoidosis, los infiltrados en snow balls y las lesiones en sacabocado en el fondo de ojo son las características que pueden guiar el diagnóstico.
















