PUNTOS CLAVE
Conocimiento actual
• Los fumadores, los ancianos y los enfer mos crónicos son propensos a infecciones pulmonares graves. Las vacunas reducen el riesgo de infecciones graves., La inmuniza ción contra COVID-19 redujo significativa mente transmisión y gravedad. Hay nuevas vacunas en el horizonte.
Contribución del artículo al conocimiento actual
• La COVID-19 hizo que los enfermos respira torios tomaran conciencia de la importan cia de la inmunización. El neumonólogo prescribe vacunas y debe estar al tanto de las indicaciones y las particularidades de las vacunas clásicas y las nuevas para asesorar y aconsejar al respecto a quienes con él se atienden.
El neumonólogo destina parte de su tiempo en la consulta revisando la historia vacunal de sus pacientes. En 2015 la Asociación Argentina de Medicina Respiratoria (AAMR) decidió elabo rar recomendaciones de vacunación en adultos con enfermedades respiratorias1. En los últimos decenios creció la expectativa de vida y la edad poblacional, y aumentó el porcentaje de pacien tes con comorbilidades, mayores de 65 años. Este grupo representaba entre el 10 y el 19% de la población en 2015, y se espera que crezca has ta duplicarse en 20502. En los años transcurridos desde la publicación de nuestra recomendación emergió la pandemia de COVID-19, que trajo im portantes avances en la elaboración de vacunas impactando de manera notable en la concien cia sobre la necesidad de esta práctica, y en la percepción de su impacto para la prevención de enfermedades y sus consecuencias de morbi-mortalidad3.
La aparición de SARS-CoV-2 como patógeno principal de las infecciones respiratorias en los últimos tres años ha mostrado las debilidades y fortalezas de los programas de vacunación, lo que junto con las nuevas vacunas aprobadas en el mundo durante los últimos años, nos llevó a revisar mediante un consenso de expertos nues tros puntos de vista1, actualizando las recomen daciones sobre vacunación contra influenza (VAG), neumococo (VAN), COVID-19 (VAC), Borde tella pertussis (VBP), herpes zoster (VHZ) y virus sincicial respiratorio (VSR).
Antecedentes
El Ministerio de Salud (MSAL) definió un ca lendario nacional compuesto por 17 vacunas indicadas en los niños desde el nacimiento con indicación del número de dosis, momento en que deben aplicarse, refuerzos, y la descripción de algunos esquemas especiales4. También pre cisa distintas indicaciones de vacunas en algu nos grupos poblacionales de riesgo como em barazadas, puérperas y personal de salud. Para otros menores de 65 años y sin comorbilidades, se mencionan la vacuna para hepatitis B y la doble bacteriana. Para embarazadas, puérperas y personal de salud se indican las mismas va cunas agregando las dosis necesarias de triple bacteriana y triple viral. En mayores de 65 años o menores de esa edad, con comorbilidades, en fermedades respiratorias y fumadores con ries go aumentado de padecer infecciones pulmona res virales y bacterianas y sus consecuencias, se incluyen las vacunas antigripales y anti-neumo cóccicas además de las ya mencionadas4.
La neumonía adquirida en la comunidad (NAC) afecta a más del 1% de las personas cada año5. Los posibles patógenos incluyen a virus, bacterias comunes, bacterias intracelulares o atípicas, hongos y protozoarios6. Las infecciones por algunos de estos patógenos pueden preve nirse mediante la inmunización7. Por ello, los Centers for Disease Control and Prevention (CDC) de EE.UU. recomiendan la vacunación durante toda la vida para proporcionar inmunidad. Sin embargo, las tasas de vacunación en adultos en todo el mundo son bajas8.
A principios del siglo XX la causa principal de muerte eran las infecciones pulmonares agu das (caracterizadas como influenza y neumo nía). Los avances de la medicina mejoraron la expectativa de vida hasta cerca de los 80 años y aunque las infecciones pulmonares quedaron relegadas como causa general de muerte, tras las enfermedades cardiovasculares, los tumores malignos, las injurias no-intencionales y las en fermedades respiratorias crónicas, durante 2020 y 2021 la COVID-19 resultó ser la primera causa de letalidad en muchos países, volviendo a po ner a las infecciones en primer plano9.
Vacunas
Vacunación antigripal
La influenza produce epidemias anuales típi camente en temporada invernal (entre abril y oc tubre en el hemisferio sur y entre octubre y abril en el hemisferio norte). Estas epidemias tienen un grado variable de gravedad. Se caracteriza por un cuadro agudo, con o sin fiebre, con sínto mas generales y respiratorios que suele mejorar en 7 a 10 días. Ocasionalmente, particularmente en mayores de 65 años, y en personas con afec ciones cardiovasculares y respiratorias crónicas, enfermedades metabólicas, insuficiencia renal, hemoglobinopatías e inmunosupresión (inclu yendo HIV +), internaciones o incluso producir un desenlace fatal10. Por ello, el Calendario Na cional de Vacunación del MSAL recomienda la vacuna para influenza a partir de los 6 meses de edad sin límite máximo de edad en las per sonas con mayor riesgo de complicaciones, del personal de salud, los convivientes de pacientes inmunodeprimidos y las personas que trabajan en contacto con aves vivas10. El MSAL en 2014 in dicaba: “En los pacientes mayores de 65 años no se requerirá orden médica para recibir la vacuna antigripal”, en un intento de reducir los obstá culos para lograr buenos niveles de vacunación. Es necesaria la revacunación anual a raíz de la caída en los títulos de anticuerpos y la pérdida de eficacia vacunal a partir de los cambios radi cales (shift) antigénicos en los componentes de hemaglutinina (H) o neuraminidasa (N), y o de cambios menores (drift) antigénicos en la estruc tura de estas proteínas que experimenta perió dicamente el virus11,12.
Los CDC en EE.UU. en 2010 (luego de la pande mia de H1N1), simplificaron la recomendación a “Todas las personas mayores de 6 meses en los EE.UU. deben vacunarse contra la influenza cada temporada, con raras excepciones”13, aclarando que si la provisión de vacunas fuera limitada deberá priorizarse a las personas con riesgo au mentado. Esta limitación de cobertura para ca sos de escasez se asemeja a la recomendación habitual en Argentina.
Los virus A y B causan epidemias en huma nos. El tipo A se divide en distintos subtipos ba sados en sus proteínas de superficie H y N. Los dos subtipos de Influenza A que circulan al mo mento actual son A(H1N1) y A(H3N2). Los virus de Influenza B se clasifican en los dos linajes ac tualmente circulantes: B/Victoria y B/Yamagata. Errores en la polimerasa dependiente de ARN en coinfecciones entre humanos y otras especies originan modificaciones en los virus favorecien do la circulación de esta variante en un nuevo huésped14.
Se dispone de la vacuna trivalente (dos subti pos de virus A y un linaje de virus B). En Argenti na está disponible la trivalente inactivada (TIV) orientada a las cepas patrón recomendadas por la OMS para el período en cuestión10. Existen vacunas con adyuvante (aTIV) para mejorar la protección en mayores de 65 años que utilizan el adyuvante registrado MF59, una emulsión de aceite en agua que mejora la tolerabilidad15. Esta vacuna conduce a una respuesta inmune mejo rada, además produce ahorro de antígeno, pro tección cruzada contra cepas que han mutado (drifted), y mayor inmunogenicidad en los suje tos expuestos. En Argentina, esta vacuna forma parte del Calendario Nacional de Inmunizaciones desde la temporada 2021, respaldada por un es tudio de costo-efectividad publicado en 202016,17. Por último, se dispondrá en Argentina de la vacu na contra influenza de alta dosis, recientemente aprobada por ANMAT18. Mientras la mayoría de las vacunas contienen 15 μg de cada antígeno de H, la vacuna de alta dosis contiene 60 μg de cada antígeno19. Un estudio mostró una reducción del 49% en el riesgo de muerte asociado a la vacuna de alta dosis y una reducción del 64% en la hos pitalización por influenza o neumonía compa rado con la dosis estándar en adultos mayores20. La mayoría de las vacunas inactivadas contra influenza se fabrican utilizando el cultivo de vi rus en huevos embrionados. Sin embargo, para mejorar la efectividad de la vacuna se ha desa rrollado una vacuna en cultivo celular que uti liza células MDCK (Madin-Darby Canine Kidney Epithelial Cells) para el desarrollo de los virus de influenza. Esta línea celular de crecimiento continuo soporta altas cargas virales y es apli cable a la producción a gran escala, puede au mentar su producción en forma rápida cubrien do la demanda de vacuna, no utiliza antibióticos ni preservantes en la producción21 y permite un desarrollo de distintas cepas virales22. La princi pal ventaja de esta plataforma es que se elimina el proceso de reordenamiento genético que se observa en el desarrollo de vacunas en huevos embrionados que puede llevar a un aumento de riesgo de mismatch (discordancia)23.
En 2013, se dispuso de la primera vacuna te travalente (QIVe) (dos subtipos de virus A y dos linajes de virus B)24, con un buen perfil de segu ridad. La inclusión de un segundo linaje B pro porciona una respuesta inmune superior para el subtipo adicional, sin reducir la respuesta inmu nitaria ni afectar negativamente el perfil de tole rancia y seguridad. La vacuna tetravalente tiene el potencial de reducir aún más la morbilidad y mortalidad relacionadas con la influenza más allá de lo logrado con las vacunas trivalentes25.
Los pacientes que se atienden con el neu monólogo suelen tener alto riesgo de complica ciones a partir de influenza grave26. La vacuna antigripal en adultos se recomienda en mayores de 65 años y en los menores de 65 años con en fermedad pulmonar crónica o cardiovascular, renal, hepática, neurológica, trastornos meta bólicos incluyendo diabetes, hemoglobinopatías e inmunosupresión (incluyendo HIV +) lo cual abarca a una amplia mayoría de los pacientes que se atienden con un neumonólogo.
En Argentina, el pico de actividad de influen za es durante los meses de invierno, mientras que en regiones tropicales ocurre a lo largo del año, especialmente en temporada de lluvias25. Un análisis en base a estudios de estacionalidad de influenza realizados por los CDC y la OMS concluyó que la temporada de influenza en la mayoría de países de América del Sur es entre abril y junio27.
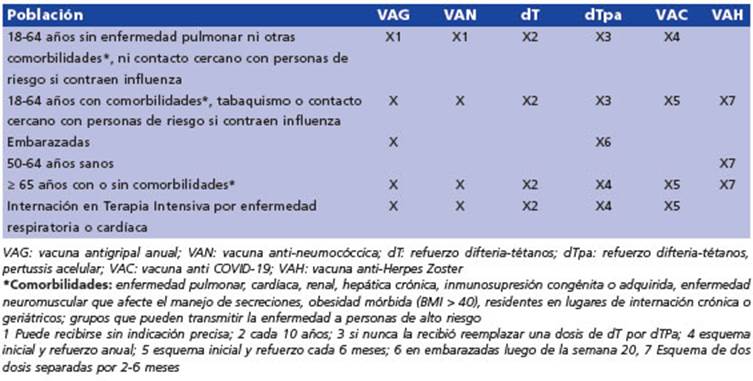
La efectividad de la vacuna es calculada anualmente por los CDC28. En la Figura 1 pue de observarse la efectividad de la VAG medida durante 16 de las últimas 17 temporadas de in fluenza en el hemisferio norte (no se midió en 2020-2021 por la baja circulación viral debida al aislamiento riguroso durante la pandemia). Si bien llama la atención la modesta efectividad de las vacunas contra la influenza actualmente disponibles, la vacuna puede prevenir complica ciones graves de influenza, reduciendo un 26% la internación en terapia intensiva y la mortali dad en adultos con influenza asociada a ingreso hospitalario un 31%29. En la Tabla 1 se resume el esquema y dosis de vacunación antigripal.
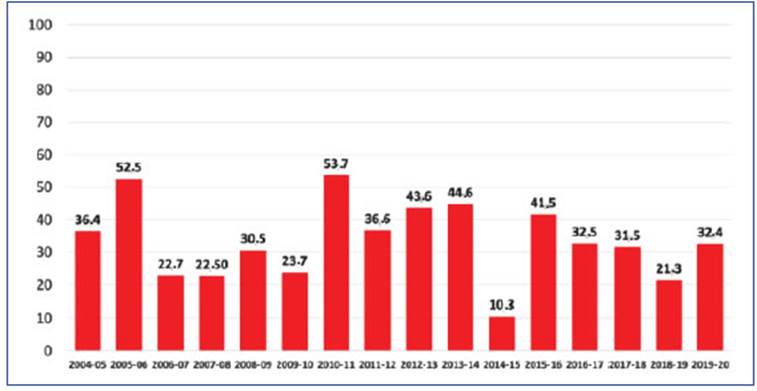
Figura 1 Estimación del porcentaje de efectividad de la vacuna antigripal estacional de influenza 2004-05 a 2019-20. (El período 2020-21 no fue considerado por la baja circulación de influenza observada durante la pandemia)4
Vacunación antineumocócica
Antes de 1945, la neumonía en adultos era causada en más del 90% de los casos por Strepto coccus pneumoniae. A partir de 1950, la proporción de neumonías causadas por este organismo co menzó a disminuir. En la actualidad, neumoco co se aísla en menos del 10%-15% de los casos, siendo esta proporción más alta en Europa, se estima que debido a diferencias en las prácticas de vacunación y el hábito de fumar. Otros pa tógenos como bacilos gramnegativos, Staphylo coccus aureus, Chlamydia, Mycoplasma y Legionella son identificados en un rango del 2% al 5% de los pacientes hospitalizados por neumonía. Los virus se encuentran en el 25% de los pacientes, y aproximadamente un tercio de ellos presentan coinfección bacteriana. Es importante destacar que en más del 50% de los casos, los estudios recientes no han logrado identificar el organis mo causante, lo cual sigue siendo el principal desafío para comprender las infecciones respi ratorias bajas30.
El Calendario de Vacunación 2023 en Argen tina no precisa las indicaciones sobre la vacuna antineumocócica (VAN), solo recomienda en el adulto el uso del esquema secuencial. En el do cumento “Lineamientos Técnicos y Manual del Vacunador de la Vacunación contra Neumococo, Estrategia Técnica 2017-2018”31, el MSAL indica que debe aplicarse la VAN en adultos que inte gran grupos de alto riesgo de padecer enferme dad invasiva incluyendo: anemia drepanocítica, cardiopatía congénita, enfermedades pulmo nares crónicas, diabetes mellitus, hepatopatía crónica, fístula de líquido cefalorraquídeo, as plenia funcional o anatómica, implante coclear, infección por HIV, leucemias, linfomas Hodgkin y no-Hodgkin, mieloma múltiple, otras neo plasias, falla renal crónica, síndrome nefrótico, tratamientos con quimioterapia o corticoides, trasplantes de órganos. En otro punto respec to de la revacunación afirma que se puede re-vacunar una vez con la vacuna polisacárida de 23 serotipos (VPN23) a personas con alto riesgo de padecer enfermedad invasiva como asplenia funcional o anatómica, insuficiencia renal cró nica, síndrome nefrótico, infección por HIV, tras plante, leucemia, linfoma, mieloma múltiple, otras neoplasias y tratamiento inmunosupresor. Afirma además que las embarazadas de grupo de riesgo que no recibieron previamente VAN, pueden recibirla a partir de la semana 16 de gestación. Es recomendable aprovechar la opor tunidad de la VAG anual para aplicar la vacuna VAN si correspondiere. Los mayores de 65 años no requieren orden médica para vacunarse32.
En un documento de consenso de expertos de la Asociación Latinoamericana del Tórax (ALAT) y de la Sociedad Española de Neumolo gía y Cirugía Torácica (SEPAR), se concluyó que el consumo de tabaco es un factor de riesgo muy significativo para el desarrollo de enfermedad neumocócica en sus formas clínicas de NAC y enfermedad neumocócica invasiva (ENI)33.
En nuestro medio disponemos de la VPN23 (con los serotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, and 33F) y de la vacuna conjugada de 13 seroti pos (VCN13) (con los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F), conjugados con la proteína transportadora CMR 197. La VCN13 fue aprobada por ANMAT para mayores de 50 años en 2012 basada en su inmunogenicidad supe rior para 10 de los 12 serotipos vacunales que comparten34. Las vacunas antineumocócicas son administradas en forma secuencial, (VCN13 se guida de la VPN23) según la recomendación del comité de consulta sobre prácticas de inmuni zación de EE. UU., Advisory Committee on Immuni zation Practices (ACIP), para mayores de 18 años con factores de riesgo, incluyendo candidatos y receptores de trasplante de células hematopo yéticas. En 2014, el ACIP comenzó a recomendar la VCN13 para adultos ≥65 años de edad35.
En 2015 Bonten y col. publicaron un estudio controlado con placebo, doble ciego aleatorizado que demostró contundentemente en los indivi duos vacunados que una dosis única de VCN13 resulta en un 45.6% menos de primer episodio de NAC debida a alguno de los serotipos pre sentes en la vacuna (p < 0.001); un 45.0% menos de episodios de NAC no bacteriémica/no invasi va debida a un serotipo presente en la vacuna (p = 0.007) y un 75.0% menos de primer episodio de ENI (p<0.001)36. Dunne y col. en una revisión narrativa compararon la efectividad de las vacu nas VPN23 y VCN13 en las mismas poblaciones de adultos, encontrando una efectividad que va ría entre 10 y 11% para VPN23, entre 40 y 79% para la VCN13, y 39 a 83% para la vacunación secuencial VCN13/VPN2337. La efectividad de la vacuna contra la infección del tracto respirato rio inferior de cualquier etiología varía entre 8 y 3% para VPN23 y entre 9 y 12% para VCN13. Estos datos confirman la mejor eficacia de la vacuna conjugada para prevenir la infección pulmonar en adultos. La última novedad es la vacuna con jugada de 20 serotipos (VCN20), que está indica da para la inmunización activa para la preven ción de la neumonía y enfermedades invasivas causadas por los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F y 33F de Streptococcus pneumoniae en adultos ma yores de 18 años. La VCN20 aprobada por la Food and DrugsAdministration (FDA) en 2021, por la Eu ropean Medicines Agency (EMEA) en 2022 y por la ANMAT a mediados de 2023, agrega 7 serotipos a la 13 valente, lo cual significa una simplificación de los esquemas de vacunación en un futuro cercano38,39.
La vacunación para neumococo en adultos re comendada en inmunocompetentes en Argen tina es la administración secuencial de VCN13 seguida a los 12 meses de la VPN23. La VPN23 requiere una 2ª dosis luego de la edad de 65 años (5 años luego de la primera dosis). En inmuno comprometidos la administración secuencial de VCN13 debe estar seguida por al menos 8 sema nas de la VPN2331. En esplenectomizados, por tadores de anemia drepanocítica o que tienen fístula de líquido cefalorraquídeo se recomienda una segunda dosis de VPN23 a los 5 años de la primera y en estos casos eventualmente una 3ª dosis luego de los 65 años de edad40 (Fig. 2). La vacunación usando la VCN20 sugiere un esquema muy simple (Fig. 3).
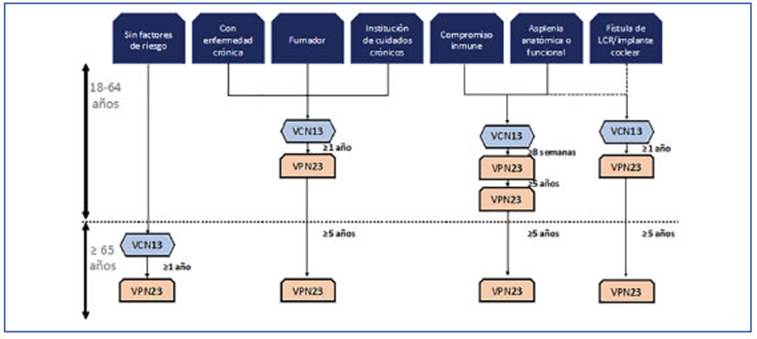
Figura 2 Esquema de vacunación secuencial en adultos con las vacunas 13-conjugada (VCN13) y 23-polisacárida (VPN23) según edad mayor o menor de 65 años, el hábito de fumar, presencia de comorbilidades y de inmunocompromiso. Es preferible aplicar VCN13 en primer lugar y esperar al menos 1 año hasta la administración de la otra vacuna (salvo en inmunocomprometidos, en cuyo caso se deja pasar al menos 8 semanas). En casos de implante coclear o fístula de LCR, si fuera alto el riesgo de infección, podría también darse la vacuna secuencial a las 8 semanas. En inmunocomprometidos se recomienda dar una 2ª. dosis de VPN23 a los 5 años de la primera dosis aún antes de la edad de 65 años
Figura 3 Esquema de vacunación en adultos con las vacunas 20-conjugada (VCN20) según edad mayor o menor de 65 años, el hábito de fumar, presencia de comorbilidades y de inmunocompromiso. La mayor cobertura y mejor inmunogenicidad para las 7 cepas agregadas a la VCN13 sugiere el logro de una cobertura mejor a la lograda con la administración secuencial de VCN-13 seguida de VPN23 además de la simplicidad del proceso
Vacunas COVID-19
En noviembre de 2019 se reportó la aparición en China de un nuevo coronavirus capaz de causar infección respiratoria grave, que la OMS declaró como pandemia en marzo en 2020. A principios de 2020 se logró secuenciarlo, lo que permitió el desarrollo y producción de vacunas basadas en vectores virales y en plataformas de ARN mensajero. Estas vacunas han demostrado ser altamente efectivas contra formas graves de la enfermedad en ensayos clínicos y de vida real, y tanto en adultos como en población ges tante, pediátrica y adolescente2,41. Se estima que las vacunas evitaron la muerte de 19 millones de personas en el primer año de su utilización42. Los esquemas completos de vacunación confie ren protección de entre el 88% y 55% según la vacuna y la variante considerada, alcanzando la mayor efectividad para la variante Alfa y la menor para Ómicron43. En Argentina, la vacuna ción con las vacunas inicialmente disponibles (Sputnik V, ChadOx1 y BBBIBP-CorV) se asoció a disminuciones significativas de infección y mor talidad44,45. La evidencia relevada por revisiones sistemáticas sugiere que las vacunas basadas en plataforma ARNm se asocian a mayor pro tección contra enfermedad sintomática46. Estu dios observacionales sugieren disminución del riesgo de aparición de síntomas del síndrome conocido como long COVID (COVID prolongado) entre vacunados47. También se observó que los esquemas heterólogos conferían protección y se llegó a usar esos esquemas para variantes de mayor contagiosidad48. En noviembre de 2021 se identificó la variante Ómicron ante la cual las vacunas exhibían menos capacidad neutrali zante y la inmunidad decaía más rápidamente49. La aplicación de dosis de refuerzo, demostró la efectividad adicional de una tercera dosis y de una cuarta dosis sobre la tercera, principalmen te en mayores de 60 años50,51. Se aprecia reduc ción de la efectividad contra infecciones del 47% a los 280 días, y una efectividad del 75% a los 112 días, para prevenir internaciones y muerte52. En Argentina en mayo de 2023 la mayoría de las personas de 50 años o más no habían recibido una dosis de refuerzo en los últimos 6 meses53.
En 2022 se introdujeron vacunas bivalentes orientadas simultáneamente contra la variante ancestral y la nueva sub-variante54,55. Los refuer zos bivalentes aportaron una efectividad adi cional a las dosis del esquema inicial, del 50% para personas entre 50 y 64 años que habían recibido dos dosis previamente. En contraste, la efectividad adicional fue de 22% para mayores de 65 que habían recibido más de dos dosis56. La explicación de esta menor efectividad compara tiva de las vacunas bivariantes sería el imprin ting (impronta genética) fenómeno por el que la respuesta inmunológica se configura princi palmente contra los antígenos de las variantes originales de las primeras vacunas sin lograrse una respuesta igual de eficiente ante otros an tígenos57.
La inmunidad más robusta se alcanza cuando se combinan la inmunidad adquirida por vacu nación y la natural por infección, situación muy frecuente por la alta prevalencia de infección en la comunidad58. El MSAL al momento de la escri tura de este documento recomienda que quie nes se encuentren dentro de grupos de riesgo de desarrollar formas graves (mayores de 50 años, inmunocomprometidos y personas gestantes) reciban una dosis de refuerzo si han transcurri do 6 meses desde la última dosis aplicada, independientemente de la cantidad de refuerzos recibidos previamente y respetando el interva lo mínimo de 4 meses desde la última dosis. Los menores de 50 años con comorbilidades y aquellos con mayor riesgo de exposición (perso nal de salud) y función estratégica se incluyen en el grupo de “riesgo medio” de experimentar enfermedad grave o muerte por infección por COVID-19. La recomendación para este grupo es que reciban un nuevo refuerzo a los 6 meses de la última dosis aplicada, y posteriormente un re fuerzo anual (impronta genética).
Los menores de 50 años sin comorbilidades tienen disponible la vacunación de refuerzo contra la COVID-19 y se recomienda que su apli cación sea anual53.
Los efectos adversos de la vacunación más frecuentes son reacciones locales leves59. Los efectos adversos más serios han sido la apari ción de trombosis (principalmente asociado con la vacuna ChadOx1) y la de miocarditis (vincula dos a las vacunas de plataforma ARNm). Aumen tos modestos de riesgo de eventos hematológicos y vasculares tras la vacunación, este riesgo es mucho mayor y prolongado para la infección por el virus60,61. Las miocarditis se registran en 1.08 casos por cada 100 000 personas vacuna das, y son graves en uno de cada 5 eventos62. Es más frecuente la miocarditis por la infección por SARS-CoV-2 que por la vacunación, la relación riesgo/beneficio resulta altamente favorable a la vacunación63.
Vacunas contra pertussis
La tos ferina también llamada coqueluche, es causada por la bacteria Bordetella pertussis. Se caracteriza por tres fases: catarral, paroxística y de convalecencia64. Durante la fase catarral, los infectados experimentan coriza, tos ocasional leve y fiebre baja. La fase paroxística se carac teriza por tos espasmódica, vómitos post-tos y sibilancias inspiratorias. Los síntomas mejo ran lentamente durante la fase de convalecen cia, que generalmente dura de 7 a 10 días, pero puede durar meses. Los factores que afectan la presentación clínica de la tos ferina incluyen la edad, el nivel de inmunidad, el historial de vacu nación y el uso de antibióticos al comienzo de la enfermedad65.
El MSAL recomienda esta vacuna junto con otras vacunas para bebés y niños pequeños. En adultos menores de 65 años no se recomienda la vacuna acelular junto con la vacuna antitetá nica y antidiftérica (dTpa). Durante el embarazo se indica una dosis de dTpa después de la se mana 20, entre las semanas 27 y 36, aun cuando hubieran recibido previamente esta vacuna. Se sugiere que los adolescentes y adultos reciban una dosis de refuerzo de la vacuna Td (toxoides tetánico y diftérico) cada 10 años para garantizar una protección continua contra el tétanos y la difteria y reducir la transmisión de esta última6,66. Para cubrir la infección por B. pertussis podría reemplazarse una de las dosis de la doble bacte riana por la dTpa.
Recientemente, las guías GOLD (Global Initiati ve for Chronic Obstructive Lung Disease) recomien dan la vacunación con dTpa a pacientes con en fermedad pulmonar obstructiva crónica que no fueron vacunados en la adolescencia67.
Vacuna contra herpes zóster
El herpes zóster (HZ) es una enfermedad neu ro cutánea producida por la reactivación de la infección primaria por el virus de la varicela-zóster (VZV). Esto resulta en la varicela, continuando con la residencia de por vida del ge noma VZV en la raíz dorsal o nervio craneal de ganglios68. La incidencia y gravedad del HZ aumentan con la edad. Más del 90% de pacientes mayores de 50 años en todo el mundo han sido infectados con VZV y por ende, están en riesgo de desarrollar HZ, con una incidencia de aproxi madamente entre 2-4,6 personas por cada 1000 personas al año69. La incidencia aumenta en adultos mayores de 80 años, llegando a valores entre 10 y 12.8 casos por cada 1000 personas-año70. Ello implica que una de cada tres perso nas entre 50 y 90 años sufrirá algún episodio de HZ71. La inmunidad al HZ, que se adquiere por primera vez de manera innata (primoinfección) en niños y adultos jóvenes cuando adquieren varicela y puede mantenerse en forma intrín seca, es decir en respuesta subclínica a la re activación de VZV o por refuerzo extrínseco, de forma asintomática por exposición al VZV en la comunidad72. El riesgo de HZ aumenta en perso nas de 50 años o más debido a los efectos de la inmuno-senescencia o a cualquier edad por in munosupresión debido a enfermedades como el HIV, diabetes mellitus, EPOC, insuficiencia renal crónica, enfermedad cardiovascular, entre otras y/o por tratamientos inmunosupresores como los tratamientos quimioterápicos en la pobla ción oncológica, trasplantes, enfermedades reumatológicas o enfermedades del intersticio pulmonar73. El HZ presenta múltiples complica ciones siendo la neuralgia post -herpética (10- 15%) la más frecuente, se caracteriza por dolor crónico radicular que puede prolongarse mucho tiempo después de la erupción vesicular, llegan do a ser incapacitante y muy difícil de tratar. La neuralgia post-herpética afecta a entre el 5% y el 30% de las personas que desarrollan HZ, más frecuente en las personas mayores de 60 años74. Si afecta la región ocular, puede complicarse con queratitis, conjuntivitis e incluso glaucoma que pueden cicatrizar y dejar lesiones graves como distintos grados de ceguera. En inmunosuprimi dos puede haber complicaciones graves como el HZ diseminado, mielitis, encefalitis y/o parálisis de nervios craneales75. La vacuna a virus vivo atenuado contra el HZ que contiene la cepa Oka VZV ha demostrado una eficacia del 51.3% en la prevención del HZ y un 66.5% de eficacia en la reducción de la neuralgia post-herpética en per sonas de 60 años o más. Su eficacia disminuye con la edad, de 69.8% en adultos de entre 50 y 59 años a un 37.6% en aquellos de 70 años o más y está contraindicada en personas con inmunosu presión70. Desde 2015 la FDA recomienda la nue va vacuna recombinante que contiene como an tígeno, una glicoproteína llamada gE (fragmento del VZV) más el adyuvante AS 01B para desper tar la respuesta inmune. Dos dosis separadas por 2-6 meses, tienen una eficacia del 97.2% en reducir el riesgo de HZ en adultos de 50 años o más69, manteniendo un 87.9% para prevención de HZ luego de 4 años de haber recibido dos dosis71. Pacientes con Asma y EPOC tienen un mayor riesgo de herpes zóster (HZ) y neuralgia post-herpética, especialmente cuando se usan tratamientos inmunosupresores. En particular, se observó un aumento del 21% y 53% en el ries go de neuralgia post-herpética en pacientes con Asma y EPOC, respectivamente. Además, los pa cientes con EPOC tienen 2.6 veces más probabili dades de ser hospitalizados debido a HZ73.
Vacuna contra virus sincicial respiratorio
El VSR es una causa frecuente de infecciones del tracto respiratorio, que puede causar enfer medad grave, es común en lactantes y adultos mayores. En EE. UU. durante el invierno se es tima que hay entre 700 000 y 2 000 000 de ca sos de VSR, las infecciones en adultos mayores representan aproximadamente 177 000 hospi talizaciones y 14 000 muertes anuales76. En Ar gentina hay alrededor de 7 000 000 de adultos mayores de 65 años, un 0.2% (14 000 personas) van a padecer una infección grave por VSR77. Las neumonías, exacerbaciones de EPOC o asma son causa de internación en pacientes con una in fección grave por VSR. Además, un 10% de estos pacientes va a fallecer como consecuencia de esta infección78. En muchos casos, los niños son la fuente de infección para los adultos mayores, mientras que en otros, los niños se contagian de los adultos mayores. Recientemente la FDA aprobó una vacuna contra el VSR para adultos. La eficacia de esta vacuna fue del 94.1% [Interva lo de Confianza (IC) del 95%, 62.4 a 99.9] frente a la enfermedad grave (neumonía) y del 71.7% (IC del 95 %, 56.2 a 82.3) frente al VSR que produce reagudización de enfermedad respiratoria rela cionada79. En Argentina esta vacuna aún no ha sido presentada ante la ANMAT y por ende, no se encuentra disponible aún.
Recomendaciones de vacunación en el adulto por el neumonólogo
Las vacunas previenen enfermedades y sus complicaciones a lo largo de la vida. Sin embargo, la cobertura de vacunación en adultos es baja en general y está lejos de alcanzar las metas esta blecidas. Entre las vacunas recomendadas para adultos, se destacan aquellas contra la influenza y el neumococo, que buscan prevenir complica ciones respiratorias y de otro tipo80. En pacientes con enfermedades pulmonares crónicas, como EPOC, asma y bronquitis crónica, estas vacunas son importantes. Recomendamos que, además de las indicaciones específicas del calendario de vacunación, se sigan las recomendaciones del MSAL y otros organismos para simplificar las indicaciones de vacunación en adultos según las distintas edades, buscando de ampliar dichas indicaciones.
Indicaciones de vacunación en enfermedades específicas
Asma bronquial
El asma es una enfermedad respiratoria cró nica caracterizada por una inflamación persis tente de los bronquios en la que diferentes ti pos de células juegan un papel importante. Esta inflamación causa síntomas en personas sus ceptibles, con una obstrucción variable pero ge neralizada del flujo de aire, que revierte espon táneamente o con tratamiento. La inflamación también aumenta la hiperreactividad bronquial ante diversos estímulos. Los asmáticos se en cuentran comprendidos entre las enfermedades pulmonares crónicas, reconocidas entre las in dicaciones de VAG anual y COVID-19 según los lineamientos dispuestos por MSAL y la Global Initiative for Asthma (GINA) 20229,81. Los CDC a tra vés de la agenda de inmunización 2030 (Healthy People 2030) plantea como principales objetivos reducir la morbilidad y mortalidad de enferme dades prevenibles mediante la vacunación, y para ello garantizar el acceso a vacunas nuevas y existentes a toda la población. En una revisión sistemática realizada por Boikos y col. se encon tró una asociación positiva entre el asma y la ENI. Este hallazgo respalda la inclusión del asma como una enfermedad de alto riesgo que requie re la administración de inmunización contra el neumococo82. Por lo anteriormente citado, docu mentos de consenso de expertos, la guía española de manejo del asma (GEMA 5.3) y el CDC se recomienda la administración de VAN en pa cientes con asma83,84.
Enfermedad pulmonar obstructiva crónica
Es una enfermedad caracterizada por sínto mas respiratorios crónicos debidos a anorma lidades en parénquima pulmonar que causan obstrucción de las vías aéreas67. Las exacerbaciones son causadas por infecciones que au mentan la inflamación originando síntomas e impactando en la calidad de vida y la sobrevida. Las personas con EPOC tienen más frecuente mente NAC y menor sobrevida tras un episodio de NAC85. La EPOC tiene indicación de VAG anual y VAN mencionada en las guías GOLD, en la es pañola GesEPOC y en la guía nacional de diag nóstico y tratamiento de la EPOC del MSAL67,86,87. La VAG parece reducir la frecuencia de exacerba ciones y de necesidad de internaciones88,89. Disminuye el número de infecciones por influenza y reduciría el riesgo de eventos cardíacos isqué micos90,91. Evita las infecciones respiratorias agu das relacionadas con influenza en un 76%92. Las guías mencionadas recomiendan la VAN por ser la neumonía una comorbilidad reconocida por los CDC. La vacunación reduce el riesgo de NAC y de exacerbaciones93,94.
Tabaquismo
Existe evidencia de estudios poblacionales de mayor riesgo de enfermedad tipo influenza (ETI) entre fumadores. Una encuesta realizada en 5943 sujetos en Gran Bretaña encontró que el tabaco era uno de los seis factores asociados a ETI en el análisis multivariable95. El consumo de tabaco es, independientemente de la edad, la presencia de comorbilidades y el estado inmu nitario, indicación formal de vacunación VAG y VAN, aunque no existan otros factores de ries go31,96,97.
Otras enfermedades pulmonares crónicas
Las exacerbaciones agudas de enfermedades pulmonares crónicas suelen estar asociadas con patógenos virales y bacterianos. Estas exacer baciones contribuyen al deterioro de la función pulmonar, a una mala calidad de vida y gene ran una carga adicional para individuos, fami lias, comunidades y el sector de la salud. Existen varias vacunas que ofrecen protección contra patógenos respiratorios (S. pneumoniae, B. pertus sis, Influenza, VSR y SARS-CoV-2) que pueden desencadenar exacerbaciones, pero la evidencia que respalda su efectividad en la prevención de exacerbaciones de enfermedades pulmonares crónicas es limitada98. La mayoría de las investi gaciones se enfocan la EPOC, el asma y la fibro sis quística. El papel de las vacunas existentes dirigidas a los patógenos asociados con las bron quiectasias no ha sido suficientemente estudia do y la evidencia de beneficio es limitada99. A pe sar de esto, debido al riesgo de complicaciones como neumonía grave, ENI y hospitalización por influenza, se recomienda que los niños y adul tos con bronquiectasias reciban las vacunas de acuerdo con el programa nacional de inmuniza ción para grupos de alto riesgo5. También es im portante considerar el papel de la inmunización materna durante el embarazo.
Recomendaciones de vacunación para el neumonólogo
Teniendo en consideración los antecedentes y la edad, apoyados en la disponibilidad de las dis tintas vacunas, las recomendaciones del MSAL y las publicaciones recientes, la Sección Infeccio nes Pulmonares de la Asociación Argentina de Medicina Respiratoria formula las siguientes re comendaciones para el neumonólogo respecto de la vacunación de adultos con enfermedades pulmonares:
Mayores de 18 años y menores de 65 años, sin antecedentes de enfermedad pulmonar y sin contacto cercano con personas con alto riesgo de complicaciones si se contagian de influenza:
Pueden recibir VAG anual, preferentemente tetravalente, aun cuando no tengan una indica ción precisa. Interrogarlos acerca de su última vacunación con la vacuna dT que debe repetirse cada 10 años. Se recomienda que alguna de las dosis de vacuna dT a aplicarse a lo largo de la vida sea realizada con la vacuna dTpa si el pa ciente nunca se hubiera realizado vacunación con vacuna acelular para pertussis. Pueden reci bir VAG esquema inicial y un refuerzo anual.
Mujeres que estén cursando un embarazo
VAG (está indicada durante cualquier trimes tre del embarazo), vacuna dPTa (después de la 20ª semana de gestación en cada embarazo).
Mayores de 18 años y menores de 65 años, con antecedentes de enfermedad pulmonar o taba quismo, u otras comorbilidades, o con contacto con pacientes de alto riesgo de sufrir complica ciones si contraen influenza:
VAG anual, preferentemente tetravalente, VAN según el esquema presente en la Figura 2. Interrogarlos acerca de su última vacunación con la vacuna dT que debe repetirse cada 10 años. Se recomienda que alguna de las dosis de vacuna dT a aplicarse a lo largo de la vida sea realizada con la vacuna dTpa si el paciente nunca se hubiera realizado vacunación con vacuna acelular contra pertussis. Pueden recibir VAC es quema inicial con refuerzo cada 6 meses.
Mayores de 18 años y menores de 65 esple nectomizados o portadores de anemia drepano cítica o que tienen fístula de líquido cefalorra quídeo:
VAG anual, preferentemente tetravalente, VAN según el esquema presente en la Figura 2. Vacuna dT cada 10 años. Se recomienda que al guna de las dosis de vacuna dT a aplicarse a lo largo de la vida sea realizada con la vacuna dTpa si el paciente nunca se hubiera realizado vacu nación con vacuna acelular para pertussis (Fig. 1). Pueden recibir VAC esquema inicial con refuer zos cada 6 meses.
Adultos de entre 50 y 65 años, sanos:
Solo tienen indicado específicamente en el ca lendario la aplicación de la vacuna doble dT cada 10 años a lo largo de la vida. Se recomienda que alguna de las dosis de dicha vacuna sea realiza da con la vacuna dTpa. Tienen indicación de va cunación contra HZ. La vacuna recombinante se aplica en 2 dosis separadas por entre 2 y 6 meses.
Mayores de 65 años, con o sin comorbilidades
VAG anual, preferentemente tetravalente alta dosis o trivalente con adyuvante y VAN según el esquema presente en la Figura 2. Vacuna dT cada 10 años. Se recomienda que alguna de las dosis de vacuna dT a aplicarse a lo largo de la vida sea realizada con la vacuna dTpa si el paciente nun ca se hubiera realizado vacunación con vacuna acelular para pertussis. Si no han sido vacunados aún contra el HZ tienen indicación de hacerlo. Pueden recibir VAC esquema inicial con refuer zos cada 6 meses.
Pacientes de cualquier edad internados en te rapia intensiva con insuficiencia respiratoria o con insuficiencia cardíaca:
Vacuna contra el herpes zóster. VAG anual, pre ferentemente tetravalente, VAN según el esquema presente en la Figura 2. Vacuna dT cada 10 años. Se recomienda que alguna de las dosis de vacuna dT a aplicarse a lo largo de la vida sea realizada con la vacuna dTpa si el paciente nunca se hubiera rea lizado vacunación con vacuna acelular para per tussis. Si no han sido vacunados aún contra el HZ tienen indicación de hacerlo. Pueden recibir VAC esquema inicial y refuerzos cada 6 meses.
Las recomendaciones se resumen en la Ta bla 2.
Conclusión
Las enfermedades respiratorias crónicas son un problema de salud creciente, especialmente en lo relacionado con el consumo de tabaco y el envejecimiento de la población asociado a la constante actualización en las inmunizaciones y profilaxis en todos los individuos con y sin fac tores de riesgo. Esto se convierte en una parado ja derivada de los avances en la atención médica durante las últimas décadas.
En este escenario, el neumonólogo juega un pa pel fundamental como referente, en especial lue go de la emergencia del COVID-19, donde muchas especialidades derivaban a la consulta por el espe cialista para consultar sobre las nuevas vacunas, coadministración con VAG y VAN y otras vacunas, tiempos entre dosis, entre otros interrogantes.
Además, el neumonólogo también se enfren ta a las consecuencias de la falta de prevención de infecciones respiratorias, como exacerbacio nes de EPOC, de asma, NAC y otros trastornos infecciosos. Como resultado, el neumonólogo es el especialista que más prescribe e informa so bre vacunas como mejor método de prevención de infecciones en enfermedades crónicas.
Es objetivo de este comité redactor, promo ver la actualización constante de los neumo nólogos de adultos para que estén preparados para desempeñar un papel directo como agen tes en la recomendación de vacunas a sus pa cientes.