Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero vol.34 no.2 Ciudad Autónoma de Buenos Aires dic. 2019
ARTÍCULO
Avifauna de los bañados de Añatuya, Área de Importancia para la Conservación de las Aves (AICA) de Santiago del Estero, Argentina
Ada Lilian Echevarria1,4, María Elisa Fanjul1,2, María Valeria Martínez1 y Analía Benavidez3
1Fundación Miguel Lillo, Ministerio de Educación de la Nación, Miguel Lillo 251, T4000 San Miguel de Tucumán, Tucumán, Argentina.
2Facultad de Ciencias Naturales e IML-UNT, Miguel Lillo 205, T4000 San Miguel de Tucumán, Tucumán, Argentina.
3Centro de Estudios Territoriales Ambientales y Sociales (CETAS), Facultad de Ciencias Agrarias, Universidad Nacional de Jujuy, Alberdi 47, 4600 San Salvador de Jujuy, Jujuy, Argentina.
Resumen
En este trabajo damos a conocer la avifauna de los Bañados de Añatuya, Santiago del Estero. Se realizaron tres campañas de tres días cada una, en octubre de 2012, marzo de 2013 y junio de 2014. Se identificaron 56 especies, 20 migratorias (15 regionales y cinco neárticas-neotropicales) y el resto residentes. Determinamos cinco ensambles tróficos de acuerdo a sus estrategias de búsqueda de alimento: I- nada en superficie, II- bucea o zambullida, III- caminata en playas o aguas someras, IV- desde perchas o en vuelo, V- desplazamiento entre la vegetación. Debido a que las aves son un grupo indicador, y los Bañados de Añatuya un Área Importante para la Conservación de las Aves (AICA), es importante se continúen los estudios para plantear pautas de manejo y conservación en la región.
Palabras clave: Bañados de Añatuya; Diversidad; Aves migratorias; Ensambles tróficos; Humedales.
Abstract
Avifauna of the bañados de Añatuya, Important Bird Area (IBA) of Santiago del Estero, Argentina
In this work we present the avifauna of the Bañados de Añatuya, Santiago del Estero. Three campaigns of three days each were held in October 2012, March 2013 and June 2014. We identified 56 species, 20 migratory (15 regional and five Neartic-Neotropical) and the remaining residents. We determined five trophic assemblages according to bird’s foraging strategies: I- swim on the surface, II- diving or plunging, III- walking on beaches or waters shallow, IV- from perches or in flight, V- moving between the vegetation. Because the birds are an indicator group and the Bañados de Añatuya an Important Bird Area (IBA), it is important to continue the studies to establish guidelines for management and conservation in the region.
Key words: Bañados de Añatuya; Diversity; Migratory birds; Trophic assemblages; Wetlands.
Recibido 3 diciembre 2018
Aceptado 15 abril 2019
Los Bañados de Añatuya son considerados un Área Importante para la Conservación de la Aves (AICA) por albergar especies de aves indicadoras de dos categorías: cuatro especies casi amenazadas a nivel global, el Ñandú (Rhea americana), el Flamenco Austral (Phoenicopterus chilensis), el Canastero Enano (Spartonoica maluroides) y el Tachurí Canela (Polystictus pectoralis), y ocho especies de endemismos de biomas (Moschione 2005).
Los Bañados de Añatuya están ubicados en los departamentos de Taboada y Avellaneda, de la provincia de Santiago del Estero, a 270 km de la capital provincial (Fig. 1). El humedal tiene una extensión aproximada de 90000 ha y se conforma por el rebalse y anegamiento del Río Salado. En 1997, mediante ley provincial Nº 6381, los bañados fueron declarados Reserva Provincial de Uso Múltiple (Chebez 2005). En la actualidad el área protegida no presenta una implementación efectiva (Moschione 2005); sin embargo, existen fincas privadas que funcionan como cotos de caza, principalmente de patos, controlados por la Dirección General de Bosques y Fauna (Santiago del Estero), por resolución de caza deportiva Nº 576/2016.
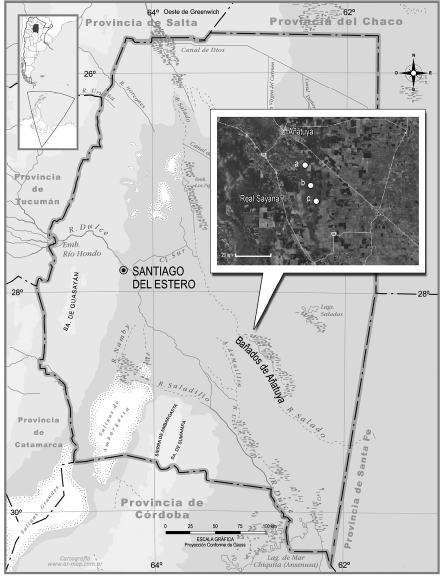
Figura 1. Ubicación de los Bañados de Añatuya, Santiago del Estero, Argentina. Los círculos blancos indican los sitios de muestreo dentro del área de los bañados.
La vegetación acuática en los bañados está compuesta por totoras (Typha latifolia, Juncus sp., Scirpus sp.) y especies flotantes y arraigadas tales como Lechuga de Agua (Pistia stratiotes), Jacinto de Agua (Eichhornia crassipes), Lenteja de Agua (Lemna minor), Hydrocharis sp., Myriophyllum sp. y Ludwigia sp. (Menghi 2000, García Murillo et al. 2009). El bosque chaqueño que rodea los bañados ha sufrido numerosos impactos antrópicos, tales como la extracción de madera, sobrepastoreo y agricultura intensiva. El bosque fue invadido por especies tales como el Vinal (Prosopis ruscifolia), numerosas especies de cactáceas y bromelias terrestres como el Chaguar (Bromelia hieronymi) (Gasparri et al. 2013). En los sitios con suelos salobres, se destacan especies de Jume (Allenrolfea vaginata y Heterostachis ritteriana), mientras que en algunos sectores permanecen pequeños parches de bosque chaqueño (Cabrera 1976), donde se observan ejemplares de Quebracho Blanco (Aspidosperma quebracho-blanco), Quebracho Colorado Santiagueño (Schinopsis quebracho-colorado), Algarrobo Blanco (Prosopis alba), Algarrobo Negro (P. nigra) y Mistol (Zyzyphus mistol), entre otros.
Existen escasos estudios de aves en los Bañados de Añatuya. Por ejemplo, Blanco y Canevari (1993), reporta en el Censo Neotropical de Aves Acuáticas de 1992, especies tales como el Pato Media Luna (Anas discors), la Bandurria Boreal (Theristicus caudatus) y el Corbatita Dominó (Sporophila collaris), las cuales no estaban citadas o tenían pocos registros en trabajos a escala provincial (Olrog 1979, Nores e Yzurieta 1981, Salvador y Salvador 1990, Nores et al. 1991). Chebez (2005) y BirdLife International (2018) en una recopilación de estudios, describen que los bañados deben ser estudiados en detalle y mencionan que son habitados por especies como el Macá Grande (Podiceps major), el Doradito Pampeano (Pseudocolopteryx flaviventris), el Jote Cabeza Amarilla (Cathartes burrovianus), el Carpintero Blanco (Melanerpes candidus), el Martín Pescador Chico (Chloroceryle americana) y el Martín Pescador Mediano (C. amazona), las cuales no fueron registradas en el presente estudio, mientras que el Chajá (Chauna torquata), el Pato de Collar (Callonetta leucophrys), el Macá Pico Grueso (Podilymbus podiceps), el Carau (Aramus guarauna), la Gallareta Escudete Rojo (Fulica rufifrons), la Jacana (Jacana jacana) y el Martín Pescador Grande (Megaceryle torquata), sí estuvieron presentes en nuestro estudio. Además, Moschione (2005) indica que los Bañados de Añatuya constituyen un AICA por ser un sitio de reproducción de aves acuáticas, especialmente de Anseriformes y Ardeiformes, y un área de invernada de especies migratorias, pampeanas y patagónicas.
El objetivo del presente trabajo es dar a conocer la composición y estructura de la avifauna de los Bañados de Añatuya, como un aporte actual al conocimiento de la biodiversidad de dichos bañados.
El área de los bañados es de difícil acceso, ya que los sitios visitados presentan aguas someras con vegetación palustre y aguas libres más profundas, por lo que la zona fue recorrida a pie, a caballo y en vehículo. Se seleccionaron tres sitios en el área de estudio: a) 28°38’09’’ S - 62°42’51’’O, b) 28°44’27’’S - 62°40’43’’O y c) 28°48’33’’S - 62°38’39’’O (Fig. 1), los cuales fueron visitados durante tres días cada uno, en los meses de octubre de 2012, marzo de 2013 y junio de 2014, con un total de 10 muestreos en cada uno de los meses. Las técnicas de muestreo dependieron de las condiciones del ambiente. Se realizaron censos de transecta de faja de 500 m de largo por 50 m a cada lado de la línea de marcha en los lugares de aguas someras y en los lugares con aguas de mayor profundidad, puntos de radio fijo de 15 m y 20 min de duración. Las aves fueron observadas mediante el uso de binoculares 10 x 50 mm e identificadas con las guías de campo y consulta a la Colección de Ornitología de la Fundación Miguel Lillo (Narosky e Yzurieta 2010, López-Lanús 2017). La lista sistemática se elaboró en base a los criterios de Remsen et al. (2019). La abundancia relativa para cada especie (AR%), se midió como la relación porcentual del número de individuos de una especie registrados en todos los censos con relación al total de individuos de todas las especies, mientras que la frecuencia relativa (F%) se consideró como la proporción entre el número de censos en que la especie estaba presente con relación al total de censos. Tanto la AR% como F%, fueron calculadas para las tres visitas realizadas. Siguiendo los criterios de Jaksic (1981), Chani (1986), Beltzer y Neiff (1992), López de Casenave y Filipello (1995), Sarrías et al. (1996), Echevarria (2001), clasificamos a las especies en ensambles o grupos funcionales de acuerdo a cómo (tácticas) y dónde buscan el alimento (microhábitats).
Se identificaron 56 especies de aves pertenecientes a 14 órdenes y 25 familias, con una abundancia total de 6686 individuos. Las familias dominantes fueron Anatidae (10 especies), Scolopacidae (seis especies), Ardeidae y Tyrannidae (cinco especies); cabe destacar que dos de las especies de Tyrannidae dependen de humedales, consideradas como tales aquellas especies que por sus características no presentan adaptaciones para la búsqueda de los recursos en ambientes acuáticos, ya sean caminando, nadando o cazando desde perchas o el aire, pero sí dependen de los humedales para su desarrollo, alimentación y reproducción. Las especies con mayor AR% y F% en octubre 2012 fueron el Jote Cabeza Negra (Coragyps atratus), la Golondrina Parda (Progne tapera) y el Chajá, en marzo 2013 la Golondrina Ceja Blanca (Tachycineta leucorrhoa) y la Golondrina Parda, y en junio 2013 el Cuervillo de Cañada (Plegadis chihi) y el Tero Real (Himantopus mexicanus) (Tabla 1). Además, se registraron 20 especies migratorias: 15 fueron migratorias regionales y cinco migratorias neárticas-neotropicales, mientras que el resto de las especies fueron residentes (Olrog 1979, Echevarria y Chani 2006, López-Lanús 2017). De acuerdo a las características de las especies registradas, se definieron cinco ensambles tróficos de acuerdo a las estrategias de búsqueda de alimento: I- nada en superficie, II- bucea o zambullida, III- caminata en playas o aguas someras, IV- desde perchas o en vuelo, y V - desplazamiento entre la vegetación. Los ensambles dominantes en los bañados fueron el III y el I (Tabla 1).
Tabla 1. Especies de aves registradas en los Bañados de Añatuya, Santiago del Estero, en los muestreos realizados durante los años 2012 a 2014. Para cada especie se indica estatus migratorio (MN-N: neárticas-neotropicales; MR: migrantes regionales; R: residentes), pertenencia a ensamble trófico (I- nada en superficie, II- bucea o zambullida, III- caminata en playas o aguas someras, IV- desde perchas o en vuelo, V- desplazamiento entre la vegetación). La abundancia relativa (AR%) y frecuencia relativa (F%) se indica para cada año de muestreo.
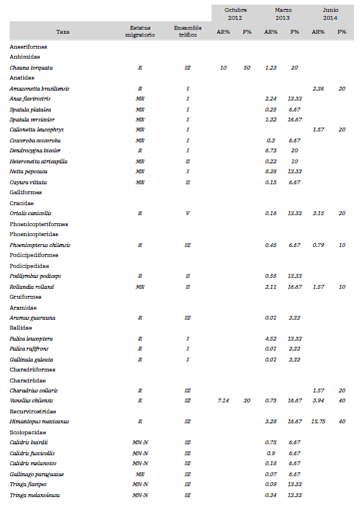
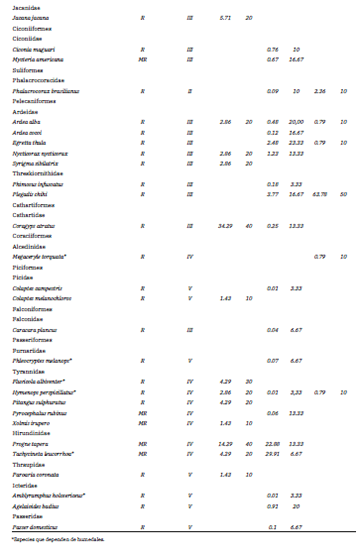
En base a los estudios previos realizados en los Bañados (Olrog 1979, Nores e Yzurieta 1981, Salvador y Salvador 1990, Nores et al. 1991, Blanco y Canevari 1993, Chebez 2005, BirdLife International 2018), el presente trabajo amplía la lista de especies y el conocimiento de la estructura de la comunidad de aves, a la vez que confirma el uso de este importante humedal por las especies identificadas anteriormente.
Según Coconier (2006), son 112 las especies de aves registradas en los humedales chaqueños, siendo frecuentes las familias Anatidae, Ardeidae, Rallidae, Charadriidae, Scolopacidae y Ciconidae. De este total, 35 especies estuvieron presentes en nuestro estudio. Especies como el Chajá, el Sirirí Colorado (Dendrocygna bicolor) y el Pato Zambullidor Chico (Oxyura vittata), no fueron consideradas en el listado de aves de humedales chaqueños, mientras que, en trabajos realizados en los Bañados de Figueroa, Santiago del Estero (Echevarria et al. 2010), Bañados del Quirquincho, Salta (Echevarria et al. 2011), y embalse El Tunal, Salta (Echevarria et al. 2014), sí estuvieron presentes. En el Censo Neotropical de Aves Acuáticas (2000-2004), López-Lanús y Blanco (2005) mencionaron que los Bañados de Añatuya son humedales de importancia internacional. Sin embargo, no se cita el número de especies registradas en dichos bañados.
Teniendo en cuenta que la heterogeneidad ambiental influye en la composición y abundancia de las aves (Ronchi-Virgolini et al. 2013, Brandolin et al. 2016), en este trabajo se observó que la presencia de ciertas familias en un tipo particular de hábitats indicaría una posible relación entre la composición y la estructura del ambiente. En los espejos de agua, por ejemplo, se observaron miembros de las familias Anatidae, Podicipedidae, Rallidae, Phalacrocoracidae, mientras que en aguas someras y playas con y sin vegetación se observaron representantes de las familias Charadriidae, Scolopacidae, Ardeidae, Ciconiidae, Recurvirostridae y Phoenicopteridae. Por último, en el bosque chaqueño que rodea a los humedales observamos numerosas especies de Passeriformes. Además, resaltamos que especies tales como el Martín Pescador Grande, el Junquero (Phleocryptes melanops), la Viudita Blanca (Fluvicola albiventer), el Pico de Plata (Hymenops perspicillatus), Golondrina Ceja Blanca y el Federal (Amblyramphus holosericeus), se deberían tomar en cuenta como especies indicadoras ya que son dependientes de los humedales para su alimentación y forma de vida (Echevarria 2014). Cabe destacar que a partir de estos resultados se deberían realizar estudios sistemáticos y diseñados para evaluar la relación entre heterogeneidad ambiental y la comunidad de aves en los Bañados de Añatuya, como se ha observado en otros ambientes (Ronchi-Virgolini et al. 2013, Brandolin et al. 2016).
Los resultados de este trabajo son el comienzo de estudios de base sobre la avifauna de la región que servirán para plantear pautas para su manejo y conservación, ya que las aves son consideradas un importante grupo indicador de la calidad del ambiente, sumado a que los Bañados de Añatuya son un AICA. Además, en esta área se cuenta con numerosos microhábitats que deberían ser estudiados, como por ejemplo playas y aguas someras que favorecerían la permanencia durante parte del año de varias especies de aves migratorias neárticas-neotropicales. Así también, es necesario continuar evaluando la alta riqueza de aves acuáticas residentes que se observaron en este estudio. Además, proponemos la realización de censos estacionales para lograr comprender la dinámica poblacional de la avifauna de los Bañados de Añatuya.
AGRADECIMIENTOS
Este trabajo se realizó gracias a la financiación de la Fundación Miguel Lillo, proyecto de investigación Z-0077-1. Al Lic. Pablo Pereyra, de la Sección Iconografía de la Fundación Miguel Lillo por la elaboración de las figuras. A la Dra. Geraldine Ramallo por la lectura e importantes aportes al manuscrito.
BIBLIOGRAFÍA
1. Beltzer AH y Neiff JJ (1992) Distribución de las aves en el valle del río Paraná. Relación con el régimen pulsátil y la vegetación. Ambiente Subtropical 2:77-102 [ Links ]
2. BirdLife International (2018) Important Bird Areas factsheet: Bañado de Añatuya. (URL: http://datazone.birdlife.org/site/factsheet/bañado-de-añatuya-iba-argentina) [ Links ]
3. Brandolin PG, Blendinger, PG y Cantero JJ (2016) From relict saline wetlands to new ecosystems: changes in bird assemblages. Ardeola 63:329-348. http://datazone.birdlife.org/site/factsheet/bañado-de-añatuya-iba-argentina [ Links ]
4. Blanco DE y Canevari P (1993) Censo Neotropical de Aves Acuáticas 1992. Humedales para las Américas (WA), Buenos Aires [ Links ]
5. Cabrera A (1976) Regiones fitogeográficas argentinas. Enciclopedia Argentina de Agricultura. Tomo II. Acme, Buenos Aires [ Links ]
6. Chani JM (1986) Estudios ecológicos de las aves acuáticas de la Albufera Mar Chiquita, Provincia Buenos Aires. Tesis Doctoral Universidad Nacional de Tucumán, Tucumán [ Links ]
7. Chebez JC (2005) Guía de las reservas naturales de la Argentina. Albatros, Buenos Aires [ Links ]
8. Coconier E (2006) Reporte final. Aves Acuáticas en la Argentina. Aves Argentinas/Asociación Ornitológica del Plata, Wetlands International, Buenos Aires [ Links ]
9. Echevarria AL (2001) Estudios ecológicos de las aves acuáticas del Embalse El Cadillal, Provincia de Tucumán. Tesis Doctoral Universidad Nacional de Tucumán, Tucumán [ Links ]
10. Echevarria AL (2014) Las aves como indicadoras de problemas ambientales en el Embalse La Angostura, Tucumán, Argentina. Acta Zoológica Lilloana 58:44-56 [ Links ]
11. Echevarria AL y Chani JM (2006) Aves migratorias, la importancia del Embalse El Cadillal (Tucumán, Argentina) como sitio de tránsito e invernada. Acta Zoológica Lilloana 50:97-108 [ Links ]
12. Echevarria AL, Marano CM y Martínez MV (2010) Birds of Figueroa Wetlands, Santiago del Estero. Biocell 34:A120 [ Links ]
13. Echevarria AL, Marano CF, Fanjul ME, Orce M, Martínez MV y Cocimano MC (2011) Humedales del Chaco: avifauna de los Bañados del Quirquincho, Salta, Argentina. IX Congreso de Ornitología Neotropical, Cuzco [ Links ]
14. Echevarria AL, Marano CF, Cocimano MC, Fanjul ME y Cormenzana Méndez A (2014) Composición y variación de la comunidad de aves del Embalse El Tunal, Salta, Argentina. Acta Zoológica Lilloana 58:80-93 [ Links ]
15. García Murillo P, Fernández Zamudio R y Cirujano Bracamonte S (2009) Habitantes del agua. Macrófitos. Agencia Andaluza del Agua, Consejería de Medio Ambiente, Junta de Andalucía, Sevilla [ Links ]
16. Gasparri NI, Grau HR y Gutierrez Angonese J (2013) Linkages between soybean and neotropical deforestation: Coupling and transient decoupling dynamics in a multi-decadal analysis. Global Environmental Change 23:1605-1614 [ Links ]
17. Jaksic FM (1981) Abuse and misuse of the term “guild” in ecological studies. Oikos 37:397-400
18. López de Casenave J y Filipello AM (1995) Las aves acuáticas de la Reserva Costanera Sur: cambios estacionales en la composición específica y en la abundancia de poblaciones y gremios. Hornero 14:9-14 [ Links ]
19. López-Lanús B (2017) Guía Audiornis de las aves de Argentina, fotos y sonidos: identificación por características contrapuestas y marcas sobre imágenes. Segunda edición. Audiornis Producciones, Buenos Aires [ Links ]
20. López-Lanús B y Blanco DE (2005) El Censo Neotropical de Aves Acuáticas 2004. Wetlands International, Buenos Aires [ Links ]
21. Menghi M (2000) Reserva Natural de Fauna Laguna La Felipa (Ucacha, Córdoba). Un encuentro con el paisaje autóctono, sus ecosistemas y comunidades vegetales. Universidad Nacional de Río Cuarto, Río Cuarto [ Links ]
22. Moschione F (2005) Bañado de Añatuya. Pp. 447-448 en: Di Giacomo AS, De Francesco MV y Coconier E (eds) Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad. Aves Argentinas/Asociación Ornitológica del Plata, Buenos Aires [ Links ]
23. Narosky T e Yzurieta D (2010) Guía para la identificación de las aves de Argentina y Uruguay. 16ª edición. Vázquez Mazzini Editores, Asociación Ornitológica del Plata, BirdLife International, Buenos Aires [ Links ]
24. Nores M e Yzurieta D (1981) Nuevas localidades para aves argentinas. Historia Natural 2:33-42 [ Links ]
25. Nores M, Yzurieta D y Salvador S (1991) Lista y distribución de las aves de Santiago del Estero, Argentina. Boletín Academia Nacional de Ciencias Córdoba 59:157-196 [ Links ]
26. Olrog CC (1979) Nueva lista de la avifauna Argentina. Opera Lilloana 27:1-324 [ Links ]
27. Remsen JV Jr, Areta JI, Cadena CD, Claramunt S, Jaramillo A, Pacheco JF, Robbins MB, Stiles FG, Stotz DF y Zimmer KJ (2019) A classification of the bird species of South America. American Ornithologists’ Union (URL: http://www.museum.lsu.edu/~Remsen/SACCBaseline.html)
28. Ronchi-Virgolini AL, Lorenzón RE, Blake JG y Beltzer AH (2013) Temporal variation of bird assemblages in a wetland: influence of spatial heterogeneity. Avian Biology Research 6:198-206 [ Links ]
29. Salvador SA y Salvador LA (1990) Nuevos hallazgos en Argentina de Anas discors, Lophornis chalybea y Tyrannus tyrannus. Hornero 13:178-179 [ Links ]
30. Sarrías AM, Blanco D y Lopez de Casenave J (1996) Estructura en gremios de un ensamble de aves acuáticas durante la estación reproductiva. Ecología Austral 6:106-114 [ Links ]














