El conocimiento de la biología reproductiva de las aves es relevante para entender aspectos de sus historias de vida (Martin 2004) e interpretar cómo responden a los crecientes cambios que enfrentan a nivel global, como el cambio climático, la intensificación de la variabilidad ambiental y el desarrollo de actividades humanas (Both et al. 2004, Frederiksen et al. 2004, Sydeman et al. 2015). Las especies de gaviota del género Larus, en particular, muestran generalmente una amplia distribución geográfica y han incrementado en las últimas décadas su interacción con diferentes actividades humanas, aprovechando subsidios de alimento de origen antrópico tales como residuos urbanos, alimento derivado de la agricultura y descartes pesqueros (Belant 1997, Calvino-Cancela 2011, Oro et al. 2013). En este contexto, la información sobre su biología reproductiva es valiosa para comprender su plasticidad ecológica y cómo diferentes poblaciones se adaptan a nidificar en ambientes cambiantes.
La Gaviota Cocinera (Larus dominicanus) es la especie de gaviota más abundante y ampliamente distribuida del hemisferio sur, anidando en Sudamérica, sur de África, Nueva Zelanda, Australia, islas sub-Antárticas y Península Antártica (Burger y Gochfeld 1996). En la Argentina se reproduce tanto en ambientes marinos como de aguas continentales, y su población reproductiva en ambientes marinos de la Patagonia se estimó en más de 100 000 parejas distribuidas en 140 colonias (Yorio et al. 2016). La Gaviota Cocinera es una especie generalista y oportunista que utiliza durante la temporada reproductiva una amplia diversidad de presas, incluido alimento derivado de actividades humanas en proporciones variables dependiendo de la localidad (Bertellotti y Yorio 1999; Petracci et al. 2004, Yorio et al. 2013, González-Zevallos et al. 2017, Marinao et al. 2018, Kasinsky et al. 2021). El monitoreo a largo plazo de más de 60 colonias del norte de la Patagonia permitió determinar que algunas de sus poblaciones se han incrementado en las últimas décadas, presentando un comportamiento demográfico diferencial dependiendo del sector costero donde se reproducen (Lisnizer et al. 2011, 2015).
A pesar de la amplia distribución y abundancia de esta especie de gaviota y de los numerosos proyectos realizados sobre su ecología trófica en la Patagonia Argentina, los estudios sobre su biología reproductiva son escasos y limitados a solo tres de sus localidades de cría (Malacalza 1987, Yorio et al. 1995, Yorio y García Borboroglu 2002, Lisnizer et al. 2014, Svagelj et al. 2015). Estos trabajos muestran que algunos aspectos de la biología reproductiva pueden variar entre colonias del litoral, como el patrón temporal de reproducción (Yorio et al. 2005, Lisnizer et al. 2014), la variación en el tamaño de los huevos dentro de la nidada (Yorio y García Borboroglu 2002, Svagelj et al. 2015) y el éxito reproductivo (Yorio et al. 1995, Lisnizer et al. 2014). Por lo tanto, el conocimiento sobre la biología reproductiva de la Gaviota Cocinera en diferentes sitios de cría es fundamental para comprender diferentes aspectos de su historia de vida y mejorar el desarrollo de modelos demográficos de sus poblaciones en la región. Por otro lado, la información sobre la biología reproductiva es de gran valor como línea de base para interpretar cambios en respuesta a modificaciones antrópicas en ambientes costeros, diseñar programas de monitoreo, y planificar actividades basadas en la costa como el turismo o la recreación. El objetivo de este trabajo fue evaluar la biología reproductiva de la Gaviota Cocinera en el Área Natural Protegida Punta Tombo, Chubut, sitio de una de las mayores colonias de la Patagonia Argentina (Yorio et al. 2016) para la cual se carecía de información detallada sobre su biología reproductiva.
Métodos
Área de estudio
La colonia de Gaviota Cocinera en la que se trabajó se encuentra ubicada en la zona costera central de la Provincia del Chubut, dentro del Área Natural Protegida Punta Tombo (44°02’25’’S, 65°11’45”O) (Fig. 1). El número de nidos fue estimado en 6457 parejas, siendo una de las cuatro colonias más grandes de la Patagonia (Lisnizer et al. 2011). La colonia se ubica hacia el final de una península rocosa de 500 m de ancho en promedio, que se extiende hacia el mar aproximadamente unos 4 km en dirección noreste.
Biología reproductiva
Durante las temporadas reproductivas de 2016 y 2017, se llevó a cabo el monitoreo de una muestra de nidos (n = 160; n = 161) de Gaviota Cocinera en un sector representativo de toda la colonia considerando la variabilidad en cuanto a características de hábitat. Los nidos se distribuyen en el extremo de la punta rocosa en áreas carentes de vegetación. En ambas temporadas se realizaron visitas cada dos o tres días, desde fines de octubre cuando las gaviotas estaban en etapa de construcción de nidos hasta principios de febrero cuando la mayoría de los pichones ya se habían independizado. Para realizar su seguimiento, los nidos fueron identificados con estacas con etiquetas plásticas numeradas. Para minimizar la dispersión de los pichones de sus nidos durante las visitas una vez que hubieran nacido y el posible efecto sobre su supervivencia, el sector fue delimitado parcialmente con una malla plástica de 0.6 m de altura sostenida por parantes de hierro. En cada visita se registró información sobre parámetros reproductivos (Yorio y García Borboroglu 2002) que fue utilizada para calcular el patrón temporal de puesta reproductiva, el tamaño de nidada, el crecimiento de los pichones, el peso a la independencia, y los éxitos de eclosión, de volantoneo y reproductivo (ver abajo para detalles metodológicos). Para controlar los posibles efectos del disturbio de investigación sobre el tamaño de nidada y el éxito reproductivo, se seleccionó en las dos temporadas un área control con nidos en sitios con similares características de hábitat al sector monitoreado regularmente (n2016 = 90; n2017 = 93). Los nidos del área control fueron visitados únicamente en dos ocasiones para determinar productividad a partir del tamaño de nidada y el éxito reproductivo (ver abajo para detalles metodológicos), y los individuos reproduciendo en dicho sector no fueron manipulados.
En cada nido del sector de monitoreo regular los huevos fueron marcados con el número de nido y una letra que indicaba el orden de puesta usando un marcador indeleble. Al nacer, los pichones fueron identificados con una cinta indicando el número de nido y orden de nacimiento. Se tomaron medidas de huevos (largo y ancho) y pichones (largo de cabeza, largo de pico y tarso) utilizando un calibre digital con una precisión de 0.1 mm, y los pichones fueron pesados con balanzas Pesola de 100, 500, 1000 o 1500 gramos dependiendo del tamaño de los mismos. Se calculó el peso (P) de los huevos a partir del ancho y largo de los mismos utilizando la fórmula propuesta por Hoyt 1979: M = Kp * Largo * Ancho2, donde Kp es un coeficiente de peso específico para la Gaviota Cocinera (Kp = 5.34 x 10-4 g.mm-3, Svagelj et al. 2015). El peso calculado es un estimador confiable del tamaño del huevo en la Gaviota Cocinera (Svagelj. et al. 2015). Para evaluar los efectos del orden de puesta, la fecha de puesta y el año (variables explicativas fijas) sobre el peso de los huevos, se utilizaron modelos lineales mixtos (Pinheiro y Bates 2000). Se realizaron modelos para las nidadas de uno, dos y tres huevos por separado, seleccionando los modelos con mejor ajuste a partir del criterio de información de Akaike para muestras pequeñas (AlCc; Akaike 1973, Hurvich y Tsai 1989), utilizando la biblioteca nlme (Pinheiro et al. 2019). El orden de puesta de huevos se incluyó como un factor de tres niveles: huevos de primer, segundo y tercer orden de puesta, codificados como a, b y c, respectivamente. Siguiendo a Svagelj et al. (2015), se estandarizó la fecha de puesta previamente, ingresando la misma como una desviación de la fecha de puesta mediana del respectivo año, y dividiendo el resultado por la desviación estándar de ese año. Asimismo, se incluyó el año como factor fijo de dos niveles: 2016 y 2017. Por otra parte, se incluyó la variable “nido” anidada en el año (código único para cada nido) como factor aleatorio para evitar la pseu-doréplica. Todas las pruebas fueron de dos colas y las diferencias se consideraron significativas en P < 0.05.
Desde el nacimiento de los pichones y cada siete días hasta que su movilidad dificultó la captura con mínimo disturbio (aproximadamente 28 días, Yorio y García Borboroglu 2002; datos inéditos) se registraron medidas morfométricas incluyendo el largo de tarso, largo de cabeza, alto de pico a la altura de las narinas y peso. Se calcularon las medias y desvíos de las medidas mencionadas anteriormente al momento de la independencia. Para evaluar los patrones de crecimiento de los pichones se utilizaron modelos no lineales de efectos mixtos apropiados para conjuntos de datos de medidas repetidas (Pinheiro y Bates 2019). Las curvas de crecimiento de los pichones fueron ajustadas a los modelos de Gompertz, Logístico y de Von Bertalanffy y se seleccionaron los modelos con mejor ajuste utilizando el criterio de información de Akaike para muestras pequeñas (AlCc; Akaike 1973, Hurvich y Tsai 1989). Los análisis fueron realizados utilizando la biblioteca nlme (Pinheiro et al. 2019). Para comparar las medidas morfométricas de los pichones entre los años de estudio se realizaron pruebas de ANOVA de una vía. Para esta prueba se utilizaron únicamente las medidas de los primeros pichones de cada nido.
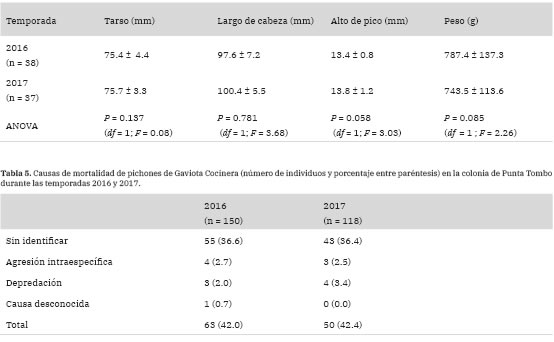
La pérdida de huevos y pichones fue registrada, identificando la causa en los casos en que fue posible. La pérdida de huevos se clasificó en tres categorías: a) sin identificar, cuando los huevos desaparecieron entre las visitas efectuadas y no se pudo identificar la causa; b) depredación, registrada a partir de huevos rotos fuera y cerca del nido con indicios de depredación (picoteados o rotos con el contenido derramado); y c) rotura, cuando se observaron huevos rotos dentro del nido, ya sea colapsados o trizados. La mortalidad de los pichones fue clasificada como a) sin identificar, cuando los pichones desaparecieron entre visitas y no se pudo identificar la causa; b) agresión intraespe-cífica, registrada a partir de pichones muertos cerca de sus nidos con indicios de agresión (ej. con picotazos en la cabeza, falta de plumas, otras heridas); c) depredación, registrada en base a pichones marcados muertos dentro o fuera de la colonia con indicios de depredación; d) causa desconocida, cuando los pichones se encontraron muertos y no se pudo identificar la causa. Debe tenerse en cuenta que para las categorías (a) de pérdidas de huevos y pichones, una posible causa haya sido la depredación pero no hayan quedado rastros. En ambas temporadas se determinó el porcentaje de huevos y pichones perdidos para cada una de las categorías mencionadas.
El tamaño de puesta se determinó como el número de huevos puestos por nido. El éxito de eclosión se definió como el número de pichones nacidos por nido donde se inició la puesta, el éxito de volantoneo como el número de pichones que sobrevivieron a los 28 días de edad por nido en relación al número de pichones nacidos, y el éxito reproductivo como el número de pichones sobrevivientes a los 28 días de edad por nido donde se inició la puesta. Para los análisis realizados no se incluyeron los nidos donde hubo reposición de huevos (n =11; n =17). Se calcularon las medias y desvíos correspondientes para cada año, y se realizaron pruebas no paramétricas (Kolmogo-rov-Smirnov o Mann-Whitney) para contrastar entre ambas temporadas de estudio la duración del período de puesta, el tamaño de nidada y el éxito de volanto-neo. Se utilizaron regresiones logísticas ordenadas (OLR) (Agresti 2002) para evaluar los efectos del año, la fecha de puesta y el tamaño de nidada sobre el éxito de eclosión. Por otro lado, también se utilizaron OLR para evaluar el efecto del año, la fecha de puesta y el éxito de eclosión sobre el éxito reproductivo. En ambos análisis, se seleccionaron los modelos con mejor ajuste utilizando el criterio de información de Akaike para muestras pequeñas (AICc; Akaike 1973, Hurvich y Tsai 1989). Todas las pruebas estadísticas realizadas en este trabajo se llevaron a cabo utilizando la versión 3.5.1 del programa R (R Development Core Team 2018).
Depredadores de huevos y pichones
Durante el año 2016 y 2017 se registró el número de nidos activos de Escúa Parda (Catharacta antarcti-ca), especie potencialmente depredadora de huevos y pichones de la Gaviota Cocinera. Además, en el pico de la puesta y finalización de incubación/inicio de cría de pichones del año 2016 se realizaron conteos de individuos de Escúa Parda que se encontraban en grupos en las playas adyacentes y cercanas a la colonia. Este conteo se replicó en el año 2017, sumando un conteo al inicio de la etapa de puesta. Para realizar esto, se relevó el extremo de la península (últimos 2 km), incluyendo toda el área que ocupó la colonia de Gaviota Cocinera y sus playas. Durante la aproximación al área de estudio en algunas de las visitas en 2016, se observaron eventos de depredación por parte de Escúas Pardas y presencia de Gaviotas Australes (Larus scoresbii) entre los nidos de Gaviota Cocinera, pero no se cuantificaron dichos eventos ni el número de potenciales depredadores presentes. En base a esta información, previo al ingreso a la colonia en cada visita realizada en el 2017, se registró la presencia de individuos de Escúas Pardas y/o Gaviotas Australes depredando sobre huevos o pichones de Gaviota Cocinera en el sector del monitoreo regular utilizando binoculares (8x40) desde una distancia de más de 40 m.
RESULTADOS
Puesta e incubación
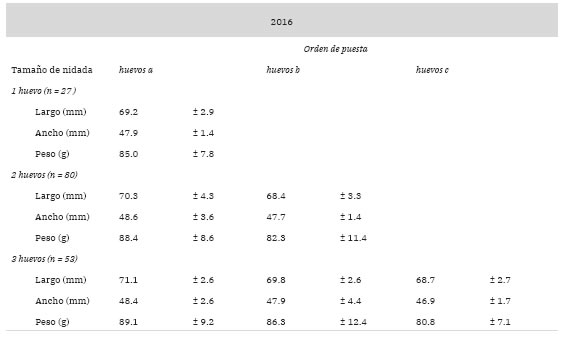
El período de puesta en ambas temporadas comenzó a principios de noviembre, registrándose el primer huevo el 8 de noviembre en el 2016, y el 1 de noviembre en el 2017. La mediana de la fecha de puesta del primer huevo fue similar en las dos temporadas, siendo el 19 de noviembre para el año 2016 y el 21 del mismo mes para 2017 (Fig. 2). La puesta se extendió durante unas cinco semanas en el año 2016 y siete semanas en el año 2017, siendo similar el patrón de puesta del primer huevo entre temporadas (Prueba de Kolmogorov-Smirnov, P = 0.493). El tamaño medio de nidada también fue similar entre temporadas, siendo de 2.09 ± 0.67 para el 2016 y 1.99 ± 0.67 para el 2017 (Mann-Whitney, U = 11588, P = 0.149). El tamaño de los huevos varió según el orden de puesta (Tabla 1). En el caso de los nidos que tuvieron un único huevo, el modelo que mejor se ajustó a los datos demostró que no existe efecto del año ni de la fecha de puesta sobre el tamaño de los mismos (Año: p = -0.4251, P = 0.973; Fecha: p = 1.6460, P = 0.746). A partir del modelo para las nidadas de dos huevos, se demostró que el tamaño de los huevos b fue menor que el de los huevo a (p = -4.1802, P < 0.001), pero no se registró efecto del año ni de la fecha de puesta (Año: p = -0.6821, P = 0.475; Fecha: p = 0.1599, P = 0.757). Finalmente, el modelo realizado para las nidadas de tres huevos mostró que el tamaño no difirió entre los huevos a y b (a - b: p = 2.5059, P = 0.0742), mientras que ambos tuvieron un tamaño mayor que los huevos c (a - c: p = -9.2660, P < 0.001; b - c: p = -6.7591, P < 0.001).
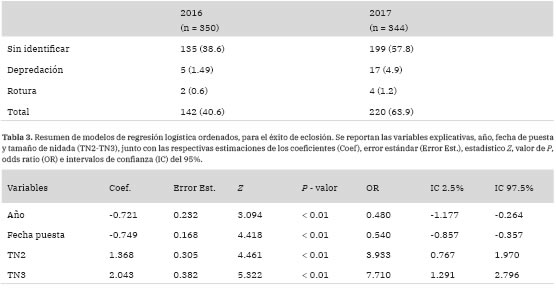
En las dos temporadas, la principal causa de pérdida de nidadas durante la incubación fue la desaparición de huevos ("sin identificar”, Tabla 2). De estas pérdidas, el 25.7% en 2016 y 44.5% en 2017, ocurrieron antes de haber transcurrido la duración media del período de incubación más un desvío estándar. La pérdida de huevos se incrementó aproximadamente un 20% del año 2016 al 2017, encontrándose también patrones diferentes en las fechas de pérdidas entre los dos años (Fig. 3). Las pérdidas por depredación y roturas fueron poco frecuentes en ambos años, con valores por debajo del 5%. Sin embargo, no se descarta que en la categoría "sin identificar” queden enmascarados eventos de depredación en los cuales los huevos pudieron haber sido depredados enteros o trasladados a otro sitio por los depredadores para su consumo.
El tiempo promedio de incubación fue de 26.47 ± 3.43 días para el año 2016 y de 27.76 ± 2.06 días para 2017. El éxito de eclosión fue menor para el año 2017 (2016: 1.23 ± 0.89; 2017: 0.81 ± 0.99), y en concordancia con esto, el modelo que mejor se ajustó a los datos mostró que el efecto del año fue significativo (AICNulo = 732.94; AICA»o+Fecha+TN = 658.66) (Tabla 3). De igual manera, los efectos del tamaño de nidada y la fecha de puesta también fueron significativos (Tabla 3), demostrando en el último caso que aquellos que pusieron más temprano en la temporada tuvieron mayor éxito de eclosión.
Etapa de pichones
Las primeras eclosiones fueron registradas el 5 de diciembre y el 24 de noviembre en las temporadas de 2016 y 2017, respectivamente. A pesar de que se observaron diferencias en el inicio de las eclosiones entre ambas temporadas, cabe señalar que en el año 2017 pasaron 15 días entre las eclosiones del primer y segundo nido, fecha a partir de la cual se comenzaron a registrar nacimientos en cada visita al área de estudio. La mediana de la fecha de eclosión del primer huevo de la nidada fue el 22 y 17 de diciembre de 2016 y 2017, respectivamente. La duración de la etapa de cría de pichones se extendió 9 semanas en el año 2016 y 10 semanas en el 2017, con las últimas eclosiones el 5 y 10 de enero, respectivamente.
Tabla 1: Largo (mm), ancho (mm) y peso (g) (media ± DE) de huevos de Gaviota Cocinera en la colonia de Punta Tombo en relación con la secuencia de puesta y el tamaño de la nidada para los años 2016 y 2017. Los huevos fueron codificados según el orden de puesta desde el primero al cuarto como a, b, c y d, respectivamente.
Los tres modelos de crecimiento individual evaluados para el año 2016 (Gompertz, Logístico y Von Bertalanffy) presentaron buen ajuste para las tres medidas morfométricas (largo del tarso, largo de cabeza y alto del pico). El Criterio de Información de Akaike (AIC) fue menor para el modelo Logístico para las medidas de largo del tarso (AIC, ,.. = 1720.9; AICco continuaron incrementándose. Para el año 2017, los tres modelos de crecimiento individual evaluados también presentaron buen ajuste para las tres medidas morfométricas consideradas. Al igual que en el año anterior, el AIC fue menor para el modelo Logístico en el caso del tarso (AIC Logístico = 1069.1; AICGompertz = 1082.8; AICBertalanffy = 1106.7) y anterior, el crecimiento del tarso en el 2017 alcanzó la asíntota aproximadamente hacia el día 32, mientras el largo de la cabeza y el alto del pico continuaron creciendo después de esa edad. Las tres medidas morfométricas tomadas a los 30 ± 2 días de edad de los pichones (largo del tarso, largo de cabeza y alto del pico) fueron similares entre las temporadas de 2016 y 2017 (Tabla 4). Asimismo, el peso de los pichones a la independencia no fue significativamente diferente entre los dos años de estudio (Tabla 4)
Tabla 2: Causas de pérdida de huevos de Gaviota Cocinera (número de huevos y porcentaje entre paréntesis) en la colonia de Punta Tombo durante las temporadas 2016 y 2017.
El éxito reproductivo fue considerablemente menor para el año 2017 (2016: 0.53 ± 0.73; 2017: 0.34 ± 0.66), y en concordancia con esto, el modelo realizado que presentó un mayor ajuste (AICNulo = 533.38; AICAño+-Fecha+EE = 412.25) mostró que el efecto del año fue significativo (Tabla 6). También indicó que el efecto del éxito de eclosión sobre el éxito reproductivo fue significativo (Tabla 6). Asimismo, la fecha de puesta también tuvo un efecto sobre el éxito reproductivo (Tabla 6), donde los individuos que iniciaron la reproducción más temprano presentaron un mayor éxito reproductivo. El éxito de volantoneo fue de 0.36 ± 0.44 para el año 2016 y 0.40 ± 0.43 para el año 2017, siendo similar entre las dos temporadas (Mann-Whitney, U = 4863, P = 0.4857). En ambas temporadas no se detectaron diferencias significativas entre el sector de monitoreo y área control para las variables tamaño de nidada (TN) y éxito reproductivo (ER) (Pruebas de Mann-Whitney: TN2016: U =
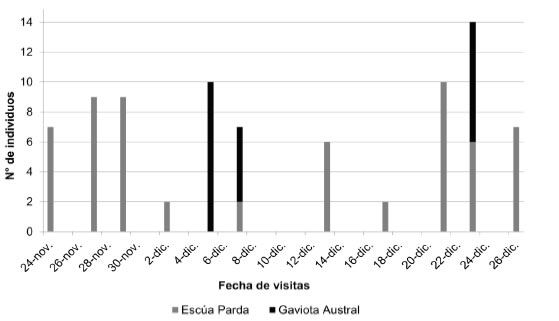
Figura 4: Número de individuos de Escúa Parda y Gaviota Austral observados depredando en la colonia de Gaviota Cocinera de Punta Tombo durante la temporada reproductiva del 2017.
Tabla 4: Medidas morfométricas (largo de tarso, largo de cabeza y alto de pico) y peso de pichones de Gaviota Cocinera a los 30 ± 2 días de vida (media ± DE) durante las temporadas de 2016 y 2017 en la colonia de Punta Tombo.
Depredadores de huevos y pichones
En ambos años, los nidos de Escúas Pardas se situaron a lo largo de la costa norte de la punta y en las adyacencias de la colonia de Gaviota Cocinera, ubicándose entre 80 y 500 m de distancia del sector de monitoreo regular. Asimismo, los individuos que se registraron generalmente en grupos sobre la playa se encontraron en la costa norte de la punta, a unos 100 m de la colonia. Durante el año 2016 se contabilizaron 13 nidos de Escúa Parda en el área de la punta y en numerosas ocasiones se observaron grupos de individuos en la periferia de la colonia de Gaviota Cocinera y en las playas adyacentes, registrándose en las fechas del pico de puesta y hacia el final de la misma 45 y 56 individuos, respectivamente. Durante el año 2017, se registraron 10 parejas de Escúa Parda con nidos activos, y se observó a lo largo del período de puesta, incubación y etapa de pichones un número variable de individuos en las playas cercanas a la colonia. Los conteos efectuados durante el inicio y pico de la puesta de huevos y durante la incubación tardía/etapa de pichones mostraron un total de 102, 130 y 95 individuos, respectivamente. Durante el año 2017, se registraron Escúas Pardas depredando en el 37.9% de las visitas realizadas al sector de monitoreo (n = 29), en números que variaron entre 2 y 10 individuos (Fig. 4). También se observaron individuos de Gaviota Austral depredando junto con las Escúas Pardas en tres ocasiones (10.3%; n = 29) (Fig. 4). En estos casos, se observó a una o más aves depredadoras sobre el nido y a las Gaviotas Cocineras desplegando comportamientos agonísticos hacia ellas.
Discusión
En este trabajo se presenta la primera descripción detallada de la biología reproductiva de la Gaviota Cocinera en el Área Natural Protegida de Punta Tombo, una de las localidades de cría más importantes en términos de tamaño poblacional de las costas de la Patagonia Argentina (Yorio et al. 2016). La información obtenida no solo contribuye al conocimiento de su historia de vida y a caracterizar aspectos de su reproducción que podrían tener valor aplicado, sino también a avanzar en la comprensión de la variabilidad regional en sus parámetros reproductivos. En ambas temporadas, el patrón temporal de reproducción fue coincidente con las estimaciones realizadas para la misma colonia en la década de 1990 (Bertello-tti y Yorio 1999) y similar al reportado en Isla Vernaci Sudoeste (45°11’S; Yorio y García Borboroglu 2002), pero más tardío que el reportado para las colonias de Punta Loma (42°35’S; Lisnizer et al. 2014) y Punta León (43°04’S; Malacalza 1987, Yorio et al. 1995). Cabe señalar que la puesta en Punta Tombo fue relativamente asincrónica, abarcando varias semanas, al igual que lo registrado en las otras colonias (Malacal-za 1987, Yorio et al. 1994, Lisnizer et al. 2014, Yorio y García Borboroglu 2002). Entre otras adaptaciones para incrementar la supervivencia y fecundidad, las aves acoplan el patrón temporal de cría con la mayor oferta de alimento en las cercanías de su sitio de ni-dificación, y en ambientes estacionales templados y fríos este contexto favorable suele ser más tardío a mayores latitudes (Lack 1950, Burr et al. 2016). El nacimiento más tardío de los pichones en función del incremento en la latitud fue reportado en distintas especies de aves, incluidas varias aves marinas (e.g. Wanless et al. 2008, Burr et al. 2016). Las diferencias entre localidades en el inicio de la puesta de las Gaviotas Cocineras pueden estar reflejando un gradiente latitudinal combinado con diferencias entre los sitios de cría en relación a la oferta local de alimento.
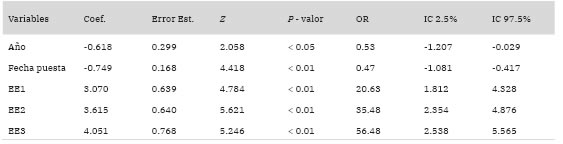 Tabla 6: Resumen de modelos de regresión logística ordenados, para el éxito reproductivo. Se reportan las variables explicativas, año, fecha de puesta y éxito de eclosión (EE1-EE2-EE3), junto con las respectivas estimaciones de los coeficientes (Coef), error estándar (Error Est.), estadístico Z, valor de P, odds ratio (OR) e intervalos de confianza (IC) del 95%.
Tabla 6: Resumen de modelos de regresión logística ordenados, para el éxito reproductivo. Se reportan las variables explicativas, año, fecha de puesta y éxito de eclosión (EE1-EE2-EE3), junto con las respectivas estimaciones de los coeficientes (Coef), error estándar (Error Est.), estadístico Z, valor de P, odds ratio (OR) e intervalos de confianza (IC) del 95%.
El tamaño medio de nidada registrado en Punta Tombo, de 2.09 y 1.99 huevos por nido en 2016 y 2017, respectivamente, fue menor al registrado en otras colonias de Chubut utilizando un diseño de muestreo similar (2.32 - 2.62 huevos por nido, dependiendo de la colonia y año; Yorio et al. 1995, Yorio y García Borbo-roglu 2002, Lisnizer et al. 2014). Esto podría deberse a diferencias en la disponibilidad/calidad de alimento durante la etapa de formación de huevos y/o en la estructura de edades de la población en las distintas localidades de cría, pero lamentablemente se carece de información adecuada para evaluar el papel relativo de estos factores en las diferencias observadas. Por otro lado, no puede descartarse la pérdida de huevos por depredación durante los días de puesta, ya que la actividad de depredadores fue registrada en numerosas ocasiones durante el monitoreo de los nidos (ver abajo), y por lo tanto que este factor de mortalidad haya impedido determinar correctamente el tamaño de nidada. Cabe señalar que Reid (1987) reporta para Punta Tombo un tamaño de nidada de 2.42 huevos por nido para el año 1983, por lo que futuros estudios deberían considerar los posibles cambios interanuales en la presión de depredación y disponibilidad de alimento y su influencia en la determinación del tamaño de nidada en el área de estudio.
Los resultados en la colonia de Punta Tombo mostraron que en general no se observaron diferencias en las variables reproductivas evaluadas entre ambos años de estudio. Sin embargo, el éxito reproductivo fue significativamente menor en el año 2017, debido principalmente a la disminución en el éxito de eclosión durante ese año. En el 2017 se registró un mayor número de huevos que desaparecieron de los nidos sin poder determinar la causa. Varios de los depredadores potenciales de huevos de Gaviota Cocinera en el área de estudio, como las Escúas Pardas, Gaviotas Australes, Zorro Gris (Lycalopex griseus) y Hurón Menor (Galictis cuja) suelen extraer el huevo de los nidos de las aves y a menudo alejarse antes de consumirlo (obs. pers.). Por lo tanto, es probable que la depredación haya sido el factor responsable de esas pérdidas. Es más, la depredación de huevos de Gaviota Cocinera por parte de Escúas Pardas fue observada en numerosas ocasiones en el área de estudio. Los resultados también mostraron que el número de parejas de Escúas Pardas anidando en cercanías de la colonia de Gaviota Cocinera fue similar entre años, pero el número de individuos no reproductores contabilizados en las playas cercanas y áreas adyacentes a la colonia fue claramente mayor en el año 2017, coincidente con una mayor desaparición de huevos en ese año. Aunque en menor medida, los huevos de Gaviota Cocinera fueron también depredados por Gaviotas Australes, como fuera observado en Punta Tombo en estudios previos (Yorio et al. 1996). El canibalismo es otro comportamiento de alimentación reportado en varias especies de gaviota, incluida la Gaviota Cocinera, que podría haber afectado el éxito de eclosión (Fordham 1964, Burger y Gochfeld 1981, Stanback y Koenig 1992, Yorio y Quintana 1996), pero no fue observado durante las frecuentes visitas a la colonia durante este estudio.
Los porcentajes de pérdida de pichones, fueron similares para las dos temporadas de estudio y ocurrieron generalmente en las dos primeras semanas de vida de los mismos. En forma similar a la etapa de incubación, en la mayoría de los casos no fue posible identificar la causa de pérdida de pichones porque desaparecieron sin dejar evidencias. El bajo porcentaje de casos en los que la pérdida pudo ser adjudicada a la depredación, los pichones estaban en una etapa avanzada de crecimiento y fueron encontrados parcialmente consumidos, mientras que los pichones de gaviota de pequeño tamaño pudieron haber sido consumidos enteros. A pesar de que en ningún caso se observó un evento de depredación de pichones por parte de las Escúas Pardas durante este estudio, estos depredadores fueron observados dentro del área de estudio también durante gran parte de la etapa de cría de pichones de la Gaviota Cocinera y por lo tanto es probable que hayan sido en parte responsables de la pérdida de las nidadas. En estudios previos tanto en Punta Tombo (P. Yorio, datos inéditos) como en Isla Vernaci Sudoeste (Yorio y García Borboroglu 2002) se observaron regularmente restos de pichones de Gaviota Cocinera en los territorios de Escúas Pardas, indicando que son consumidos por esta especie. Por otro lado, no puede descartarse que parte de las pérdidas de pichones en sus primeras dos semanas de vida hayan sido resultado de la provisión insuficiente de alimento por parte de sus padres. Estudios en otras especies de gaviota muestran que los pichones mal alimentados suelen alejarse más de los nidos, resultando en un incremento en el riesgo de sufrir mortalidad principalmente por agresión intraespecífica (Hunt y McLoon 1975, Pierotti y Murphy 1987). Para el caso de la Gaviota Cocinera, en particular, Ford-ham (1970) reportó que la mortalidad derivada de la agresión intraespecífica en la Gaviota Cocinera reproduciendo en Nueva Zelanda fue mayor cuando la disponibilidad de alimento fue menor. En ambos años de estudio en Punta Tombo se registró agresión intraespecífica y, en algunos casos, la mortalidad subsiguiente de los pichones agredidos.
Los resultados también mostraron que los individuos que iniciaron la reproducción más temprano presentaron un mayor éxito de eclosión y reproductivo, como fuera ya observado para la Gaviota Cocinera en un estudio previo en la colonia de Isla Vernaci Sudoeste (García Borboroglu et al. 2008). La disminución en el éxito reproductivo al avanzar la temporada de cría fue demostrada en estudios de varias especies de aves marinas (Moreno 1998, Svagelj y Quintana 2011), incluidas varias especies de gaviotas (Brown 1967, Parsons 1975, Sydeman et al. 1994). Se han propuesto varias hipótesis no mutuamente excluyentes para explicar este fenómeno, incluidos cambios en la disponibilidad de alimento o en el riesgo de depredación, la reproducción más tardía de individuos jóvenes o inexpertos y /o la disminución en la inversión de los individuos que se reproducen tardíamente (Moreno 1998), pero lamentablemente se carece de información para evaluar cada una de ellas. Por otro lado, y en forma similar a lo registrado para la colonia de Isla Vernaci Sudoeste (García Borboroglu et al. 2008), no se detectó un efecto de la fecha de puesta sobre el tamaño de los huevos, a diferencia de lo reportado para otras especies de aves marinas incluidas gaviotas (Moreno 1998).
Como resultado del impacto de la depredación, principalmente de huevos, el rendimiento reproductivo de la Gaviota Cocinera en Punta Tombo fue relativamente bajo en comparación con las colonias de Punta León (1.05 - 1.21 pichones por nido; Yorio et al. 1995) e Isla Vernaci Sudoeste (0.84 - 0.86 pichones por nido; Yorio y García-Borboroglu 2002), pero similar al de la colonia de Punta Loma (0.30 -0.65 pichones por nido; Lisnizer et al. 2014). El factor de mortalidad responsable del bajo rendimiento reproductivo de Punta Loma fue también la depredación, pero principalmente en la etapa de pichones, aunque se argumentó que también pudo deberse a que la colonia estaba conformada por una mayor proporción de individuos jóvenes y primeros reproductores (Lisnizer et al. 2014). Esto muestra la variabilidad regional en la productividad de las colonias como resultado del efecto diferencial de distintos factores ecológicos.
Varios trabajos han mostrado que las pérdidas de nidada en especies que nidifican en la superficie y tienen crías semi-precociales, como las gaviotas, pueden estar en parte asociadas al disturbio de investigación generado por la visita a la colonia y la consiguiente depredación y/o agresión intraespecífica inducida (Yorio y Quintana 1996, Carney y Sydeman 1999). Sin embargo, tanto el tamaño de nidada como el éxito reproductivo en el área de estudio fueron similares a los obtenidos en el área control, sugiriendo que el disturbio generado por la investigación no fue significativo y que las pérdidas de nidada fueron ocasionadas por causas naturales. Resultados similares fueron obtenidos en Isla Vernaci Sudoeste (Yorio y García Borboroglu 2002). Aunque no fue cuantifica-da, la respuesta comportamental de las Gaviotas Cocineras al trabajo de investigación en Punta Tombo estuvo restringida a un área de pocos metros alrededor del foco de disturbio, al igual que lo observado en estudios previos (Yorio y Quintana 1996). Esto, sumado a que los individuos que abandonaron los nidos en respuesta al disturbio se asentaron en sus territorios después de sólo unos pocos minutos sugiere que las gaviotas en el área de estudio pueden haberse habituado a las visitas, como ha sido observado en otras especies de aves marinas (Nisbet 2000, Price 2008). La información obtenida indica que la evaluación de diferentes aspectos de la biología reproductiva de esta especie puede en general desarrollarse con un mínimo efecto sobre las aves si los trabajos en la colonia se implementan adecuadamente.
La información sobre la biología reproductiva obtenida en la colonia de Punta Tombo constituye una línea de base para un futuro monitoreo de la reproducción de la Gaviota Cocinera en esta área protegida y para identificar posibles cambios en las variables medidas en respuesta a modificaciones antrópicas en ambientes costeros de Chubut. El monitoreo a largo plazo de más de sesenta colonias del norte de la Pa-tagonia permitió determinar que algunas de las poblaciones de Gaviota Cocinera se han incrementado en las últimas décadas, presentando un comportamiento demográfico diferencial dependiendo del sector costero donde se reproducen (Lisnizer et al. 2011, 2015). El incremento de sus poblaciones sumado a los potenciales efectos negativos de la Gaviota Cocinera sobre otros componentes del ecosistema costero (Yorio et al. 2016) han puesto en valor la necesidad de programas de monitoreo e incluso motivado que se considere la implementación de medidas de control poblacional (Sironi et al. 2009).
Los resultados de este estudio serán de utilidad para fortalecer la evaluación de cambios demográficos en las poblaciones de este sector costero del centro de la Provincia del Chubut. Cabe señalar que en el desarrollo de futuros modelos demográficos se debería considerar la posible variabilidad interanual en el éxito reproductivo, así como la posible subestimación del tamaño de nidada obtenido en este estudio. Por otro lado, las diferencias observadas en varios de los parámetros registrados en Punta Tombo con respecto a otras colonias del litoral Chubutense indican la necesidad de estudios en nuevas colonias a lo largo de su rango de distribución reproductiva en el litoral Patagónico de manera de contar con información para evaluar adecuadamente la dinámica poblacional de esta especie en un contexto metapoblacional.
Agradecimientos
Este estudio fue financiado por Wildlife Conser-vation Society Argentina. Agradecemos a la Subsecretaría de Conservación y Áreas Protegidas y a la Dirección de Fauna y Flora Silvestre de la Provincia de Chubut por los permisos para trabajar en el Área Natural Protegida Punta Tombo, y al Centro Nacional Patagónico (CONICET) por el apoyo institucional. También agradecemos a Tania Klages por su ayuda en la carga de datos, y a Cynthia Ibarra, Miriam Pollicelli, Ximena Navoa, Juan Carileo, Brenda Aguiar y Sara Barón por su asistencia en los trabajos de campo.
Recibido 05 de julio 2021
aceptado 13 de septiembre 2021












 uBio
uBio