Las aves realizan diariamente una amplia variedad de actividades dentro de las cuales la búsqueda de alimento tiene una importancia evidente. La eficiencia de alimentación de un individuo puede estar afectada tanto por factores extrínsecos (e.g., tamaño de grupo, interacciones entre individuos, variables climáticas, entre otros) como intrínsecos (e.g., sexo, edad, experiencia, tipos comportamentales, entre otros) (Berón et al. 2011, Duriez et al. 2012, Toscano et al. 2016, Beauchamp 2019). La formación de grupos a la hora de alimentarse trae beneficios potenciales, principalmente asociados a una disminución del tiempo empleado para vigilar por parte de los individuos (Beauchamp 2017, Beauchamp 2019). Sin embargo, el aumento en el número de individuos que conforman un grupo de alimentación trae ciertas desventajas asociadas, como, por ejemplo, el incremento de las interacciones tróficas intra e interespecíficas (Giraldeau y Caraco 2000, Krause y Ruxton 2002).
Dentro de los diferentes tipos de interacciones tróficas intraespecíficas que influyen sobre la eficiencia de alimentación de los individuos, se destacan los desplazamientos tróficos y el cleptoparasitismo, comportamientos que ocurren cuando el interés de dos o más individuos sobre un área de alimentación o una presa, respectivamente, entra en conflicto. Los desplazamientos tróficos ocurren con el fin de desplazar a un individuo de un área de alimentación. Estás áreas suelen ser sitios con elevada abundancia de presas potenciales, por lo que los desplazamientos tróficos podrían ser considerados como una forma indirecta de parasitismo (Barnard 1984). Este tipo de comportamiento ha sido registrado en numerosas especies de aves (Favero 1996, Annorbah y Holbech 2012, Duriez et al. 2012, Miller et al. 2014, Zumpano et al. 2021) y pueden afectar el comportamiento de alimentación tanto del emisor como del individuo receptor influyendo sobre la tasa de ingesta, el tiempo de alimentación y de vigilancia de los individuos (Amat 1990, Bautista et al. 1998, Duriez et al. 2012). Por otra parte, el cleptoparasitismo, definido por Ro-thschild y Clay (1952) como el robo deliberado por un animal del alimento capturado previamente por algún otro individuo, se halla ampliamente reportado en la literatura para el grupo de las aves (Brockman y Barnard 1979) y en especial para las aves marinas (Furness 1987, García et al. 2010, 2020). Este comportamiento ocurre en forma regular bajo condiciones tales como la presencia de grandes concentraciones de hospedadores potenciales, presas abundantes, visibles para el cleptoparásito (e.g., presas grandes que conllevan altos tiempos de manipuleo) y disponibles en forma predecible. El cleptoparasitismo puede afectar las tasas de ingesta de los hospedadores, tanto de forma directa por la pérdida de la presa, como indirecta induciendo cambios en el comportamiento de búsqueda, manipuleo y vigilancia (Goss-Custard et al. 1999, García et al. 2011, 2012).
Factores como la edad y el sexo de los individuos pueden influir en la dinámica de las interacciones entre conespecíficos al momento de alimentarse de manera agregada (e.g., Shealer et al. 2005, García et al. 2020, Zumpano et al. 2021). Por un lado, individuos más jóvenes pueden ser más propensos a iniciar interacciones debido a la inexperiencia en el reconocimiento, la captura, y manipuleo de las presas (Steele y Hockey 1995, Bertellotti y Yorio 2000, Berón et al. 2011, García et al. 2019a). Por otro lado, los individuos más experimentados (i.e., adultos) pueden tener una mayor eficiencia a la hora de realizar una interacción alimenticia (e.g., Burger y Gochfeld 1979, Gómez-Tejedor y De Lope 1995). En relación al sexo de los individuos, varios estudios han reportado diferencias en la ocurrencia de interacciones intra-específicas, principalmente asociadas a jerarquías, segregación espacial y temporal en la alimentación y diferencias en el requerimiento energético entre sexos (e.g., García et al. 2011, Flower y Gribble 2012). En este sentido, los machos suelen ser quienes utilizan estrategias de alimentación basadas en interacciones tróficas con mayor frecuencia (García et al. 2011, Flower et al. 2013, Zumpano et al. 2021).
Las gaviotas (Fam. Laridae) son aves marinas de hábitos alimentarios principalmente generalistas que pueden explorar diferentes hábitats y utilizar muy variadas tácticas de búsqueda y captura de alimento dependiendo del lugar y tipo de presa (Burger 1988). Dentro de esta familia se encuentra la Gaviota de Olrog, también denominada Gaviota Cangrejera (Larus atlanticus), una especie cuya distribución se restringe a la costa atlántica del sur de Sudamérica (Yorio et al. 2020). La Gaviota de Olrog está listada como "Cercana a la Amenaza” por la Unión Internacional para la Conservación de la Naturaleza (BirdLife International 2021), como "Vulnerable” en Argentina (MAyDS y Aves Argentinas 2017) y "Amenazada” en Uruguay (Azpiroz et al. 2012). En invierno, la especie se desplaza desde la costa patagónica hacia el norte, a lo largo de la costa de la provincia de Buenos Aires en Argentina, pudiendo alcanzar incluso la costa de Uruguay y Brasil. A diferencia de la mayoría de los Láridos, esta especie presenta un alto grado de especia-lización en la dieta, asociada con el consumo de cangrejos varúnidos y se alimenta tanto solitariamente como en grupo (Escalante 1966, Herrera et al. 2005,Zumpano et al. 2021). La Reserva de Mar Chiquita, en Argentina, es una de las áreas de invernada preferidas por esta especie en la costa bonaerense (Favero et al. 2001). A pesar de contar con vasta literatura disponible sobre la ecología, estado sanitario y comportamiento trófico de la especie durante el periodo no reproductivo (e.g. Copello y Favero 2001, Berón et al. 2011, Ravasi et al. 2019, García at al. 2019b, 2021, Castano et al. 2020, Quadri-Adrogué et al. 2021, Zumpano et al. 2021, entre otros), son escasos los estudios de ecología que abordan aspectos relacionados con las interacciones tróficas entre individuos (ver García et al. 2019a, Zumpano et al. 2021).
Sobre la base de lo expuesto, nuestro trabajo tuvo como objetivo estudiar las interacciones tróficas (i.e., cleptoparasitismo, desplazamientos tróficos) que ocurren entre individuos de Gaviota de Olrog durante su alimentación en grupo en la Reserva de Mar Chiquita. Adicionalmente, se analizó la relación de diferentes factores como el tamaño del grupo de alimentación, el sexo y edad de los individuos con la ocurrencia de desplazamientos tróficos y clepto-parasitismo. También se analizó la relación entre el tamaño de la presa y la ocurrencia de interacciones cleptoparasíticas. Se hipotetizó que la ocurrencia de interacciones intraespecíficas dentro de un grupo de alimentación estaría afectada por el tamaño del grupo, el tamaño de la presa en disputa (solo en interacciones cleptoparasíticas), la clase etaria y sexo de los individuos.
MÉTODOS
Área de estudio
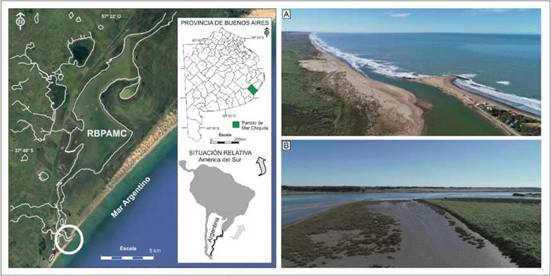
El presente trabajo se llevó a cabo en la Reserva de Mar Chiquita (37°46’ S, 57°27’ O, Reserva Mundial de la Biosfera “Parque Atlántico Mar Chiquito” y Reserva Provincial según Ley Provincial 12270) la cual se encuentra a 32 km al noreste de la ciudad de Mar del Plata, provincia de Buenos Aires (ver Fig. 1). Mar Chiquita es una laguna costera que ocupa un área de 46 km2, con una longitud de 25 km y una profundidad máxima de 4.9 m (Fasano et al. 1982). La dinámica es muy particular, dado que su conexión con el mar permite el ingreso de agua de elevada salinidad causando una gran influencia en la dinámica física y biológica del área (Fasano et al. 1982). La salinidad en la zona del estuario varía entre el 6 y 33 %o y la amplitud de marea varía entre 0.3 y 1 m (Isla 1997). La zona intermareal se caracteriza por planicies de marea de composición sedimentaria variable, las cuales se encuentran rodeadas por marismas dominadas por la gramínea halófita Spartina densiflora (Spivak et al. 1994, Iribarne et al. 1997). Tanto las marismas como las planicies de marea son el hábitat del Cangrejo Cavador Neohelice granulata, el macroinvertebrado ben-tónico dominante en ambientes estuariales del Atlántico Sudoccidental (Boschi 1964, Spivak et al. 1994). Además de N. granulata, otros organismos epibentó-nicos de importancia numérica en las planicies de marea son los cangrejos Cyrtograpsus angulatus y Uca uruguayensis (Boschi 1964, Spivak et al. 1994). Tanto N. granulata como U. uruguayensis dominan en el meso-litoral y construyen cuevas, mientras que C. angulatus domina en el infralitoral y se encuentra en playas de arena y limo desprotegida (Spivak et al. 1994). Neohelice granulata y C. angulatus constituyen las presas principales de la Gaviota de Olrog durante el período de invernada en la Reserva de Mar Chiquita (Copello y Favero 2001, Berón et al. 2011).
Obtención de datos
Comportamiento de alimentación. Las interacciones tróficas entre los individuos de Gaviota de Olrog se cuantificaron durante el período de invernada, entre los meses de mayo y agosto de 2016, por medio del análisis de observaciones focales (“focal sampling”, ver Martin y Bateson 1993) sobre individuos alimentándose en grupo (n=171). Para el registro de las observaciones se utilizaron binoculares (8X), telescopio monocular (20-60X) y grabador de voz. Las mismas se iniciaron 30 min luego del arribo del observador a la zona de alimentación para que las gaviotas se habitúen a su presencia y finalizaron al perder de vista al ejemplar o cuando el mismo finalizó la actividad de alimentación. La duración mínima de cada observación focal fue de 3 minutos y en aquellos casos que se contó con un registro de 20 minutos, la misma se dio por finalizada (promedio: 8.92 ± 3.45 minutos). Durante cada observación focal, se registró: 1) identidad del ave en aquellos casos en los cuales el individuo focal estaba marcado con anillo plástico (de los individuos identificados con anillos se pudo obtener información del sexo), 2) tamaño del grupo de alimentación; teniendo en cuenta la experiencia de los autores en el área de estudio, se consideró como un grupo de alimentación la presencia de 2 o más individuos alimentándose a una distancia menor o igual a 50 metros, distancia máxima en la cual los individuos se perciben unos a otros durante la alimentación (Zumpano et al. 2021), 3) composición del grupo de alimentación en términos de clase etaria (proporción de juveniles, subadultos y adultos), 4) intentos de desplazamiento tróficos -un individuo intenta imponerse sobre otro en un área determinada de alimentación-, 5) intentos de cleptoparasitismo -un individuo intenta robar una presa visible en el pico del hospe-dador, ni bien el hospedador capturó la presa o bien durante el manipuleo de la misma-, 6) tipo y tamaño relativo de la presa en disputa durante un evento de cleptoparasitismo (ver sección siguiente), 7) medio de ataque durante una interacción intraespecífica (i.e., aéreo, terrestre, acuático), 8) táctica de ataque utilizada por el emisor del desplazamiento trófico o el cleptoparásito, 9) tipo de respuesta realizada por el receptor del desplazamiento trófico o el hospeda-dor del evento de cleptoparasitismo, y 10) éxito de la interacción; un desplazamiento trófico se consideró exitoso cuando el individuo emisor logró desplazar al receptor de un área de alimentación, y un evento de cleptoparasitismo se consideró exitoso cuando el cleptoparásito robó la presa que fue capturada previamente por un hospedador. Las tácticas de ataque utilizadas por los individuos durante las interacciones registradas fueron categorizadas de la siguiente manera: 1) "con contacto físico” (aleteos y/o picotazos entre congéneres donde el emisor/cleptoparásito entra en contacto con el receptor/hospedador el cual defiende el territorio y/o la presa), y 2) "sin contacto físico” (vocalizaciones, vuelo y/o corridas donde el emisor/cleptoparásito interacciona con el receptor/ hospedador sin contacto físico). La respuesta de un individuo ante un ataque de otro que busca desplazar o robar una presa fueron categorizadas de la siguiente manera: 1) "huida” (corridas y/o vuelos), y 2) "enfrentamiento” (vocalizaciones, aleteos, y/o picotazos). Para cada observación focal se calcularon los siguientes parámetros comportamentales: (1) tasa de desplazamientos tróficos (número de desplazamientos emitidos y/o recibidos por minuto de alimentación), y (2) tasa de cleptoparasitismo (número de eventos de cleptoparasitismo emitidos y/o recibidos por minuto de alimentación).
Figura 1: Localización geográfica del área de estudio. El circulo blanco señala la desembocadura de la laguna costera Mar Chiquita (37°46’ S, 57°27’ W, Reserva Mundial de la Biosfera Parque Atlántico Mar Chiquito y Reserva Provincial según Ley Provincial 12270). Las fotografías muestran la desembocadura de la laguna costera de Mar Chiquita (A), y las marismas y planicies de marea, hábitat del Cangrejo Cavador Neohelice granulata (B). RBPAMC: Reserva de Biosfera Parque Atlántico Mar Chiquito.
Con el objetivo de robustecer la base de datos en relación al comportamiento de cleptoparasitismo, se realizaron observaciones de eventos de robo fuera de protocolo, es decir, eventos que ocurrieron en la zona de estudio de forma espontánea cuando no se estaban realizando observaciones focales (n=33). Durante estas observaciones se registraron las mismas variables consideradas durante las observaciones focales. Estas observaciones fueron incorporadas a la base de datos general y utilizadas en aquellos casos que el tipo de análisis aplicado lo permitiera.
Caracterización de las presas. La totalidad de las presas registradas durante las observaciones focales fueron identificadas, con telescopio monocular (20-60X), al menor nivel taxonómico posible. Para reducir el error en la determinación y caracterización de las presas, todas las observaciones fueron realizadas por el mismo observador (FZ). La especie de cangrejo fue identificada por la forma del caparazón y la coloración del mismo. Para estimar la talla de los cangrejos capturados se utilizó un método ampliamente reportado en la literatura (e.g., García et al. 2008, Josens et al. 2010, Berón et al. 2011) donde se relativiza el tamaño del cangrejo (ancho del caparazón, AC) respecto al largo del pico de la especie de estudio (largo de pico promedio: 51.66 ± 3.46 mm, n=41, García G datos no publicados). El tamaño de los cangrejos se categorizó en: "chico” (AC <15 mm); "mediano” (15 mm < AC < 25 mm); "grande” (25 mm < AC < 35 mm); "muy grande” (AC > 35 mm) (para detalles ver Berón et al. 2011).
Análisis estadístico
Desplazamientos tróficos. Mediante test de Chi cuadrado (Siegel 1979) se comparó: 1) la distribución de las distintas clases de edad de los individuos que recibieron o emitieron un desplazamiento trófico con la proporción esperada (i.e., media de la proporción de cada clase etaria en los grupos de alimentación registrados a lo largo de este estudio), y 2) la distribución de los sexos de los individuos que emitieron un evento de desplazamiento con una distribución uniforme. Mediante este test también se analizó: 1) la distribución de los diferentes medios de ataques utilizados por los emisores durante un desplazamiento trófico, 2) la distribución de las diferentes tácticas de ataques empleadas por los emisores durante una interacción, y 3) la distribución de las diferentes respuestas desarrolladas por los receptores ante la presencia de una interacción.
Se utilizó un test exacto de Fisher (Agresti 2002) para evaluar si la eficiencia con que los emisores llevaron adelante sus eventos de desplazamientos tróficos fueron independientes de la táctica de ataque empleada. Se usó este tipo de análisis debido a que algunas de las frecuencias observadas fueron menores a cinco (Bower 2003).
Para analizar si la ocurrencia de un desplazamiento trófico estuvo explicada por el tamaño del grupo de alimentación se utilizó un Modelo Lineal Generalizado (MLG, Crawley 2007), en el cual, como variable respuesta, se consideró si ocurrió o no un evento desplazamiento durante el registro de una observación focal (n=163, observaciones en las cuales se pudo registrar el tamaño de grupo) y como variable explicativa se contempló el tamaño del grupo de alimentación (variable continua). Se utilizó una distribución de errores bino-mial (0: ausencia de desplazamiento trófico, 1: presencia de desplazamiento trófico) y función de enlace “logit”.
Cleptoparasitismo. Mediante test de Chi cuadrado se comparó: 1) la distribución de las diferentes edades de los individuos cleptoparásitos u hospedadores con la proporción esperada, y 2) la distribución de los diferentes sexos de los individuos que realizaron un evento de cleptoparasitismo con una distribución uniforme. Adicionalmente, utilizando test de Chi cuadrado se analizó: 1) la distribución de los diferentes tamaños de presas involucrados en un evento de cleptoparasitismo, 2) la distribución de los diferentes medios de ataques utilizados por los cleptoparásitos durante un evento de robo, 3) la distribución de las diferentes tácticas de ataques empleadas por los cleptoparásitos durante una interacción, y 4) la distribución de las diferentes respuestas desarrolladas por los hospedadores ante la presencia de una interacción. Se utilizó un test exacto de Fisher para evaluar si la eficiencia con que los clep-toparásitos llevaron adelante sus eventos de robo fue independiente de la táctica de ataque empleada.
Para analizar si la ocurrencia de un evento de clep-toparasitismo estuvo afectado por el tamaño de presa y el tamaño de grupo, se usó un MLG. Como variable respuesta se consideró si ocurrió o no un evento de robo luego de la captura de una presa (n=351). Como variables explicativas se utilizó el tamaño de presa (variable categórica: chica, mediana, grande, muy grande), el tamaño de grupo y la interacción entre ambas variables. El modelo de partida fue aquel que incluyó a las variables nombradas anteriormente y su interacción. Se utilizó una distribución de errores binomial (0: ausencia de evento de robo, 1: presencia de evento de robo) y función de enlace “logit”. Para la selección del mejor modelo empleamos un procedimiento de selección hacia atrás para eliminar, uno por uno, en nivel decreciente de interacciones y valores P, los efectos principales no significativos hasta que solo quedaron aquellos términos significativos.
Todos los análisis estadísticos fueron realizados utilizando el programa estadístico R, versión 4.0.5 (R Development Core Team 2021), se utilizó la función glm del paquete lme4 (Bates et al. 2015). Todos los valores fueron expresados como promedio ± desvío estándar (DE) y el nivel de significancia para todos los test fue de P < 0.05.
RESULTADOS
Se registraron un total de 171 observaciones focales. En el 97% de las mismas se registró el tamaño de grupo de alimentación, el cual tuvo como mínimo dos individuos y como máximo 104 (tamaño de grupo promedio: 15 ± 19 individuos). La composición del grupo de alimentación en términos de clases de edad se pudo registrar en el 95% de los casos, siendo los juveniles los que predominaron sobre el resto de las clases etarias (promedio: Juveniles (J)=58%, Subadultos (SA)=25%, Adultos (A)=17%; x21=27.85, P<0.001; Fig. 2).
Desplazamientos tróficos
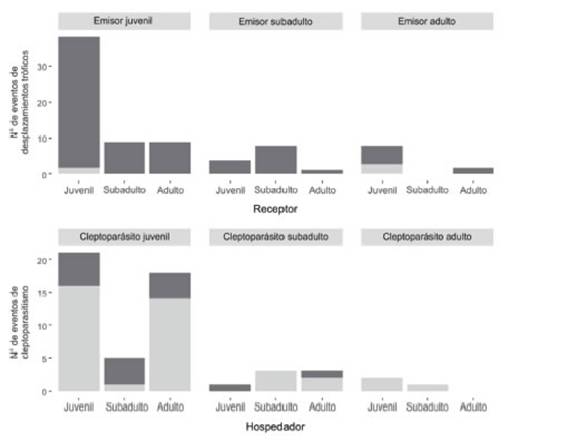
A lo largo de este estudio se registraron un total de 98 desplazamientos, de los cuales el 95% resultó ser exitoso, es decir que el individuo que inició la interacción (emisor) logró excluir a otro individuo (receptor) de la zona de alimentación en disputa. La tasa de desplazamientos tróficos fue 0.06 ± 0.12 eventos de des-plazamientos/min de alimentación (n=171 focales). En el 90% de los eventos registrados se pudo reconocer la edad del individuo emisor; la distribución de las edades de los emisores difirió de las proporciones observadas en los grupos de alimentación (x22=7.84, P<0.05), siendo los individuos categorizados como juveniles aquellos que iniciaron este tipo de interacción con mayor frecuencia que la esperada (J=72%, SA=17%, A=11%; Figs. 2 y 3). De estos eventos, en el 90% (n=88) de los casos se pudo registrar la edad del receptor, siendo los juveniles los que recibieron este tipo de interacción con mayor frecuencia (J=63%, SA=22%, A=15%), aunque esta distribución no difirió de lo esperado según la composición etaria de los grupos de alimentación (x22=1.27, P=0.52; Fig. 2).
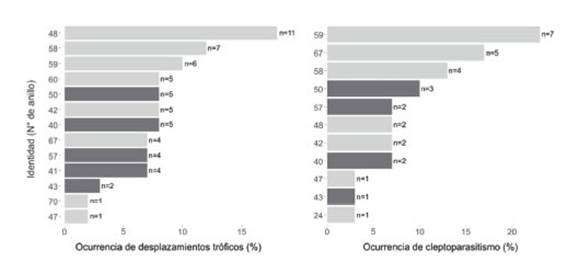
En términos generales, el éxito de desplazamiento fue alto indistintamente de la clase etaria del emisor (J=87%, SA=100%, A=70%; Fig. 3). En el 60% de los casos se pudo registrar el sexo del emisor, encontrándose que más del 65% de los desplazamientos fueron producidos por machos (x21=9.00, P<0.01; Fig. 4).
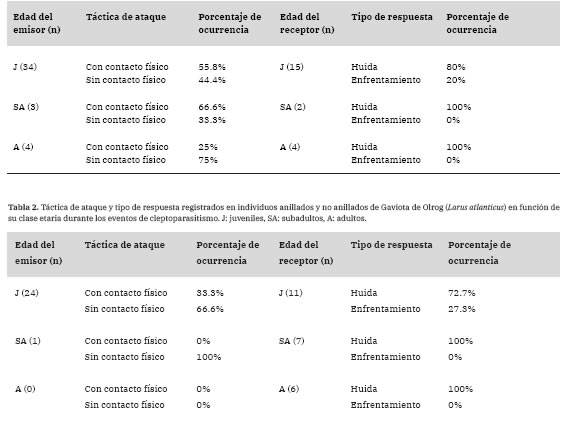
El medio de ataque utilizado por el emisor de la interacción se pudo identificar en el 95% de los casos, siendo el medio terrestre el de mayor ocurrencia (terrestre=89%, aéreo=10%, acuático 1%; x22=141.81, P<0.001). En el 42% (n=98) de los desplazamientos se pudo identificar la táctica de ataque, de las cuales en el 54 % de las mismas el emisor atacó “con contacto físico” y en un 46 % “sin contacto físico” (x21=1.00, P=0.31). El éxito de desplazamientos fue independiente del tipo de ataque (100% de éxito “con contacto físico”, 89% de éxito “sin contacto físico”; Test Exacto de Fisher, CI 95%=0-349, OR=0, P=1.00). En relación a la respuesta de los individuos, la misma fue registrada sólo en el 21% de los casos, siendo la “huida” la principal respuesta por parte de los receptores (“huida” =86%, “enfrentamiento” =13%; x21=54.76, P<0.001; Tabla 1). No se observó un efecto del tamaño del grupo de alimentación sobre la probabilidad de ocurrencia de un desplazamiento trófico (z=0.15, P=0.88).
Cleptoparasitismo
Durante este estudio se registraron un total de 70 eventos de cleptoparasitismo; el 24% de los mismos resultó de manera exitosa causando la perdida de la presa para el hospedador. La tasa de eventos de cleptoparasitismo fue de 0.04 ± 0.11 eventos/min de alimentación (n=171 focales). De las 70 presas en disputa se reconoció el 81% de los mismas, siendo la totalidad clasificadas como el Cangrejo Cavador. El 82% de los cangrejos involucrados en un evento de robo fueron categorizados como grandes y muy grandes (chicos=6%, medianos=13%, grandes=45%, muy grandes=36%; f3=41.04, P<0.001).
Figura 2: Porcentajes relativos de ocurrencia de desplazamientos tróficos y cleptoparasitismo en función de la clase etaria del emisor/cleptoparásito y del receptor/hospedador en la Gaviota de Olrog (Larus atlanticus). En gris claro se señalan las interacciones observadas y en gris oscuro la media de los porcentajes de cada clase de edad en los grupos de alimentación (frecuencia esperada).
Figura 3: Número de eventos y éxito de desplazamientos tróficos y cleptoparasitismo en función de la clase etaria del emisor y receptor en la Gaviota de Olrog (Larus atlanticus). En gris oscuro se señalan las interacciones exitosas y en gris claro las no exitosas.
Figura 4: Frecuencia de ocurrencia (%) de desplazamientos tróficos y cleptoparasitismo emitidos por diferentes individuos de Gaviota de Olrog (Larus atlanticus) con identidad conocida. En gris claro se señalan los individuos machos y en gris oscuro las hembras.
En el 90% de los eventos de robo se registró la edad del parásito, difiriendo esta de la distribución observada en los grupos de alimentación (J=81%, SA=14%, A=5%; x22=22.86, P<0.001; Figs. 2 y 3). De estos eventos (n=63), en el 86% se pudo conocer la edad del hospedador, en donde los juveniles recibieron menos y los adultos más intentos de robo que lo esperado según la distribución observada en los grupos de alimentación (J=44%, SA=17%, A=39%; X22=34.79, P<0.001; Fig. 2).
En el 43% de los eventos de cleptoparasitismo se pudo reconocer el sexo del parásito; una mayor frecuencia de intentos de robo estuvo representada por individuos machos (machos= 73%, hembras=27%; X21=21.16, P<0.001; Fig. 4).
El medio de ataque por el cual se efectuaron los eventos de robo se pudo identificar para el 91% de los casos, siendo el medio terrestre el más utilizado (terrestre=86%, aéreo=14%; x22=127.50, P<0.001). La táctica de ataque utilizada por parte de los parásitos pudo ser identificada en el 35% de los casos, donde el ataque "sin contacto físico” fue el de mayor frecuencia ("con contacto físico”=32%, "sin contacto físico” =68%; x\=12.96, P<0.001). El éxito de cleptoparasi-tismo fue independiente del tipo de ataque (25% de éxito "con contacto físico”, 29% de éxito "sin contacto físico”; Test Exacto de Fisher, CI 95%=0.14-16.69, OR=1.23, P=1.00). El tipo de respuesta por parte de los hospedadores se pudo registrar para el 34% de los casos, siendo la "huida” la más utilizada ("huida” =88%; "enfrentamiento” = 12%; ^=57.76, P<0.001; Tabla 2).
La probabilidad de que ocurra un evento de robo difirió significativamente en función del tamaño de presas (Tabla 3); la probabilidad de un evento de clep-toparasitismo fue mayor cuando los cangrejos en disputa fueron grandes y muy grandes en comparación con los cangrejos chicos y medianos (MLG: zC-M=-0.40, P=0.97; z CG=-2.59, P<0.001; zcm=-3.05, P<0.001; P=0.60). No se observó un efecto del tamaño de grupo de alimentación sobre la probabilidad de ocurrencia de un evento de cleptoparasitismo ante la captura de un determinado tipo de presa (Tabla 3).
DISCUSIÓN
En este estudio se analizaron dos tipos de interacciones que ocurren durante la alimentación en grupo entre individuos invernantes de Gaviota de Olrog: desplazamientos tróficos y eventos de clepto-parasitismo. La mayoría de las interacciones fueron iniciadas por individuos juveniles, resultado que está en concordancia con lo reportado en estudios previos (Steele y Hockey 1995, Bertellotti y Yorio 2000, García et al. 2019a) y lo hipotetizado durante este estudio. García et al. (2019a), durante la realización de experimentos a campo a partir del montaje de estaciones de cebado, observaron que los individuos juveniles de Gaviota de Olrog eran los que principalmente iniciaban las interacciones. Durante el mismo estudio, los autores encontraron que los juveniles presentaban una menor percepción del riesgo hacia situaciones novedosas a la hora de acceder a una fuente de alimentación (ver también Castano et al. 2020), lo cual estaría relacionado, en parte, con la poca experiencia en la adquisición de presas de esta clase etaria (Berón et al. 2011). Estas características podrían explicar por qué los juveniles son los que principalmente inician interacciones para acceder a una presa previamente capturada o desplazar a otro individuo de la zona de alimentación.
Tabla 1: Táctica de ataque y tipo de respuesta registrados en individuos anillados y no anillados de Gaviota de Olrog (Larus atlanticus) en función de su clase etaria durante los desplazamientos tróficos. J: juveniles, SA: subadultos, A: adultos.
Tabla 3: Variables que afectan la ocurrencia de un evento de cleptoparasitismo analizadas mediante un MLG («=351 presas). Los estadísticos se presentan para las variables incluidas en el último modelo o en la eliminación de un modelo anterior utilizando un enfoque paso a paso hacia atrás de variables no significativas (P>0.05). Las variables significativas están resaltadas en negrita (P<0.05).
De acuerdo con lo hipotetizado, encontramos una relación entre el sexo de los individuos y la proporción de interacciones intraespecíficas; las hembras realizaron menos interacciones que los machos. Las diferencias sexo-dependiente en el patrón de las interacciones tróficas estudiadas podrían estar reflejando una variabilidad en: 1) la habilidad de machos y hembras para capturar presas por ellos mismos versus las que obtienen mediante una interacción intraespecífi-ca, y/o 2) la agresividad entre sexos. En este sentido,Zumpano et al. (2021) reportaron resultados similares para individuos juveniles de Gaviota de Olrog, en donde los machos ocuparon más tiempo interaccionando con otros individuos en comparación al tiempo ocupado por las hembras para dicha actividad. Además, estas diferencias están en concordancia con lo reportado para otras especies de aves (García 2010, Flower y Gribble 2012, Flower et al. 2013). Recientemente, Puehringer-Sturmayr et al. (2021) reportaron que los machos de Ibis Eremita (Geronticus eremita) se vieron más involucrados en interacciones agonísticas que las hembras. En un ave marina ártica (Uria lomvia), Paredes e Insley (2010) registraron que los machos fueron los que mayormente iniciaban las interacciones durante el período reproductivo, atribuyendo esos resultados a diferencias en la agresividad entre sexos que les permiten a los machos defender a los pichones. En ese estudio, además, los autores reportan resultados similares para otras especies de aves marinas. En un ave marina emparentada, el Gaviotín Golondrina (Sterna hirundo), se observó que los machos fueron principalmente los que cleptoparasi-taron a lo largo de todo el ciclo reproductivo (García et al. 2011, 2013, 2020). Futuras investigaciones deberían indagar las interacciones que ocurren durante la alimentación en el período reproductivo en individuos de Gaviota de Olrog, y relacionar los resultados con lo encontrado durante el periodo de invernada. Esto nos permitiría identificar patrones comporta-mentales durante la alimentación de la especie a lo largo del ciclo anual.
Durante la alimentación en grupo los individuos de Gaviota de Olrog se alimentan principalmente caminando sobre fondos blandos (Copello y Favero 2001, Gatto et al. 2008, Suárez et al. 2014), lo cual, en parte, podría explicar el principal medio de ataque utilizado por la especie durante las interacciones tróficas. En relación a la táctica de ataque, los resultados indican que, durante los eventos de robo, el ataque principalmente resultó ser sin contacto físico a diferencia de lo encontrado para los desplazamientos tróficos en los cuales la frecuencia entre ataques con contacto y sin contacto físico fue similar. Esto podría estar relacionado con: 1) la velocidad de los hospeda-dores para defender la presa ante un evento de clep-toparasitismo, y 2) el tipo de recurso que está en juego en cada tipo de interacción estudiada (presa vs. área potencial de alimentación). Durante un evento de cleptoparasitismo, los hospedadores principalmente huyen con la presa sin dar lugar al enfrentamiento físico con el parásito. Por otro lado, durante un evento de desplazamiento trófico lo que está en juego es el territorio. Esto hace que los receptores no abandonen inmediatamente el área, quedando expuestos muchas veces a enfrentamientos donde ocurre el contacto físico. La supremacía en la huida como tipo de respuesta ante ambas interacciones tróficas se encuentra en línea con lo reportado para la especie de estudio y para otras aves marinas y costeras (e.g., García et al. 2012, 2019a). Por ejemplo, en individuos de Gaviota de Olrog, García et al. (2019a) reportaron que en la mayoría de los casos (entre el 70 y 80%), ante una interacción agonística, los individuos huyeron volando. En la Reserva de Mar Chiquita se reportó que el Ostrero Común (Haematopus palliatus), ante un evento de robo emitido por individuos de Gaviota Capucho Café (Chroicocephalus maculipennis) y Gaviota Capucho Gris (Chroicocephalus cirrocephalus), utiliza la huida como táctica principal de defensa (García et al. 2012).
Dentro de las principales diferencias entre los dos tipos de interacciones registradas se encuentran los porcentajes de éxito. Los valores de éxito encontrados para los desplazamientos tróficos (95% de éxito) son acordes a los reportados por García et al. (2019a). En este sentido, Medina et al. (2008) reportaron para 8 especies de aves, valores generalmente altos en la tasa de éxito de desplazamientos (mayores al 60%), principalmente cuando hubo diferencias de tamaños entre emisores y receptores. A pesar de no contar con valores previos sobre éxito de cleptoparasitismo para la Gaviota de Olrog, nuestros resultados (24% de éxitos) se encuentran en concordancia con lo reportado para otras especies de Láridos (rango= 1-85%, promedio= 23%, ver Furness 1987). El bajo porcentaje de éxitos en este tipo de interacción podría estar explicado por el recurso que se encuentra en juego. En función de esto, generalmente, ante un intento de robo, los hospedadores responden huyendo con la presa (evitando así cualquier tipo de lesión durante la defensa de la misma). Además, teniendo en cuenta que la mayoría de las interacciones fueron emitidas por juveniles, el bajo porcentaje de éxitos de clepto-parasitismo podría estar dado, en parte, por la falta de experiencia de los individuos en la estrategia de alimentación utilizada.
En este estudio encontramos que la ocurrencia de un evento de cleptoparasitismo estuvo explicada por el tamaño de la presa. La relación entre el tamaño de presas robadas y la ocurrencia de cleptoparasitismo podría ser explicada en cierta medida a la relación existente entre el tamaño de la presa, el contenido energético de las mismas y los tiempos de manipuleo (Gaglio et al. 2018); presas de mayor tamaño (y mayor retorno energético) acarrean tiempos de manipuleo más altos quedando mayor tiempo expuestas para ser detectadas por un cleptoparásito, además de proporcionar mayores beneficios energéticos (e.g., Brock-mann y Barnard 1979, Amat 1990, García et al. 2008). Este resultado es similar a lo observado en otras especies de aves marinas como la Gaviota Cocinera (Larus dominicanus), la Gaviota Reidora (Chroicocephalus ridi-bundus) y el Gaviotín Golondrina, entre otras (Steele y Hockey 1995, Ratcliffe et al. 1997, García et al. 2010, 2012, 2013, Gaglio et al. 2018).
En contraposición con lo hipotetizado, no se encontró una relación entre la ocurrencia de interacciones intraespecíficas y el tamaño de grupo, por lo que, el principal desencadenante, al menos para el caso del cleptoparasitismo, sería el tamaño de la presa en disputa. Este resultado podría ser explicado en función de lo reportado recientemente por Zumpano et al. (2021) donde observaron que con el aumento del tamaño de grupo los individuos de Gaviota de Olrog ajustan el tamaño de las presas capturadas como mecanismo de evitación de eventos de cleptoparasitis-mo entre congéneres.
Este estudio es el primero en analizar las interacciones intraespecíficas entre individuos de Gaviota de Olrog durante la alimentación en grupo a lo largo del periodo de invernada. Comprender el comportamiento de alimentación de la Gaviota de Olrog junto a las interacciones entre conespecíficos que ocurren durante esta actividad es importante para conocer nuevos aspectos de la historia natural y generar información de base de una especie endémica amenazada. Futuras investigaciones deberían focalizarse en incrementar el número de muestras sobre individuos marcados de Gaviota de Olrog durante el periodo de invernada.
AGRADECIMIENTOS
Los autores agradecen a los revisores anónimos, quienes con sus comentarios y sugerencias ayudaron a mejorar la calidad del trabajo. Agradecemos a la Dra. Laura Zulaica por el mapa de la Figura 1. Este estudio contó con el apoyo institucional y el financia-miento provisto por la Universidad Nacional de Mar del Plata y la Agencia Nacional de Promoción de la
Investigación, el Desarrollo Tecnológico y la Innovación Agencia I+D+i (PICT 2013-0711, IR M.F; PICT 2016-618, IR G.O.G). Para llevar adelante este trabajo se contó con el permiso de investigación correspondiente otorgados por el Organismo Provincial de Desarrollo Sostenible (OPDS) Disposición 203/2012 y el aval del Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL, UNMdP) OCA N° 229/2016.
Recibido: 6 de Octubre de 2021
Aceptado: 30 de Marzo de 2022












 uBio
uBio