INTRODUCCIÓN
El simple hecho de observar el comportamiento de un niño recién nacido en distintas situaciones nos brinda valiosa información sobre su desarrollo, en relación con su edad gestacional e influencias ambientales. Su capacidad de autorregularse, sus necesidades de apoyo y los estados del comportamiento se expresan a través del sistema motor. De este modo, el análisis del movimiento de un niño a través de la observación clínica ha vuelto a tomar fuerza en particular para la detección de la parálisis cerebral.1'2
El siguiente trabajo tiene como objetivo realizar una revisión bibliográfica sobre nuevas herramientas de detección precoz de la parálisis cerebral utilizando evaluaciones clínicas estandarizadas, como son los movimientos generales (MG), y la posibilidad de combinarlas con aplicaciones tecnológicas.
ANTECEDENTES
Se define como prematuros a los niños nacidos antes de las 37 semanas de gestación y se clasifican dependiendo de la edad gestacional.3 Los avances en los cuidados perinatales han incrementado la supervivencia de los niños prematuros de muy baja edad gestacional y se recomienda que estos ingresen a programas de seguimiento y sean evaluados individualmente en distintas áreas del desarrollo.4
En nuestro país, los nacimientos prematuros se estiman en un 10 % de todos los recién nacidos vivos y generan gran preocupación para la salud pública, ya que son la principal causa de muerte y comorbilidades en niños menores de 5 años.5
El sistema nervioso central es uno de los sistemas más afectados en esta población y puede presentar lesiones de distinta gravedad con secuelas a corto y largo plazo. La identificación del posible compromiso del sistema nervioso a temprana edad es un desafío desde hace muchos años en el campo de la neurología. Su detección temprana permitiría intervenir en forma oportuna y así potenciar los grandes cambios que ocurren en la neuroplasticidad en los primeros años, con una mejora de la calidad de vida de los niños.4,6-8
SUSTRATO NEUROBIOLÓGICO DE LOS MOVIMIENTOS A TEMPRANA EDAD
Los cambios que ocurren en el desarrollo del sistema nervioso en el primer año de vida permiten comprender la transformación de la actividad motora en este período. Las modificaciones más significativas en el cerebro se producen durante la segunda mitad de la gestación y los tres primeros meses después del parto, en particular en la subplaca cortical y el cerebelo. En ese período se distinguen dos fases de desarrollo: a) la fase de la subplaca cortical transitoria, presente principalmente desde los primeros meses de vida fetal hasta los 3 meses posnatal y posteriormente, b) la fase en la que dominan los circuitos permanentes.9
Esta transformación de la arquitectura del cerebro y del cerebelo tiene enorme influencia sobre los movimientos que se observan en los niños prematuros y podrían ser responsables de trastornos del neurodesarrollo, como son la parálisis cerebral (PC), los trastornos del espectro del autismo y los déficits de atención e hiperactividad.10
Esto ha podido comprobarse realizando estudios histológicos de la corteza cerebral en los que han analizado los procesos de neurogénesis, migración y apoptosis neuronales, como así también a través de resonancias magnéticas funcionales en estados de descanso en fetos desde las 20 semanas de edad posmenstrual a las 38 semanas de edad posmenstrual, en niños en los que estudiaron los niveles de conectividad inter- e intrahemisféricas.11 En el desarrollo típico, la integridad de las complejas redes corticales-subcorticales y la conectividad de la sustancia blanca y la subplaca cortical que luego desaparecerá juegan un rol dominante en la presencia temporal de los movimientos generales en los últimos meses de gestación y los primeros 3 meses de vida posnatal. La actividad cortical en las cortezas sensoriomotoras primarias se desplaza de la subplaca a la placa cortical generando modificaciones en la conectividad entre los 3 y los 5 meses de edad corregida. Por otro lado, esta actividad estructural y funcional que se desarrolla en el cerebro en los últimos meses de gestación lo hacen más vulnerable a lesiones de todo tipo. De ahí parte la necesidad de monitorear por medio de evaluaciones estandarizadas cómo avanzan estos procesos tan complejos involucrados en el desarrollo motor del niño.12
DESCRIPCIÓN DE LOS MOVIMIENTOS GENRALES. SU VALOR PREDICTIVO EN LOS TRASTORNOS GRAVES DEL NEURODESARROLLO
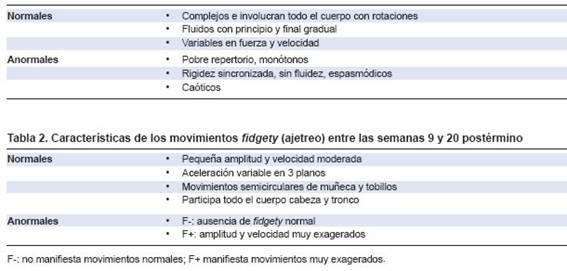
A partir de la 8.a-10.a semanas de edad posmenstrual, se han detectado movimientos de todo el cuerpo por medio de ecografías ultrasónicas intravaginales y de resonancia magnética dinámica,13,14 que suele realizarse de la semana 18 en adelante en gestantes. En estos y otros trabajos se han basado Prechtl, Einspieler y Marschik para identificar algunos tipos de movimientos que se distinguen del repertorio motor que manifiesta un feto intraútero y que tienen continuidad en el desarrollo hasta los 5 meses posnatales, a los cuales se los denominó movimientos generales (MG). Estos MG se diferencian de otros tipos de movimientos que realiza el feto, como sobresaltos, bostezos, succión, hipo, movimientos aislados de piernas y brazos, entre otros. Se caracterizan por ser más frecuentes en ocurrir y con patrones más complejos, e incluyen una secuencia variable de movimientos de piernas, brazos, cuello y tronco que aceleran y disminuyen en intensidad, fuerza y velocidad con un comienzo y final gradual. Las rotaciones de las extremidades y los delicados cambios de dirección de los movimientos los hacen más fluidos y elegantes, y así expresan la complejidad y variabilidad. Por otro lado, también existe evidencia de que estos movimientos se manifiestan estereotipados y rígidos, y pierden su complejidad si el sistema nervioso está dañado (Tablas 1 y 2).2,15,16
Prechtl y Einspieler sugieren que los MG surgen del generador central de patrones que se encuentra en el tronco encefálico y la médula espinal, y se van modificando a medida que se modifican las estructuras de la corteza cerebral. Estas modificaciones se manifiestan en cambios temporales de los movimientos, los cuales se denominan: a) movimientos generales de pretérmino a partir de la semana 8 posconcepcional a la edad de término, b) movimientos de contorsión o writhing en niños de término hasta la semana 6-9 postérmino y gradualmente desaparecen para dar lugar a los c) movimientos de ajetreo o fidgety, los cuales estarán presentes hasta los 5 meses aproximadamente, cuando los movimientos voluntarios y antigravitatorios progresivamente van tomando el control del movimiento (Figura 1).2,17,18 Analizar estos MG ha permitido utilizarlos como herramienta de evaluación de su calidad, debido a la sencilla utilización, el bajo costo y a la sensibilidad del 98 % en detectar precozmente trastornos motores antes de los 5 meses de vida cuando se la utiliza junto con una historia clínica detallada del niño.4'16'18’19
Tabla 1: Características de los movimientos writhing o de contorsión normales y anormales entre las semanas 20 y 46 posconcepcional
Figura 1: Desarrollo temporal de los movimientos generales
El procedimiento para realizar las filmaciones y evaluar los MG consta de realizar videos de 1 a 3 minutos de duración, con el niño acostado boca arriba, tomando la imagen del cuerpo entero solo vestido con pañal o muy ligera ropa que permita observar sus movimientos libremente. El niño debe estar en estado de vigilia y tranquilo. Luego se analiza el video, haciendo un análisis gestáltico, y se lo categoriza según está recomendado por Prechtl y Einspieler en normales y anormales, como se menciona en la Tabla l2’15’16
RELEVANCIA DE LOS TRASTORNOS MOTORES GRAVES EN NIÑOS PREMATUROS
Los niños prematuros presentan comorbilidades motoras, sensoriales y conductuales cuando se los compara con los niños nacidos a término. Dentro de los trastornos motores, existe una mayor prevalencia de manifestar parálisis cerebral y este riesgo se incrementa a medida que disminuye la edad gestacional.20 La principal causa es la encefalopatía del prematuro, que genera secuelas y es la responsable que del 5 % al 25 % de los niños prematuros manifiesten déficits motores.8,21 La encefalopatía del prematuro es provocada por lesiones en la sustancia blanca periventricular y frecuentemente está acompañada por lesiones en cerebelo, tálamo, ganglios basales y tronco encefálico, en una combinación de destrucción primaria y de impedimentos en los mecanismos tróficos.22
Existe actualmente un amplio consenso sobre las ventajas que presenta el diagnóstico precoz en esta población, que permite brindar programas de intervención temprana dentro de su primer año de vida. Esta recomendación se basa en que, por un lado, su cerebro se encuentra en un período de grandes cambios estructurales y funcionales, como así también con gran potencial para contrarrestar las secuelas debido a la enorme plasticidad cerebral. Por otro lado, la detección precoz tiene por objeto ofrecer apoyo a las familias de los niños que necesitan orientación y participación en la crianza de sus hijos.'7A23
AVANCES EN LA DETECCIÓN PRECOZ DE LA PARÁLISIS CEREBRAL
La parálisis cerebral es la discapacidad más común en la infancia con dispar prevalencia en el mundo. Abarca un grupo de síndromes que presentan trastornos permanentes del desarrollo del movimiento y la postura, que causan una limitación de la actividad, y que se atribuyen a alteraciones no progresivas ocurridas en el desarrollo del cerebro del feto o del niño. A menudo estos desórdenes son secundarios a lesiones o anomalías del cerebro, surgen en las primeras etapas del desarrollo, van modificando su expresión y provocan limitaciones en el desempeño y las actividades de la vida diaria del niño.24
El diagnóstico continúa basándose en criterios de hallazgos clínicos, en algunos casos realizando neuroimágenes y en otros pocos casos se complementa con estudios metabólicos y/o genéticos,4,25 debido a que es poco clara la etiología en el 80 % de los casos. Nueva evidencia sugiere que el 14 % del total de los niños con parálisis cerebral responde a alteraciones génicas propias.26
En relación con los avances de los estudios moleculares y genéticos, nuevas pruebas sugieren que los marcadores epigenéticos relacionados con el entorno psicosocial, químico, físico y ambiental al que están expuestos la madre y el niño son también predictivos y condicionantes de los resultados del neurodesarrollo, ya que pueden provocar efectos nocivos en el cerebro en desarrollo a largo plazo.1,26
En un estudio multicéntrico publicado por Novak y otros autores, han encontrado que las tres herramientas con mayor validez predictiva para detectar la parálisis cerebral son, en primer lugar, la evaluación cualitativa de los MG de Prechtl con el 98 % de sensibilidad,16,17 descripta previamente; en segundo lugar, el examen neurológico infantil de Hammersmith (HINE) con el 90 % de sensibilidad, y, en tercer lugar, la resonancia magnética neonatal (RM) con el 8689 % de sensibilidad.4,27,28
La evaluación infantil Hammersmith (HINE) es una evaluación estandarizada con 26 ítems fácilmente replicable que permite evaluar niños entre los 2 y los 24 meses. Se obtiene un puntaje entre 0 y 78, y tiene alta predicción de PC a los 2 años. Esta escala puede combinarse con evaluación de MG a los 3 meses y esto mejora aún más los resultados de predecir la PC.4,29 Acerca de la utilización de la resonancia magnética como método, puede realizarse hasta los 3 meses durante el sueño natural del niño o con una dosis de sedación y envuelto en su nido de contención; ya después de los 3 meses requiere anestesia general.29
PERSPECTIVAS DE LA EVALUACIÓN DE LOS MOVIMIENTOS GENERALES COMBINADA CON EL USO DE LA TECNOLOGÍA
En los últimos años, se ha desarrollado el análisis de videos por medio de distintas aplicaciones computacionales junto con la evaluación de los MG y valiéndose de los avances de lo que se conoce como aprendizaje profundo (AP) e inteligencia artificial (IA). Sobre estas nuevas posibilidades, aún no existe una forma estandarizada de utilizar tanto AP como IA, ni tampoco consenso sobre cuáles son las formas de registros más convenientes.
Se han realizado publicaciones que utilizan distintas metodologías para procesar los videos. Unas lo hacen colocando un traje o pechera con sensores sobre el niño; otros colocan solo brazaletes con sensores en muñecas y tobillos sobre la piel mapeando puntos clave del cuerpo de los niños,30 y en otros casos se utiliza el análisis 2D con cámaras que rastrean partes del cuerpo y características de los patrones de movimientos que luego son procesados por algoritmos.31'32
Finalmente, se han publicado experiencias en las que han utilizado aplicaciones que funcionan en el teléfono celular. Basándose en esta tecnología, Adde L. y cols., crearon una aplicación que se llama In Motion, la cual instalaron en el teléfono de un grupo control de 86 padres. Esta aplicación permite seguir 7 puntos claves del cuerpo del niño y luego el equipo médico procesa los datos obtenidos de los acelerómetros que contiene el software, y analizan los MG obtenidos por los padres.33 En otro estudio, Spittle propone utilizar otra aplicación para evaluar niños prematuros que se descarga en el teléfono móvil. Se les solicita a los padres que filmen a sus hijos para su posterior análisis basándose en la calidad del movimiento.34
DISCUSIÓN
Sobre la base de la revisión que hemos realizado y de la experiencia personal estudiando los MG y utilizando softwares de data tracking, consideramos que este tipo de herramientas para el análisis de los videos, tal como Silva y colaboradores describen,30 aún no son capaces por sí solas de distinguir, como lo hace el ojo humano, entre distintos tipos de movimientos anormales, y esto les quita el valor pronóstico.35 Obtener buenos resultados a corto y mediano plazo utilizando inteligencia artificial parece ser muy aventurado a pesar de los intentos que se vienen realizando, ya que estos procedimientos insumen mucho tiempo, recursos tecnológicos y económicos en contraste con la posibilidad tradicional de poder sacar conclusiones luego de la observación de un corto video. Es de destacar que los estudios realizados que utilizan AP e IA utilizan muestras pequeñas, han requerido importante apoyo financiero y tecnológico para su realización, y esto nos limita ampliamente en nuestro medio, sumado a que aún las aplicaciones que se descargan en los teléfonos son de uso cerrado para investigadores y no de uso libre. Es muy probable que se deba seguir utilizando el análisis humano de videos durante cierto tiempo en la evaluación de los MG y esperar mayores y mejores resultados a gran escala de los softwares que podrían analizar gran cantidad de videos.
CONCLUSIONES
Consideramos que los desafíos de los próximos años serán mejorar la precisión con que se detectan precozmente niños con alto riesgo y mantener comunicación entre los expertos en desarrollo junto con ingenieros informáticos para poder garantizar la confiabilidad de los futuros modelos matemáticos.30
La utilización a futuro de una combinación de evaluaciones estándar junto con AP o IA a gran escala facilitaría la detección precoz y la pronta incorporación de niños a programas de intervención temprana. De este modo, se podría beneficiar el niño y su familia, desde los primeros meses de vida, al aportarle asesoramiento e incorporándola en el tratamiento de sus hijos como parte fundamental, asimismo disminuiría el estrés y mejoraría la salud mental.
Agradecimientos
A Viridiana Pistorio y a Ramilo Freudhenthal por sus valiosos aportes al manuscrito.
Recibido: 5-7-2022
Aceptado: 1-11-2022