Caso clínico
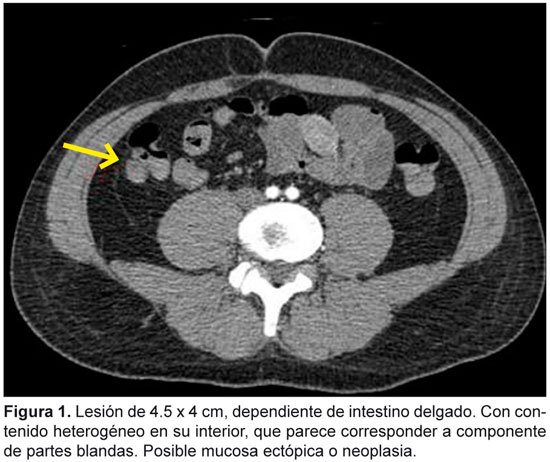
Se presenta el caso de un varón sano, de 34 años, que acude a Urgencias por síncopes de repetición y melenas con inestabilidad hemodinámica (frecuencia cardíaca: 115 lpm, presión arterial: 90/60 mmHg) y anemia grave (hemoglobina [Hb]: 6.6 g/dl). Tras estabilización inicial en la Unidad de Cuidados Intensivos, se realiza gastroscopia urgente, sin comprobar hallazgos reseñables ni restos hemáticos. Por persistencia de inestabilidad hemodinámica se realiza tomografía computarizada con contraste de abdomen, que demuestra una lesión dependiente de un asa del intestino delgado, sugerente de divertículo de Meckel complicado, por lo que se realiza resección intestinal urgente por laparotomía (Figura 1). Tras la cirugía, el paciente permanece estable hemodinámicamente, con valores de Hb de 9.2 g/dl. El estudio histológico confirma un tumor del estroma gastrointestinal (GIST, por su sigla en inglés) (CD34-, CD117+, DOG1+). Al tratarse de un GIST de bajo riesgo de metástasis o recurrencia (tamaño 5 cm, índice mitótico de 2 mitosis/5 mm2, localización en el yeyuno, Ki67 2% y cápsula íntregra tras la resección quirúrgica), se decide no aplicar tratamiento adyuvante y realizar seguimiento del paciente.
Discusión
Los GIST son las lesiones subepiteliales (LSE) malignas (neoplasias estromales/mesenquimales) más frecuentes del tracto gastrointestinal (TGI), aunque constituyen únicamente el 1% de las neoplasias primarias del TGI.
Otras neoplasias mesenquimales son los lipomas, los liposarcomas, los leiomiomas, los leiomiosarcomas y los schwannomas, entre otros.
Aunque su incidencia es difícil de determinar por no existir criterios diagnósticos definidos, oscila alrededor de los 7 a 15 casos por millón de habitantes por año (este porcentaje es mayor si se incluyen los casos de GIST pequeños, entidad subclínica microscópica, recientemente descrita, que hace alusión a los GIST < 1 cm). La edad promedio de presentación es 64 años, y son raros en menores de 40 años. No existe diferencia de sexo a la edad de presentación habitual, pero sí son más frecuentes en el sexo femenino cuando ocurren en la infancia y en la juventud. La mayoría se presenta de forma esporádica, y existe asociación familiar hasta en el 5% de los casos en el contexto de síndromes autosómicos dominantes (síndrome familiar primario de GIST, neurofibromatosis 1, síndrome de Carney-Stratakis).
Estos tumores se originan a partir de las células intersticiales de Cajal, localizadas entre las capas musculares y consideradas las células marcapasos de la motilidad del TGI. La morfología celular de estos tumores es mayoritariamente en forma de huso o patrón fascicular (70%). Existe un 20% de tumores de células epiteliales y un 10% de morfología mixta.
Se asocian en su gran mayoría, con mutaciones en el receptor de tirosina quinasa (KIT; 80%), con lo que se produce la sobreexpresión de este. También existe relación, aunque menos frecuente, con la mutación en el receptor PDGFR-alfa (tumores KIT de tipo salvaje). El perfil inmunofenotípico muestra positividad para los marcadores CD34, CD117/KIT o DOG1 (discovered on GIST1). Casi el 66% de los GIST son positivos para el marcador CD34, sin embargo, este no es sensible ni específico para GIST, dado que es también positivo hasta en el 15% de los leiomiomas. El marcador CD117, también conocido como KIT, es más específico de los tumores GIST y es negativo en leiomiomas y leiomiosarcomas. Hasta el 90% de los GIST son positivos para el marcador CD117, independientemente del estado mutacional del receptor KIT. Por último, el estudio del inmunomarcador DOG1 se lleva en cabo habitualmente en los casos en que los marcadores previos son negativos. En el caso que se presenta, tanto el CD117 como el DOG1 fueron positivos.
La localización más habitual es en el estómago (51%), seguido del intestino delgado (36%), sobre todo en el yeyuno-íleon. Otras localizaciones menos habituales son el colon, el recto y el esófago, y otras aún más infrecuentes, en el retroperitoneo, el mesenterio y el epiplón.
Los GIST son habitualmente asintomáticos. Cuando ocasionan síntomas, las formas de presentación posibles son: distensión y saciedad precoz (secundarias al efecto de masa inducido por el tumor), sangrado del TGI (en forma de melenas, hematemesis o sangrado oculto) hasta en el 50% de los casos gástricos y el 28% de los intestinales, con dolor abdominal y obstrucción intestinal.
Las opciones diagnósticas de estas lesiones consisten en técnicas de imagen como la TC con contraste y la resonancia magnética, así como en técnicas endoscópicas.
La panendoscopia oral permite detectar LSE como bultomas lisos cubiertos de mucosa normal, por lo que es difícil el diagnóstico diferencial con otras LSE. La ultrasonografía endoscópica (USE) permite caracterizar las lesiones descritas en la panendoscopia oral y realizar un amplio diagnóstico diferencial de las LSE al aportar información sobre: 1) la capa de la pared del TGI de la que se origina la lesión, 2) la naturaleza de la lesión (líquida, grasa, sólida, vaso) y 3) el tamaño real, gracias a la imagen móvil (cross-sectional image). Desde el punto de vista ecoendoscópico, los GIST se presentan como masas sólidas hipoecogénicas localizadas en la capa 4 del TGI o, menos frecuentemente, en la capa 2. Además, permite tomar muestras de la lesión para estudio histológico e inmunogénico mediante la técnica de punción y aspiración con aguja fina (PAAF). Sin embargo, en un pequeño número de casos y debido a la forma de presentación (como ocurre en nuestro paciente), es necesaria la cirugía para conseguir el diagnóstico.
En cuanto al pronóstico de estas lesiones, todos los GIST son potencialmente malignos. Por ello, existen clasificaciones (modelos pronósticos) que estratifican las lesiones en función del riesgo de recurrencia y metástasis: clasificación modificada de Fletcher (basada en las variables tamaño e índice mitótico), clasificación de Miettinen (que añade la variable localización de la lesión) y el sistema de estadificación TNM. También existen métodos para cuantificar dicho riesgo en forma de variables continuas (nomogramas) y para ejemplificarlo de una forma más visual y así accesible al paciente (mapas de contorno que incluyen la integridad del tumor, el tamaño, el índice mitótico y la localización).
El tratamiento de estas lesiones incluye desde la opción quirúrgica hasta la quimioterapia. La cirugía erradicadora (ya sea por vía laparoscópica o por laparotomía) es el tratamiento estándar y curativo de los GIST primarios localizados mayores de 2 cm. No existe consenso sobre el abordaje de los GIST de menor tamaño, dado que su crecimiento y su potencial metastásico es desconocido, por ello, se recomienda un tratamiento individualizado en estos casos. Algunos expertos recomiendan el seguimiento endoscópico de estas lesiones hasta que alcanzan los 2 cm o provocan síntomas. Otras guías clínicas apoyan la resección quirúrgica cuando una LSE es inmunohistológicamente diagnosticada como GIST, incluso si es menor de 2 cm.
Si existe diseminación a distancia (GIST metastatizado, sobre todo en hígado o peritoneo) el tratamiento de elección son los fármacos inhibidores de la tirosina quinasa (imatinib como primera línea, sunitinib como segunda y regorafenib como tercera), sin intención curativa. En estos casos, la biopsia del tumor es necesaria para confirmar el diagnóstico y establecer su genotipo (para poder determinar si existe mutación en el gen del receptor KIT y valorar si serán útiles dichos fármacos). El imatinib también se emplea en adyuvancia (durante más de 36 meses) tras la cirugía de tumores de riesgo alto de metástasis o recurrencia, y en neoadyuvancia (durante 10 a 12 meses) en tumores potencialmente resecables, en tumores de localizaciones atípicas o en aquellos localmente avanzados (aunque sin metástasis a distancia), cuya progresión local lo hace irresecable. Además, la cirugía citorreductora y la resección completa de metástasis residuales ha demostrado, en estudios retrospectivos únicamente, mejoría de la supervivencia en casos de buena respuesta inicial a imatinib.
Por último, el objetivo del seguimiento de estas lesiones es la detección y el tratamiento precoz de la posible recurrencia (local, metástasis hepática o peritoneal), para lo cual es útil el empleo de TC abdómino-pelviana con contraste. La frecuencia de seguimiento no está bien establecida, pero siempre se llevará a cabo en función del riesgo de metástasis o recurrencia durante más de 10 años, en los casos posquirúrgicos.
En conclusión, los GIST son los tumores estromales malignos más frecuentes del TGI. El estudio histológico es determinante para su diagnóstico y para diferenciarlos de otras lesiones intestinales, permitiendo así evitar el retraso diagnóstico de neoplasias que pudieran requerir tratamiento adyuvante.