Introducción
Colombia enfrenta problemáticas de contaminación ambiental, causadas por abuso de sustancias químicas en explotación minera, especialmente oro, actividad que representa el principal foco de contaminación por mercurio (Hg). Este Hg desemboca por escorrentía a los cuerpos de agua por su uso en los pequeños molinos de bolas, lavados y amalgamación 27,38.
Según los reportes de la Agencia Nacional de Minería, Colombia ha presentado un aumento en la producción de oro, ya que en 2013 se produjeron 66 toneladas de oro, 6% por encima de la meta oficial; respecto al segundo periodo del presente año (2020) se reportó una producción de 76 toneladas, 16% por encima de la meta.
Ello fue debido a que las instituciones o entidades que regulan la actividad minera no logran recopilar la información esencial sobre las metodologías de extracción, la forma y cantidad en que el Hg es empleado para la explotación aurífera informal de los yacimientos en las diferentes regiones del país, como: Antioquia, Bolívar, Cauca, Chocó, Caldas, Córdoba, Nariño, Risaralda y Tolima 1,27.
El Hg es producido naturalmente por volcanes, sedimentos oceánicos, desgasificación de la corteza e incendios forestales, y antropogénicamente por la fabricación de cloro alcalinos, combustión de combustibles fósiles y minería del oro 2.
El Hg se encuentra como metal líquido o como catión, ya sea Hg0o Hg2 2+, formando diversos compuestos, teniendo propiedades distintas en función de su estado. En el medio ambiente, exceptuando la atmósfera, el Hg se encuentra en forma de sales mercúricas inorgánicas y compuestos organo-mercuriales. Los compuestos de mercurio más comunes en el medio ambiente son: las especies inorgánicas Hg(ll), HgCl2, Hg (OH)2, HgS y compuestos de metilmercurio: CH3HgCl y CH3HgOH (ATSDR 2; Gaona 19, Sanchez 33).
El metil-mercurio (MeHg) es problemático por su bioacumulación y bio-magnificación en peces de agua dulce y salada y en mamíferos acuáticos2. En cuanto a la toxicidad de las diferentes especies de mercurio, la pared intestinal actúa como barrera para formas inorgánicas, aunque sin embargo es permeable al MeHg.
El MeHg, al tener contacto con el organismo, inicia el proceso de bio-acumulación y bio-magnificación del metal, dándose preferentemente en el tejido muscular en proporciones de hasta 50% de la dosis total de mercurio circulante, también puede darse por el sistema respiratorio y/o por vía cutánea 19,26,38 .
El movimiento del MeHg en la fauna silvestre se da por la cadena trófica, las especies u organismos pequeños lo acumulan y este pasa a especies más grandes cuando son ingeridos, la mayor parte del MeHg acumulada en la especie pequeña se bio-acumulará en la especie más grande (ASTDR, 1999)2 , el proceso se beneficia por el tiempo de vida que puedan tener las especies contaminadas porque aumenta el nivel de Hg en la cadena trófica.
De acuerdo a investigadores 37, los animales pueden purgar sus cuerpos del Hg bio-acumulado a través de la orina, las heces, la expiración y el aliento, o secuestrándolo en componentes corporales inertes como el pelo, las plumas, las garras, las conchas y el caparazón; las hembras pueden eliminar Hg cuando depositan sus huevos o dan a luz las crías, mecanismo no disponible para los machos 7,11,25.
La tortuga Trachemys scripta elegans (Tse) es una tortuga exótica de agua dulce proveniente de Norteamérica que se encuentra activa en pisos térmicos cálidos (entre 10 y 37°C) y una temperatura del aire y agua entre 22 y 26°C 32. En Colombia, Tse es categorizada como especie invasora debido a su comercialización como mascota a nivel local, convirtiéndola en un ani mal amenazante para las especies autóctonas del país, debido a su potencial colonizador 32.
Tse es considerada una especie centinela de contaminación ambiental debido a su longevidad y susceptibilidad a la bioacumulación de xenobióticos, y a que sus eritrocitos nucleados (RBCs) poseen una alta afinidad por MeHg, el cual se une a grupos tioles (SH) y a moléculas de bajo peso molecular que circulan en el plasma. De acuerdo con este comportamiento y la baja tasa metabólica de las tortugas, el MeHg puede bio-acumularse y bio-magnificarse en órganos como el hígado, el cerebro, los riñones y los músculos de las tortugas 8,40.
El objetivo del estudio fue determinar la citotoxicidad y genotoxicidad in vitro en eritrocitos de tortugas Trachemys scripta elegans producido por exposición aguda a diferentes concentraciones de MeHg. Se determinó adicionalmente la viabilidad y la concentración letal media (CL50), y se registraron anormalidades citológicas.
Material y métodos
Toma de muestras
Se recolectaron muestras de sangre total de la aleta dorsal de 2 tortugas Trachemys scripta elegans (Tse) procedentes del Centro de Rehabilitación y Rescate de Fauna Silvestre de la Universidad Nacional de Colombia (URRAS). Para la toma de la muestra se empleó jeringa estéril de 5 mL y dos tubos heparinizados de mL BD Vacutainer®. Las muestras fueron llevadas al Laboratorio de Biología Molecular del Departamento de Ciencias Biológicas y Ambientales para ser almacenadas a 4°C en la Universidad Jorge Tadeo Lozano.
Aislamiento y pre-adaptación de eritrocitos
Los eritrocitos (RBCs) de tortugas Tse fueron aislados por centrifugación a 3500 rpm por 5 minutos a 4°C. Residuos de plasma y buffy coat fueron removidos. El pellet de RBCs resultante fue lavado cinco veces con buffer fosfato solución salina (PBS 0.9% pH 7.4). Alícuotas con 20 μL de RBCs fueron resuspendidas en 980 μL de Medio Mínimo Esencial (MEM) (Gibco, Grand Island, NY, USA) suplementado con bicarbonato de sodio, 13% de suero fetal bovino (SFB), y 1% de antibiótico penicilina/ estreptomicina (100 mg/L, penicilina, 10 mg/L, estreptomicina) (MEM-S). Los RBCs fueron preadaptados por 24 h a 30°C y luego utilizados en los bio-ensayos.
Bio-ensayos
Se preparó una solución stock de 1000 m g L-1 de MeHg (Sigmal Aldrich) diluyendo el mercurio orgánico (cloruro de metil-mercurio, CH3HgCl) en una solución de DMSO al 1%. A partir de esta solución stock se prepararon en solución salina estéril 0,85% siete soluciones de MeHg, en concentraciones finales de 0,5, 0,7, 1, 10, 20, 50 y 100 m g L-1, las cuales fueron utilizadas para los bio-ensayos. Luego, 1.69 x 106RBCs de Tse fueron expuestos in vitro a concentraciones de 0, 0,5, 0,7, 1, 10, 20, 50 100 m g L-1 MeHg a 30°C en medio MEM-S y se evaluó la viabilidad de las células a las 24 y 96 h. Se determinó la CL50 a las 96 horas de ex posición y se realizaron 5 réplicas por tratamiento en alícuotas de 200 μL.
Evaluación de citotoxicidad y cálculo de CL50
En tubos Eppendorf de 100 μL se mezclaron de forma individual 10 μL de RBCs provenientes de cada uno de los tratamientos del bioensayo y se mezclaron con 10 μL de azul tripán al 0.4% (v/v) (Sigma-Aldrich; Merck KGAa) 29. Las mezclas individuales de RBCs-azul tripán se incubaron por 5 min a temperatura ambiente, y después, una alícuota de 10 μL de cada una de las mezclas fue servida en cámara de Neubauer (Zeiss, Oberkochen, Germany). Los RBCs viables y no viables fueron contados utilizando un microscopio Leica DM750 (Leica Microsystems, Heerbrugg, Switzerland) con un lente de 40X de magnificación. El porcentaje de viabilidad se calculó utilizando la siguiente fórmula: (células vivas / (células vivas + muertas)* 100). Con base en los datos de viabilidad registrados en cada uno de los grupos experimentales (0, 0,5, 0,7, 1, 10, 20, 50 100 m g L -1MeHg) en el bioensayo, se determinó la CL50 utilizando regresión lineal Probit, empleando el paquete estadístico MASS diseñado para software libre Rwizard 21.
Identificación de anormalidades citológicas
Alícuotas de 10 μl de RBCs provenientes de cada uno de los grupos experimentales del bioensayo fueron extendidos en láminas portaobjetos y teñidos con Giemsa al 20% y formaldehído al 16%. Se registraron anormalidades nucleares y citoplasmáticas utilizando un microscopio Leica DM750 (Leica Microsystems, Heerbrugg, Switzerland) con una lente de 40X de magnificación.
Evaluación de la genotoxicidad. Extracción del ADN
A las 96 horas se extrajo ADN de los RBCs de Tse sometidos a siete concentraciones de MeHg (0,5, 0,7, 1, 10, 20, 50, 100 m g L -1) y el control negativo y el control de citotoxicidad (DMSO 1%) con el kit GF-1 Blood DNA Extraction Kit (Vivantis, No. Cat. GF-BD-050) el cual emplea una metodología de membrana de sílica gel para extracción de ADN. A los RBCs de los controles (CN y DMSO1%) y las siete concentraciones de MeHg se agregó 200 μL de buffer BB más 20 μL de Proteinasa K y 200 μL de etanol absoluto al 100%. Posteriormente, se transfirió la muestra a una columna de Sílica Gel y se centrifugó a 5000 g por un minuto eliminando el sobrenadante. Luego se lavó la columna con 500 μL de Wash Buffer 1 y se centrifugó a 5000 g por un minuto eliminando el sobrenadante, se realizó un segundo lavado adicionando 500 μL de Wash buffer 2 y se centrifugó a 5000 g por un minuto eliminando el sobrenadante. Adicionalmente se realizó un tercer lavado con 500 μL de Wash Buffer 2 y se centrifugó a 1200 rpm por tres minutos. El ADN extraído se transfirió a un tubo eppendorfy se adicionó 100 μL de Elution Buffer; cada extracción se dejó a temperatura ambiente por dos minutos, posteriormente se centrifugó a 5000 g por un minuto y se almacenó a 4°C. Para verificar la integridad del ADN extraído, se realizó electroforesis en gel de agarosa al 1% en tampón TBE 0.5X y se tiñó con bromuro de etidio. La electroforesis corrió a 100 voltios por 45 min en cámara de electroforesis Gel XL ultra V-2 (Labnet International, Inc. Bioscience Research®, Nueva Jersey, EE. UU). El DNA se cuantificó y la pureza fue determinada utilizando el equipo NanoDrop 1000 Spectrophotometer y el programa ND-1000 V3.7.1 (Thermo Scientific®, Denver, EE.UU.).
Estandarización de las condiciones de PCR para polimorfismos de ADN amplificados al azar (RAPDs)
Para la estandarización de la temperatura y concentración de cloruro de magnesio (MgCl2) se realizaron dos PCR con el control negativo (RBCS+MEM) y 6 Primers OPA1 (CAGGCCCTTC), OPA5 (AGGGG- TCTTG), OPA7 (GAAACGGGTG), OPA8 (GTGACG- TAGG), OPA13 (CAGCACCCAC) y OPA17 (GAC-CGCTTGT) (Kit A, Operon RAPD 10mer Kit, Cosmo Genetch, Seoul Corea), empleando una master mix primer con temperatura de anillamiento de 37°C, dos concentraciones de MgCl2(1,5 y 2,5 mM), Buffer 10X, Taq polimerasa 1 Unit, primer 0,5 μM, dNTPS 200μM. El corrido electroforético se realizó en gel de agarosa al 2.5% en una cámara de electroforesis Gel XL ultra V-2 (Labnet International, Inc. Bioscience Research, Nueva Jersey, EEUU.) por 1 h a 135 voltios.
Polimorfismos de ADN amplificados al azar (RAPD-PCR)
Se evaluó el daño genotóxico mediante marcadores RAPD-PCR de tipo fenotípico (cualitativo - semi cuantitativo) que amplifican al azar diferentes regiones del genoma. Se utilizaron los primer-oligo nucleótidos OPA 1 y OPA 5 (Kit A, Operon RAPD 10mer Kit, Cosmo Genetch, Seoul Corea) con una master mix por primer empleando 5 ng/10 μL de ADN templado con temperaturas de anillamiento de 38 y 39 °C, 2.5 y 3 mM de MgCl2, buffer 10X, Taq polimerasa 1 Unidad, primer 0,5 μM, dNTPS 200 μM. Se empleó el marcador de peso (Mp) Hyper Ladder 1Kb (Bioline) el corrido electroforético se realizó en gel de agarosa al 2,5% en una cámara de electroforesis Gel XL ultra V-2 (Labnet International, Inc. BioscienceResearch, Nueva Jersey, EEUU.) por 40 minutos a 135 voltios. Para la lectura de los geles se empleó el programa Gel Analizer V19.1, y así visualizar las bandas y estimar el peso molecular; a partir de las bandas generadas se construyó una matriz binaria de presencia (1) y ausencia (0), con la cual se calcularon el porcentaje de polimorfismos P=(a/n)xl00 (a= número de bandas polimórfi- cas detectadas en cada una de las concentraciones de MeHg, n= total de número de bandas en las células no tratadas con MeHg), el índice de estabilidad genética (GST) GST=(1-a/n)x100 (a= es el número promedio de las bandas polimórficas detectadas en cada una de las concentraciones de MeHg, n= el número de bandas totales en las células no tratadas con MeHg)4, el índice de disimilitud de Jaccard (dJSC) y un dendrograma con los paquetes estadísticos Vegan y StatR para software libre Rwizard V.4.3.
Resultados
Citotoxicidad y CL50 Se observaron valores de viabilidad a las 24 h de incubación de 99.1 al 100% a concentraciones de 0,5, 0,7, 1, 10 m g L -1 de MeHg; de 90 % a 20 m g L -1 MeHg y de 53 a 57 % a 50 y 100 m g L -1 de MeHg. A las 96 h la viabilidad se mantuvo entre el 91.3 al 100% a 0,5, 0,7 1, y 10 m g L -1 de MeHg y se mantuvo de 20 a 0% a 20, 50 y 100 m g L -1 de MeHg. (Figura 1). La CL50 se determinó en 22,55 m g L -1 de MeHg con un intervalo de confianza del 95 %.
Anormalidades citológicas: A las 24 h de tratamiento en concentraciones de 0,5, 0,7 y 1 m g L -1 de MeHg se observó RBCs sin irregularidades en estructura y forma celular. A las concentraciones de 10, 20, 50 y 100 m g L -1 de MeHg se presentan formas de medialuna, inclusiones citoplasmáticas similares a cuerpos de Heinz, desplazamiento de núcleo y destrucción del citoplasma. A las 96 h de tratamiento en concentraciones de 0,5, 0,7, 1 y 10 m g L -1 de MeHg se observó desvanecimiento y/o ruptura de la membrana; a diferencia de las concentraciones de 20, 50 y 100 m g L -1 de MeHg que predomina la lisis o destrucción celular (Figura 2).
Genotoxicidad. Extracción y cuantilicación del ADN. Se obtuvo ADN íntegro sin signos de degradación o fragmentación, con una concentración de 5,4 a 29,8 ng/pL y una pureza en DO de 260/280 de 1.7 a 2.0.
Estandarización de las condiciones de PCR para polimorfismos de ADN amplificados al azar (RAPDs). Se evaluó la amplificación de seis primers OPA 1, 5, 7, 8, 13 y 17, con dos concentraciones de MgCl2 (1,5 y 2,5 mM) a 37°C. De acuerdo a la intensidad y nitidez de las bandas observadas en la electroforesis de los pro ductos de PCR con los 6 primers (Figura 3),se seleccionaron para evaluación de los RAPD los primers OPA 1 y 5 estableciendo las condiciones para la PCR para cada uno de estos primers con las muestras de ADN extraído de RBCs sometidos a las concentraciones de 0,5, 0,7, 1, 10, 20, 50, y 100 m g L -1 de MeHg.
Marcadores RAPD-PCR. Los marcadores RAPD-PCR produjeron bandas claras y legibles que permitieron realizar la evaluación de los RBCs sometidos a diferentes concentraciones de MeHg. El polimorfismo se determinó por cuantificación de las bandas monomórficas y polimórficas. Se identificaron todas las bandas existentes en el conjunto de muestras y con base en la matriz de presencia y ausencia el primer OPA1 (Figura 4 A1) produjo 14 bandas (2 monomórficas y 12 polimórficas) con un tamaño de 350 a 2000 pb y un polimorfismo de 85%. El OPA5 (Figura 4 B1) produjo 8 bandas (4 monomórficas y 4 polimórficas) con tamaños de 300 a 1350 pb y 0% de polimorfismo.
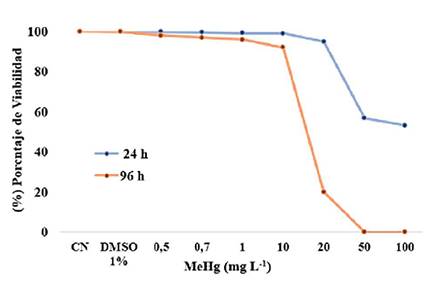
Figura 1 Viabilidad de eritrocitos de la tortuga Trachemys scripta elegans sometidos a concentraciones agudas de MeHg, y cuantificados a las 24 y 96 h de tratamiento. Se observa a las 96 h el 100% de mortalidad de los eritrocitos en concentraciones de 50 y 100 mg L-1 de MeHg. CN: control negativo, DMSO 1%: control negativo con dimetil sulfóxido al 1% en agua.
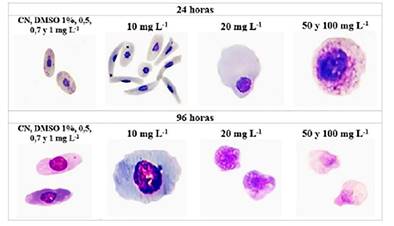
Figura 2 Anormalidades citológicas en RBCs de Trachemys scripta elegans post tratamiento a las 24 y 96 h. A las 96 h a 0,5, 0,7, 1 y 10 mg L-1 de MeHg se identificó pérdida de la relación de núcleo y citoplasma y desvanecimiento de la membrana. Tinción Giemsa al 20 %, y observación en microscopio de luz 100X.
Perfiles electroforéticos de marcadores RAPD-PCR generados a partir del ADN de RBCS de Trachemys scripta elegans sometidos in vitro a concentraciones agudas de 0,5, 0,7, 1, 10, 20, 50 y 100 mg L-1 de MeHg (Carril 4 - 10) incluyendo el Mp, control negativo y control citotoxicidad (Carril 1 - 3). A: primer OPA 1 que presentó 11 bandas (4 monomórficas y 7 polimórficas) con tamaños entre 400-2000 pb. A1: Interpretación del perfil electroforético de marcadores RAPD-PCR utilizando el primer OPA1. B: OPA5 presentó 8 bandas (4 monomórficas y 4 polimórficas) con tamaños entre 450-1700 pb B2: Interpretación del perfil electroforético de marcadores RAPD-PCR utilizando el primer OPA5.
Se identificó la presencia de una banda para el OPA1 en los RAPDs de DNAs provenientes de las muestras con concentraciones de 0,5, 0,7 y 1 m g L -1 de MeHg (2 bandas) y en la muestra de concentración de 100 m g L -1 de MeHg (1 banda). El primer OPA5 presentó una banda en los RAPDs en los DNAs provenientes de las muestras con concentraciones de 0,5, 0,7, 50 y 100 m g L -1 (1 banda). Se observaron ausencia de cinco bandas para el primer OPA1 en los DNAs provenientes de las muestras con concentraciones de a 0,5 y 0,7 m g L-1 de MeHg , cuatro bandas para la concentración de 1 m g L -1 seis bandas para 10 m g L -1, entre siete y ocho bandas en 20 y 50 m g L -1 y nueve bandas en 100 m g L -1 de MeHg. Para el primer OPA5 ausencia de una banda en los RAPDs de las concentraciones de 0,5, 0,7, 1, 10, 20 y 50 m g L -1, tres bandas en 100 m g L -1. (Fig.4A1-4B1).
La estabilidad genética (GST=(1-a/n) X 100)4 establecida con base en el perfil polimórfico de los marcadores RAPDs, frente a los controles con 100 % de GST disminuyó a 64% en las concentraciones de 0,5, 0,7 y 1 m g L -1 de MeHg, a 57% en 10 m g L -1 de MeHg, a 50% en 20 y 50 m g L -1 de MeHg y 42% a 100 m g L -1 de MeHg.
El dendrograma construido con base en la matriz disimilitud del coeficiente de Jaccard (dJSC) que mide la disimilitud entre un grupo de datos, es una comparación entre los RBCs tratados y no tratados con MeHg, que muestra distancias desde 0 a 0,64 (Tabla 1) asociados en 4 grupos: A.(Control negativo y control de citotoxicidad (DMSO 1%) (0,0)), B.(0,5, 0,7y 1 m g L -1 (0,4-0,47)), C.(10, 20 y 50 mg-L-1 0,35-0,5)), D. (100 mg-L-1 de MeHg (0,63)). La distancia del grupo B frente al grupo A, es menor que en el grupo C y D por presentar elevado número de polimorfismos, siendo el grupo D el de mayor disimilitud genética (Figura 5).
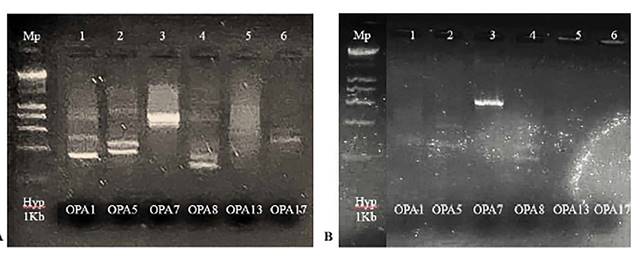
Figura 3 Estandarización de temperatura y concentración de cloruro de magnesio (MgCl2) para seis primers OPA1, OPA5, OPA7, OPA8, OPA13 y OPA17 (Carril 1 - 6) (Kit A, Operon RAPD 10mer Kit, Cosmo Genetch, Seoul Corea). A: corrida electroforética de los 6 primers a MgCl2 1,5 mM. B. Corrida electroforética de los 6 primers a MgCl2 2,5 mM con temperatura de annea ling de 37°C. El corrido electroforético en gel de agarosa al 2.5% por 1 h a 135 voltios.
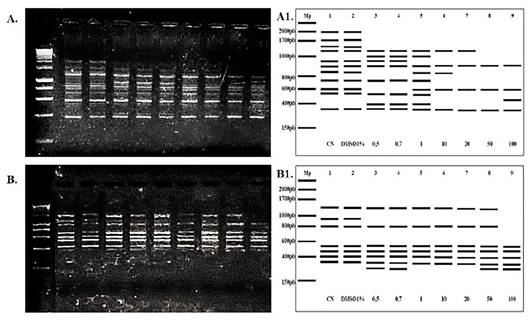
Figura 4 Marcadores RAPDs generados a partir de ADN de RBCs de Trachemys scripta elegans sometidos in vitro a MeHg (mg L-1).
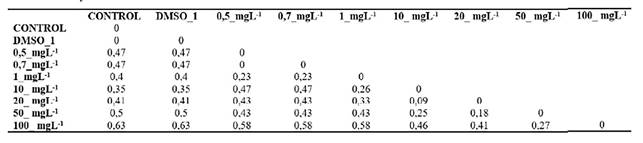
Tabla 1 Matriz de disimilitud del coeficiente de Jaccard de RBCS de Trachemys scripta elegans sometidos in vitro a MeHg. Obtenida con la matriz de presencia y ausencia de bandas producidas por los marcadores RAPD-PCR que muestra la disimilitud entre los controles y los RBCs sometidos in vitro a concentraciones agudas de 0,5, 0,7, 1, 10, 20, 50 y 100 mg L-1de MeHg con una distancia de 0 a 0.63, siendo 50 y 100 mg L -1 las concentraciones de mayor disimilitud.
Discusión
En este estudio empleamos concentraciones agudas de MeHg para estresar RBCs de la tortuga Trachemys scripta elegans. Los RBCs representan un excelente modelo experimental para estudios de ecotoxicología.
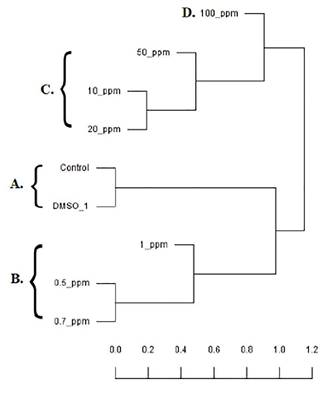
Figura 5 Dendrograma construido con base a la matriz de disimilitud del coeficiente de Jaccard de los RBCS de Trachemys scripta elegans sometidos in vitro a concentraciones agudas de MeHg, que indican la asociación en 4 grupos: A (control negativo y control de citotoxicidad (DMSO 1%)); B (RBCS con 0,5; 0,7y 1 mg L -1); C (RBCS con 10, 20 y 50 mg L-1); D (RBCS con 100 mg L-1de MeHg).
En estudios realizados en RBCs de mamíferos (humanos, ratones y delfines) sometidos a MeHg describen que el metal se ancla a las membranas, ingresa al RBC e interactúa con los grupos sulfhidrilos presentes en residuos de cisteína en la cadena β1 de la hemoglobina. Gracias a esta unión el MeHg alcanza un equilibrio con rapidez en sangre con una relación del 98.1% en RBCs y 1.9% en plasma 3,18 .
Los RBCs de Tse poseen isoformas de hemoglobina con número elevado de residuos de cisteínas (3 residuos por cadena b), lo que le da mayor facilidad al metal de unirse a los enlaces SH, que en condiciones ambientales donde se presentan las formas disueltas del mercurio en altas concentraciones ocasiona que estas tortugas cuando entran en contacto sean más resistentes y lo acumulen en los RBCs 14,30.
Lo anterior permite entender el proceso de ingreso y/o interacción de los RBCs sometidos a MeHg durante el estudio. La viabilidad de los RBCs de Tse está condicionada por las concentraciones de MeHg (0,5 100 mg-L-1) y el tiempo de exposición. Al determinar la CL50 en 22,55 mg-L-1 de MeHg a 96 h de exposición, se corrobora la disminución en la viabilidad en un 80- 100% en concentraciones de 20, 50 y 100 mg-L-1 de MeHg.
En comparación con estudios publicados 15, empleando linfocitos de Caretta caretta sometidos a 0,5-1 mg-L-1 de MeHg, reportó viabilidad disminuida frente a concentraciones de 0,1 y 0,35 mg-L-1 de MeHg, arrojando una CL50 de 0.08 mg-L-1 MeHg a las 136 horas.
De otra parte, algunos 28 emplearon leucocitos de Sparus aurata (Pez dorado) y Dicentrarch uslabrax (Pez lubina) obteniendo una CL50 de 2,40 mg-L-1 y 98,5 mg-L-1 de MeHg a las 24 h respectivamente.
Igualmente, otros10 evaluaron in vivo RBCs de Cyprinus carpio (Carpa común) y obtuvieron una CL50 de 0.1 mg-L-1 de Hg a 96 h de tratamiento. Según el Decreto 3930 de 2010 para la preservación de flora y fauna se permite hasta 0.01 mg-L-1 de HgT en fuentes hídricas 17, de acuerdo con la CL50 y la viabilidad determinadas para RBCs de Tse, la CL50 supera en gran medida las concentraciones límites de los estudios citados anteriormente y las estipuladas en la legislación colombiana.
Las anormalidades citológicas observadas en los RBCs de Tse a las 24 y 96 h a 0,7, 1, 10 m g L -1 de MeHg como formas de media luna e inclusiones citoplasmáticas semejantes a cuerpos de Heinz (que son la precipitación de hemoglobina inestable), sugieren que pueden ser provocadas por la oxidación de la hemoglobina debido a la acción de la albúmina y el glutatión que reaccionan con el MeHg rompiendo la unión con los grupos SH inhibiendo a la G6PD produciendo meta- hemoglobina perturbando la distribución intracelular y de la membrana.
El efecto fue observado en estudios realizados36, donde expusieron eritrocitos in vitro de ratones y humanos a concentraciones de 0,02 m g L-1 de MeHg. En la tortuga boba (Caretta caretta) se han reportado inclusiones citoplasmáticas con descripciones idénticas a los cuerpos de Heinz humanos (que son la precipitación de hemoglobina inestable), considerando que la hemoglobina de las tortugas es menos estable que la humana, los contaminantes oxidan la hemoglobina generando los cuerpos de inclusión, los RBCs con las inclusiones citoplasmáticas presentaban alteraciones en el tamaño, y forma celular como crenulación de la membrana ce lular 5.
Los RBCs de Tse sometidos a concentraciones de 20, 50 y 100 m g L -1 de MeHg a 24 y 96 h presentaron cambios de desplazamiento de núcleo, desvanecimiento y/o ruptura de membrana hasta lisis celular. De acuerdo con algunos investigadores 24, el mantenimiento de la forma elipsoidal se afecta por la interacción del MeHg con los grupos SH en los dímeros de tubulina necesarios para el mantenimiento de los microtúbulos presentes en la banda marginal de los RBCs de la tortuga, debido a que el metal promueve la despolimerización a exposiciones bajas y altas 22,39.
Las interacciones del ADN con los contaminantes son causadas, al parecer, por inhibición de la síntesis y/o reparación de ADN, por acumulación de especies reactivas de oxígeno (ROS) formadas por la acción del MeHg que se une al GSH, agotando el sistema antioxidante, el acoplamiento del MeHg a la guanina y citosina, uniéndose al nitrógeno del grupo amino dando como producto ácido clorhídrico produciendo un mal emparejamiento de las bases y fragmentando el ADN 23.
En ecógeno-toxicología, para detectar la genotoxicidad se emplean los RAPDs por medio de diferencias en los perfiles del ADN de individuos tratados y no tratados con agentes genotóxicos 13,31,34. Los marcado res moleculares dominantes RAPD-PCR empleados en este estudio evalúan la presencia, ausencia de bandas y con ello los cambios en el ADN producidos por el xenobiótico al cual las células son expuestas. Los RAPDS requieren de poco material genético, primers cortos (10 pb) temperaturas bajas de annealing, alta pureza y baja concentración del ADN 6,16.
La estabilidad genética (GST) se relaciona con la extensión del daño del ADN además de la eficiencia en la reparación y replicación del mismo, es decir el alto nivel de daño en el ADN inducido por el tóxico no disminuye obligatoriamente la GST total, no obstante, los cambios puntuales pueden alterar esta medida 31. La GST en los RBCs de Tse sometidos a concentraciones bajas de MeHg presentaron niveles mayores al 50 %, mientras que a dosis medias se mantiene mayor o igual al 50 % pero a dosis altas es menor al 50 %.
La dJSC mostró una disimilitud entre los controles y las concentraciones de MeHg de 0 a 0,61, indicado en el dendrograma como la distancia entre los grupos A y B, que la disimilitud es menor al comparar concentraciones bajas (0,4 a 0,47), mientras que los grupos C y D presentaron mayor disimilitud (0,5 a 0,63), por su elevado número de polimorfismos, siendo el grupo D con mayor disimilitud genética frente al grupo A. Los resultados presentados no son comparables con otros estudios en la literatura.
Esta investigación es pionera en la determinación in vitro de los efectos citotóxicos y genotóxicos producidos por el metil-mercurio en los RBCs de la tortuga Trachemys scripta elegans, ya que los estudios encontrados sobre los efectos del mercurio son realizados en células leucocitarias, líneas celulares, tejidos de peces, mamíferos y humanos9,12. La evaluación ecotoxicológica se hace necesaria a través de bioensayos in vitro con RBCs y de esta manera evitar métodos invasivos o el sacrificio de los animales para la obtención de muestras.
Las tortugas representan un modelo para estudios de toxicología, son especies centinelas debido a su longevidad y la bio-acumulación y bio-magnificación de los contaminantes ambientales, brindando información del comportamiento de las células in vivo frente a exposiciones ambientales 35,20.
La simplicidad y la versatilidad en la manipulación de los RBCs junto al limitado volumen de desechos sirven para ejecutar investigaciones futuras de reptiles en eco-toxicología de metales pesados que están presentes hoy en día en el medio ambiente, fomentando planes y proyectos para manejo y conservación de especies.
Conclusiones
Este es el primer estudio que utiliza los RBCs de la tortuga Trachemys scripta elegans en la determinación de citotoxicidad y genotoxicidad mostrando que representan un invaluable modelo in vitro para estudios de ecotoxicología con MeHg y otros xenobióticos. En el bioensayo la viabilidad de los RBCs de Trachemys scripta elegans sometidos a MeHg disminuye más del 50 % a partir de 22.55 m g L -1(CL50) a las 96 h de exposición.
A medida que aumenta la concentración de MeHg se observan anormalidades citológicas generadas por la citotoxicidad del metal en los RBCs de Trachemys scripta elegans. La genotoxicidad evaluada revela elevado porcentaje de polimorfismos, disimilitud y deses tabilidad genética significativa en los RBCs a medida que se eleva la concentración de MeHg.














