Introducción
La mejora genética del ganado vacuno en todo el mundo ha sido, y seguirá siendo, un importante motor de la sostenibilidad de la agricultura animal. Esta tecnología ha intensificado la producción ganadera mundial y ha reducido notablemente el intervalo generacional, que es un factor muy importante en el mejoramiento genético (Ferré et al. 2020). Asimismo, los avances recientes en biotecnología, impulsados por mejoras en técnicas como la fertilización in vitro y el cultivo de embriones (Sirard 2018, Simões et al. 2021, Mueller et al. 2022), han permitido la reproducción masiva de líneas genéticamente superiores y han abierto nuevas posibilidades en el campo de la investigación, como es el caso de la utilización de semen sexado (SX) en la ganadería.
La utilización del sistema de sexaje (SS) junto con otras biotecnológicas reproductivas maximiza sus ventajas y, al mismo tiempo, contribuye a reducir sus costos al lograr el “producto” deseado (ya sea hembras o machos), lo que en consecuencia puede dar como resultado un incremento de la mejora genética en el sector lácteo (Filipiak et al. 2017, Maicas et al. 2020).
De esta manera, la producción de embriones in vitro ha experimentado un gran avance en los últimos tiempos (Sovernigo et al. 2017), que combinada con el uso de semen sexado (SX), está dando gran éxito en Norteamérica, Sudamérica y Europa (Ferré et al. 2020). En el mismo contexto, los laboratorios de producción in vitro de embriones (PIVE), utilizan SX en condiciones similares al semen convencional, es por lo que en EE. UU. y Europa la aplicación de SX es muy utilizado en procedimientos como la inseminación artificial, transferencia de embriones y producción de embriones, ya que presenta una eficacia que oscila entre el 75 y el 80%, en contraste con el semen convencional (Sá et al. 2015).
A finales de los años ochenta, la obtención de cientos de embriones por experimento utilizando material de matadero era una posibilidad real (Salgado et al. 2005). Sin embargo, con el tiempo se ha desarrollado la técnica de Ovum pick up, que es una técnica que implica la extracción de ovocitos directamente de los ovarios de una vaca, que luego se utilizan para la producción de embriones in vitro (Bhoopendra et al. 2022). Además, es importante mencionar que los ovocitos necesitan condiciones de cultivo óptimas, a pesar de que los primeros medios usados en gran medida se han mantenido iguales durante más de 30 años, se han desarrollado nuevos métodos como el co-cultivo en lugar de la gestación en oviductos y el uso de fluidos sintéticos enriquecidos con aminoácidos para el desarrollo de embriones (Sirard 2018).
Hay que recordar que los espermatozoides no están listos para fertilizar inmediatamente después de la eyaculación, por lo que es necesario que pasen por cambios previos, conocidos como “capacitación”, para adquirir la “capacidad fertilizante” (Chang 1951). La capacitación solo ocurre después de que el espermatozoide ha pasado un tiempo determinado en el tracto reproductivo femenino, conocido como “residencia espermática” (Ormachea et al. 2019).
La capacitación espermática se caracteriza por una secuencia de modificaciones bioquímicas y fisiológicas. Estas transformaciones permiten que el espermatozoide complete su maduración y supere las barreras fisiológicas presentes en el tracto reproductivo femenino. De esta manera, adquiere la aptitud necesaria para llevar a cabo los pasos cruciales para la fertilización del óvulo, incluyendo procesos como la hiperactivación y la reacción acrosomal (Rasmussen et al. 2013). Es posible inducir la reacción acrosomal en un entorno controlado fuera del cuerpo, empleando diferentes métodos. Estos incluyen la utilización de fuerzas iónicas aumentadas, la incorporación de ionóforos de calcio (Ca²+), la presencia de cafeína, incubación prolongada durante 18 a 24 horas, condiciones de pH elevado y procedimientos de lavado a través de gradientes de Percoll o el medio B.O (Sánchez 2014).
Entendiendo que la capacitación espermática in vivo es regulada, se puede obtener una mayor comprensión de la fisiológica y el desarrollo de las técnicas específicas utilizadas en la fertilización in vitro (FIV), y otras técnicas similares, es por ello que la heparina fue la primera sustancia de capacitación espermática usada para FIV a principio de 1984, aunque no está presente en el oviducto, podría imitar algunos constituyentes del fluido folicular como los proteoglicanos (Salgado et al. 2005).
Se han desarrollado diversas técnicas de purificación de semen, entre ellas la centrifugación en gradiente de densidad con Percoll®, basada en la densidad espermática y correlacionada con la maduración e integridad de los espermatozoides (Duszewska et al. 2018). Durante la centrifugación, los espermatozoides con núcleo normal se depositan en la zona de mayor densidad, y los móviles tienen una deposición más rápida, gracias a la alineación de sus movimientos con la fuerza centrífuga.
Percoll®, una solución coloidal de sílice recubierta con polivinilpirrolidona, ha tenido éxito en la eliminación de espermatozoides indeseables en diversas especies (Eberhardt et al. 2022). Además, el medio B.O en espermatozoides es esencial para la investigación y manipulación de gametos masculinos, mejorando su supervivencia y capacidad fertilizante, siendo crucial en tecnologías reproductivas asistidas y destacando su relevancia en la eficiencia reproductiva, incluida la humana (Soliman et al. 2018).
En este estudio se evaluó la capacitación de espermatozoides bovinos en semen sexado y convencional, con el fin de mejorar la eficiencia reproductiva. Esta información será pertinente y útil en biotecnología reproductiva.
Materiales y métodos
Diseño experimental. Se propuso un diseño de cuatro tratamientos independientes, consistieron en: T1: semen convencional capacitado con Percoll; T2: semen convencional capacitado con B.O; T3: SX capacitado con Percoll; y T4: SX capacitado con B.O. Cada tratamiento tuvo cuatro repeticiones con 10 ovocitos en cada una. Las variables evaluadas fueron: porcentaje de clivaje (48 h), Embriones día 7 (embriones/ovocitos), mórulas (día 6), Blastocistos Tempranos (día 7), Blastocistos Expandidos (día 8) y Blastocistos Protruidos (día 9).
Transporte de ovarios y obtención del complejo ovocito-cumulus (COCs). Se obtuvieron ovarios de bovinos que fueron sacrificados en un centro ubicado en la localidad de Loja, Ecuador. Los ovarios se transportaron al laboratorio en termos con solución salina estéril y una mezcla de penicilina-estreptomicina (0,50 mg L-1 Sigma, St. Louis, MI, EUA) a una temperatura inicial de 36 °C. Estos fueron llevados al Laboratorio de Reproducción Animal de la Universidad Técnica Particular de Loja, que se encuentra a 5 minutos.
En el entorno del laboratorio, se realizó un lavado de los ovarios utilizando una solución salina 0,9% (9 g de NaCl en 1000 ml de agua destilada). Posterior, se llevó a cabo la recolección de los COCs. El líquido folicular se extrajo con ayuda de una jeringa de 5 ml y aguja 18 × 11/2; se aspiraron los folículos de 2 a 8 mm (Quispe et al. 2018). Este líquido se vertió en tubo Falcon® y se mantuvieron en baño María mientras se preparaban los demás ovarios. El líquido folicular con los complejos cúmulos/ovocitos se dejó decantar por al menos 10 minutos y luego de este tiempo se recuperaron del fondo del tubo y se ubicaron en cajas de Petri de una medida de 100 mm de diámetro, esta se colocó encima de la platina calentadora. Se buscaron los ovocitos con la ayuda de un estereoscopio con (40X) y fueron seleccionados; se agrupó de diez a quince para facilitar el trabajo. Se utilizaron COCs, clases A y B según los criterios de Hawk y Wall (1994). El medio utilizado para el conteo y clasificación de los ovocitos fue tampón fosfato salino (PBS) + 1% suero fetal bovino (SFB).
Maduración de ovocitos. Los 157 COCs seleccionados fueron sometidos a Maduración in vitro (MIV). El protocolo de maduración de COCs es adaptado de Quintanilla et al. (2015), donde la maduración de COCs se realizó en TCM-199 + 10% de SFB + 0,005 U/ml de (FSH-p) + 10 IU hCG/ml (equina) + 1 μg Estradiol (E2) / ml, en gotas de 100 ml, conteniendo aproximadamente 10 COCs por gota, cubiertas con aceite mineral, en incubadora Thermo Forma Scientific (38,50 ºC, 5% de CO2 y 95% de humedad a saturación) durante 22 horas.
Manejo de pajuelas, semen sexado (SX) y semen convencional (SC). Las pajuelas de semen (0,25 ml) se descongelaron durante 60 segundos a 37°C en un baño María. En cada réplica se llevó a cabo el cálculo de la concentración inicial mediante cámara de Neubauer. Se examinó la viabilidad y la morfología de los espermatozoides mediante la técnica de Tinción de Eosina- Nigrosina. Después de secar la muestra con la tinción, se realizó una observación microscópica exhaustiva del campo completo para identificar anormalidades en la membrana plasmática y evaluar la viabilidad. Posteriormente, se llevó a cabo la evaluación de espermatozoides anormales en el semen capacitado, donde se identificaron irregularidades en la cabeza, el tracto intermedio y la cola, siendo estas detalladamente observadas bajo el microscopio.
Capacitación espermática. La capacitación espermática se realizó en dos entornos distintos: utilizando el medio B.O (semen sexado y convencional) cuya composición es la siguiente NaCl 6,55 g L-1, KCl 0,30 g L-1, CaCl2 2H2O 0,33 g L-1, NaH2PO4. H2O 0,11 g L-1, MgCl26H2O 0,10 g L-1, NaHCO3 3,10 g L-1, Glucosa 2,50 g L-1, Piruvato de Sodio 0,11 g L-1, Albúmina Sérica Bovina 3 g L-1, Gentamicina 0,03 g L-1 y Agua Ultrapura (Embryo tested), en un tubo Eppendorf™ de 1,50 ml, se añade 1 ml de medio B.O, y la pajuela (semen convencional o sexado), en el fondo del tubo, y se llevó a la incubadora por 30 min. Con la pipeta se obtuvo el sobrenadante de 1 ml aproximadamente y fue colocado en otro tubo Eppendorf™, el cual se pasó por centrífuga a 200 G por 5 min.
Por otro lado, la gradiente Percoll se preparó en un tubo Eppendorf de 1,50 ml, se adicionó 200 µl de Percoll al 45%, seguidamente 200 µl de Percoll al 90% formando dos columnas, sobre ello se colocó el semen para luego centrifugar a 600 G durante 10 minutos. En un tubo Eppendorf™ se colocó medio de lavado (1 ml) y el pellet obtenido de la capacitación fue llevado nuevamente a centrífuga por 5 min a 200 G juntamente con el semen capacitado con B.O e incubado. En cuanto al vigor de los espermatozoides que se trata del movimiento en remolinos exhibido por el conjunto completo de espermatozoides en la muestra. La evaluación se lleva a cabo subjetivamente en una escala que varía de 0 a 5, asignándose una puntuación de 5 a la presencia de oleadas o remolinos con movimientos rápidos y vigorosos, y una puntuación de 0 cuando no se observa ningún tipo de movimiento ondulatorio
Fecundación in vitro ovocitos con semen capacitado. Los 157 COCs se dividieron aleatoriamente en cuatro grupos y se llevó a cabo el experimento de fecundación in vitro de manera simultánea y bajo las mismas condiciones. Para llevar a cabo la fecundación, se formaron gotas de 60 µl sobre una platina térmica caliente a una temperatura de 38,50 ºC. Luego, se cubrieron con aceite mineral y se ubicaron en ellas ovocitos madurados, en una proporción aproximada de 10 COCs por gota. Además, se añadió semen capacitado (sexado o convencional) con una concentración promedio 2 x 10⁶ espermatozoides para el semen sexado y para el convencional de 30 x 10⁶ y se incubó el co-cultivo a una temperatura de 38,50 ºC, con una concentración del 5% de CO2 y una humedad del 10% a saturación durante 18 horas.
Cultivo in vitro. Una vez que se completó el proceso de fecundación, se procedió a desnudar los presuntos cigotos mediante vórtex en medio de lavado que contenía un 5% de SFB y antibióticos durante 2 minutos. Luego, se lavaron y se cultivaron en medio de cultivo comercial (Singamia) con un 5% de SFB en una incubadora con una concentración del 5% de CO2, 5% de O2, 90% de N2, a una temperatura de 38,50 ºC y una humedad a saturación para su desarrollo. El día 7 se evaluó la formación de embriones en el estado de blastocisto o completos. La evaluación de los embriones se efectuó bajo un microscopio estereoscópico utilizando los criterios morfológicos de la Sociedad Internacional de Transferencia de Embriones (IETS).
Análisis estadístico. Se aplicó ANOVA a una vía, posteriormente a la comprobación de normalidad de los datos con la prueba de Shapiro Wilks (p<0,05). Para las variables donde se observaron diferencias estadísticamente significativas entre tratamientos, se realizó una prueba de Bonferroni (p<0,05), utilizando el programa estadístico SPSS 29.0.
Resultados
Evaluación preliminar del material de partida. La concentración promedio de las pajuelas del semen sexado fue de 2 x 10⁶ espermatozoides por una pajuela de 0,25 ml, con una motilidad promedio del 60% y un vigor de 3 sobre 5, tras un lapso de incubación de 2 horas a 36 ºC. El T4 tuvo una motilidad individual del 68%, un vigor de 3 y una concentración de 1,50 x 10⁶, mientras que el T3 tuvo una motilidad individual del 62,50%, un vigor de 5 y una concentración de 9,50 x10⁶. Asimismo, el semen convencional con una concentración de 30 x 10⁶ espermatozoide (spz) / pajuela de 0,25 ml y una motilidad individual 66,70% y un vigor de 4. Después de 2 horas de incubación, la motilidad promedio del T2 fue de 76,60% y de vigor 5 con una concentración 11,50 x 10⁶. En cambio, el T1 se obtuvo una motilidad individual de 91,60%, 5 de vigor, con una concentración de 29 x 10⁶.
Valorización de la viabilidad del semen capacitado por los medios B.O y Percoll. La viabilidad con semen convencional Percoll es de 89,50% y con B.O 73%, mientras tanto, la viabilidad de SX capacitado con Percoll es de 68,14 y con B.O 84,80%.
Valorización de la morfología del semen capacitado por los medios B.O y Percoll. La valorización de espermatozoides anormales en el semen capacitado fue: en el T1 10,50% y 2,85%, en el T2 27% y 3,14%, en T3 31,86% y 6,79% y en T4 15,19% y 5% para muertos y anormales, respectivamente.
Tasa de división (clivaje), desarrollo embrionario y blastocistos en las diferentes etapas con semen capacitado con B.O y Percoll.
El clivaje (división). La Figura 1 muestra el porcentaje en los diferentes tratamientos de capacitación en fecundación in vitro aplicados a las 48 horas, se puede observar que, el tratamiento T3 mostró los mayores porcentajes, sin embargo, no se observaron diferencia estadística significativa (p>0,05) frente a T1 y T2, sin embargo, T3 sí presentó diferencia estadística (p<0,05) respecto a T4 que resultó en el menor porcentaje. Por otra parte, se pudo apreciar que no existe significancia estadística entre los tratamientos T1, T2 y T4 (p>0,05).
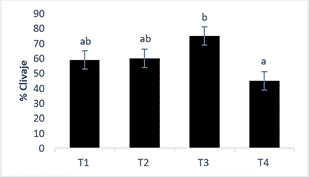
Figura 1 Porcentaje de clivaje. Las columnas indican el promedio del porcentaje de clivaje de cada tratamiento, las barras representas el error estándar y, letras minúsculas diferentes muestran diferencia estadística significativa entre tratamientos (p≤0,05).
Embriones día 7 (Embriones/ ovocitos). En la Figura 2 se expresa el porcentaje de embriones D7 (Embriones/ovocitos). El tratamiento con los mayores porcentajes de FIV es el T1, no existiendo diferencia estadística significativa (p>0,05), con relación al T2 y el T3, sin embargo, T1 mostró diferencia estadística frente al T4 (p<0,05), que es el que ha presentado los menores porcentajes de FIV.

Figura 2 Embriones día 7. Las columnas indican el promedio del porcentaje de embriones a los 7 días de cada tratamiento, las barras representas el error estándar y, letras minúsculas diferentes muestran diferencia estadística significativa entre tratamientos (p≤0,05).
Embriones D7 (Embriones/clivados). El T1, presenta los valores más elevados, no obstante, no indica diferencia estadística significativa frente al T2 (p>0,05), pero, indica diferencia estadística significativa con el tratamiento T3 y T4 (p<0,05).
Mórulas. El porcentaje en esta variable no se muestra diferencia estadística significativa (p>0,05), en ninguno de los tratamientos aplicados, sin embargo, de manera observacional el tratamiento con mayores porcentajes de mórulas es el de T2 (Figura 3 A).
Blastocistos Tempranos. Los porcentajes de Blastocistos Tempranos expresados tampoco han mostrado diferencia estadística significativa (p>0,05) en ninguno de los tratamientos (Figura 3 B). Además, cabe indicar que el T2 muestra los mayores porcentajes.
Blastocistos Expandidos. No se muestra diferencia estadística significativa entre los tratamientos (p>0,05), siguiendo el mismo patrón que los resultados de blastocistos tempranos (Figura 3 C).
Blastocistos Protruidos. Los porcentajes muestran resultados más elevados en los grupos tratados con T2 y T3 en comparación con los otros tratamientos, aunque sin diferencia estadísticamente significativa entre ellos (p>0,05) (Figura 3 D).

Figura 3 A. mórulas, B. blastocistos tempranos, C. blastocistos expandidos y D. blastocistos protruidos. Las columnas indican el promedio del porcentaje de mórulas (A), blastocistos tempranos (B), blastocistos expandidos (C) y blastocistos protruidos (D) de cada tratamiento, las barras representas el error estándar y, letras minúsculas diferentes muestran diferencia estadística significativa entre tratamientos (p≤0,05).
Discusión
Los datos obtenidos en el T1 coinciden con los obtenidos por Filipiak (2017), el cual hace conocer que, con la aplicación de este tipo de técnicas o tratamientos, existe bajo porcentaje de espermatozoides anormales, así también, una baja o media mortalidad. La ventaja es que es fácil de usar, requiere menos pasos en la preparación, y puede usarse para procesar grandes o pequeñas cantidades de semen (Abraham et al. 2016); por lo cual, el gradiente de Percoll es aún aplicado de forma frecuente en los laboratorios de FIV de preparación de semen de toro, ya que existe mayor motilidad y número de dosis de inseminación resultantes del procesamiento (Rasmussen et al. 2013).
Aunque el protocolo de Percoll ha sufrido ligeros cambios a lo largo de los años, con el reciente uso generalizado de espermatozoides clasificados por sexo en la FIV, se han propuesto modificaciones (Ferré et al. 2018), como la utilización de un menor volumen de Percoll y una centrifugación a mayor fuerza, pero menor duración independientemente de si las muestras sean semen convencional o semen sexado, ya que reduciría el costo y el tiempo de preparación (Rasmussen et al. 2013).
En el análisis previo del material utilizado con el tratamiento de densidad inicial promedio de pajuelas SX, se obtuvieron resultados similares a los de la investigación llevada a cabo por Filipiak et al. (2017), donde se logró un promedio del 65% y una puntuación de vigor de 3,50 en una escala de 0 a 5. Mientras que, en comparación con el trabajo de Mutmainna et al. (2021), quienes obtuvieron motilidad y vigor tras 2 horas de la capacitación con 50% y 3, respectivamente, siendo la motilidad de esta investigación superior. La variación observada entre los tratamientos podría estar vinculada a las disparidades en la preparación y procesamiento del semen. Específicamente, la utilización de Percoll, un método que implica centrifugación, posiblemente condujo a la selección de espermatozoides con una movilidad superior. Esta diferencia en la técnica de procesamiento podría explicar, en parte, las divergencias notadas en los parámetros de motilidad entre los grupos. En relación con la capacidad de movimiento individual, el semen procesado mediante Percoll mostró un mejor rendimiento en comparación con la investigación de Limache (2015).
En un estudio realizado por Filipiak et al. (2017) en lo concerniente a clivaje y desarrollo embrionario (DE), para semen convencional capacitado con B.O es de 62,81%, lo que es superior en 2% al obtenido en este estudio.
Asimismo, la investigación de Filipiak et al. (2017) y Gardón et al. (2001) obtuvieron tasas de clivaje del 52% y 69,66%, respectivamente, en tratamientos con semen sexado capacitado con BO, superiores a los resultados obtenidos en el presente estudio. A pesar de ello, un estudio realizado por Xu et al. (2009), logró una tasa de clivaje del 61,70% y un 20% de desarrollo en FIV utilizando semen sexado (SX), sin embargo, en el presente estudio se obtuvieron mejores resultados usando semen sexado. Los diferentes valores en las investigaciones podrían haberse producido por factores múltiples, como condiciones de manejo, del laboratorio, de las técnicas utilizadas, medios de desarrollo, o por problemas en la nutrición animal, ya que, en la zona de estudio debido a las condiciones climáticas adversas, no hay gran disposición de pastos o alimento para el ganado, lo cual está en relación directa con un deficiente estado corporal y problemas reproductivos del animal.
Además, los datos obtenidos en cuanto al clivaje del T3 son similares a los reportados por Demyda et al. (2015). Sin embargo, al comparar los resultados obtenidos mediante el desarrollo embrionario con los reportados por Filipiak et al. (2017), se observa que ellos obtuvieron mejores resultados con un promedio del 65% y una puntuación de vigor de 3,50 (en una escala de 0 a 5) para semen sexado y un promedio de 60% y una puntuación de vigor de 3,50 para el convencional. Por otro lado, Gardón et al. (2001) obtuvo 25,04% en desarrollo embrionario a los 6 días usando B.O como medio de capacitación, lo cual es diferente a los resultados presentados.
En relación con el tratamiento de T3 y T4, los datos obtenidos han mostrado similitudes con los resultados encontrados por Wilson et al. (2006), quienes no encontraron diferencia en la tasa de clivaje al usar semen sexado y no sexado o convencional, lo cual es consistente con los hallazgos de Ormachea et al. (2019) y Larocca y Filipiak (2017), quienes tampoco encontraron diferencia significativa al usar semen sexado por citometría de flujo. Además, Chowdhury et al. (2019) no hallaron diferencias en la tasa de clivaje o en el porcentaje de embriones obtenidos en el día siete, al utilizar un anticuerpo monoclonal (WholeMom®) para sexar el semen.
Presumiblemente, la discrepancia entre los estudios podría deberse a variaciones en los sistemas de producción in vitro, por lo que aún se requeriría una mayor investigación utilizando diversas condiciones de cultivo (Magata et al. 2021). La fertilización es un proceso complejo y difícil de simular en condiciones in vitro, incluso en la FIV, los espermatozoides no están expuestos a los mismos desafíos para alcanzar un ovocito que en el tracto reproductivo femenino después de la inseminación. Por lo tanto, es probable que las tasas de fertilización y desarrollo sean más altas in vitro que in vivo. Además, el desarrollo hasta la eclosión in vitro no implica que los embriones sean capaces de sobrevivir e implantarse in vivo (Thys et al. 2009).
Igualmente, Bonilla et al. (2018), realizó un estudio con semen sexado capacitado con Percoll y obtuvo una tasa de división embrionaria del 69,60%, la cual fue menor a la obtenida en este estudio, mientras que para el semen convencional fue del 74,50% (p<0,001), resultado superior al indicado en esta investigación. Los resultados obtenidos concuerdan con los estudiados por Trigal et al. (2012) quienes obtuvieron un mejor desempeño en clivaje y desarrollo de embriones en el semen convencional en comparación al sexado.
La mejora en la producción de embriones en el T1 se debe a la combinación de la calidad del semen convencional y los beneficios del medio Percoll. El semen convencional en el T1 exhibe una concentración óptima de espermatozoides con alta movilidad y vigor, y el proceso de obtención y preparación del semen conserva eficazmente su viabilidad. La implementación del medio Percoll en el T1 facilita la selección eficiente de espermatozoides de alta calidad mediante la centrifugación, mejorando la calidad general del esperma utilizado en la inseminación. Además, este medio crea un entorno propicio para la fertilización temprana y el desarrollo embrionario, gracias a su composición que ofrece nutrientes esenciales y condiciones óptimas. No obstante, es necesario implementar mejoras adicionales, con el propósito de mitigar el impacto en los espermatozoides durante el proceso de separación y preservación. Para poder aplicar el semen sexado con éxito en un programa comercial. Otros estudios han mostrado una disminución en la tasa de blastocistos al usar semen sexado, similares a los resultados obtenidos en este estudio (Stinshoff et al. 2012).
En el estudio realizado por Cabrera et al. (2012), no evidenciaron diferencias estadísticas significativas entre los toros en lo que respecta al índice de fertilidad in vitro de los ovocitos, utilizando medios de Percoll. Las tasas de fertilidad para cada toro fluctuaron en un intervalo comprendido entre el 56,80% y el 72,90%. Además, no se hallaron diferencias estadísticas significativas en la producción de embriones entre los toros (p<0,05). Se postula que los porcentajes superiores de penetración de espermatozoides capacitados con Percoll podrían atribuirse al incremento en la vitalidad y motilidad progresiva, facilitando así una mayor eficacia en la penetración del ovocito.
Las bajas tasas de escisión y desarrollo embrionario, probablemente se deben a que el semen sexado es utilizado bajo condiciones y protocolos similares a los del semen convencional en el laboratorio. Por lo tanto, la penetración de la zona pelúcida del ovocito parece ser un obstáculo importante cuando se usa semen sexado (Lu y Seidel 2004). Las posibles causas subyacentes de este deterioro de la funcionalidad pueden ser una baja supervivencia y motilidad después de la descongelación, un deterioro de la capacitación y la hiperactivación, y problemas con la integridad del acrosoma (Garner et al. 2013).
En cuanto a los Blastocistos Protruidos, los resultados de los porcentajes se muestran mayores en el tratamiento convencional Percoll, datos inferiores a los obtenidos por Resende et al. (2009), en donde obtuvieron un clivaje (70,65 ± 5,29), con un 63% de embriones fertilizados, estos resultados obtenidos fueron con semen convencional capacitado en Percoll.
En una investigación llevada a cabo por Machado et al. (2009), quienes aplicaron la capacitación del semen sexado mediante gradientes de Percoll en cuatro toros distintos, lograron obtener un rango de clivaje entre el 65% y el 85%, así como un desarrollo embrionario que osciló entre el 17% y el 47%. En nuestro estudio, al emplear el Percoll, los resultados obtenidos son comparables a los de esta investigación, lo que indica que el proceso de capacitación con Percoll, cuando se realiza adecuadamente, puede generar buenos resultados en la penetración del espermatozoide en el óvulo.
Conclusiones
Los resultados de esta evaluación preliminar resaltan la notable influencia del método de sexado y del tratamiento en la calidad del semen y el desarrollo embrionario en programas de reproducción animal. La evidencia de una motilidad y viabilidad destacadas en el semen sexado tratado con Percoll sugiere un potencial promisorio para mejorar las tasas de clivaje y desarrollo embrionario. A pesar de esto, el semen convencional, especialmente en el tratamiento T1, exhibe una superioridad en términos de motilidad individual y concentración. Estos aspectos deben ser considerados al diseñar estrategias para optimizar la reproducción animal.















