INTRODUCCIÓN
A pesar de los notables progresos logrados en las últimas décadas en las estrategias de prevención y abordaje terapéutico, la enfermedad coronaria ateroesclerótica (ECA) continúa siendo la principal causa de morbilidad y mortalidad a nivel global. 1 Si bien la angioplastia transluminal coronaria (ATC) se reconoce como una estrategia terapéutica de revascularización endovascular fundamental en pacientes con ECA, su beneficio se ve restringido por la necesidad de una interpretación previa y precisa de los datos obtenidos mediante angiografía coronaria diagnóstica, la cual debido a sus características, presenta limitaciones significativas en la evaluación del compromiso vascular. En este contexto, y en consonancia con los progresos en las estrategias farmacológicas de tratamiento, se han desarrollado y refinado tecnologías basadas en métodos de imagen y fisiología endovascular con el propósito de evaluar el riesgo en pacientes con ECA y mejorar su tratamiento.
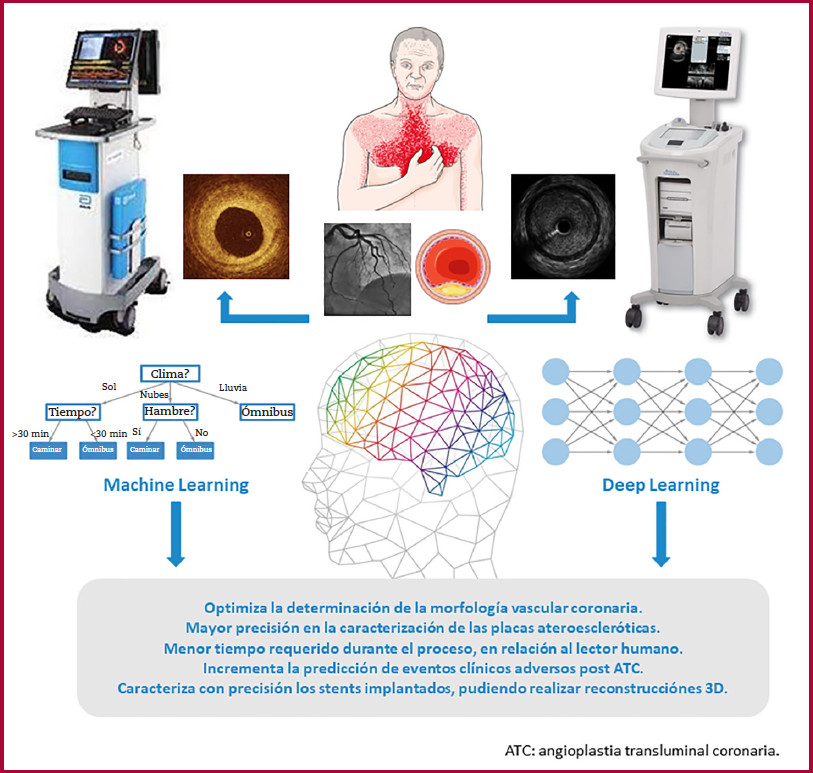
Hasta el momento, diversos estudios han respaldado la optimización del implante de stent a través de ATC utilizando métodos de imagen endovascular, como el ultrasonido endovascular (IVUS, por su sigla en inglés) o la tomografía de coherencia óptica (OCT, por su sigla en inglés). Estos métodos ofrecen notables ventajas al mejorar significativamente el proceso de implante del stent y reducir la incidencia de eventos clínicos adversos durante el seguimiento. 2,3,4,5 Sin embargo, en la actualidad el empleo de estos métodos de optimización es limitado, posiblemente debido a los costos que implican para los sistemas de salud, la necesidad de experiencia por parte de los operadores a fin de realizar una interpretación precisa de los datos obtenidos y a que pueden prolongar considerablemente el tiempo total del procedimiento a realizar. En este contexto, la incorporación de la inteligencia artificial (IA) como herramienta para promover y simplificar el uso de los métodos de imagen endovascular y la interpretación de la información adquirida se revela como una estrategia atractiva. El propósito de la presente revisión es destacar cómo los sistemas actuales basados en IA pueden desempeñar un papel fundamental en la interpretación de los datos generados por los métodos de imagen endovascular, lo que a su vez conduce a una mejora en la optimización de la ATC en pacientes con ECA.
FUNDAMENTOS DE LA INTELIGENCIA ARTIFICIAL
La IA se puede definir como un programa computarizado que se asemeja al cerebro humano al tener la capacidad de recopilar y procesar datos. 6 Este concepto se acuñó por primera vez en 1956 durante el Proyecto de Investigación de Verano de Dartmouth 7 y suscitó un interés explosivo para su aplicación en las ciencias biomédicas en la década de 1970. 8
El aprendizaje de máquinas o machine learning (ML) es una subdisciplina de la IA que involucra la creación de algoritmos capaces de analizar extensos 9 La versatilidad y el gran potencial de estos algoritmos se deben a su gran capacidad de incorporar un amplio conjunto de variables de diversas modalidades, que abarcan desde parámetros clínicos hasta datos de imágenes bidimensionales y tridimensionales, teniendo en cuenta las interacciones no lineales multidimensionales entre estas variables. En términos generales, los enfoques de ML se pueden clasificar en tres categorías principales: aprendizaje supervisado, aprendizaje no supervisado y aprendizaje semisupervisado. 10 En el aprendizaje supervisado, el sistema establece asociaciones al ser entrenado con ejemplos que ya tienen un resultado identificado por un especialista; este es el enfoque más común en ML, en el cual el algoritmo encapsula el conocimiento del especialista dentro del modelo. En este método, se proporcionan datos de entrenamiento y la máquina deriva un clasificador o regresor adecuado que permite categorizar y/o analizar correctamente las características en los datos clínicos y también en los oriundos de las imágenes. Por otro lado, en situaciones en las que los datos de entrenamiento no están disponibles o son insuficientes, se recurre al aprendizaje no supervisado para descubrir estructuras ocultas en los datos. 10 Por su parte, el aprendizaje semisupervisado se vale de un pequeño conjunto de datos de entrenamiento para luego ampliar el tamaño del conjunto al clasificar y/o analizar las características que no están etiquetadas.10 (Table 1).
En cuanto al aprendizaje profundo, también conocido como deep learning (DL), es una subdisciplina del ML que se enfoca en la construcción y entrenamiento de redes neuronales artificiales profundas y complejas. Estas redes están diseñadas para imitar ciertos mecanismos del cerebro humano en la forma en que éste procesa y aprende de los datos. A diferencia de las redes neuronales convencionales, que pueden tener solo unas pocas capas ocultas, las redes neuronales profundas tienen múltiples capas ocultas, lo que les permite aprender características jerárquicas y abstractas de los datos de entrada, lo que las hace especialmente efectivas para tareas de procesamiento de imágenes. Por su parte, las redes neuronales convolucionales (convolutional neural network [CNN]) representan un tipo especializado de red neuronal artificial diseñada especialmente para el procesamiento y análisis de datos en los cuales existe la noción de espacialidad, y por lo tanto hay relación de cada información con las informaciones vecinas. Estos datos están dispuestos en una cuadrícula o matriz, como en el caso de imágenes y otros formatos similares. De entre varias aplicaciones, podemos mencionar, por ejemplo, el desarrollo de diversos estudios que han buscado caracterizar de manera automática las placas ateroescleróticas presentes en las arterias coronarias empleando una CNN, utilizando una variedad de enfoques. (11-13)
De esta manera, un sistema de IA adecuadamente entrenado puede analizar datos heterogéneos en forma holística y realizar un diagnóstico a partir de interpretar información de una forma sin precedentes, lo que lo convierte en una herramienta muy atractiva para su integración en los métodos biomédicos basados en imágenes, con el propósito de mejorar la predicción de riesgos y potenciar la personalización de las decisiones clínicas.
Tabla. 1 Categorías de Machine Learning
| Categoría | Descripción | Subtipo | Ejemplos |
|---|---|---|---|
| Aprendizaje supervisado | Los datos contienen etiquetas y resultados | Clasificación: Emplea un algoritmo para asignar un conjunto de datos a categorías específicas, llegando a conclusiones sobre cómo etiquetar adecuadamente esas categorías dentro del conjunto de datos | Regresión logística, redes Bayesianas, Random Forest, regresión de Ridge, regresión de Elastic Net, regresión de LASSO (Least Absolute Shrinkage and Selection Operator) y redes neuronales artificiales. |
| Regresión: Analiza la relación entre variables dependientes e independientes, especialmente para realizar proyecciones | |||
| Aprendizaje no supervisado | Detecta relaciones cruciales y similitudes en conjuntos de datos no etiquetados | Clustering (agrupamiento): Organiza datos no etiquetados en función de similitudes y diferencias. | Incluye el agrupamiento jerárquico, el agrupamiento K-means y el análisis de componentes principales. |
| Reducción de dimensiones: Disminuye la cantidad de entradas de datos manteniendo la integridad de la información; se utiliza cuando el número de características o dimensio nes en un conjunto de datos aumenta significativamente | |||
| Aprendizaje semisupervisado | Una combinación de aprendizaje supervisado y no supervisado | Incluye una amalgama de resultados y clases, que varían entre etiquetados y no etiquetados, y se emplea en sistemas de reconocimiento de imágenes y voz. | |
| Aprendizaje por refuerzo | Basado en la psicología conductual, utiliza una función de recompensa | Utiliza criterios de recompensa específicos y se emplea en imágenes médicas, análisis y detección de en- fermedades. |
APLICABILIDAD DE LA IA EN MÉTODOS DE IMAGEN ENDOVASCULAR
Cuando se realiza la visualización de la anatomía coronaria a través de una sección transversal mediante métodos de imagen endovascular, se aprecia una alta sensibilidad para la identificación y caracterización morfológica de las placas ateroescleróticas mediante la extracción de parámetros específicos del tejido derivados de la señal de ultrasonido retrodispersado. 14,15 En este contexto, al considerar al IVUS como una estrategia para optimizar la revascularización mediante ATC, múltiples estudios clínicos han demostrado beneficio en términos de reducción de eventos clínicos adversos en el seguimiento, en comparación con la guía angiográfica estándar. (2-4)
Entre las limitaciones del IVUS se pueden mencionar su resolución axial limitada, lo que dificulta la identificación precisa de los fibroateromas de capa delgada (FACD), y su resolución lateral limitada, que puede dificultar la identificación adecuada de las disecciones vasculares coronarias y placas de ateroma, así como el correcto posicionamiento de los struts de los stent. Teniendo en cuenta estas limitaciones, los algoritmos de IA basados en ML ofrecen oportunidades de optimización para el método de IVUS.
Por otra parte, debido a su alta resolución espacial, la OCT presenta una ventaja inherente en el análisis morfológico de las placas ateroescleróticas. 16 En comparación con el IVUS, la OCT ofrece una resolución superior, lo que permite visualizar con claridad las capas de fibras delgadas. No obstante, tiene limitaciones para detectar el tamaño de la placa, núcleos de lípidos grandes y capas elásticas externas debido a su reducida capacidad de penetración en los tejidos. 17 Es fundamental resaltar que el ojo humano tiene limitaciones que resultan en la omisión de una considerable cantidad de datos en las imágenes. Por tanto, existe una urgente necesidad de implementar nuevas tecnologías de optimización en los métodos de imagen endovascular con el fin de mejorar la eficiencia y precisión diagnóstica. Dentro de este marco, la IA se posiciona como una alternativa altamente prometedora.
En este escenario, existen métodos de DL basados en redes de tipo ‘CNN adversarias’ que podrían ser utilizadas para transferir conocimiento entre las modalidades IVUS y OCT. Por ejemplo, imágenes registradas conjuntamente con OCT y de IVUS podrían ser utilizadas para entrenar modelos de IA teniendo como objetivo aumentar la resolución de las imágenes del IVUS. De forma similar, imágenes de IVUS podrían ser utilizadas para entrenar modelos de IA con el objetivo de complementar la información de la placa aterosclerótica profunda en imágenes de OCT, respectivamente. (Figura 1)
INTEGRACIÓN DE LA IA EN LA VALORACIÓN PREVIA AL PROCEDIMIENTO
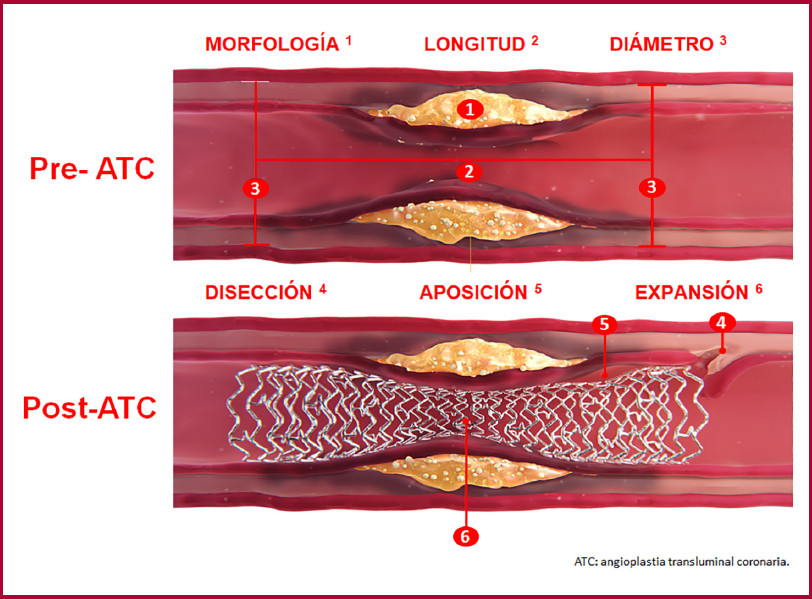
En la etapa de valoración previa a la ATC, es crucial realizar una minuciosa caracterización de la anatomía vascular y de la placa ateroesclerótica mediante el empleo de métodos de imagen endovascular. Esto es fundamental para seleccionar de manera adecuada la técnica endovascular a llevar a cabo y las dimensiones del stent que se implantará. En este contexto, antes de realizar la ATC, es esencial identificar las siguientes características: la morfología de la placa aterosclerótica, la longitud de la placa aterosclerótica, el diámetro vascular coronario y la predicción de la intervención. (Figura 2)
Diversos estudios han explorado la factibilidad de implementar sistemas de IA para mejorar la precisión, reproducibilidad y velocidad en el análisis de métodos de imagen endovascular. En este escenario, un estudio observacional multicéntrico evaluó la precisión y consistencia de un enfoque basado en un sistema de IA diseñado para cuantificar automáticamente las placas ateroscleróticas identificadas mediante OCT. 18 Se llevó a cabo un análisis post hoc de los pullbacks de OCT de cohortes de pacientes con ECA que participaron en cinco ensayos clínicos diferentes, dividiendo estos datos en dos grupos: datos para el “entrenamiento” del sistema de IA y datos de “prueba”, respectivamente. Así, mediante el uso de un sistema de DL basado en una CNN para el análisis de OCT, se logró una considerable concordancia en la cuantificación de la carga de placa aterosclerótica en comparación con las mediciones manuales de pullback convencionales (coeficiente de determinación R2=0,98; p < 0,001). 18 Además, mediante un proceso de validación externa que incluyó pullbacks de OCT diferentes a los analizados previamente, el sistema de DL basado en una CNN demostró una precisión diagnóstica global del 86,6 % (IC 95% 83,7-89,1 %). Esta precisión fue aún mayor en placas con características fibrosas (97,6 %; IC 95% 93,4-99,3 %), seguidas de placas lipídicas (90,5 %; IC 95% 85,2-94,1 %) y placas calcificadas (88,5 %; IC 95% 82,4-92,7 %). 18 Es importante destacar que uno de los desafíos asociados a este tipo de estudio radica en la falta de validación histológica, ya que la clasificación inicial en la mayoría de los casos se fundamenta en observaciones de expertos.
La integración de modelos de IA en la caracterización vascular coronaria llevada a cabo a través de OCT ha evidenciado una mejora en la interpretación de las placas ateroscleróticas y un aumento en la capacidad predictiva de eventos clínicos adversos en el seguimiento. En este contexto, un estudio observacional retrospectivo analizó pullbacks de OCT en el vaso no culpable de pacientes con síndrome coronario agudo. 19 En este análisis, se utilizó la IA para determinar la relación de flujo óptico (RFO) como un parámetro subrogante de la fisiología coronaria basado en OCT, así como para identificar la relación lípido-capa (RLC), un índice morfológico novedoso obtenido mediante OCT que combina la carga lipídica de la placa aterosclerótica y el grosor de su capa fibrosa a lo largo del segmento vascular afectado. 19 En este sentido, la determinación de la RFO y la RLC a través de un sistema de IA demostró una capacidad de discriminación superior en cuanto a la ocurrencia de eventos clínicos adversos mayores (MACE) relacionados con el vaso no culpable del evento índice (NC-MACE), en comparación con las predicciones basadas en la determinación del área luminal mínima (ALM) y la identificación de FACD, respectivamente. Además, se identificó que un valor de RLC >0,33 y RFO ≤0,84 son factores independientes de riesgo para los NC-MACE durante el seguimiento. 19 La Tabla 2 presenta estudios en los que la IA se empleó como estrategia de optimización de la OCT.
Tabla. 2 Estudios de inteligencia artificial como estrategia de optimización de la tomografía de coherencia óptica 10
| Autor | Año | Objetivo | Algoritmo | Algoritmo |
|---|---|---|---|---|
| Athanasiou LS, et al. 20 | 2011 | Extraer un conjunto de características de imáge nes OCT en escala de grises y emplearlas para realizar la clasificación de la placa aterosclerótica mediante un algoritmo de ML. | Random Forest | El algoritmo de ML asociado a la OCT logró caracterizar con elevada precisión las placas ateroescleróticas. |
| Wang Z, et al. 21 | 2012 | Proponer y validar un método de ML asociado a OCT que permita el análisis volumétrico de la capa fibrosa a fin de identificar placas ateros cleróticas vulnerables. | Dynamic Programming | El método propuesto de ML es rápido, preciso y robusto, y puede utilizarse en estudios futuros para una caracterización más completa de las placas ateroescleróticas. |
| Ughi GJ, et al. 22 | 2013 | Desarrollar y validar un algoritmo de ML para optimizar la caracterización de placas ateroes cleróticas mediante OCT. | Random Forest | El algoritmo de ML caracterizó las placas ate roescleróticas con elevada precisión. |
| Xu M, et al. 23 | 2014 | Postular un algoritmo de ML para la detección automática de las placas ateroescleróticas mediante OCT. | Support Vector Machine | El sistema de ML propuesto es preciso y estable para la detección de ateroesclerosis mediante OCT. |
| Wang Z, et al. 24 | 2014 | Examinar las propiedades cuantitativas del tejido que permiten distinguir entre la erosión de las placas fibrosas intactas, y desarrollar un modelo de computador asistido por IA para el diagnóstico in vivo de la erosión de las placas ateroscleróticas | Regresión logística | El modelo cuantitativo de regresión logística propuesto puede utilizarse para mejorar la precisión diagnóstica de la erosión de la placa in vivo mediante OCT. |
| Shalev R, et al. 25 | 2016 | Desarrollar un método de ML para la clasifica ción automática del calcio en imágenes de OCT. | Filtering (filtrado) de regiones para la extracción de sub-imágenes (SIs) | El algoritmo de ML presenta una gran precisión para la caracterización del calcio coronario mediante OCT, lo cual podría utilizarse en 'tiempo real'. |
| Rico-Jime nez JJ, et al. 26 | 2016 | Presentar un novedoso sistema de ML para la caracterización de placas ateroescleróticas mediante OCT. | A-line Modeling | El algoritmo de ML presentó una elevada precisión para la caracterización de placas ateroescleróticas. |
| Xu M, et al. 27 | 2017 | Proponer un modelo de DL para la identificación y caracterización de fibroateromas mediante OCT. | AlexNet, GoogLeNet, VGG-16, VGG-19 | El sistema de DL permite caracterizar los fibroa teromas con elevada precisión. |
| Shi P, et al. 28 | 2018 | Desarrollar un modelo basado en DL para la identificación de placas ateroescleróticas vul nerables mediante OCT. | Fully CNN, Deep CNN | El método propuesto de DL presentó una elevada precisión para la caracterización de placas ateroescleróticas vulnerables. |
| Guo X, et al. 29 | 2018 | Crear un algoritmo de DL para la caracterización de los componentes de la placa aterosclerótica y la medición del grosor de la capa fibrosa. | Least Squares Support Vector Machine (LS-SVM) | El método de segmentación basado en LS-SVM proporcionó una caracterización precisa del grosor del cap fibroso. |
| Kolluru C, et al. 30 | 2018 | Desarrollar métodos basados en redes neuro nales para clasificar tipos de placas ateroescle róticas en OCT. | CNN, ANN | El modelo de DL presentó una elevada preci sión para categorizar los subtipos de placas ateroescleróticas. |
| He S, et al. 31 | 2018 | Analizar el desempeño de un modelo de DL para la caracterización de placas ateroescleróticas mediante OCT. | CNN | El algoritmo de DL demostró una elevada precisión para la caracterización de placas ateroescleróticas. |
| Lee J, et al.32 | 2019 | Desarrollar un sistema de DL para la segmen tación automática de placas ateroescleróticas basado en OCT. | SegNet | El algoritmo de DL presentó una elevada precisión para la segmentación de placas ateroescleróticas. |
| Prabhu D, et al. 33 | 2019 | Desarrollar métodos de ML para identificar líneas A fibrolipídicas y fibrocálcicas en imáge nes de OCT. | Support Vector Machine | El algoritmo de clasificación propuesto es adecuado para la automatización de la clasificación y segmentación de imágenes a través de OCT. |
| Liu R, et al.34 | 2019 | Optimizar la calidad de detección de la placa vulnerable mediante un algoritmo de DL aso ciado a OCT. | Deep CNN | El algoritmo de DL propuesto puede detectar placas vulnerables mediante OCT con una gran precisión. |
| Johnson KW, et al.35 | 2019 | Utilizar un algoritmo de ML y datos transcriptó micos para estimar la probabilidad de incremen to en el grosor de la capa fibrosa como resultado del tratamiento con estatinas. | Elastic net K top scoring pair | Un algoritmo de ML a través de modelos transcriptómicos podría anticipar el incremento en el grosor de la capa fibrosa como resultado del tratamiento con estatinas. |
| Baruah V, et al.36 | 2020 | Determinar la factibilidad de un algoritmo de OCT virtual validado por histología (VH-OCT) utilizando IA. | CNN | Este es el primer informe en clasificar automá ticamente componentes del tejido mediante IA basada en validación histológica y su extensión a imágenes de pacientes in vivo. |
| Lee J, et al.37 | 2020 | Desarrollar un algoritmo de ML para la carac terización de placas ateroscleróticas a través de un enfoque de aprendizaje híbrido. | Deep CNN | El algoritmo propuesto logró caracterizar las placas ateroescleróticas con elevada precisión. |
| Lee J, et al.38 | 2020 | Desarrollar un algoritmo de DL de 'dos pasos' para caracterizar en forma automática las placas ateroescleróticas mediante OCT. | CNN, SegNet | En relación al enfoque estándar, el sistema de DL de 'dos pasos' presenta una gran precisión para la caracterización de las placas ateroes cleróticas mediante OCT. |
| Cha JJ, et al.39 | 2020 | Valorar la utilidad de un sistema de ML para la determinación de la FFR basada en OCT, en re lación con la FFR obtenida bajo guía de presión. | Random Forest | La determinación de la FFR mediante OCT ba sada en algoritmos de ML presenta una buena correlación con la FFR por guía de presión. |
| Chu M, et al.18 | 2021 | Desarrollar y validar un algoritmo de DL para la caracterización de placas ateroescleróticas mediante OCT. | CNN | El algoritmo de DL para la caracterización automática de placas ateroescleróticas por OCT ofrece una excelente precisión diagnóstica tanto en la validación interna como externa. |
| Balaji A, et al.40 | 2021 | Desarrollar un algoritmo de DL para la seg mentación coronaria automática de imágenes mediante OCT. | DeepCap | El sistema de IA vinculado a la OCT demostró una elevada precisión para la segmentación automática de arterias coronarias. |
| Yin Y, et al.41 | 2021 | Desarrollar un algoritmo de DL para la ca racterización de las placas ateroescleróticas mediante OCT. | TwopathCNN | Un algoritmo de DL propuesto presentó una mayor precisión para la caracterización de placas ateroescleróticas, en relación con los algoritmos de DL convencionales. |
| Li C, et al.42 | 2021 | Desarrollar un algoritmo de DL para la cuan tificación automática del calcio coronario mediante OCT. | DenseNet, CNN | El modelo de DL propuesto presenta una elevada precisión para la discriminación del calcio coronario mediante OCT. |
| Yang G, et al.43 | 2021 | Desarrollar un modelo de DL para analizar au tomáticamente stents con cobertura de tejido tanto delgada (≤0,3 mm) como muy gruesa (>0,3 mm), y un algoritmo para analizar con precisión el área de stent en vasos con múlti ples stents. | CNN | El modelo propuesto puede detectar con precisión las estructuras de los stents con una cobertura de tejido muy gruesa y analizar el área de los stents en vasos con múltiples stents implantados. |
| Hong H, et al.19 | 2022 | Analizar el rol de la IA en la predicción de eventos cardiacos adversos mayores mediante la determinación morfológica de la placa y fisiología coronaria a través de OCT. | Deep CNN | Se identificó un novedoso algoritmo de DL para la caracterización morfológica y fisiológica de las placas ateroescleróticas, lo cual puede predecir el riesgo de eventos clínicos adversos. |
| Sun H, et al.44 | 2022 | Desarrollar un método de IA basado en DL para la detección totalmente automatizada de la erosión de la placa ateroesclerótica. | Mask RCNN with convexity and curvature, Support Vector Machine | El algoritmo de DL desarrollado presentó una buena capacidad de discriminación de la erosión de la placa ateroesclerótica por OCT. |
| Wu P, et al.45 | 2023 | Analizar la asistencia favorecida por IA de las imágenes obtenidas mediante IVUS y OCT para la reconstrucción 3D de los stents. | F1-score | Mediante sistemas de IA se logró una asis tencia recíproca entre las imágenes obtenidas mediante IVUS y OCT para la reconstrucción 3D de stents. |
ANN: red neural artificial; CNN: red neural convolucional; DL: aprendizaje profundo; FFR: reserva fraccional de flujo; IA: inteligencia artificial; IVUS: ultrasonido intravascular; LS SVM: máquina de vectores de soporte de cuadrados mínimos; ML: aprendizaje de máquinas; OCT: tomografía de coherencia óptica; SVM: máquina de vectores de soporte
El IVUS es uno de los principales métodos de imagen endovascular para evaluar la presencia de calcio coronario, un factor predictor de eventos cardiovasculares adversos y mortalidad a largo plazo. 46 Una de sus limitaciones radica en la falta de un sistema de cuantificación automática del calcio coronario. No obstante, esta limitación podría superarse mediante la implementación de sistemas de IA que proporcionen una cuantificación automática objetiva y reproducible correlacionada con los puntajes de calcio validados. 47 En este contexto, se llevó a cabo un estudio retrospectivo de cohorte unicéntrico que evaluó la capacidad de un algoritmo de IA entrenado con datos de imágenes de IVUS para cuantificar el calcio coronario y su relación con la aparición de eventos clínicos adversos. 48 Se demostró que un score de calcio coronario derivado de IVUS y basado en un modelo de IA (ICS) tiene un alto valor predictivo para la ocurrencia de eventos clínicos adversos en el seguimiento. Se observó un aumento del 51 % en el riesgo de eventos adversos en pacientes con un ICS ≥85. Este ICS representa el primer score de calcio coronario validado asociado a eventos clínicos adversos desde la introducción del score de calcio derivado de la tomografía computarizada. 48,49 Asimismo, en lo que concierne al análisis del calcio coronario, resulta notable la habilidad que los sistemas de IA pueden demostrar al distinguir entre diversos patrones de calcio coronario, tales como el calcio parietal y el nódulo calcificado. (Tabla 3)
Predicción de la infraexpansión del stent mediante algoritmos de IA
A pesar de las mejoras sustanciales en procedimientos intervencionistas, diseño de stents, fármacos y polímeros, y la adopción de estrategias terapéuticas, la trombosis aguda de stent y la reestenosis intrastent continúan siendo cuestiones críticas. Además, cuando se implanta un stent en tejido aterosclerótico altamente resistente a la dilatación, puede ocurrir una infraexpansión. Por lo tanto, la evaluación minuciosa de estos riesgos de subexpansión antes de la intervención contribuye a la planificación del tratamiento. Dado que la caracterización morfológica de la placa aterosclerótica y la predicción del riesgo de infraexpansión del stent suelen ser procedimientos desafiantes, los sistemas basados en IA desempeñan un papel fundamental en la obtención de una predicción automatizada y reproducible.
El IVUS se encuentra entre los procedimientos endovasculares más comúnmente utilizados para perfeccionar la ATC posterior al implante de stent, y se ha asociado con una disminución de eventos clínicos adversos en el seguimiento. 2,3,4 Sin embargo, el IVUS presenta ciertas limitaciones, ya que la determinación del área mínima del stent (AMS) en una sola sección transversal no refleja completamente el estado del stent a lo largo de toda la longitud del vaso, y no existe una guía precisa para predecir el AMS postprocedimiento ni el grado de expansión. En este contexto, los algoritmos de IA basados en CNN podrían calcular de manera automática y adaptable la probabilidad de infraexpansión después del implante. Un estudio ha desarrollado un algoritmo de IA basado en IVUS para predecir el área del stent después del procedimiento y la probabilidad de infraexpansión. 58 Mediante el análisis de registro conjunto de las imágenes obtenidas mediante IVUS antes y después de la ATC, se generó un conjunto de datos que posteriormente se dividió en un subgrupo de “entrenamiento” y otro de “validación” para el algoritmo. Así, a través de un sistema de DL basado en CNN, se creó un modelo de regresión para predecir el área después de la ATC y un modelo de clasificación binaria (XGBoost) para anticipar la infraexpansión del stent después de la ATC (definida como un AMS < 5,5 mm2). Se logró una correlación significativa entre el MSA predicha por el modelo de DL antes de la ATC y la medida mediante IVUS luego del implante del stent (r=0,802; p < 0,001), y se obtuvo una precisión del 94 % en la predicción de la infraexpansión del stent (área ROC=0,94). 58 (Tabla 3) 58 (Table 3)
Tabla 3 Estudios de inteligencia artificial como estrategia de optimización del ultrasonido endovascular (IVUS)
| Autor | Año | Objetivo | Algoritmo | Algoritmo |
|---|---|---|---|---|
| Sheet D, et al. 50 | 2014 | Desarrollar una innovadora técnica basada en el ML (HED) a fin de de automatizar la caracte rización de la morfología en imágenes de IVUS. | Random Forest | HED es altamente consistente con la histología tradicional en la caracterización de calcificacio nes, tejidos fibrosos y lípidos. |
| Kim GY, et al. 51 | 2018 | Desarrollar un modelo de clasificación basado en HV para la caracterización de placas ateroes cleróticas, según fibrosas, fibrolipídicas, núcleo necrótico y calcio denso. | Modelo de clasificación multi nivel en tres redes (nets) | El método propuesto mostró una precisión de clasificación significativamente alta para todos los tipos de placas. |
| Bae Y, et al. 52 | 2019 | Desarrollar modelos de ML para predecir fibroa teromas de capa delgada (FACD) derivados de tomografía de coherencia óptica (OCT). | ANN, Support Vector Machine , Naïve Bayes | Los algoritmos de ML predijeron con alta precisión la presencia de OCT-FACD |
| Jun TJ, et al. 53 | 2019 | Identificar el clasificador de ML más preciso para la clasificación de FACD. | Feed-forward neural network(FNN), K-nearest neighbor (KNN), Random Forest, CNN | El clasificador CNN obtuvo el mejor rendimien to, mientras que clasificadores FNN, KNN y Random Forest eran similares a los criterios diagnósticos del médico para FACD. |
| Wang L, et al. 54 | 2020 | Identificar el clasificador de ML más preciso para identificar el cambio en la vulnerabilidad de la placa ateroesclerótica, determinada por IVMP. | Generalized linear mixed regression model (GLMM), Support vector machine , Random Forest | El IVMP fue el mejor predictor de riesgo indi vidual, tanto mediante el uso de GLMM como Random Forest, mientras que el área de placa fue mejor mediante SVM. |
| Ziemer PG, et al.55 | 2020 | Evaluar la utilidad un novedoso y automatizado sistema de ML para segmentar el límite del lumen en conjuntos de datos de IVUS. | Multi-frame convolutional neural network | El algoritmo de ML propuesto logró una segmentación efectiva del límite del lumen en IVUS, disminuyendo el tiempo requerido como la necesidad de una delineación manual. |
| Lee JG, et al. 56 | 2020 | Determinar la utilidad de algoritmos de IA para identificar estenosis coronarias funcionalmente significativas (FFR ≤0,80) | L2 penalized logistic regres sion, ANN, Random Forest, AdaBoost, CatBoost, Support Vector Machine | Los algoritmos de ML basados en IVUS mos traron un buen rendimiento diagnóstico para identificar estenosis que producen isquemia. |
| Cho H, et al. 57 | 2021 | Desarrollar algoritmos de ML basados en IVUS para clasificar placas con atenuación y placas calcificadas. | EfficientNet | El algoritmo de ML para la caracterización de placas ateroscleróticas identifica estenosis coronarias de alto riesgo con elevada precisión. |
| Neleman T, et al.48 | 2021 | Desarrollar y validar un algoritmo de ML para cuantificar automáticamente las calcificaciones coronarias mediante IVUS. | Support Vector Machine | El score de calcio derivado de IVUS calculado por un algoritmo de ML demostró una fuerte asociación con el riesgo de eventos cardíacos adversos mayores a largo plazo. |
| Min HS, et al. 58 | 2021 | Desarrollar modelos de DL basados en IVUS previos al procedimiento para predecir la in fraexpansión del stent. | CNN, eXtreme Gradient Boosting (XGBoost) | Los algoritmos de DL predijeron con gran precisión (94%) la infraexpansión del stent. |
| Bass RD, et al. 59 | 2022 | Evaluar el desempeño de los lectores humanos, en comparación con el de la máquina y las lec turas de un laboratorio central (core lab) en la segmentación de imágenes de IVUS. | Multi-frame convolutional neural network | Se observó una similitud entre la segmentación realizada por humanos, el algoritmo de ML y el core lab, siendo las maquinas más eficientes en términos de tiempo. |
| Bajaj R, et al. 60 | 2022 | Entrenar y evaluar la eficacia de un algoritmo de ML para la clasificación de componentes de placas ateroscleróticas, basado en la ecogenici dad de IVUS y la señal de EIRC. | Algoritmo J48 | La combinación de ecogenicidad con la señal de EIRC parece ser capaz de superar las limi taciones de la ecogenicidad. |
| Wissel T, et al. 61 | 2022 | Proponer una estrategia totalmente basada en datos para detectar de forma longitudinal y luego segmentar los struts del stent en IVUS. | Deep cascade learning | Mediante el algoritmo de DL se observó un riesgo reducido de ambigüedades y predic ciones falsas positivas, en relación con la segmentación de los stents |
| Blanco PJ, et al. 62 | 2022 | Determinar la precisión de un algoritmo de DL para la segmentación automática de las imágenes de IVUS. | Multi-frame convolutional neural network, Gaussian process | El enfoque de DL propuesto ofrece segmen taciones precisas, lo que facilita su implemen tación en la rutina clínica al reducir los costos relacionados con la gestión manual de los datos de IVUS. |
| Arora P, et al. 63 | 2023 | Utilizar un algoritmo de DL para identificar la extensión de calcificación vascular en imágenes de IVUS. | AlexNet, GoogLeNet, SqueezeNet | Los algoritmos de DL identifican la extensión de calcificación vascular con gran precisión. |
ANN: red neural artificial; CNN: red neural convolucional; DL: aprendizaje profundo; EIRC: espectroscopía de infrarrojo cercano; FACD: fibroateromas de capa delgada; FFR: reserva fraccional de flujo; HED: histología estocásticamente dirigida; HV: histología virtual; IVMP: índice de vulnerabilidad de placa ateroscleró tica; ML aprendizaje de máquinas; OCT: tomografía de coherencia óptica; SDH: histología estocásticamente dirigida; SVM: Máquina de vectores de soporte
La presencia de calcificación coronaria moderada a grave constituye un sólido indicador de MACE luego de la ATC, 64 posiblemente vinculados con la infraexpansión del stent debido a la presencia de una placa gravemente calcificada y una preparación inadecuada de la lesión previo al implante. En este contexto, la ATC optimizada mediante OCT permite una evaluación minuciosa de la calcificación coronaria y el despliegue del stent, incluyendo aspectos como la expansión, la mala aposición y la disección en el borde. 65 En este escenario, se han desarrollado sistemas basados en DL para optimizar el tiempo de realización y predecir la infraexpansión del stent mediante OCT. Así, un estudio retrospectivo unicéntrico analizó pullbacks de OCT con el objetivo de desarrollar un algoritmo de DL para predecir la infraexpansión del stent antes de la ATC. 66 El algoritmo de DL exhibió una notable capacidad de discriminación en lo que respecta a la detección de infraexpansión del stent después de la ATC, con un área bajo la curva ROC de 0,853. Este hallazgo respalda firmemente la idea de que los sistemas de IA pueden representar una adición sumamente valiosa a los métodos de imagen endovascular, con mejora de la estrategia de optimización. 66 En este contexto, actualmente tenemos a nuestra disposición un software de IA basado en DL a través de OCT (Ultreon™ 1.0, Abbott). Este software permite la cuantificación automática del calcio coronario, la determinación automatizada de la lámina elástica externa y las dimensiones del lumen vascular, lo que no solo incrementa la precisión en la colocación de stents en tiempo real, sino que también simplifica la interpretación de las imágenes adquiridas, con reducción de la variabilidad interobservador. 67.
Segmentación y determinación del área del lumen vascular mediante IA
Dentro de la evaluación previa a la ATC, resulta fundamental medir con precisión las dimensiones vasculares a fin de seleccionar el stent adecuado. La determinación de la longitud de la placa ateroesclerótica es crítica para evitar la “pérdida de geografía” al momento del implante. Además, conocer el diámetro del lumen coronario y el diámetro del vaso proporciona información valiosa para tomar la decisión correcta sobre el stent a implantar. Al examinar los datos adquiridos a través de IVUS, se enfrenta al desafío de llevar a cabo la segmentación manual de los contornos del lumen vascular y de la lámina elástica externa. Este proceso requiere ser realizado tanto en el eje transversal como en la vista longitudinal, y con frecuencia resulta en una alta variabilidad entre diferentes observadores. Además, los artefactos presentes en las imágenes longitudinales de IVUS pueden dar lugar a errores en la segmentación del lumen vascular. Para corregir estos errores en la medición, es necesario sincronizar las imágenes con el electrocardiograma. Dado que este proceso es crucial para la interpretación precisa de los datos, los algoritmos de IA se presentan como una alternativa precisa y consistente para la selección de los cuadros correctos. Mediante el análisis de datos recopilados de pullbacks de IVUS, un estudio se propuso desarrollar un algoritmo basado en DL y una CNN de múltiples cuadros (MF-CNN) con el objetivo de lograr la detección automatizada del contorno del lumen vascular. La IA identificó los segmentos gatillados al final de la diástole para evitar los artefactos longitudinales y realizó la segmentación automática del lumen vascular utilizando el algoritmo MF-CNN, con el logro de una alta correlación entre el lumen real y el obtenido por el algoritmo de DL (r=0,99). 55) (55 (Table 3). Ese algoritmo de DL fue extendido para segmentar lumen y la lámina elástica externa con excelentes resultados. 62 A su vez, estos resultados se replicaron en otros estudios, como se observó en un subanálisis post hoc de la cohorte del estudio IBIS-4 68, que evaluó el rendimiento de un algoritmo de DL basado en una MFCNN para la determinación automática del contorno del lumen y los diámetros vasculares. 59 Este estudio demostró que en comparación con la determinación de las estructuras vasculares por observadores humanos, la objetivación mediante un algoritmo de DL presentó una fuerte correlación con el laboratorio central. Esto ofrece la ventaja de eliminar la variabilidad inter e intraobservador de los humanos, mejorar la precisión en la determinación del contorno del lumen vascular y reducir significativamente el tiempo necesario para realizar las mediciones (promedio de interpretación humana por pullback=47 minutos vs. ML=1 minuto). 59
Utilidad de la IA para la optimización del implante del stent
Luego de una ATC, es esencial optimizar la colocación del stent para reducir la probabilidad de eventos clínicos adversos en el seguimiento. Está comprobado que los métodos de imagen endovascular (IVUS, OCT) ofrecen ventajas respecto a la guía angiográfica convencional en términos de una mejor optimización. Sin embargo, en procedimientos de ATC complicados, determinar los parámetros que deben corregirse es una tarea desafiante. En este contexto, la creación de una reconstrucción tridimensional (3D) de los stents implantados basada en los métodos de imagen endovascular resulta de gran utilidad para abordar los problemas asociados al implante. Es importante destacar que hacer esto manualmente es un proceso complicado, por lo que los algoritmos de IA pueden ser una herramienta valiosa. Han sido desarrollados algoritmos de DL que han revolucionado la reconstrucción automática en 3D de los stents visualizados a través de métodos de imagen endovascular, lo que permite un análisis fiable y en tiempo real durante la intervención. 61 En este contexto, y teniendo en cuenta que la OCT y el IVUS tienen estilos de imagen diferentes en apariencia pero comparten las mismas estructuras anatómicas y pueden alinearse mediante traslación entre ambas modalidades, un estudio investigó la viabilidad de la colaboración recíproca entre el IVUS y la OCT, basada en un algoritmo de DL para la reconstrucción automática en 3D de los stents implantados durante la ATC. Los resultados de este estudio revelaron que el algoritmo de DL posee un excelente rendimiento en la generación de reconstrucciones 3D de los stents implantados, independientemente de si se habían optimizado mediante IVUS convencional o IVUS de alta definición, lo que podría resultar de gran utilidad al analizar posibles mejoras y optimización en el procedimiento de implante. 45 (Table 2).
Considerando que la IA es una ciencia fundamentada en datos, la falta de estandarización en la recopilación y el almacenamiento de los datos médicos puede influir negativamente en la interoperabilidad de los sistemas de IA en el campo de la medicina. A su vez, la heterogeneidad de los datos dificulta la integración efectiva de los algoritmos de IA en diferentes entornos clínicos y la compartición de información entre los sistemas de salud.
Además, el desempeño de los algoritmos de IA en la rutina clínica depende fuertemente de la representatividad de los datos empleados en el entrenamiento, en relación con los datos a los que el algoritmo es expuesto en la práctica diaria. Puede ocurrir que los datos recolectados para el desarrollo de los algoritmos de IA no sean representativos de los pacientes sobre los cuales el algoritmo realiza predicciones, y en tal caso el desempeño puede caer considerablemente. En este sentido la validación externa y la prueba de campo son fundamentales para determinar el nivel de confianza que se puede tener sobre los algoritmos de IA.
Dado que la IA ya está siendo incorporada en el flujo de trabajo clínico, es fundamental evidenciar su valor en la atención al paciente, respaldar la inversión en estos nuevos algoritmos y fomentar la adopción de nuevos modelos de reembolso o pago. Para lograr esto a gran escala, resulta imprescindible realizar estudios de coste-efectividad de estas tecnologías emergentes.
CONCLUSIONES
Los sistemas de IA, cuando se combinan con los métodos de imagen endovascular como IVUS u OCT, mejoran significativamente la precisión en el implante de stents mediante ATC al automatizar la identificación de estructuras vasculares y del correcto posicionamiento del stent implantado. Esto facilita la selección precisa del stent a implantar, el requerimiento de técnicas de corrección del stent y, al mismo tiempo, reduce tanto el tiempo total del procedimiento como la variabilidad interobservador, lo que podría promover una mayor adopción de las técnicas de imagen endovascular y, en última instancia, reducir la incidencia de eventos clínicos adversos en el seguimiento.











 texto en
texto en