Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.57 no.4 Córdoba dic. 2022
http://dx.doi.org/10.31055/1851.2372.v57.n3.36749
10.31055/1851.2372.v57.n3.36749
Micología
Evaluación de los micromicetes asociados a la corteza de fresno en Buenos Aires (Argentina): su capacidad para degradar madera y tolerancia a metales pesados
Evaluation of micromycetes Associated with green-ash bark in Buenos Aires (Argentina): their ability to degrade wood and tolerance to heavy metals
Liliana EvelinNavarro
LauraLevin
SoniaRosenfeldt
1. Laboratorio de Mico logia, Fitopatología y Liquenologia, Facultad de Ciencias Exactas y Naturales, Departamento de Biodiversidad y Biologia Experimental, Universidad de Buenos Aires, INMIBO-CONICET, Buenos Aires, Argentina.
2. Laboratorio de Micología Experimental, Facultad de Ciencias Exactas y Naturales, Departamento de Biodiversidad y Biología Experimental, Universidad de Buenos Aires, INMIBO-CONICET, Buenos Aires, Argentina.
3. Laboratorio de Sistemática y Biología Reproductiva en Plantas Superiores, Facultad de Ciencias Exactas y Naturales, Departamento de Biodiversidad y Biología Experimental, Universidad de Buenos Aires, Buenos Aires, Argentina.
* evelin2navarro@gmail.com
Summary
Background and aims: Environmental poMution can affect tree health and biodiversity of microorganisms, among them fungi, existing in the bark. Fraxinus pennsylvanica Marsh. is the most cultivated tree in Buenos Aires city. The purposes of this work were to screen the micromycetes present in green-ash wood and bark, to determine if the micromycetes most frequently associated with ash bark produce lignocellulolytic enzymes, to describe the anatomical changes they caused in wood and to evaluate their tolerance to Cu and Pb as indicators of environmental pollution.
M&M: Barks and wood were collected along an urban-periurban gradient. The decay caused in vitro in green-ash wood by the most frequently isolated micromycetes was evaluated, anatomical characters were described. The production of lignocellulolytic enzymes by these fungi and their tolerance to Cu and Pb was assessed.
Results: Diplodia sp., Fusicoccum sp. and Sordaria sp. were the most frequently found micromycetes in green-ash bark, whereas Alternaría sp., Diplodia sp. and Phialophora sp. were isolated from wood. None of them caused symptoms of soft rot. They colonized ash wood in vitro but neither important wood weight losses were detected (3-5% after 6 months) nor micro anatomical relevant changes. Cellulolytic activity was produced by all the assayed micromycetes. All of them were able to grow with the addition of 250 mg/ Kg of Cu or 1000 mg/Kg of Pb.
Conclusions: The micromycetes most frequently isolated did not affect tree health. Their tolerance to high concentrations of heavy metals suggests their potential as biomonitors of environmental pollution.
Key words: Biomonitoring, contamination, green-ash, micromycetes.
Resumen
Introducción y objetivos: La contaminación ambiental podría afectar el estado sanitario del arbolado y la biodiversidad de microorganismos. Fraxinus pennsylvanica Marsh. es uno de los árboles más frecuentes en la Ciudad de Buenos Aires. Los objetivos del trabajo fueron: relevar los micromicetes presentes en la corteza y madera de fresno, determinar si los micromicetes hallados con mayor frecuencia en la corteza producen enzimas lignocelulolíticas, describir los principales cambios anatómicos generados en la madera, y evaluar su tolerancia a metales pesados (Cu y Pb).
M&M: Se recolectaron trozos de corteza y madera en un gradiente urbano-periurbano. Se evaluó el deterioro causado in vitro en la madera por los micromicetes aislados con mayor frecuencia. Se determinó la pérdida de peso, se analizaron los cambios anatómicos. Se determinó la producción de enzimas lignocelulolíticas y tolerancia al Cu y Pb.
Resultados: Diplodia sp., Fusicoccum sp. y Sordaria sp. fueron los micromicetes detectados con mayor frecuencia en corteza, mientras que Alternaría sp., Diplodia sp. y Phialophora sp. se aislaron de madera. Ninguno causó síntomas de pudrición blanda, ni pérdidas importantes en el peso seco de la madera (3-5% luego de 6 meses), ni cambios microanatómicos. Se detectó actividad celulolítica en todos los micromicetes evaluados. Todos fueron capaces de crecer en 250 mg/Kg de Cu o 1000 mg/Kg de Pb.
Conclusiones: Los micromicetes presentes en la corteza no afectarían el estado sanitario del arbolado. Su tolerancia a altas concentraciones de metales pesados sugiere potencialidad como biomonitores de contaminación ambiental.
Palabras clave: Biomonitoreo, contaminación, fresno, micromicetes.
Introducción
El fresno (Fraxinus pennsylvanica Marsh.) es uno de los árboles más frecuentes en el arbolado urbano y representa el 36% del total de árboles en la Ciudad de Buenos Aires (CABA) según el último censo de 2018 (https://data. buenosaires.gob.ar/dataset/arbolado-publico-lineal). En la década del '70 fue introducido en nuestro país debido a su rápido crecimiento y resistencia a enfermedades, frío y heladas (Filippini et al., 2000). Recientes investigaciones consideran a la parte externa de la corteza como receptor pasivo de la contaminación ambiental, dado que entre sus grietas se deposita material particulado que inmoviliza sustancias gaseosas (Chrab^szcz & Mróz, 2017; Moreira et al., 2018). La contaminación afecta también el estado sanitario del arbolado y, en consecuencia, a la biodiversidad de organismos que los utilizan para su reproducción, alimentación y/o refugio (Schwarze et al., 2000). Entre ellos, los hongos asociados a la corteza y a la madera, que pueden manifestarse de manera endofítica y/o patogénica (Schwarze et al., 2000; Swislowski et al., 2020). Cuando actúan como patógenos, secretan enzimas capaces de degradar la lignocelulosa que compone las paredes celulares vegetales (Stempien et al., 2017) y cuando los hongos crecen como endófitos colonizan las plantas sin causar enfermedades produciendo compuestos activos que le otorgan protección contra patógenos y contra la herbivoría (Sánchez-Fernández et al., 2013).
Alrededor del 10% de todas las especies fúngicas descritas pueden causar enfermedades en las plantas. Para ello, deben atravesar las paredes celulares vegetales, importante barrera que previene el ataque fúngico, y producir diversas enzimas que poseen la capacidad de degradar sus principales polisacáridos: celulosa, hemicelulosa y pectina (Glass et al., 2013; Kubicek et al., 2014). La deposición de lignina en las paredes celulares vegetales incrementa su resistencia y la degradación de este polímero aromático es un prerrequisito para la hidrólisis de los demás componentes de la biomasa vegetal, los cuales son la principal fuente de carbono y energía para los microorganismos (Janusz et al., 2017).
Los estudios de biomonitoreo en zonas arboladas se limitan en general a líquenes o musgos (Lijteroff et al., 2009; Milicevic et al., 2017; Moreira et al., 2018). En Argentina, los líquenes Usnea amblyoclada (Carreras & Pignata, 2002) y Ramalina celastri (Pignata et al., 2004) fueron utilizados para determinar la calidad del aire y la distribución de metales pesados en la provincia de Córdoba. Los musgos, como los líquenes, son más sensibles a la contaminación reciente y ofrecen escasa información acerca de la contaminación pasada. En cambio, la corteza, como biomonitor de contaminación, posibilita el seguimiento de una zona de estudio a largo plazo y permite identificar y mapear los contaminantes orgánicos e inorgánicos del aire (Chrab^szcz & Mróz, 2017; Alatou & Sahli, 2019; El-Khatib et al., 2020). La corteza abarca todos los tejidos por fuera del cambium vascular. La muerte de las células por fuera de la peridermis lleva a distinguir entre corteza externa muerta de la interna viva. El floema funcional es la parte más interna de la corteza viva (Evert, 2006). La corteza externa absorbe pasivamente la contaminación del aire y la corteza interna podría absorber la contaminación a través del sistema vascular, directamente del suelo. El contenido natural de metales en el medio ambiente es relativamente bajo, pero emisiones excesivas de ellos hacia la atmósfera pueden derivar en su acumulación en algún eslabón de la cadena trófica (Kabata-Pendias, 2011). Además, estos metales poseen diferente capacidad para translocarse a través de la raíz hacia el vástago. Metales como el Co, Cr, Cu, y Pb, que son continuamente liberados al ambiente como resultado de distintas actividades industriales (Iskandar et al., 2011), muestran menor movilidad en comparación a otros elementos como el Ti y Cd. En base a esto, se puede inferir que parte de estos elementos menos móviles presentes en la corteza del arbolado, puede provenir de la contaminación del aire (Chrab^szcz & Mróz, 2017). En trabajos previos, la corteza del fresno fue utilizada para detectar metales pesados (Catinon et al., 2009; 2012). Perelman et al. (2006) evaluaron la presencia de distintos metales pesados en la corteza de fresno a lo largo de un gradiente de urbanización en el Área Metropolitana de Buenos Aires (AMBA), demostrando que algunas partículas asociadas a la corteza eran de origen antropogénico y/o geogénico.
Los hongos también pueden utilizarse para monitorear la contaminación ambiental por metales pesados (Lepsová, 1993). Los primeros trabajos con basidiomicetes, en áreas contaminadas, se limitaron a la recolección de basidiomas y la determinación de su contenido de metales pesados (Cuny et al., 2001; Swislowski & Rajfur, 2018). Se conoce poco sobre el comportamiento de los hongos saprótrofos frente a la presencia de metales (Baldrian, 2010). Iskandar et al. (2011) determinaron la capacidad de Aspergillus niger, Penicillium simplicissimum y Trichoderma asperellum para captar Pb y Cu, en soluciones acuosas. Oladipo et al. (2018), aislaron micromicetes filamentosos, provenientes de minas de oro y piedras preciosas, y analizaron su tolerancia a diferentes concentraciones de metales pesados. Escasos trabajos de relevamiento de micromicetes presentes en corteza y madera se asocian al monitoreo de contaminación (Kowalski et al., 1998; Barengo et al., 2000). Existen en Argentina trabajos de relevamiento de micromicetes en árboles nativos de diferentes regiones (Sánchez et al., 2018; Catania, 2021), pero sólo Robles (2014) caracterizó el biodeterioro de madera de Platanus acerifolia también introducido en el arbolado público de la Ciudad de Buenos Aires, en relación con los agentes etiológicos, los endófitos fúngicos y diferentes niveles de disturbio antrópico.
El presente trabajo tiene como objetivos: I) relevar los micromicetes presentes en la corteza y la madera de fresno; II) determinar si los micromicetes hallados con mayor frecuencia en la corteza, producen enzimas lignocelulolíticas; III) describir los principales cambios anatómicos que generan en la madera los micromicetes más frecuentes, a través de microscopia óptica y microscopia electrónica de barrido; IV) evaluar su tolerancia a la presencia de ciertos metales pesados (Cu y Pb) indicadores de contaminación ambiental.
Materiales y Métodos
Recolección de las muestras
Se recolectaron trozos de corteza y madera de 30 fresnos, a lo largo de un gradiente urbano-periurbano en el AMBA, durante los meses de junio y julio de 2016 y noviembre y diciembre de 2017. Las muestras colectadas correspondieron a dos sectores: a) Urbano (barrio de Constitución, Ciudad Autónoma de Buenos Aires -Coordenadas 34°37'16.1"S 58°23'09.0''O-y barrio de Floresta, Ciudad Autónoma de Buenos Aires -Coordenadas 34°38'14.8"S 58°28'36.8"O). b) Periurbano (Ezeiza, Provincia de Buenos Aires -Coordenadas 34°46'45.1"S 58°32'17.8''O).
Se seleccionaron aleatoriamente diez árboles en cada una de las zonas. En la zona urbana se muestrearon en ambas veredas. En el periurbano se trabajó en un área verde al costado del camino de acceso al predio. En todos los casos, los árboles no presentaban síntomas en su fuste y las muestras se extrajeron a la altura del pecho (1,3 m). Siguiendo los postulados de Koch (1882), se aislaron y determinaron los micromicetes presentes en las muestras de corteza y madera. Los micromicetes determinados se depositaron en la micoteca de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (BAFCcult). Se seleccionaron cepas de tres micromicetes más representativos detectados en la corteza: Diplodia sp. (BAFCcult 4759), Fusicoccum sp. (BAFCcult 3914). y Sordaria sp. (BAFCcult 4761), los cuales fueron hallados en todas las zonas de estudio y en mayor proporción que el resto. Todos los aislamientos de un mismo género pertenecen a la misma especie. Estos hongos fueron utilizados para los ensayos de pérdida de peso, detección de enzimas ligninocelulolíticas y tolerancia a metales pesados.
Aislamientos y metodología
Para realizar los aislamientos se obtuvieron con martillo sacabocado rodajas de madera de 0,5-1 cm de espesor y 0,5 de diámetro y con cuchillo se extrajeron porciones de la corteza asociada (1 cm2). Las muestras fueron subdivididas y esterilizadas superficialmente con alcohol 70% (30 s), hipoclorito de sodio 1:3 (1 min) y alcohol 50% (30 s). Se sembraron 4 discos de madera o 4 porciones de corteza por caja de Petri con medio Nobles (1965) y cloranfenicol (100 mg/1000 ml). Se incubó en oscuridad a 22°C durante 3-5 días. Las colonias desarrolladas se aislaron y se las cultivó en medio agar malta (2%), a 22°C en oscuridad. Para la identificación se utilizaron caracteres morfológicos (von Arx, 1970; Carmichael et al., 1980; Sutton 1980; Dennis, 1981). Se realizaron preparados montados en KOH al 3%, floxina y lactofenol. Se determinó la frecuencia de micromicetes presentes y la diversidad de cada área mediante el índice de diversidad de Simpson (1949).
Capacidad de degradación de la madera
Se evaluó la pérdida de peso in vitro siguiendo la metodología de Job & Wright (1986). Se inocularon 30 probetas de madera de fresno de 3 x 1 x 0,5 cm con cada uno de los hongos seleccionados (Diplodia sp., Fusicoccum sp. y Sordaria sp.) en medio malta (Nobles, 1965). Las probetas fueron incubadas en oscuridad a 28°C durante 6 meses y cada 2 meses se retiraron 10 de cada tratamiento. Se extrajo el micelio de la superficie; 8 probetas fueron utilizadas para determinar la pérdida de peso y 2 de ellas, para estudios anatómicos. Probetas sin inocular fueron utilizadas como controles.
Estudios anatómicos
Para los estudios de microscopía, las probetas se fijaron en FAA (formaldehído 10%, alcohol etílico 96° 50%, ácido acético glacial 5%, agua destilada 35%) y luego se cortaron en secciones transversales, longitudinales radiales y tangenciales de 15 gm de grosor con micrótomo de deslizamiento. Para microscopía óptica, las secciones se colorearon con Safranina-Fast Green y se montaron en medio sintético PYRM (Zarlavsky, 2014). Los cortes longitudinales radiales se tiñeron con lugol para determinar la presencia de gránulos de almidón. Para los estudios con microscopio electrónico de barrido (MEB), las secciones de las probetas se secaron a temperatura ambiente y metalizaron con oro-paladio durante 3 min. Las fotomicrografías fueron tomadas con el microscopio Philips XL30 del Museo Argentino de Ciencias Naturales Bernardino Rivadavia.
Relevamiento de la secreción de enzimas lignocelulolíticas
Los micromicetes se cultivaron durante 4 días a 28°C en placas de Petri con medio extracto de malta (2%) agarizado, al cual se le adicionó alternativamente: carboximetilcelulosa (CMC) 0,1% para determinar actividad celulolítica (endoglucanasa), revelada con el colorante Rojo Congo (Carder, 1986); ácido 2,2'- azino-bis (3-etilbenzotiazolin-6-sulfónico) (ABTS) 0,5 mM para determinar actividad ligninolítica lacasa (Srinivasan et al., 1995); Azure B 50 gM para evaluar actividad ligninolítica lignina-peroxidasa (Archibald, 1992) y MnCl24H2O 1 mM para testear actividad ligninolítica Mn-peroxidasa (Steffen et al., 2000). Como controles positivos se utilizaron Trametes versicolor (BAFCcult 4272) (Kuhar et al., 2015) y Pycnoporus sanguineus (BAFCcult 2126) (Levin et al., 2007). Todos los ensayos se realizaron por triplicado.
Tolerancia a metales pesados
Se cultivaron los micromicetes (Diplodia sp., Fusicoccum sp. y Sordaria sp.) en medio malta agarizado al 2%, al cual se le adicionó SO4Cu.5H2O (0; 125; 250; 500 mg/Kg) o Pb (C2H3O2)2 (0; 125; 250; 500 y 1000 mg/Kg). Las placas se incubaron durante 13 días a 28°C en oscuridad. Se midió el radio de crecimiento y se determinó el índice de tolerancia al final del ensayo:
Indice de Tolerancia= -
radio (mm) de crecimiento sin adición de metal
La tolerancia fue valorada según el criterio establecido por Oladipo et al. (2018).
Análisis estadístico
Los resultados corresponden a tres réplicas con un error estándar menor al 5%. Para el análisis estadístico de los datos obtenidos, se realizó un análisis de varianza de una vía (ANOVA) al 5% de nivel de significancia, utilizando el programa InfoStat (Di Rienzo et al., 2020).
Resultados
Biodiversidad de micromicetes en corteza y madera de fresno
En la Tabla 1, se registran los micromicetes detectados en las 3 zonas de estudio en corteza y madera. En el área del periurbano (localidad de Ezeiza) se encontró mayor diversidad de micromicetes (Índice de Simpson: 0,89), respecto a las zonas urbanas estudiadas: barrios de Constitución (0,81) y Floresta (0,82). Diplodia sp. y Fusicoccum sp. se encontraron en mayor frecuencia en corteza en todas las áreas relevadas y Sordaria sp. en ambas áreas urbanas. En madera se detectaron Diplodia sp. (Floresta), Alternaria sp. (Ezeiza) y Phialophora sp. (Constitución).
Tabla 1. Frecuencia de micromicetes según las áreas muestreadas.
| Micromicete | Urbano (Constitución) | Urbano (Floresta) | Periurbano | |||
| corteza | madera | corteza | madera | corteza | madera | |
| Alternaria sp. (Pleosporaceae) | - | - | - | - | 2 | |
| Chaetomium globosum (Chaetomiaceae) | - | 2 | - | 1 | - | |
| Cladosporium sp. (Cladosporiaceae) | - | - | - | 2 | - | |
| Colletotrichum sp. (Glomerellaceae) | - | - | - | 1 | - | |
| Diplodia sp. (Botryosphaeriaceae) | 3 | - | 4 | 2 | 3 | - |
| Ellisembia sp. (Sordariomycetes) | - | - | - | 1 | - | |
| Fusarium sp. (Nectriaceae) | 2 | - | 1 | - | 1 | - |
| Fusicoccum sp. (Botryosphaeriaceae) | 4 | - | 3 | - | 3 | - |
| Neurospora seminuda (Sordariaceae) | - | 1 | - | - | - | |
| Neurospora tetrasperma (Sordariaceae) | - | 1 | - | - | - | |
| Nigrospora sacchari (Apiosporaceae) | 1 | - | 2 | - | 1 | - |
| Phialophora sp. (Herpotrichiellaceae) | 1 | - | - | - | - | |
| Phoma sp. (Didymellaceae) | 1 | - | 1 | - | 1 | - |
| Sordaria sp. (Sordariaceae) | 4 | - | 6 | - | - | - |
| Sporidesmium sp. (Sporidesmiaceae) | - | - | - | 1 | - | |
Capacidad de degradación de la madera
Las probetas, en todos los casos, se cubrieron superficialmente con micelio al mes de incubación. Sólo se observó desarrollo de estructuras reproductivas en dos de los tres micromicetes: conidiomas en Diplodia sp. y ascomas periteciales en Sordaria sp. (Fig. 1). Se determinó la pérdida de peso que osciló entre 3-5 % luego de 6 meses de ensayo. No se encontraron diferencias significativas entre las probetas inoculadas con los distintos hongos.
Estudios anatómicos
En todos los casos, se observó desarrollo de micelio a los 2 meses del inicio del ensayo, en comparación al control (Figs. 2A; 3A). Las hifas colonizaron el parénquima radial y los elementos de vaso (Figs. 2B-I; 3B-C, F). Además, se detectaron ascosporas, algunas en germinación, en el lumen de los elementos de vaso, en la madera colonizada por Sordaria sp. (Fig. 3C). Al cabo de 6 meses, no se detectaron cambios estructurales de relevancia. Se registró la presencia de gránulos de almidón (Fig. 3D-F).

Fig. 1 . Probetas de madera de fresno. A: Conidiomas de Diplodia sp. B: Ascomas periteciales de Sordaria sp. Abreviaturas= cd: conidioma; ap: ascoma peritecial. Escalas= A: 10 mm; B: 1 mm.
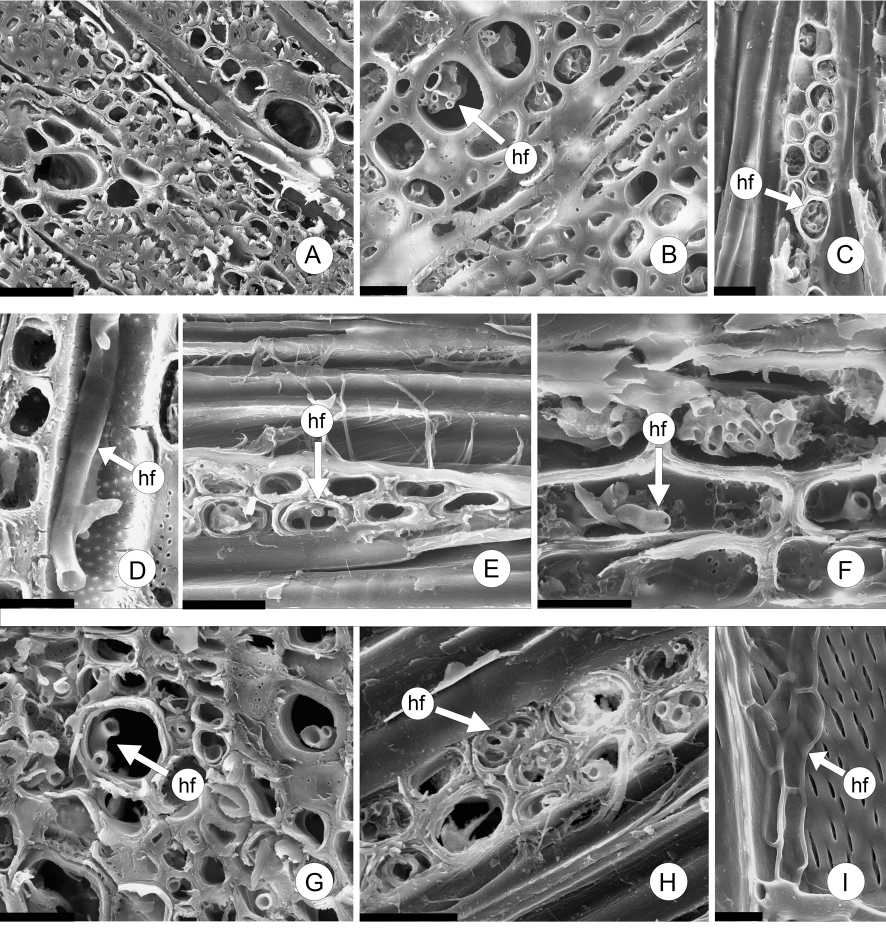
Fig. 2. Fotomicrografías del leño de F pennsylvanica (MEB). A: Control (sin inocular). B-D: Probetas inoculadas con Diplodia sp. B: 2 meses, C: 4 meses, D: 6 meses. E-F: Probetas inoculadas con Fusicoccum sp. E: 2 meses, F: 4 meses. G-I: Probetas inoculadas con Sordaria sp. G: 2 meses, H: 4 meses, I: 6 meses. Abreviaturas= hf: hifa. Escalas= A: 50 pm; B, E-F, H: 20 pm; C-D, H: 25 pm; I: 10 pm.
Relevamiento de la secreción de enzimas lignocelulolíticas
Se detectó actividad celulolítica en todos
los micromicetes. No se observó el halo de color verdoso, característico de la oxidación del compuesto ABTS (indicativo de actividad ligninolítica lacasa) en ningún tratamiento, pero sí se produjo un halo rojizo en las placas de Fusicoccum sp. No se observó halo de degradación en los cultivos con Azure B, pero sí un cambio de color hacia el verde-azulado en las placas de Sordaria sp. y Fusicoccum sp. No se observó actividad Mn-peroxidasa en ningún caso (Fig. 4).
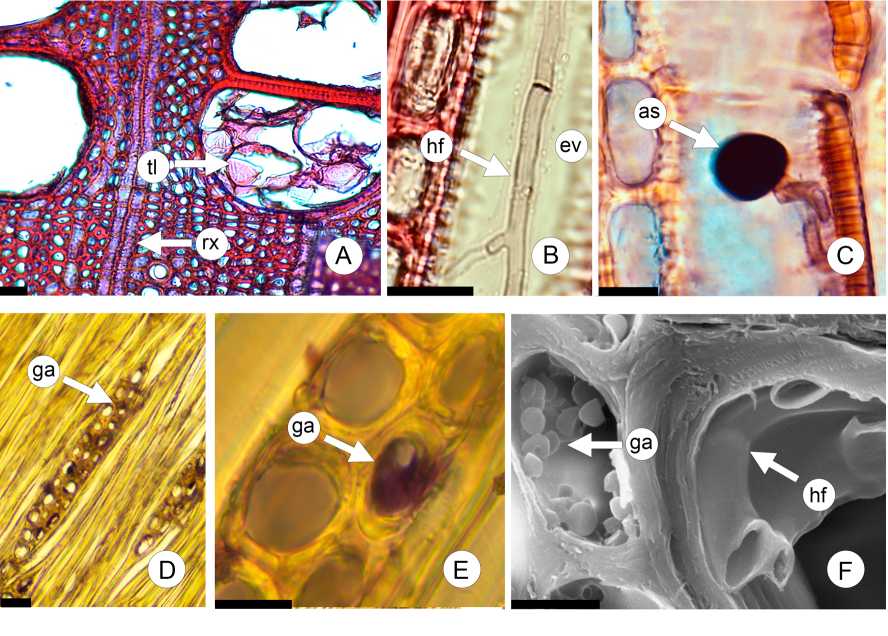
Fig. 3. Cortes del leño de F pennsylvanica (MO). A: Control. B: Hifa de Sordaria sp. en elemento de vaso, C: Germinación de ascospora de Sordaria sp. en elemento de vaso. D-F: Gránulos de almidón en parénquima radial. Abreviaturas= as: ascospora; ev: elemento de vaso; ga: gránulos de almidón; hf: hifa; rx: radio xilemático; tl: tílide. Escalas= A, D: 30 pm; B-C: 20 pm; E-F: 10 pm.
Tolerancia a metales pesados
El agregado de 125 mg/Kg de Cu al medio de cultivo no afectó el crecimiento ni la pigmentación oscura del micelio de Fusicoccum sp., tampoco el crecimiento de Sordaria sp. aunque sí su pigmentación. En cambio, esta concentración de Cu afectó el crecimiento de Diplodia sp. (índice de tolerancia: 0,63), pero no modificó su pigmentación. Por otro lado, todos los micromicetes presentaron muy baja tolerancia a la presencia de concentraciones mayores de este metal, su crecimiento disminuyó en un medio con 250 mg/Kg (índices de tolerancia: 0,1-0,28) y sólo Fusicoccum sp. fue capaz de crecer en presencia de 500 mg/Kg (índice de tolerancia: 0,07). El agregado de 250 mg/Kg de Cu al medio de cultivo afectó también la melanización del micelio en Diplodia sp. y Sordaria sp.
Los micromicetes evaluados demostraron mayor tolerancia al Pb ya que concentraciones de este metal de hasta 500 mg/Kg no afectaron su crecimiento. Para una concentración de 1000 mg/Kg de Pb, los índices de tolerancia variaron entre muy bajo (Fusicoccum sp.: 0,17), bajo (Sordaria sp.: 0,55) y moderado (Diplodia sp.: 0,63) de acuerdo al criterio establecido por Oladipo et al. (2018) (Tabla 2 y Figs. 5-6.) Se observó una disminución notoria de la capacidad de melanización del micelio en todos los micromicetes con una concentración de 1000 mg/Kg de Pb (Fig. 6).
ABTS
Azure B
MnCL
Control
Diplodia sp. Fusicoccum sp.
Sorda rio sp.
Fig. 4. Relevamiento en placa de actividades lignocelulolíticas.
Tabla 2. Tolerancia de micromicetes a diferentes concentraciones de Cu y Pb (mg/Kg): muy baja (0-0,39), baja (0,4-0,59), moderada (0,6-0,79). NT: no testeado.
Concentración (mg/Kg)
| Metal | Micromicete | 125 | 250 | 500 | 1000 | Tolerancia |
| Diplodia sp. | 1 | 1 | 1 | 0,63 | Moderada | |
| Pb | Fusicoccum sp. | 1 | 1 | 1 | 0,17 | Muy baja |
| Sordaria sp. | 1 | 1 | 1 | 0,55 | Baja | |
| Diplodia sp. | 0,63 | 0,1 | - | NT | Muy baja | |
| Cu | Fusicoccum sp. | 1 | 0,28 | 0,07 | NT | Muy baja |
| Sordaria sp. | 1 | 0,16 | - | NT | Muy baja |
Diplodia sp. Fusicoccum sp. Sordaria sp.

Fig. 5. Efecto de diferentes concentraciones de Cu (control; 125; 250 y 500 mg/Kg) sobre el aspecto de las colonias de Diplodia sp., Fusicoccum sp. y Sordaria sp. a los 13 días de incubación.
Discusión
Biodiversidad de micromicetes en la corteza y madera de fresno
En el periurbano (localidad de Ezeiza), se encontró una mayor diversidad de micromicetes, respecto a las zonas urbanas estudiadas. Diplodia sp. y Fusicoccum sp. (Boüyosphaeriaceae) fueron aislados en mayor proporción en la corteza al igual que Sordaria sp. (Sordariaceae). Tanto Diplodia como Fusicoccum se detectaron en corteza de fresno en ambientes urbanos y periurbanos, probablemente con diferentes niveles de disturbio antrópico. El género Botryosphaeria, de distribución cosmopolita, presenta numerosas especies que pueden encontrarse como saprótrofos, endófitos o parásitos. Estas especies han sido objeto de estudio, como parásitos, debido a que afectan a numerosos cultivos comerciales provocando grandes pérdidas económicas. En Argentina, Botryosphaeria ha sido el responsable de la muerte de cultivares de vid, manzanos, perales, cítricos, arándanos y árboles de importancia en la industria maderera (Wright et al., 2010; Rista et al., 2011; https://www.sinavimo.
Diplodia sp. Fusicoccum sp. Sordaria sp. gob.ar/plaga/botryosphaeria-dothidea). El género Sordaria pertenece a los Sordariomycetes, hongos saprotróficos de amplia distribución (Dennis, 1981). Los estudios en este género se enfocan en procesos morfológicos (Teichert et al., 2014), genéticos (Nowrousian et al., 2012) y en producción de enzimas con posibles aplicaciones biotecnológicas (Yang et al., 2020).
Control
125 mg/Kg

250 mg/Kg

500 mg/Kg
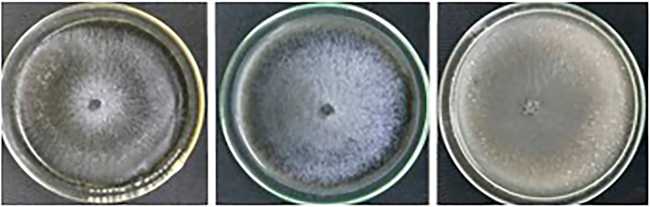
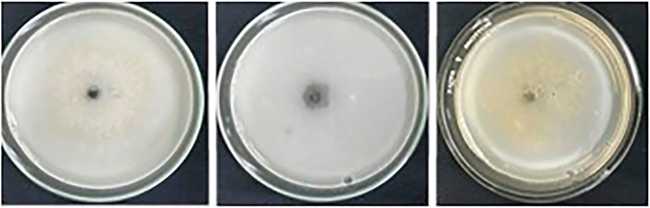
Fig. 6. Efecto de diferentes concentraciones de Pb (control; 125; 250; 500 y 1000 mg/Kg) sobre el aspecto de las colonias de Diplodia sp., Fusicoccum sp. y Sordaria sp. a los 13 días de incubación.
Capacidad de degradación de la madera
De acuerdo al criterio de Findlay (1967), la madera resultó resistente al ataque por los hongos estudiados (pérdida de peso menor al 5 %). Los micromicetes colonizaron los elementos de vaso y el parénquima radial. Sin embargo, durante el período de ensayo no se observó una alteración ultraestructural de la madera. El crecimiento fúngico podría deberse al aprovechamiento de los gránulos de almidón, presentes en el parénquima radial, como fuente de carbono. Se ha comprobado la eficiente secreción de enzimas amilolíticas en otros miembros de la familia Botryosphaeriaceae como Macrophomina phaseolina (Fernandes et al., 2007).
Relevamiento de la secreción de enzimas lignocelulolíticas en placa
Las micrografías de la madera deteriorada por los micromicetes evaluados, las cuales no mostraron cambios estructurales relevantes, concuerdan con los resultados de los estudios sobre producción enzimática lignocelulolítica in vitro, en los cuáles se detectó escasa producción de estas enzimas. Tampoco se detectaron síntomas visibles de pudrición blanda en los árboles muestreados. Los micromicetes evaluados podrían estar actuando como endófitos, sin expresar su batería enzimática. Muchas de las especies de Botryosphaeriaceae se conocen como patógenos oportunistas con una fase latente endofítica y actividad patogénica en plantas sometidas a estrés ambiental (Slippers y Wingfield, 2007; Luo et al., 2019; Hrycan et al., 2020). En este trabajo, para los tres hongos evaluados, solo se evidenció actividad celulolitica (endoglucanasa). En el medio con ABTS utilizado para relevar actividad ligninolítica lacasa no se observó la coloración verdosa que típicamente indica la oxidación de este compuesto, sin embargo, en las placas de Fusicoccum sp. se detectó una coloración rojiza, que podría atribuirse al dicatión del ABTS oxidado. Gramss (2017) reportó resultados similares asociados a actividad lacasa. También se observó un cambio de color del medio Azure B hacia el verde azulado aunque no se registró decoloración del mismo. Este cambio de coloración hacia el verde azulado, podría ser indicio de actividad peroxidasa (Archibald, 1992; Casciello et al., 2017; Lakshmi et al., 2017) en Fusicoccum sp. y Sordaria sp. Generalmente los Ascomycota se asocian a una pudrición blanda de la madera. La habilidad para degradar lignina es limitada en este grupo (Cragg et al., 2015). Sólo la alteran, facilitando así el acceso a la celulosa y hemicelulosas. Recientemente se identificó la primera peroxidasa decolorante de tintes en un Ascomycota (Xylaria grammica), pero aún no existen registros de actividad Mn-peroxidasa-enzima degradadora de la lignina- en hongos de esta división (Kimani et al., 2021). Cabe destacar que anteriormente Ishfaq et al. (2017) reportaron actividad lacasa en Sordaria fimicola, hongo no patogénico. Esteves et al. (2014) detectaron expresión de lacasas y celulasas en los 56 aislamientos de Botryosphaeriales que relevaron. La producción de enzimas lignocelulolíticas ha sido escasamente estudiada en este grupo hasta el presente (Esteves et al., 2014).
Tolerancia a metales pesados
Todos los micromicetes evaluados fueron capaces de crecer con el agregado de 250 mg/Kg de Cu y también con 1000 mg/Kg de Pb en placas de extracto de malta agarizada. Sólo Fusicoccum sp. toleró 500 mg/Kg de Cu, mientras que Diplodia sp. se destacó por su mayor tolerancia al Pb. Una característica asociada a algunos órdenes dentro de Ascomycota es la producción de melanina, la cual se deposita en la pared celular o como polímero extracelular. Este pigmento puede actuar como fotoprotector, intercambiador catiónico, agente quelante, y posee actividades antioxidantes y antimicrobianas. Protege contra un amplio rango de agresiones tóxicas, tanto ambientales como producto de la respuesta inmune del hospedante durante la infección. Tiene además un papel importante en la virulencia de muchos hongos (Cordero & Casadevall, 2017). La melanina fúngica puede adsorber eficientemente distintos metales pesados como Pb y Zn (Fogarty & Tobin, 1996; Iskandar et al., 2011). Los micromicetes estudiados en este trabajo fueron capaces de crecer en presencia de distintas concentraciones de Pb y Cu, asociados a contaminación ambiental, pero sin embargo estos metales pesados afectaron la producción de melanina. Baldrian (2010) y Kumar et al. (2019) reportaron que los metales pesados pueden afectar el crecimiento, la reproducción y la producción enzimática en distintas especies fúngicas. Cabe destacar que todos los micromicetes evaluados resultaron tolerantes a concentraciones de Pb y Cu que exceden los límites globales de Cu y Pb permitidos en suelos (38,9 y 27 mg/Kg, respectivamente) (Kabata-Pendias, 2011).
Conclusiones
Los micromicetes hallados con mayor frecuencia en la corteza del fresno no afectarían el estado sanitario del arbolado, ya que no ocasionaron pérdidas de relevancia en el peso seco de su madera ni se detectaron cambios microanatómicos en las células del xilema secundario. Estos resultados concuerdan con la escasa producción de enzimas asociadas a la degradación de paredes celulares vegetales relevada in vitro. La tolerancia a altas concentraciones de Cu y Pb detectada en los aislamientos de Diplodia sp., Fusicoccum sp. y Sordaria sp. evaluados, sugiere su potencialidad como biomonitores de contaminación ambiental.
Contribución de los Autores
LN coleccionó el material de campo. Todos los autores diseñaron y realizaron la investigación, su interpretación y redacción del manuscrito.
Agradecimientos
Los autores agradecen al Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICET) (PIP 11220170100283 a LL) y Universidad de Buenos Aires (UBA) (UBACYT 2020020170100163 a LL) por el financiamiento recibido para la realización de este trabajo, y a la Dra. Eliana Melignani por su colaboración con el análisis estadístico.
Bibliografía
ALATOU, H. & L. SAHLI. 2019. Using tree leaves and barks collected from contaminated and uncontaminated areas as indicators of air metallic pollution. Int. J. Phytoremediation. 21: 985-997. https://doi.org/10.1080/15226514.2019.1583723.
ARCHIBALD, F. S. 1992. A new assay for lignin-type peroxidases employing the dye azure B. Appl. Environ. Microbiol. 58: 3110-3116. https://doi.org/10.1128/aem.58.9.3110-3116.1992.
BALDRIAN, P. 2010. Effect of heavy metal on saprotrophic soil fungi. In: SHERAMETI, I. & A. VARMA (eds.). Soil Heavy Metals. Soil Biology. pp 263-279. Springer. Germany. https://doi.org/10.1007/978-3-642-02436-8_12.
BARENGO, N., T. N., SIEBER & O. HOLDENRIEDER. 2000. Diversity of endophytic mycobiota in leaves and twigs of pubescent birch (Betula pubescens). Sydowia. 52: 305-320.
CARDER, J. H. 1986. Detection and quantitation of cellulase by congo red staining of substrates in a cup-plate diffusion assay. Anal. Biochem. 153: 7579. https://doi.org/10.1016/0003-2697(86)90063-1.
CARMICHAEL, J. W., W. BRYCE KENDRICK & I. L. CONNERS. 1980. Genera of Hyphomycetes. University of Alberta, Canada.
CARRERAS, H. A. & M. L. PIGNATA. 2002. Biomonitoring of heavy metals and air quality in Cordoba City, Argentina, using transplanted lichens. Environ. Pollut. 117: 77-87. https://doi.org/10.1016/S0269-7491(01)00164-6.
CASCIELLO, C., F. TONIN, F. FERINI, E. FASOLI, F. MARINELLI, L. POLLEGIONI & E. ROSINI. 2017. A valuable peroxidase activity from the novel species Nonomuraea gerenzanensis growing on alkali lignin. Biotechnol. Rep. 13. https://doi. org/10.1016/j.btre.2016.12.005.
CATANIA, M. V. 2021. Micromycetes on bark and wood of Podocarpus parlatorei (Podocarpaceae) from Argentina. X. Chaetosphaeria (Chaetosphaeriaceae, Ascomycota). Bonpladia 30: 107-118. http://dx.doi.org/10.30972/bon.3014670.
CATINON, M., S. AYRAULT, R. CLOCCHIATTI, O. BOUDOUMA, J. ASTA, M. TISSUT & P. RAVANEL. 2009. The anthropogenic atmospheric elements fraction: a new interpretation of elemental deposits on tree barks. Atmos. Environ. 43: 11241130.https://doi.org/10.1016/j.atmosenv.2008.11.004.
CATINON, M., S. AYRAULT, O. BOUDOUMA, J. ASTA, M. TISSUT & P. RAVANEL. 2012. Atmospheric element deposit on tree barks: The opposite effects of rain and transpiration. Ecol. Indic. 14: 170-177.
https://doi.org/10.1016/j.ecolind.2011.07.013. CHRAB^SZCZ, M. & L. MRÓZ. 2017. Tree bark, a valuable source of information on air quality. Pol. J. Envirom Stud. 26: 453-466. https://doi.org/10.15244/pjoes/65908. CORDERO, R. J. & A. CASADEVALL. 2017. Functions of fungal melanin beyond virulence. Fungal Biol. Rev. 31: 99-112. https://doi.org/10.1016/j.fbr.2016.12.003. CRAGG, S. M., G. T. BECKHAM, N. C. BRUCE, T. D. H. BUGG, D. L. DISTEL, P. DUPREE, A.
G. ETXABE, B. S. GOODELL, J. JELLISON, J. E. Mc GEEHAN, S. J. Mc QUEEN-MASON, K. SCHNORR, P. H. WALTON, J. E. M. WATTS & M. ZIMMER. 2015. Lignocellulose degradation mechanisms across the Tree of Life. Curr. Opin. Chem. Biol. 29: 108-119. https://doi.org/10.1016/jxbpa.2015.10.018. CUNY, D., C. VAN HALUWYN & R. PESCH. 2001. Biomonitoring of trace elements in air and soil compartments along the major motorway in France. Water Air Soil Pollut. 125: 273-290. https://doi.org/10.1023/A:1005278900969 DENNIS, R. W. G. 1981. British Ascomycetes.
Strauss & Cramer, Germany.
DI RIENZO, J. A., F. CASANOVES, M. G. BALZARINI, L. GONZALEZ, M. TABLADA & C. W. ROBLEDO. 2020. InfoStat. Centro de Transferencia InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Disponible en: http://www. infostat.com.ar.
EL-KHATIB, A. A., N. A. BARAKAT, N. A. YOUSSEF & N. A. SAMIR. 2020. Bioaccumulation of heavy metals air pollutants by urban trees. Int. J. Phytoremediation. 22: 210-222.
https://doi.org/10.1080/15226514.2019.1652883. ESTEVES, A. C., M. SARAIVA, A. CORREIA & A. ALVES. 2014. Botryosphaeriales fungi produce extracellular enzymes with biotechnological potential. Can. J. Microbiol. 60: 332-342. https://doi.org/10.1139/cjm-2014-0134.
EVERT, R. F. 2006. Esau'sPlantAnatomy. Meristems, cells, and tissues of the plant body. 3rd Ed. Willey, Canada. https://doi.org/10.1002/0470047380.
FERNANDES, L. P., C. J. ULHOA, E. R. ASQUIERI & V. NEVES MONTEIRO. 2007. Produjo de amilases pelo fungo Macrophomina phaseolina. Revista Eletronica de Farmácia 4: 43-51. https://doi.org/10.5216/ref.v4i1.2120.
FILIPPINI, L. M., L. BUSTILLO, H. P. MOR! 17,74. G. INOMATA, J. A. FLORENTINO & M. A. LAUDANI. 2000. El arbolado de la Ciudad de Buenos Aires: situación y estado actual, metodología para su estudio, pautas para su manejo racional. Santísima Trinidad, Buenos Aires.
FINDLAY, W. P. K. 1967. Timber pests and diseases. Pergamon series of monographs on furniture and timber. Pergamon Press, United Kingdom. https://doi.org/10.1016/C2013-0-01899-3. FOGARTY, R. V. & J. M. TOBIN. 1996. Fungal melanins and their interactions with metals. Enzyme Microb. Technol. 19: 311-317.
https://doi.org/10.1016/0141-0229(96)00002-6. GLASS, N. L., M. SCHMOLL, J. H. D. CATE & S. CORADETTI. 2013. Plant cell wall deconstruction by ascomycete fungi. Annu. Rev. Microbiol. 67: 477-498.
https://doi.org/10.1146/annurev-micro-092611-150044. GRAMSS, G. 2017. Reappraising a controversy: Formation and role of the azodication (ABTS2+) in the laccase-ABTS catalyzed breakdown of lignin. Fermentation 3: 27.
https://doi.org/10.3390/fermentation3020027. HRYCAN, J., M. P. HARTBOWEN, T. FORGE & J. R. ÚRBEZ-TORRES. 2020. Grapevine trunk disease fungi: their roles as latent pathogens and stress factors that favour disease development and symptom expression. Phytopathol. Mediterr. 59: 395-424. https://doi.org/10.14601/Phyto-11275. ISHFAQ, M., N. MAHMOOD, I. A. NASIR & M. SALEEM. 2017. Biochemical and molecular analysis of laccase enzyme in saprobic fungus Sondaría fimicola. Int. J. Agric. Biol. 19: 204-210. https://doi.org/10.17957/IJAB/15.0265. ISKANDAR, N. L., N. A. I. M. ZAINUDIN & S. G. TAN. 2011. Tolerance and biosorption of copper (Cu) and lead (Pb) by filamentous fungi isolated from a freshwater ecosystem. J. Environ. Sci. 23: 824-830.
https://doi.org/10.1016/S1001-0742(10)60475-5. JANUSZ G., A. PAWLIK, J. SULEJ, U. SWIDERSKA-BUREK, A. JAROSZ-WILKOLAZKA & A. PASZCYÑSKY. 2017. Lignin degradation: microorganisms, enzymes involved, genomes
analyses and evolution. FEMS Microbiol. Rev. 41: 941-962. https://doi.org/10.1093/femsre/fux049. JOB, D. J. & J. E. WRIGHT. 1986. Experimental wood-rot of Salix humboldtiana blocks by species of Hymenochaete (Aphyllophorales). Mater. und Org. 21: 301-310. KABATA-PENDIAS, A. 2011. Trace elements in soils and planta. 4th ed. CRC Press, USA.
KIMANI, V, R. ULLRICH, E. BÜTTNER, R. HERZOG,
H. KELLNER, N. JEHMLICH, M. HOFRICHTER & C. LIERS. 2021. First dye-decolorizing peroxidase from an ascomycetous fungus secreted by Xylaria grammica. Biomolecules. 11. https://doi.org/10.3390/biom11091391.
KOWALSKI, T. & M. GAJOSEK. 1998. Endophytic mycobiota in stems and branches of Betula pendula to a different degree affected by air pollution. Austrian J. Mycol. 7: 13-24.
KUBICEK, C. P., T. L. STARR & N. L. GLASS. 2014. Plant cell wall-degrading enzymes and their secretion in plant-pathogenic fungi. Annual Rev. Phytopathol. 52: 427-451.
https://doi.org/10.1146/annurev-phyto-102313-045831. KUHAR, F., V. CASTIGLIA & L. LEVIN. 2015. Enhancement of laccase production and malachite green decolorization by co-culturing Ganoderma lucidum and Trametes versicolor in solid-state fermentation. InternationalBiodeterior. Biodegrad. 104: 238-243. https://doi.org/10.1016/jibiod.2015.06.017.
KUMAR, A., A. K. CHATURVEDI, K. YADAV, K. P. ARUNKUMAR, S. K. MALYAN, P. RAJA & A. N. YADAV. 2019. Fungal phytoremediation of heavy metal-contaminated resources: current scenario and future prospects. In: YADAY, A., S. SINGH, S. MISHRA & A. GUPTA (eds). Recent Advancement in White Biotechnology through Fungi. pp. 437-461. Springer, Germany.
https://doi.org/10.1007/978-3-030-25506-0_18. LAKSHMI, K. M. S., P. S. SOUMYA, A. SHAJI & P. NAMBISAM. 2017. Lenzites elegans KSG32: a novel white rot fungus for synthetic dye decolourization. J. Bacteriol. Mycol: Open Access. 5: 311-317. https://doi.org/10.15406/jbmoa.2017.05.00138 . LEPSOVÁ, A. 1993. Applicability of fUngi to the monitoring of environmental pollution by heavy metals. In: MARKERT, B. (ed.). Plants as Biomomitors. pp. 365378. VCH, Germany.
https://doi.org/10.13140/RG.2Z2.16344.60165.
LEVIN L., L. VILLALBA, V DA RE, F. FORCHIASSIN & L. PAPINUTTI. 2007. Comparative studies of loblolly pine biodegradation and enzyme production
by Argentinean white rot fungi focused on biopulping processes. Process Biochem. 42: 995-1002. https://doi.org/10.1016Zj.procbio.2007.03.008. LIJTEROFF, R., L. LIMA & B. PRIERI. 2009. Uso de líquenes como bioindicadores de contaminación atmosférica en la ciudad de San Luis, Argentina. Rev. Int. Contam. Ambient. 25: 111-120.
LUO, Y., P. S. F. LICHTEMBERG, F. J. A. NIEDERHOLZER, D. M. LIGHTLE, D. G. FELTS & T. J. MICHAILIDES. 2019. Understanding the process of latent infection of canker-causing pathogens in stone fruit and nut crops in California. Plant Dis. 103: 23742384.
https://doi.org/10.1094/PDIS-11-18-1963-RE. MILICEVIC, T., M. A. UROSEVIC, G. VUKOVIC, S. SKRIVANJ, D. RELIC, M. V. FRONTASYEVA & A. POPOVIC. 2017. Assessment of species-specific and temporal variations of major, trace and rare earth elements in vineyard ambient using moss bags. Ecotoxicol. Environ. Saf 144: 208-215. https://doi.org/10.1016/j.ecoenv.2017.06.028. MOREIRA, T. C., L. F. AMATO-LOURENCO, G. T. DA SILVA, C. D. SALDIVA DE ANDRÉ, P. A. ANDRE,
L. V BARROZO, J. M. SINGER, P. H. N. SALDIVA,
M. SAIKI & G. M. LOCOSSELLI. 2018. The use of tree barks to monitor traffic related air pollution: a case study in Sao Paulo-Brazil. Front. Environ. Sci. 6: 1-12. https://doi.org/10.3389/fenvs.2018.00072.
NOBLES, M. K. 1965. Identification of culture of wood-inhabiting Hymenomycetes. Can. J. Bot. 43: 10971139. https://doi.org/10.1139/b65-126. NOWROUSIAN, M., I. TEICHERT, S. MASLOFF & U. KÜCK. 2012. Whole-genome sequencing of Sordaria macrospora mutants identifies developmental genes. G3: Genes/Genomes/Genetics. 2: 261-270. https://doi.org/10.1534/g3.111.001479.
OLADIPO, O. G., O. O. AWOTOYE, A. OLAYINKA, C. C. BEZUIDENHOUT & M. S. MABOETA. 2018. Heavy metal tolerance traits of filamentous fungi isolated from gold and gemstone mining sites. Braz. J. Microbiol. 49: 29-37.
https://doi.org/10.1016/j.bjm.2017.06.003. PERELMAN, P., M. A. CASTRO, L. E. NAVARRO, M. RECHI, M. ARRIAGA, S. LÓPEZ, M. MARTÍNEZ CARRETERO & A. FAGGI. 2006. Análisis multielemental de cortezas de fresno (Fraxinus pennsylvanica) a lo largo de un gradiente urbano-periurbano en la metrópolis de Buenos Aires. Rev. Mus. Argent. Cienc. Nat. 8: 231-236. https://doi.org/10.22179/REVMACN.8.323.
PIGNATA, M. L., C. M. GONZALEZ, E. D. WANNAZ, H. A. CARRERAS, G. L. GUDIÑO & M. S. MARTINEZ. 2004. Biomonitoring of air quality employing in situ Ramalina celastri in Argentina. Int. J. Environ. Pollut. 22: 409-429. https://doi.org/10.1504/IJER2004.005678.
RISTA, L. M., R. MAUMARY, N. F. GARIGLIO & J. C. FAVARO. 2011. Botryosphaeria dothidea (Moug.) afectando plantaciones de manzano y duraznero de la región centro-este de Santa Fe. FAVE- Ciencia Agrarias 10: 45-52.
https://doi.org/10.14409/FA.V10I1/2.4136. ROBLES C. A. 2014. Biodeterioro fúngico de madera en el arbolado urbano: prospección, histopatología y control biológico en plátanos (Platanus acerifolia). Tesis Doctoral. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. SÁNCHEZ, R. M, C. C. CARMARÁN & M. V. BIANCHINOTTI 2018. Ostreichnion (Dothideomycetes, Ascomycota) en los bosques andino patagónicos (Argentina). Darwiniana 6: 4757. https://www.jstor.org/stable/26852065. SÁNCHEZ- FERNÁNDEZ R. E., B. L. SÁNCHEZ-ORTIZ, Y. K. M. SANDOVAL-ESPINOSA, Á. ULLOA-BENÍTEZ, B. ARMENDÁRIZ-GUILLÉN, M. C. GRACÍA-MÉNDEZ & M. L. MACÍAS-RUBALCAVA. 2013. Hongos endófitos: fuente potencial de metabolitos secundarios bioactivos con utilidad en agricultura y medicina. TIP 16: 132-146. https://doi.org/10.1016/S1405-888X(13)72084-9.
SCHWARZE, F. W. M. R, J. ENGELS & C. MATTHECK. 2000. Fungal Strategies of Wood Decay in Trees. Springer-Verlag, Germany.
SISTEMA NACIONAL DE VIGILANCIA Y MONITOREO DE PLAGAS [online]. Disponible en: https://www.sinavimo.gob.ar/plaga/botryosphaeria-dothidea. [Acceso: 23 diciembre 2021].
SIMPSON, E. H. 1949. Measurement of diversity. Nature 163: 688-688. https://doi.org/10.1038/163688a0.
SLIPPERS, B., W. A. SMIT, P. W. CROUS, T. A. COUTINHO, B. D. WINGFIELD & M. J. WINGFIELD. 2007. Taxonomy, phylogeny and identification ofBotryosphaeriaceae associated with pome and stone fruit trees in South Africa and other regions of the world. Plant Pathol. 56: 128-139. https://doi.org/10.1111/j.1365-3059.2006.01486.x
SRINIVASAN,C.,T. M.D'SOUZA,K.BOOMINATHAN & C. A. REDDY. 1995. Demonstration of laccase in the white rot basidiomycete Phanerochaete chrysosporium BKM-F1767. Appl. Environ. Microbiol. 61: 4274-4277. https://doi.org/10.1128/aem.61.12.4274-4277.1995.
STEFFEN, K. T., M. HOFRICHTER & A. HATAKKA. 2000. Mineralisation of 14C-labelled synthetic lignin and ligninolytic enzyme activities of litter-decomposing basidiomycetous fungi. Appl. Microbiol. Biotechnol. 54: 819-825. https://doi.org/10.1007/s002530000473
STEMPIEN E., M. L. GODDARD, K. WILHELM, C. TARNUS, C. BERTSCH & J. CHONG. 2017. Grapevine Botryosphaeria dieback fungi have specific aggressiveness factor repertory involved in wood decay and stilbene metabolization. PLoS ONE 12(12): e0188766.https://doi.org/10.1371/journal.pone.0188766.
SUTTON, B. C. 1980. The Coelomycetes. Fungi Imperfecti with Pycnidia, Acervulli and Stromata. CAB, United Kingdom.
SWISLOWSKI, P. & M. RAJFUR. 2018. Mushrooms as biomonitors of heavy metals contamination in forest areas. Ecol. Chem. Eng. S. 25: 557-568. https://doi.org/10.1515/eces-2018-0037.
SWISLOWSKI, P., J. KRÍZ & M. RAJFUR. 2020. The use of bark in biomonitoring heavy metal pollution of forest areas on the example of selected areas in Poland. Ecol. Chem. Eng. S. 27: 195-210. https://doi.org/10.2478/eces-2020-0013.
TEICHERT, I., M. NOWROUSIAN, S. POGGELER & U. KÜCK. 2014. The filamentous fungus Sordaria macrospora as a genetic model to study fruiting body development. Adv. Genet. 87: 199-244. https://doi.org/10.1016/B978-0-12-800149-3.00004-4.
VON ARX, J. A. 1970. The Genera of Fungi Sporulating in Pure Culture. Verlag von Cramer, England.
WRIGHT, E. R., A. MANDOLESI, M. C. RIVERA & B. A. PÉREZ. 2010. Neofusicoccumparvum, blueberry pathogen in Argentina. XXVIII International Horticultural Congress on Science and Horticulture for People (IHC2010): International Symposium. 926: 619-623.https://doi.org/10.17660/ActaHortic.2012.926.89.
YANG, X., C. GU & Y LIN. 2020. A novel fungal laccase from Sordaria macrospora k-hell: expression, characterization, and application for lignin degradation. Bioprocess Biosyst. Eng. 43: 11331139. https://doi.org/10.1007/s00449-020-02309-5.
ZARLAVSKY, G. E. 2014. Histología Vegetal: Técnicas Simples y Complejas. Sociedad Argentina de Botánica. Argentina.














