Introducción
El imatinib es un inhibidor de la tirosina-cinasa que se utiliza como primera elección para la leucemia mieloide crónica (LMC) y tumores sólidos del estroma gastrointestinal (GIST). Es en general bien tolerado, con baja incidencia de reacciones adversas a medicamentos (RAM) graves. La erupción liquenoide (EL) por imatinib es infrecuente y suele mejorar sólo con tratamiento tópico. Una minoría requiere descenso de dosis y/o tratamiento sistémico con corticoides y acitretino1,2.
Caso clínico
Mujer de 74 años con antecedente de hepatocarcinoma que requirió hepatectomía parcial. Cinco meses después de la cirugía, inició imatinib 400 mg/día. La paciente además presentaba hipertensión arterial, hipotiroidismo y depresión, por lo cual estaba tratada con bisoprolol, losartán, hidroclorotiazida, levotiroxina, escitalopram y omeprazol.
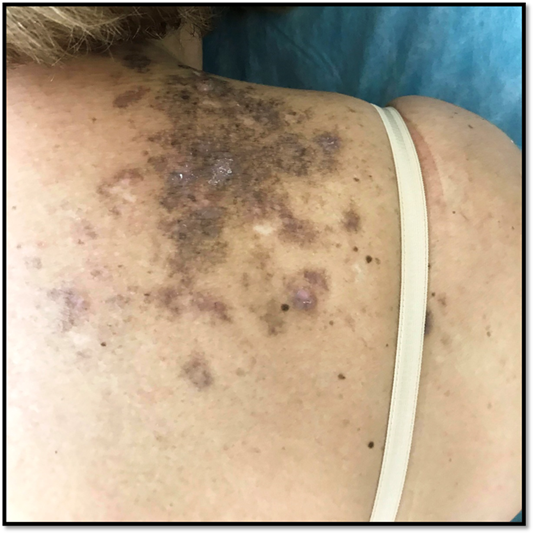
Consultó por una dermatosis pruriginosa de nueve meses de evolución, que apareció un mes después del inicio de imatinib. Previamente había sido tratada con clobetasol local y antihistamínicos sin respuesta. Al examen físico, se constataron múltiples placas infiltradas eritematovioláceas pruriginosas en dorso, extremidades y axilas. No presentaba lesiones en mucosas y anexos (Figura 1).
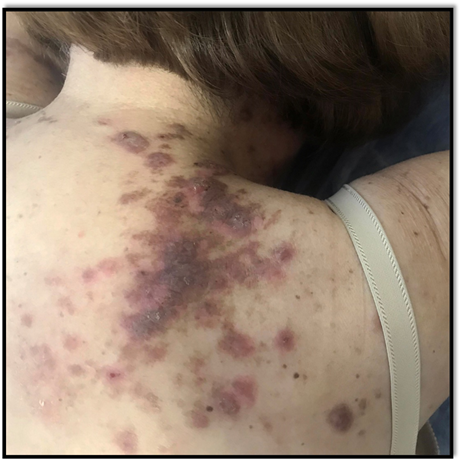
Figura 1: Primera consulta. Placas infiltradas eritematovioláceas y otras hipercrómicas en nuca, región vertebral (cervical y dorsal), región posterior del hombro, región interescapular, y región escapular (supraespinosa e infra espinosa).
El estudio histopatológico mostró hiperqueratosis con paraqueratosis, hiperplasia epitelial, degeneración vacuolar de la capa basal y un infiltrado inflamatorio linfohistiocitario con patrón liquenoide en dermis (Figura 2). Con dicho resultado, y ante la relación temporal entre el inicio del fármaco y las manifestaciones cutáneas, se interpretó como EL secundario a imatinib. De acuerdo con el algoritmo de Naranjo, se clasificó como una RAM posible.
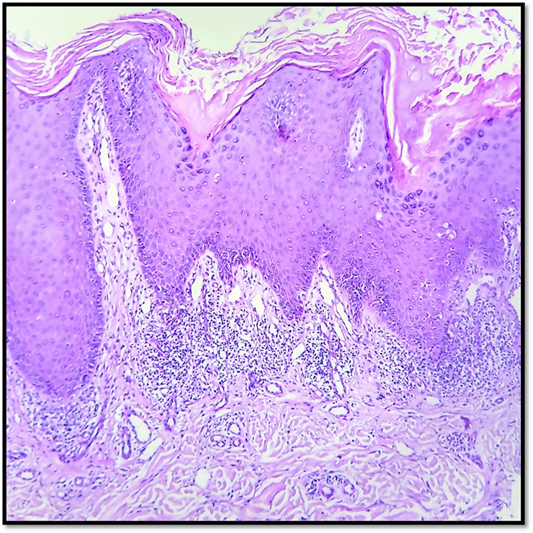
Figura 2: 100X H&E. Nótese la paraqueratosis. Degeneración vacuolar de la capa basal. Dermis con infiltrado inflamatorio linfohistiocitario en patrón liquenoide.
En el contexto de su enfermedad de base, se decidió continuar con la droga sin modificar la dosis administrada y adicionar al tratamiento local con clobetasol, terapia de luz ultravioleta B de banda estrecha (UVBbe) trisemanal. La dosis de inicio fue 350 mJ/cm2, hasta una dosis máxima tolerada de 470 mJ/cm2.
Al cabo de diez sesiones, la paciente refirió una notable mejoría del prurito. Luego de 30 sesiones, se evidenció una disminución en la infiltración y aclaramiento de las lesiones y no aparecieron lesiones nuevas al cabo de un año de seguimiento (Figura 3).
Discusión
El imatinib es tratamiento de elección para la LMC y GIST. Suele ser bien tolerado y sólo un 5% de los pacientes deben suspenderlo debido a la gravedad de las RAM.
En cuanto a las RAM con signos cutáneos (RAMc), en general son leves y autolimitadas. Se cree son dosis dependiente, ya que aparecen más frecuentemente con dosis iguales o mayores a 400 mg/día. Esto indicaría que no se deben a una reacción de hipersensibilidad del individuo, sino a un efecto farmacológico directo del imatinib1,3. Están documentados: exantema maculo papuloso, edema facial, fotosensibilidad, eccema, alopecia, vasculitis, exantemas liquenoides, alteraciones pigmentarias, erupción psoriasiforme, erupción pitiriasis rosada- like, pustulosis exantemática generalizada aguda, síndrome Steven Johnson, necrólisis epidérmica tóxica, dermatosis neutrofílicas e incluso trastornos linfoproliferativos 1,4.
La EL por imatinib aparece uno a 12 meses posterior al inicio 4. Se presenta clínicamente como pápulas violáceas pruriginosas, similares a las del liquen plano idiopático (LP), algunas de las cuales confluyen formando placas. Las lesiones extensas, simétricas, ubicadas en tronco y extremidades son sugestivas de EL por fármacos, así como la distribución en áreas fotoexpuestas y la hiperpigmentación postinflamatoria. Las estrías de Wickham, típicas de LP, son raras de encontrar en EL 5. Suele además presentar compromiso de mucosa oral y genital y recurrencia de dichas lesiones6. Aunque más raro aún, se ha descrito también el compromiso ungueal, caracterizado por hiperqueratosis subungueal 2.
Las opciones terapéuticas descritas para la EL por imatinib son corticoides orales, tópicos y acitretino 2. La fototerapia no se menciona en la literatura dentro de éstas. Sin embargo, existen publicaciones que hacen referencia a EL secundario a nivolumab y a pembrolizumab tratados con UVBbe y otro de reacción mano pie secundaria a imatinib tratado con terapia con luz ultravioleta A más psoraleno tópico (PUVA) 7,8,9.
El mecanismo de acción de la fototerapia es inducir la apoptosis de linfocitos T, producir citoquinas antiinflamatorias, disminuir las vías proinflamatorias Th1/th17 y reducir el número de células de Langerhans7,10. Actúa como inmunosupresor local e inmunomodulador, por lo que se utiliza para otros síndromes liquenoides como LP. Tomamos en cuenta este fundamento para iniciar el tratamiento.
Conclusiones
La EL por imatinib es una RAMc que muchas veces representa un desafío terapéutico debido a la imposibilidad de suspenderlo e incluso de disminuir la dosis. Cabe destacar la buena evolución que presentó nuestra paciente con la fototerapia. Consideramos es una alternativa terapéutica por su buen perfil de seguridad, especialmente en pacientes con polifarmacia y con comorbilidad. Son necesarios más estudios para poder estandarizar este tratamiento.