Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Quebracho (Santiago del Estero)
versión On-line ISSN 1851-3026
Quebracho (Santiago del Estero) vol.21 no.1 Santiago del Estero jul. 2013
Germinación y cultivo in vitro de Schinopsis balansae Engl.
Germination and in vitro culture of Schinopsis balansae Engl.
Alzugaray, C.1; J. Giampaoli1 y M. Bueno1
1 Cátedra de Biología, Facultad de Ciencias Agrarias, Universidad Nacional de Rosario (UNR), CC 14 (S2125ZAA) Zavalla, Santa Fe, Argentina. E-mail: calzugar@gmail.com
Recibido en diciembre de 2011
Aceptado en febrero de 2013
RESUMEN
Schinopsis balansae es un árbol del Chaco oriental, de crecimiento lento y una producción de semillas heterogéneas entre años y entre individuos, por lo que la germinación, el vigor y la sanidad sufren gran variación. El objetivo de este trabajo fue establecer un protocolo de germinación in vitro de semillas y de cultivo in vitro de S. balansae a partir de plántulas de tres meses de edad. Se cosecharon frutos en Vera, Santa Fe. Se extrajeron las semillas, se desinfectaron con etanol 96%, se sumergieron 10 minutos en hipoclorito de sodio al 2 % con 2 gotas de Tween 20, se sembraron en agar-agua (AA). Las plántulas se repicaron a medio Murashige y Skoog: 1-100 % (MSE) y 2-50% (MS 0,5). Se evaluó porcentaje de germinación en AA y número de hojas, longitud de vástago y de raíces a los 30 días del repique. Se obtuvieron explantos de las plántulas in vitro y se sembraron en tres medios MS y distintas concentraciones de BAP y ANA. Se evaluó formación de callos, explantos necrosados y que exudaron taninos. Se obtuvo un 69% de plántulas normales, no hubo diferencias en el crecimiento entre medios. El porcentaje de callos diferenciados varió significativamente según el medio, la máxima diferenciación se observó en el medio con 2 mg.L-1 BAP y 1 mg. L-1 ANA, la cantidad de explantos que exudaron taninos y de explantos necrosados varió según el medio de cultivo.
Palabras clave: Micropropagación; Quebracho colorado.
ABSTRACT
The Schinopsis balansae is a typical tree of the Oriental Chaco whose growth is relatively slow; its seeds are produced quite unevenly yearly and among individuals so that germination, vigor and health show great variation. The aim of this study was to establish an in vitro seed germination protocol and an in vitro culture of S. balansae out of three month seedlings. Fruits were harvested in Vera, Santa Fe and their seeds extracted and disinfected using alcohol 96% by immersing them into a 2% sodium hypochlorite solution added with 2 drops of Tween 20 for 10 minutes were afterwards sown on water-agar (AA). Seedlings were transferred to the Murashige and Skoog medium: 1-100% (MSE) and 2-50% (MS 0.5). Germination percentage in AA and number of leaves, stem and roots length were evaluated 30 days after being transferred. Explants from the in vitro seedlings were extracted and sown in three MS media at different concentrations of BAP and ANA. Callus regeneration and necrotic explants that exuded tannins were evaluated. It was obtained 69% of normal seedlings with no growth differences among means. The percentage of differentiated callus varied significantly among means, being those in the 2 mg.L-1 BAP and 1 mg.L-1 NAA media the maximal differentiation observed. The number of explants exuding tannins and of necropsied explants varied according to the culture.
Keywords: Micropropagation; Quebracho colorado.
1. INTRODUCCION
Schinopsis balansae es un árbol perteneciente a la familia de las Anacardiáceas, cuya altura puede llegar hasta los 24 m con un diámetro del fuste a veces mayor de un metro. Es una especie heliófila, descripta como polígamo dioica por Muñoz (2000). Las flores pistiladas tienen un androceo con cinco estambres vestigiales y un ovario con tres estilos, mientras que las flores estaminadas poseen un gineceo vestigial y cinco estambres. La especie se comporta por lo tanto como dioica y se reproduce por semillas. Florece desde diciembre a enero y sus frutos maduran desde mediados de febrero hasta mediados de marzo (Dimitri, 1997 a). Los frutos son sámaras semileñosas, con la parte seminífera ovoidea comprimida, de 1cm de largo por 4 mm de ancho y ala oblonga de 2 cm de largo por 9 mm de ancho.
La madera de esta especie es sumamente pesada y dura, su peso específico (P.E) es de 1,2 kg.dm-3. La principal aplicación fue la obtención de extractos de quebracho de su madera (34-35 %) con un rendimiento de 63-67 % de tanino puro a 20 % de humedad (Solá, 1942, Valentini, 1960). En la actualidad se lo usa por su madera dura e imputrescible, para postes y tirantes y para la obtención de carbón de alto rendimiento calórico.
Es un árbol nativo de Sudamérica, crece en la zona oriental de la región chaqueña, y en Argentina se lo encuentra en las provincias de Formosa, Chaco y Santa Fe, en la región denominada Cuña Boscosa santafesina. En la actualidad, grandes superficies de los bosques remanentes se encuentran sumamente fragmentadas (Carnevale et al., 2007) con el consiguiente riesgo de una drástica disminución de las poblaciones de esta especie.
S. balansae presenta, además, una producción de semillas muy heterogéneas entre años y entre individuos de poblaciones distintas, por lo que la germinación, el vigor y la sanidad sufren gran variación (Alzugaray et al., 2005; Alzugaray et al., 2007).
Los crecientes riesgos de pérdidas de recursos genéticos forestales y la necesidad de una producción sostenible de madera de calidad, hacen necesario orientar la investigación hacia especies arbóreas nativas no domesticadas. Para rescatar la diversidad genética amenazada y como una importante herramienta para el mejoramiento genético, resulta necesario estudiar la capacidad de las especies para propagarse vegetativamente, así como desarrollar técnicas para obtener copias génicas (Aparicio et al, 2009).
La micropropagación in vitro de plantas, permite la propagación de árboles y proporciona una ventaja económica importante a la industria forestal (Attrre y Fowke, 1993; Gupta et al., 1993). Entre otras ventajas permite reducir los largos períodos de maduración y la baja viabilidad de las semillas (Trigiano et al., 1992), requiere poco equipamiento y puede también ser utilizada como conservación de germoplasma a bajo costo (Verzino y Joseau, 2005). Para S. balansae otros autores han desarrollado la propagación clonal a partir de árboles de 10 años de edad a través de la inducción in vitro de segmentos nodales (Sansberro et al., 2003) como un modo de sortear los problemas reproductivos de esta especie.
El objetivo de este trabajo fue establecer un protocolo de germinación in vitro de semillas y de cultivo in vitro de hojas de Schinopsis balansae a partir de plántulas de tres meses de edad.
2. MATERIALES Y METODOS
Las plantas madres se obtuvieron a partir de sámaras recolectadas en febrero de 2010 en la Estación Experimental del Ministerio de Agricultura, Ganadería y Pesca, Dr. Tito Livio Copa en Las Gamas, localidad de Vera, provincia de Santa Fe, Argentina (29 º 30´ L.S.; 60 º 45´ L.O.). Las sámaras se abrieron con pinzas y se extrajeron las semillas que fueron desinfectadas mediante un pasaje por etanol 96 %, 10 minutos en hipoclorito de sodio al 2 % con unas gotas de Tween 20. Se realizaron 3 lavados con agua destilada esterilizada y se sembraron en un medio de agua destilada con 7 g.L-1 de agar (medio AA) (Bueno et al., 2006). La siembra in vitro se realizó en 100 tubos de vidrio bajo cámara de flujo laminar y se incubó a 25 ± 2°C, con fotoperíodo de 16 hs y una intensidad lumínica de 60 mmol.m-2.s-1. Posteriormente las plántulas obtenidas se repicaron a dos diluciones del medio MS (100 y 50 %) (Murashige y Skoog, 1962) con 7 g.L-1 de agar, suplementado con 30 g.L-1 sacarosa. Se evaluó número de hojas, longitud del vástago y longitud de la raíz para las plántulas obtenidas en los dos medios a los 30 días del repique.Estas variables se compararon con el test de T de Student, para número de hojas se transformaron los datos para normalizarlos. Una vez realizadas las mediciones, se llevaron las plántulas a invernadero en macetas conteniendo suelo y arena en proporciones iguales.
Las hojas jóvenes utilizadas como explantos se obtuvieron de plántulas de tres meses de edad, se seccionaron en tres partes y se colocaron con el envés en contacto con el medio de cultivo (Abedini et al, 2000). Previamente a la siembra, los explantos se desinfectaron sumergiéndolos 10 min en hipoclorito de sodio al 2 % con Tween 20, posteriormente se enjuagaron tres veces con agua destilada esterilizada y se sembraron en tres medios de cultivo, todos conteniendo la base salina y vitaminas de Murashige y Skoog, 7 g. L-1 de agar-agar, 30 g. L-1 sacarosa y se variaron las concentraciones de BAP (6-benzilaminopurina) y ANA (ácido naftalen acético): (M1) 1 mg. L-1BAP y 1 mg. L-1ANA; (M2) 2 mg L-1 BAP y 1 mg. L-1 ANA y (M3) 1 mg L-1BAP y 2 mg. L-1ANA. El pH de los medios se ajustó a 5,8 con NaOH y HCl.
Se realizaron observaciones cada 7 días y se evaluó: contaminación, explantos que diferenciaron callos, explantos que exudaron taninos y explantos necrosados (todas las variables se expresaron como porcentaje).
3. RESULTADOS Y DISCUSIÓN
Se obtuvo un 69 % de germinación en medio agar-agua, en el primer recuento a los siete días de la siembra (Figura 1). Posteriormente no se registraron más semillas germinadas. Este porcentaje estuvo dentro de los valores obtenidos por otros autores (Alzugaray et al., 2005, Valentini, 1960) para lotes de buena calidad. Sin embargo dichos autores indican que la germinación se extiende por casi un mes, lo que indica que la germinación in vitro implica una gran ventaja en cuanto al tiempo necesario para la obtención de plántulas.
No se observaron diferencias significativas entre las diluciones del medio MS en el número de hojas, la longitud de vástago y la longitud de la raíz primaria (Figuras 2 y 3). Las plantas madres fueron obtenidas en forma eficiente, bajo condiciones sanitarias óptimas, y originaron plantines vigorosos.

Figura 1. a) Semillas y frutos de S. balansae b) plántula con cotiledones, hojas y raíz principal, germinada en agar-agua.
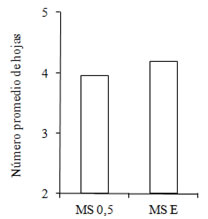
Figura 2. Número promedio de hojas obtenidas en plántulas de tres meses repicadas a dos diluciones (100 y 50 %) del medio MS.
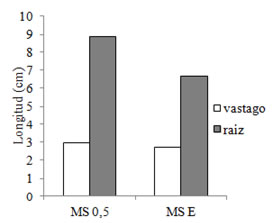
Figura 3. Longitudes promedio de vástagos y de raíces primarias en plántulas de tres meses repicadas a dos diluciones (100 y 50 %) del medio MS.
El porcentaje de explantos contaminados para las condiciones de desinfección ensayadas fue del 30%. Contaminaciones del 20-30% de los explantos fueron presentados por Rodríguez et al. (2011) en Gleditsia amorfhoides. Otros autores completan la desinfección con fungicidas que pueden afectar los cultivos. Es el caso de Rosero (2004) en Tectona grandis que agregan Cobox a la desinfección.
En el extremo apical de la nervadura se registraron callos a los 21 días posteriores a la siembra in vitro. El porcentaje de callos diferenciados varió significativamente según el medio de cultivo empleado, con el mayor porcentaje en el M2 (Figura 4). Estos resultados difieren con los encontrados por Rodriguez et al. (2001) en Gleditsia amorphoides. Los autores informaron la aparición de callos a los 15 días en los explantos provenientes de hipocótilos de semillas y que esta diferenciación fue independiente de los reguladores de crecimiento utilizados. Sin embargo Abedini y Sharry (1994), para obtener callos de diferentes explantos de Melia azederach utilizaron combinaciones de BAP y ANA, siendo la de mayor producción en el medio con 3 mg de BAP y 1 mg de ANA, resultados similares a los obtenidos en este trabajo.
Si bien en todos los medios se observó la presencia de taninos, la cantidad de explantos que exudaron taninos varió entre 5-41% según el medio de cultivo empleado (Figura 5). El M1 mostró los menores valores de oscurecimiento de explantos por taninos, pero también el menor porcentaje de callos. Sansberro et al. (2003) indican que el exudado de taninos es la principal causa de inhibición del crecimiento de brotes y aún de muerte de explantos. En el presente trabajo, el uso de hojas de plántulas jóvenes redujo este problema, a pesar que el medio en que se obtuvo más callos fue el medio con más explantos con exudados.
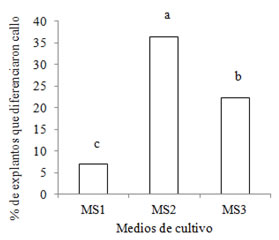
Figura 4. Porcentaje de explantos de S. balansae que diferenciaron callos en los medios MS1, MS2 y MS3.
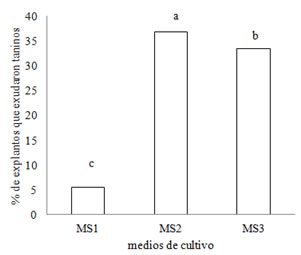
Figura 5. Porcentaje de explantos de S. balansae que exudaron taninos en los medios MS1, MS2 y MS3.
Respecto a la presencia de explantos necrosados, estos se registraron en todos los medios. Los porcentajes de explantos fueron 5% para M1, 15 % para M2 , siendo el M3 (25%) el que mostró el mayor porcentaje (Figura 6). Iguales resultados fueron informados por Rodriguez et al. (2001) en Gleditsia amorphoides. Murashige (1974) señala que en la etapa de establecimiento in vitro de los explantos algunas veces es necesario agregar al medio de cultivo un antioxidante que retarde o evite la oxidación, sea del explanto o del medio de cultivo.
El oscurecimiento de tejidos es con frecuencia más pronunciado en un tipo de medio de cultivo que en otro, lo que implica el uso inapropiado de alguno de los nutrientes empleados en el medio. Con frecuencia el oscurecimiento es menor en un medio diluido que en uno con alta concentración salina, como el MS (George, 1996; Cassells y Curry, 2001). En nuestro trabajo se utilizó la base salina de MS completo, esto puede haber causado el oscurecimiento de los explantos en todos los medios.
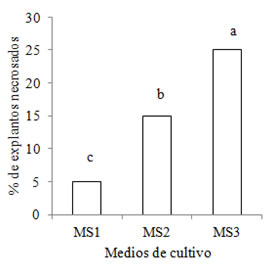
Figura 6. Porcentaje de explantos necrosados de S. balansae en los medios MS1, MS2 y MS3.
4. CONCLUSIONES
La técnica aplicada permitió la obtención de plántulas de Schinopsis balansae con alto vigor y sanidad controlada.
Se desarrolló un protocolo de diferenciación de callos a partir de hojas, el cual puede utilizarse para estudios de variación somaclonal.
Las concentraciones de reguladores de crecimiento con las cuales se logró mayor diferenciación de callo y menor número de explantos necrosados fueron: 2 mg L-1 BAP y 1 mg. L-1 ANA.
5. REFERENCIAS BIBLIOGRAFICAS
1. Abedini W. y S. Sharry. 1994. "Producción de callos in vitro de Melia azedarach L. para la obtención de compuestos con propiedades insectífugas". Anales de SAIPA - Sociedad Argentina para la Investigación de Productos Aromáticos. VIII Congreso Nacional de Recursos Naturales Aromáticos y Medicinales Volumen XV pág 289-294. [ Links ]
2. Alzugaray, C.; N. J. Carnevale; A. R. Salinas y R. Pioli. 2005. "Observations on quality of Schinopsis balansae Engl. Seeds". Seed Technology (27) 1: 49-58. [ Links ]
3. Alzugaray, C.; N. J. Carnevale; A. R. Salinas y R. Pioli. 2007. "Factores bióticos y abióticos que afectan la calidad de las semillas de Schinopsis balansae Engly Aspidosperma quebracho-blanco Schlecht". Revista Iberoamericana de Micología 24 (2): 142-147. [ Links ]
4. Aparicio, A.; M. Pastorino y A. Martínez-Meier. 2009. "Propagación vegetativa de Ciprés de la cordillera, una especie vulnerable del bosque subantártico de Sudamérica". Bosque (Valdivia) 30 (1): 18-26. [ Links ]
5. Attree, S. M. y L. C. Fowke. 1993. 2Embryogeny of gymnosperms: advances in synthetics seed technology of conifers". Plant Cell Tissue and Organ Culture 35: 1-35.
6. Bueno, M.; C. Severín; N. J. Carnevale; C. Alzugaray y G. Giubileo. 2006. "In vitro germination and production of Maytenus vitis-idaea plants in two culture media". Molecular Medicinal Chemistry 11: 8-9. [ Links ]
7. Carnevale, N. J.; C. Alzugaray y N. Di Leo. 2007. "Estudio de la deforestación en la Cuña Boscosa santafesina mediante teledetección espacial". Revista Quebracho 14: 47-56. [ Links ]
8. Cassells, A y R. Curry. 2001. "Oxidative stress and physiological, epigenetic and genetic viariability in plant tissue culture: implications for micropropagators and genetic engineers". Plant Cell, Tissue and Organ Culture 64:145-157. [ Links ]
9. Dimitri, M. J. 1997 a. "El Nuevo Libro del Arbol". Tomo I. Editorial El Ateneo. Buenos Aires. 120 pp. [ Links ]
10. George, E. 1993. "Plant propagation by tissue culture" Part 1. The technology. 2ed. Exegetics Limited. England. 574 p. [ Links ]
11. Gupta, P. K.; G. Pullman; R. Timmins; M. Kreitinger; W. C. Carlson; J. Grob y E. Welty. 1993. "Forestry in the 21st century: the biotechnology of somatic embryogenesis". BioTechnology 11: 454-459. [ Links ]
12. Murashige, T. y Skoog, F. 1962 "A revised medium for rapid growth and bioassays with tobacco tissue cultures". Physiol. Plant. 15: 473-497. [ Links ]
13. Murkute, A.; Shanti-patil, M. 2003. Exudation and browning in tissuecultureof pomegranate. Agricultural ScienceDigest 23: 29-31. [ Links ]
14. Muñoz, J. D. D. 2000. "Flora Fanerógama Argentina" Fascículo 65. ProFlora. CONICET. Buenos Aires. 28 pp. [ Links ]
15. Rosero, N. C. 2004. "Micropropagación Clonal de árboles seleccionados de Tectona grandis L. (Teca) [en linea] Disponible en: <http://www.visagesoft.com> [ Links ]
16. Rodriguez, V. M.; S. K. Vila; H. Rey Hebe y L. A. Mroginski. 2001 "Organogenésis in vitro de Gleditsia amorphoides (Leguminosae)".Comunicaciones Científicas y Técnicas UNNE. 4 pp [ Links ]
17. Sansberro, P.; H. Rey; L. Mroginski y C. Luna. 2003. "In vitro plantlet regeneration of Schinopsis balansae (Anacardiaceae)". Trees 17: 542- 546. [ Links ]
18. Solá, W. 1942. "Arboles y arbustos de Córdoba". Ed. Celtis. Buenos Aires. 97 pp. [ Links ]
19. Trigiano, R. N.; R. L. Geneve y S. A. Merckle. 1992. "Tissue and cell culture of woody legumes". Horticultural Review 14: 265-331. [ Links ]
20. Valentini, J. A. 1960. "La reforestación con quebracho colorado y algunas normas silvícolas relacionadas con su aprovechamiento racional". Bomplandia,1(1): 51-69. [ Links ]
21. Verzino, G. E. y M. J. Joseau. 2005. "El banco nacional de germoplasma de Prosopis". Facultad de Ciencias Agropecuarias. UN de Córdoba. 172 pp. [ Links ]













