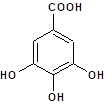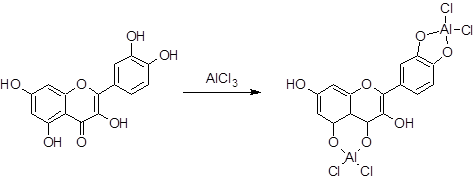1. INTRODUCCIÓN
El monte ha sido y es proveedor de recursos naturales que permiten la subsistencia de sus pobladores, tanto a lo referido a la explotación de la madera como a la utilización de los bienes y servicios que ofrecen: los denominados Productos Forestales No Madereros (PFNM). A pesar de que la utilización de los productos del monte viene llevándose a cabo desde siempre, recién en los últimos tiempos ha crecido el interés en ellos debido a la concientización del ambiente y sus problemáticas y además, porque la producción y comercialización responsable de los PFNM pueden proveer alternativas para el desarrollo de las comunidades (López Camacho, 2008; Medina, 2010).
El monte santiagueño forma parte del denominado bosque Chaco Argentino, el cual es considerado de poca productividad si sólo se lo considera como proveedor de madera dura, hecho erróneo dado que el 80 % de la biomasa forestal es desaprovechada en las diferentes etapas de la industrialización de la madera (Giménez et al., 2008). Sobre estos hechos resulta sumamente necesario revertir esta concepción y promover un aprovechamiento integral de los recursos naturales de la región.
En lo que respecta a PFNM del monte santiagueño son muy pocas las investigaciones destinada a ellos, especialmente en lo que respecta a su caracterización química. Conocer acerca de estas especies autóctonas significa conocer las potencialidades que ofrecen, las posibilidades de comercialización, estrategias de manejos sustentables y, finalmente, la conservación de estos recursos naturales.
Dentro de la flora autóctona de la provincia de Santiago del Estero se encuentra Tessaria dodoneifolia, un arbusto ramoso de dos a tres metros de alto perteneciente a la familia de las Asteraceae, la familia más numerosa en nuestro país. (Katinas et al., 2007) Sus hojas son simples, opuestas, sésiles, lanceoladas. Las flores son de color rosado-lilacinas, Los nombres vernáculos o vulgares con los que se conoce son: chilca, chilca dulce, chilca negra, suncho, suncho dulce. Esta especie es oriunda de Bolivia, Paraguay, Uruguay y Argentina siendo muy frecuente su presencia en el centro-norte del país. Crece en terrenos bajos, en general salitrosos, y cercanos a los cursos de agua. Florece y fructifica en primavera y verano. Con sus ramas, los indios tobas confeccionan asadores para pescados y armazones para mosquiteros. Las unidades floríferas son abortivas. La infusión de hojas frescas tiene propiedades antimicóticas y es usada para el tratamiento de la micosis vaginal (Rondina et al., 2010). Las hojas de Tessaria dodoneifolia son dulces dado que contienen el dihidroflavonol dihidroquercetin 3-acetato, 80 veces más dulce que una solución al 2 % p/v de sacarosa representando una nueva clase de edulcorantes no calóricos de origen natural (Dhammika Nanayakkara et al., 1988).
Dentro de las potencialidades de las especies vegetales se encuentra la de ser fuente de sustancias bioactivas con múltiples beneficios, tanto para la salud como para la industria, por ejemplo, proporcionando compuestos que contribuyan a preservar de alimentos, etc. (Valenzuela, et al., 1992). Estas sustancias bioactivas incluyen a los denominados polifenoles. Los compuestos polifenólicos son una clase de biomoléculas que se originan en las plantas como producto de su metabolismo secundario y poseen variadas funciones fisiológicas y morfológicas (Ignat et al., 2011).
En los últimos tiempos este grupo de sustancias ha despertado el interés de los investigadores debido a las numerosas propiedades que poseen y entre las que se destacan los efectos benéficos para la salud, específicamente la prevención de enfermedades crónicas (García-Lafuente et al., 2009). Si bien el mecanismo por el cual estos compuestos influencian el metabolismo humano no se conoce en detalle, existen en la bibliografía resultados que indican que tienen propiedades antioxidantes, antialérgicas, antimutagénicas, antiinflamatorias, entre otras. (González y Nazreno, 2011; Miyazawa y Hisama, 2003; Singh et al., 2011; Nichols y Katiya, 2010; Dos Santos et al., 2006).
Los compuestos polifenólicos están ampliamente distribuidos en la naturaleza. Entre los presentes en el reino vegetal se destacan ligninas, lignanos, taninos condensados e hidrolizables, ácidos polifenólicos y flavonoides.
Los flavonoides son los compuestos polifenólicos más frecuentes en los tejidos vegetales. La familia de estos compuestos incluye a varios subgrupos: flavonas, flavonoles, isoflavonoles, antcininas, antocianidinas, proantocinidinas y catequinas. Todos los flavonoides derivan de los aminoácidos aromáticos fenilalanina y tirosina y poseen una estructura base de tres anillos. La variación en la estructura de acuerdo al patrón de hidroxilación, prenilación, alcalinización y glicosilación, modifican el núcleo base y dan lugar a las subfamilias dentro de los flavonoides. Al igual que el resto de los polifenoles presentan actividad antioxidante desempeñando un papel esencial en la protección frente a los fenómenos de daño oxidativo, y tienen efectos terapéuticos en un elevado número de patologías, incluyendo la cardiopatía isquémica, la aterosclerosis o el cáncer. (Martínez-Flórez et al., 2002)
En la determinación del contenido polifenólico de matrices naturales resulta sumamente importante la etapa de extracción. Al respecto, existen numerosas técnicas convencionales tales como maceración, Soxhlet, y reflujo. Estos métodos presentan ciertas desventajas tales como el empleo de solventes tóxicos y contaminantes como así también considerables consumos de energía Una alternativa lo constituye la Extracción por Fluido Supercrítico (EFS) considerada una “técnica de extracción verde” (Ameer et al., 2017). En esta técnica se utiliza, como solvente de extracción, un fluido en condiciones de presión y temperaturas supercríticas bajo las cuales presenta propiedades que son intermedias a las exhibidas por gases y líquidos. En particular, la densidad de un fluido supercrítico se puede cambiar variando la presión aplicada lográndose así valores de densidad tan próximos a los de un líquido. La EFS ofrece ventajas sobre los métodos convencionales por ser más eficiente llevándose a cabo en menos tiempo y consumir menos energía (calor). Por lo tanto, al no someter a la muestra a temperaturas elevadas se evitan reacciones indeseables tales como oxidaciones. Finalmente, lo que la hace más atractiva: no se utilizan solventes orgánicos o se utilizan en mínimas proporciones (cuando se necesita mejorar la polaridad del fluido) resultando un método amigable con el ambiente. Estos beneficios son particularmente importantes cuando el fluido utilizado es CO2. dado que presenta ventajas prácticas tales como temperatura crítica baja (31 °C), no es tóxico, no es inflamable, es relativamente económico y puede ser fácilmente purificado y reciclado en un proceso de extracción continua. Existen en bibliografía trabajos en los que se comparan a los métodos convencionales con la EFS, tal como el de Herrera et al, (2007), quienes llevaron a cabo un estudio comparativo de la capacidad antioxidante de extractos de Baccharis incarum obtenidos por Soxhlet, maceración y EFS utilizando CO2. como solvente y etanol como cosolvente a distintas proporciones desde el 5 al 15 %. Los resultados obtenidos revelaron que la mayor potencia antioxidante correspondió a la extracción por Soxhlet seguido por maceración y EFS al 15 % de etanol. Un caso similar fue el informado por Ordoñez et al,(2006) en su estudio de la extracción de cafeína a partir de granos de café mediante CO2. supercrítico y Soxhlet usando acetato de etilo. A pesar que en esta última se obtuvo un mayor rendimiento que en la EFS, su especificidad resultó ser menor, poniendo en evidencia una ventaja de la extracción supercrítica sobre los métodos convencionales. Además, otros beneficios están relacionados a los costos de la operación, los cuales son menores para EFS además del hecho de ser una técnica amigable con el ambiente.
Sobre los antecedentes descritos anteriormente el objetivo de este trabajo fue determinar la composición de polifenoles y flavonoides totales de extractos de Tessaria dodoneifolia obtenidos por maceración, reflujo y EFS empleando CO. como fluido supercrítico.
2. MATERIALES Y MÉTODOS
Material vegetal y preparación de las muestras
Las muestras de Tessaria dodoneifolia empleadas en este trabajo fueron recolectadas en el predio de la sede Zanjón de la Facultad de Ciencias Forestales de la Universidad Nacional de Santiago del Estero en el mes de noviembre de 2016. Una vez recogidas fueron inmediatamente llevadas al laboratorio donde se seleccionaron ramas y tallos, se lavaron y se secaron en estufa a 40 °C hasta peso constante, para ser luego molidas con una picadora doméstica, y almacenadas herméticamente en oscuridad.
Extracción
Extracción por Reflujo (ER): 1 g de muestra seca de Tessaria dodoneifolia, ramas y tallos previamente molidos, fue colocada en 100 ml de etanol absoluto Ciccarelli en un equipo de extracción por reflujo y fue calentada a ebullición por el lapso de una hora. El tiempo de extracción fue seleccionado mediante ensayos previos que indicaron que ese tiempo era el mínimo necesario para obtener los máximos contenidos. Cumplidos los tiempos de extracción, los extractos fueron filtrados e inmediatamente analizados.
Extracción por Maceración (EM). se procedió de la misma manera que en la extracción por reflujo igual, esto es, se colocaron la misma cantidad de muestra y solvente, dejándose macerar 24 h a temperatura ambiente y protegidos de la luz.
Extracción por Fluido Supercrítico (EFS).el sistema de extracción empleado fue descripto por Giannuzzo et al, (2003). en la celda de extracción se colocaron 0.35 g deTessaria dodoneifolia seca y previamente molida. El fluido utilizado fue CO2 y como cosolvente se empleó alcohol etílico absoluto para Análisis (ACS) marca Dorwil al 10 % v/v. La presión de la cámara fue de 9.0 MPa y la temperatura 50 ºC. El tiempo de extracción correspondió a 30 min y fue determinado previamente, ya que se corroboró que el o los compuesto/s de interés se extraen entre los primeros 15 a 20 min. Los componentes de los extractos se recolectaron haciendo burbujear el fluido sobre una alícuota de alcohol etílico. Una vez obtenidos los extractos, se llevaron a un volumen final de 50 ml con etanol absoluto. Cada una de las extracciones se llevó a cabo por triplicado.
Determinación de polifenoles totales
El contenido de polifenoles totales (PT) fue determinado de acuerdo al método de Folin-Ciocalteu (Ivanova et al., 2005; Shaghaghi et al., 2008). Este método es ampliamente utilizado para la determinación de los PT totales presentes en una muestra y se basa en la capacidad de los fenoles para reaccionar con agentes oxidantes formando complejos de un color azul intenso. Dado que el método es colorimétrico, la técnica implica la utilización de la espectroscopia UV-Vis leyéndose la absorbancia a 750 nm. A 0,5 ml de cada extracto se adicionó 0,6 ml del reactivo de Folin-Ciocalteu (Biopack) previamente diluido 1:2 con agua destilada. Transcurridos 5 minutos se agregó 0.6 ml de Na2CO3 al 20 % y se llevó a 10 ml con agua destilada. Luego del tiempo de incubación en ausencia de luz, 90 minutos a temperatura ambiente, se procedió a leer la absorbancia en un espectrofotómetro UV-Vis Spectrum, modelo SP 2100 UV con cubeta de vidrio de 1 cm de paso óptico. El contenido de PT se obtuvo a partir de una curva de calibración (y = 0,1089x + 0,0297, R² = 0,9986), realizada con ácido gálico como compuesto de referencia (MP Biomedicals, Figura 1).
Los resultados se expresan como mg equivalentes a ácido gálico por g de muestra seca (mg EAG/ g MS). Los análisis se realizaron por triplicado informándose las correspondientes desviaciones estándar.
Determinación de flavonoides totales
El contenido de flavonoides totales (FT) fue determinado mediante el método espectrofotométrico basado en la formación de un complejo coloreado entre el AlCl. y los grupos carbonilo e hidroxilo del flavonoide (Figura 2), (Mabry et al., 1970).
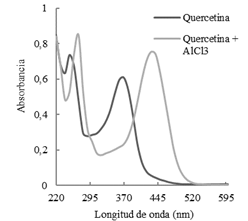
La formación de este complejo ocasiona un corrimiento batocrómico e hipercrómico del espectro de absorción (Figura 3) pudiéndose de esta manera determinar el contenido de la muestra. Para la cuantificación se eligió como flavonoide de referencia a quercetina (Q) a partir de la cual se determinó la correspondiente curva de calibración (y = 0,0591x. + 0,0034, R² = 0,9991). El procedimiento consistió en agregar a un matraz 1,5 ml de etanol, 0,2 ml de solución metanólica de AlCl3 al 5 %, 0,1 ml de solución de acetato de sodio 1M, alícuotas de la solución de Q y se llevó a volumen final de 5 ml con agua destilada. Luego de 30 minutos se procedió a la lectura de la absorbancia a 415 nm. Para la determinación del contenido de FT de las muestras de Tessaria dodoneifolia se procedió de la misma manera que la descripta anteriormente sólo que en lugar de adicionar la solución patrón de quercetina se adicionó 0,5 ml del extracto etanólico. El contenido se expresó como mg equivalentes a quercetina por g de materia seca, mg EQ/g MS. Todos los análisis se realizaron por triplicado, informándose las correspondientes desviaciones estándar.
3. RESULTADOS Y DISCUSIÓN
En la Tabla 1 se indican los resultados obtenidos por las diferentes técnicas de extracción empleadas.
Tabla 1 Contenido polifenólico total (PT) expresado como mg EAG/g de MS y contenido de flavonoides totales (FT) expresados como mg EQ/g MS para extractos etanólicos de T. dodoneifolia.ER: extracción por reflujo. EM: extracción por maceración 24 h. EFS: extracción por fluido supercrítico.

Los valores obtenidos para PT están en concordancia con los reportados en la bibliografía. Petacci et al., (2012), informan el contenido PT, determinado por el método de Folin-Ciocalteu, de extractos de hierbas de la especie Asteraceae que van desde 32.65 ± 0.70 (Lychnophora ramosissima) a 147,97 ± 2,66 mg/g. Este contenido parece conferir a la familia de las Asteraceae actividad insecticida, principalmente hacia las especies Lepidoptera, Orthoptera e Hymenoptera.
El contenido de FT se encuentra dentro del rango de lo informado en bibliografía para otras especies similares. Torres Carro et al. (2015) reporta que Tessaria absinthioides tiene un contenido de flavonas/flavonoles que varía entre 21-24 µg equivalente de quercetina/mg peso seco, además observa que mezclada con otras dos especies nativas (Parastrephia lucida y Ephedra multiflora) son capaces de inhibir a la enzima lipoxigenasa, asociada a la aparición de enfermedades crónicas.
En relación al tipo de técnica de extracción utilizada muestran que los métodos convencionales (reflujo y maceración) presentan contenidos similares, siendo los obtenidos por reflujo levemente superiores tanto para PT como para FT. Este resultado es esperado dado que el calor mejora la eficiencia de la extracción al mejorar la velocidad de difusión y la solubilidad de las sustancias a extraer. Sin embargo, también es un hecho conocido que la extracción con altas temperaturas provoca simultáneamente la degradación de las sustancias.
Para la EFS el contenido polifenólico total es menor que los obtenidos por métodos convencionales, aproximadamente un 25 % menos que el obtenido por ER. Sin embargo, para el caso de flavonoides totales, con la EFS se obtuvo un contenido un 30 % más que por las técnicas convencionales. Este hecho pone de manifiesto una de las características de la metodología: su selectividad la cual podría deberse a cuestiones relacionadas con la solubilidad de los compuestos en el fluido supercrítico. El CO2 solubiliza mejor a sustancias apolares o muy poco polares dentro de las cuales se encuentran los flavonoides, mientras que los polifenoles, tales como el ácido gálico, tienen un carácter polar y por ende son menos solubles en el fluido supercrítico, hecho observado en los resultados obtenidos (Ignat et al., 2011; Ameer et al., 2017).
Más allá de los resultados obtenidos, resulta importante destacar el hecho de que la EFS es una técnica con numerosas ventajas tales como: la rapidez en la extracción, la eficiencia, el bajo costo y el no consumo de solventes orgánicos, tóxicos y contaminantes, por lo que es una técnica preferible a los métodos convencionales.
4. CONCLUSIONES
Tessaria dodoneifolia es una potencial fuente de sustancias polifenólicas que le confieren propiedades benéficas no sólo para la salud sino también para ser utilizadas en la industria. Dentro de los compuestos que pueden obtenerse de sus extractos, se destacan los flavonoides, sustancias sumamente valiosas para la industria farmacéutica y cosmética, entre otras.
Para la extracción de estos metabolitos se puede recurrir a diferentes técnicas convencionales tales como las que se usaron en este trabajo, sin embargo, debido a la tendencia a preferir técnicas amigables con el ambiente, la extracción por fluido supercrítico, EFS es una excelente alternativa. En este trabajo se compararon los resultados obtenidos por las técnicas convencionales frente a EFS. Si bien los resultados obtenidos por EFS en este trabajo no mostraron un mayor rendimiento en la bajo esta técnica, se obtuvo un extracto de mayor calidad en lo que respecta a su composición poniendo en evidencia una las tantas ventajas que ofrece, además de menores tiempos de operación, menores costos y mayor cuidado del ambiente.