INTRODUCCIÓN
Caso clínico:
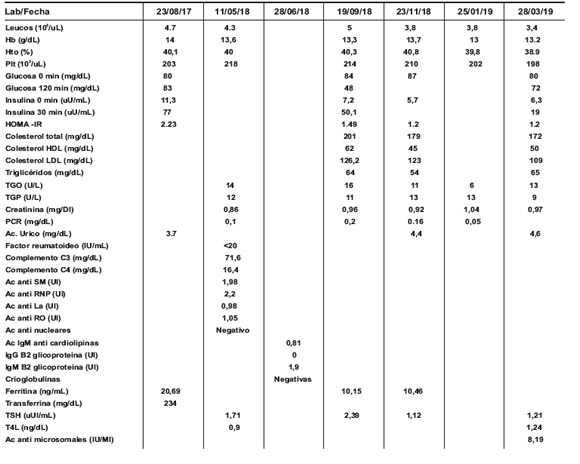
Mujer de 35 años, con antecedente de hipotiroidismo primario, en suplencia con levotiroxina 100 mcg cada 24h; test de tuberculina cutánea positiva, sin evidencia clínica de actividad de la enfermedad, por lo cual se consideró tuberculosis latente al haber un estado de viabilidad bacteriana persistente, con control inmune, sin evidencia clínica de tuberculosis activa, siendo tratada con isoniazida por 9 meses; animo triste, e impresión diagnóstica de artritis reumatoidea desde 2003, en presencia de poliartralgias simétricas de pequeñas articulaciones de predominio a nivel de metacarpofalanges e intefalangicas proximales, y factor reumatoideo positivo. Reumatología ordenó múltiples esquemas de tratamiento inmunomodulador, que incluyo leflunomida 20 mg cada 24h e hidroxicloroquina 200 mg cada 24h durante 7 años, desde 2003 al 2010, ante la no mejoría se inició rituximab 1 gr cada 6 meses, el cual recibió hasta julio de 2017, junto a ácido fólico 2mg cada día y prednisolona según síntomas en ciclos de 5 a 10 mg día por 5 días máximo. Durante este tiempo la paciente fue valorada en conjunto por los servicios de neurología, psiquiatría y medicina interna, sin que se lograra control sintomático de la enfermedad. Asiste al servicio de endocrinología en noviembre de 2017 por síntomas referidos como sensación vertiginosa, aumento de peso y pérdida subjetiva de la fuerza, desencadenados por la alta ingesta de carbohidratos. Al examen físico inicial se documentó sobrepeso (IMC 26 kg/m2), circunferencia de cadera y cintura aumentadas (108 y 93.7 cm respectivamente), índice cintura/cadera (0.94) y cintura/altura (0.55) elevados. En impedanciometria, tejido adiposo visceral elevado (155 cm2) con baja masa magra (23.6 kg, 32% de la masa corporal total) y alta masa grasa (29.6 kg, 40.3% de masa corporal total) para el género y edad. En los resultados de exámenes complementarios de perfil metabólico inicial, se observa inadecuada excursión glucémica (pre 80 mg/dL y 2 h post carga de 75 g de glucosa 73 mg/dL), insulina basal de 17 U/mL (valor normal 4-6 U/mL) y 30 min post carga de 75 g de glucosa de 28 U/mL (valor normal 80U/mL), con HOMA-IR de 3.4, hallazgos sugestivos de alteración en resistencia insulínica, asociado a alta adiposidad y rangos de volumen de masa libre de grasa bajos, lo anterior, en probable relación a hábitos de estilo de vida inadecuados y uso crónico de medicamentos, incluyendo esteroides, terapia biológica y antidepresivos (prednisolona, rituximab y escitalopram), los cuales fueron administrados previo a los exámenes complementarios del perfil metabólico.
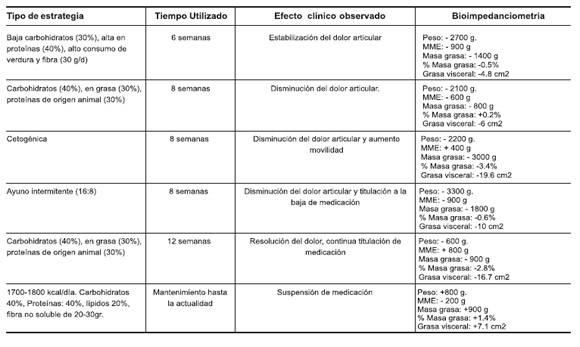
Se integra al centro de obesidad, dismetabolismo y deporte (COD2), donde se práctica una intervención multidisciplinaria y multifocal la cual se inició posterior al analisis de paraclínicos, con ajustes en habitos de sueño (calidad y duración), estrategias nutricionales según tolerancia al ejercicio y programa de mindfullness. En enero de 2018 el plan de nutrición se deteminó por fases, siendo la primera fase con duración de seis semanas, un plan nutricional bajo en carbohidratos (30%), alto en proteínas (40%) y con alto consumo de verduras, con aporte de fibra calculado en 30g/día, posteriormente se cambia a estrategia de aporte intermedio de carbohidratos (40%) con incremento en grasas (30%) y proteínas de origen animal (30%) (de predominio pescado rico en PUFA's) y alto aporte en minerales y vitaminas (vit D, magnesio, zinc) por ocho semanas y consecutivamente se cambia a dieta cetogénica por otras ocho semanas, en este momento se decide incrementar la actividad física de fortalecimiento, continuando con plan de ayuno intermitente con estratégia 16:8, con distribución de macronutrientes usual (periodo de ayuno de 4 pm a 7 am), por ocho semanas de duración; todas las estrategias nutricionales se calcularon con 1400 a 1500 kcal/día. Se evalua con la paciente sintomatología asociada a planes nutriconales y dada la mejoría referida se retoma plan nutricional inicial de restricción en carbohidratos del 40% descrita previamente, esta fase se mantuvo por doce semanas, hasta noviembre de 2018, siempre asociado con incremento de actividad física en tiempo, intesidad y frecuencia, prescrito por deportología por último se continuó en plan de mantenimiento con aporte de 1700 a 1800 kcal/día con distribución de macronutrientes de 40% de carbohidratos, 40% de proteínas y 20% de lípidos, con aporte de fibra de 20-30gr (no soluble), en 3 servicios al día con suspención de estos después de las 3 pm.
La estrategia deportiva inició con actividad aeróbica de moderada intensidad, con secuencias de fortalecimiento con propio peso, rutina dirigida por segmentos 3 a 4 veces por semana, para un total de 160 min/sem, por 8 semanas, posteriormente se cambia de esquema con incremento de carga dirigida por rutinas de grupos musculares mayores y menores, con uso de pesos libres iniciales y con actividad aeróbica de moderada intensidad logrando 80% de la FC máxima sugerida para la edad, por 20 minutos, 4 días a la semana, para un total de 240 min/sem, duración de 8 semanas, y se progresa a fase de gimnasio con rutina secuencial de fortalecimiento y pesos incrementales, con fase aeróbica final de 25 min, de intensidad moderada, para un total de 60 minutos/día aumentando a 5 sesiones de ejercicio a la semana con 2 días de descanso intercalado, manejo dirigido por deportología orientado a la optimización de la masa muscular y reducción de masa grasa, además se realizó psicoterapia breve basada en mindfulness (8 sesiones), dirigido por psicología.
En el seguimiento se observó reducción progresiva de peso de hasta 10 kg de masa grasa, con discreto amento de masa musculoesquética, disminución en porcentaje de grasa segmentaria en extremidades y tronco, con pérdida del 6% de masa grasa total y aumento porcentual de la masa libre de grasa. Luego de aproximadamente 6 semanas del inicio de plan nutricional de bajo aporte en carbohidratos se observó la disminución y posterior resolución de la sintomatología autonómica y osteoarticular, posteriormente, el servicio de reumatología ordenó retiro progresivo de medicamentos así: esteroides hasta diciembre de 2017, hidroxicloroquina 200 mg cada 24h hasta abril 2018, leflunomida 20 mg cada 24h que recibió hasta mayo 2018 y rituximab 1 g cada 6 meses hasta diciembre 2018. En reporte de exámenes complementarios de control se evidenció reducción de insulina basal y mejoría de excursión glucémica, cambios referidos en la Tabla No. 1
DISCUSIÓN
La homeostasis existente entre los distintos sistemas corporales, depende de un equilibrio mediado por comunicaciones auto, para y endocrinas, regulado por proteínas que sirven como medio de comunicación entre órganos distantes (1).
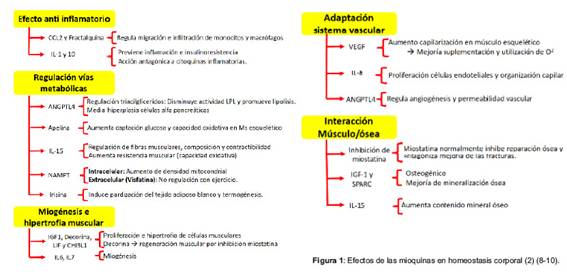
Por un lado, el músculo, como órgano endocrino, a través del secretoma muscular, tiene la capacidad de producir y secretar mioquínas que sirven de conexión con células inmunes, endoteliales, fibroblastos, osteocitos, hepatocitos y adipocitos (2). Estas, ejercen control sobre la regeneración, diferenciación y proliferación celular, así como efectos anti inflamatorios, por su acción antagónica sobre citoquinas pro inflamatorias (IL-1RA, IL-6, IL-10) y por su mediación en la migración e infiltración de monocitos/macrófagos. Por otra parte las adipoquinas, en su mayoría con efecto pro inflamatorio, tienen niveles proporcionales a la cantidad de tejido adiposo, estimulan el reclutamiento de células inmunes y producción de citoquinas pro inflamatorias (TNF-a, IL-6, IL-8, MCP-1)(3), lo cual favorece estados inflamatorios con manifestaciones clínicas como las poliartralgias además de alteraciones metabólicas propias como disglucemia y alteraciones lipídicas(4).
Los niveles y efectos de las organoquinas se ven afectados por condiciones como la actividad física (5), la alimentación y el uso de medicamentos inmunomoduladores. La contracción muscular generada por el ejercicio y entrenamiento genera aumento de mioquinas, tales como la CCL2, fractalquina, IL-1 y 10, que han mostrado regulación anti inflamatoria, de vías metabólicas anabólicas, miogénesis e hipertrófia muscular, así como adaptación del sistema vascular e incluso interacción músculo esquelética (Figura 1). A nivel del sistema nervioso central, en modelos humanos y animales, el eje músculo/cerebral ha mostrado un efecto neuroprotector, optimizando la diferenciación, plasticidad, conexión y sobrevida neuronal, con aumento inclusive del volumen hipocampal (6) y de sustancia gris (7), como consecuencia se observa mejoría de funciones a nivel emocional, cognitivo y motor.
Si bien el foco de este articulo es exponer los beneficios del músculo como un órgano “anti-inflamatorio”, no podemos desconocer el efecto benéfico que tienen algunos alimentos (ácidos grasos y minerales), así como el efecto deletéreo de otros que favorecen las reacciones inmunes y estados inflamatorios (azucares) (11-12). Estas estrategias nutricionales asociadas a terapia cognitiva de tercera generación (13) tienen efectos en la disminución de sintomatología en este tipo de patologías.
En el caso presentado, podemos evidenciar la importancia del interrogatorio médico, que no debe ser solamente orientado a la sintomatología del paciente, sino al abordaje global y multidisciplinario, dando la misma importancia a la esfera mental, osteomuscular y metabólica. De esta manera se logra optimizar con diferentes estrategias la reacción de órganos (músculo) que promueven efectos neurológicos e inmunológicos que ayudan a la resolución de los síntomas y posiblemente disminución de fármacos, lo cual podría explicarse en relación al eje músculo-cerebral. Todo lo anterior invita a un cambio en el paradigma terapéutico actual, donde podamos alejarnos del enfoque farmacocéntrico de patologías inflamatorias.
Previene inflamación e insulinoresistencia Acción antagónica a citoquinas inflamatorias.
Regulación vías metabólicas